Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300
Rev Cubana Invest Bioméd vol.31 no.3 Ciudad de la Habana jul.-sep. 2012
ARTÍCULO ORIGINAL
Obtención de un biocompuesto constituido por fosfato tricálcico y quitosana para ser usado como sustituto óseo en un modelo animal
Development of a biocomposite made up of tricalcium phosphate and chitosan to be used as bone substitute in an animal model
MSc. Sandra Arce Guerrero,I Dr. Carlos Valencia Llano,II Ing. Diego Alexander Garzón-AlvaradoIII
IUniversidad Autónoma de Occidente. Cali, Colombia.
IIUniversidad del Valle. Cali, Colombia.
IIIUniversidad Nacional de Colombia, Bogotá, Colombia.
RESUMEN
La investigación se trata de la obtención de un biocompuesto a partir de una matriz cerámica y un polímero, con el fin de utilizarlo como relleno óseo. Se mezcló la matriz cerámica, fosfato tricálcico Ca (OH)2 y quitosana, polímero de origen natural. En el estudio se realizaron pruebas preliminares de mezclas para escoger 4 tipos de biocompuestos (BC1, BC2, BC3, BC4), con diferentes proporciones de los elementos de la matriz cerámica. Se trabajó en la preparación del biocompuesto con un pH entre 6,5 y 8,5 y un tiempo de secado entre 7 y 20 min. Se seleccionaron las mezclas óptimas para analizar sus propiedades mecánicas a partir de la prueba de la resistencia a la compresión. Se determinaron los valores de pH, los cuales estuvieron en un rango de 7,05 y 7,6. Igualmente se hallaron unos tiempos de secado que oscilaron entre 7 y 15 min, la pasta mantuvo una temperatura constante de 25 ºC y consistencia moldeable, condiciones que son apropiadas para su utilización como sustituto óseo. La muestra que obtuvo mejores propiedades en cuanto a pH, temperatura y tiempo de secado fue seleccionada para ser implantada en tibias de conejo para determinar la respuesta histológica después de 60 días.
Palabras clave: regeneración ósea, sustituto óseo, biocompuesto, fosfato tricálcico, quitosana.
ABSTRACT
The research deals with the development of a biocomposite from a ceramic matrix and a polymer with the purpose of using it as bone filler. A mixture was made of the ceramic matrix, tricalcium phosphate Ca (OH)2 and chitosan, a polymer of natural origin. The mixtures underwent preliminary testing to choose 4 types of biocomposites (BC1, BC2, BC3, BC4) with varying proportions of ceramic matrix elements. The biocomposite was prepared at a pH between 6.5 and 8.5. Drying time ranged between 7 and 20 minutes. Optimal samples were chosen and their mechanical properties analyzed by means of compression resistance testing. PH measurements showed values between 7.05 and 7.6, and drying times ranged between 7 and 15 minutes. The paste remained at a constant temperature of 25 ºC and maintained molding consistency. These properties are required for use as bone substitute. The sample exhibiting the best pH, temperature and drying time values was chosen for implantation in rabbit tibiae to verify the histological response after 60 days.
Key words: bone regeneration, bone substitute, biocomposite, tricalcium phosphate, chitosan.
INTRODUCCIÓN
La ingeniería de tejidos se define como el uso de los principios y métodos de la ingeniería, la biología y la bioquímica orientados a la comprensión de la estructura y función de los tejidos normales y patológicos de los mamíferos, y el consecuente desarrollo de sustitutos biológicos para restaurar, mantener o mejorar su función.1
Los ingenieros utilizan conocimientos en la elaboración y caracterización de materiales que puedan ayudar a solucionar problemas concretos como el de la regeneración ósea.
Tradicionalmente, los problemas de pérdida de tejido óseo se han resuelto con el empleo de injertos del mismo paciente (autoinjertos), con material tomado de donantes o de banco de huesos (homoinjertos o aloinjertos), o de otras especies (xenoinjertos).
Sin embargo, la utilización de tejido óseo genera algunas complicaciones como disponibilidad en cantidades adecuadas, y necesidad de otra intervención quirúrgica como en el caso de los autoinjertos; posibilidades de transmisión de enfermedades como en el caso de los homoinjertos, y riesgo de generar problemas transgénicos en el caso de los xenoinjertos.
La ciencia ha buscado soluciones a los problemas de disponibilidad de tejido adecuado, y ha recurrido a la ingeniería de tejido óseo. Se han planteado estrategias como utilizar materiales biocompatibles que sirvan como sustitutos óseos y/o matrices, (aloplásticos). También se ha trabajado en la obtención y aplicación de proteínas morfogenéticas que puedan inducir la diferenciación de células osteoprogenitoras.
Como sustitutos óseos se han utilizado diferentes materiales como las cerámicas; de estas, la primera en aplicarse fue el sulfato de calcio,2 y con usos actuales como relleno, barrera y vehículo en regeneración ósea. En este grupo también están los biovidrios, considerados como una cerámica bioactiva clase A, por su alta tasa de intercambio iónico, y las hidroxiapatitas o cerámicas bioactivas clase B, con baja tasa de intercambio iónico. Igualmente están los fosfatos tricálcicos, considerados como cerámicas reabsorbibles.
En general los fosfatos de calcio muestran facilidad para unirse a proteínas séricas y a factores de crecimiento.3
Otro grupo de materiales utilizados son los polímeros, como el ácido poliláctico y el ácido poliglicólico. La gran versatilidad que muestran estos polímeros, por la posibilidad de modificar sus propiedades físicoquímicas, permite obtener materiales con una consistencia tan suave como una silicona, o tan dura como el hueso, con una cualidad adicional, la termoplasticidad, situación que es permitida debido a que los polímeros tienen una temperatura de transición vítrea.
El desarrollo de la bioingeniería ha hecho posible la producción de una serie de materiales sintéticos con características de biocompatibilidad, biodegradabilidad, porosidad, estabilidad, entre otros, que facilitan la colocación de células óseas y otras sustancias como factores de crecimiento y moléculas de adhesión, que optimizan el proceso de cicatrización ósea y facilitan la técnica de regeneración ósea guiada. Para que esto ocurra, la matriz debe permitir el transporte de fluidos y nutrientes para la expansión celular y la organización tisular.
Entre las cerámicas utilizadas están la hidroxiapatita y el fosfato tricálcico. Estos materiales se usan cuando los requerimientos mecánicos no son muy altos y se desea obtener superficies biomiméticas.
El fosfato tricálcico es un material que lleva más de 2 décadas siendo utilizado como sustituto óseo con numerosas aplicaciones y es considerado el fosfato biodegradable por excelencia.
El quitosano, derivado de la quitina, es un biomaterial que ha sido reportado por más de 40 años en la literatura científica como biocompatible y biorreabsorbible, con aplicaciones para transporte de medicamentos,4,5 y también como cicatrizante en procedimientos quirúrgicos.6,7 Sus cualidades en los procesos cicatrizantes han sido reportadas en numerosos modelos animales y en estudios con pacientes humanos.8-12
En este trabajo se utilizó una cerámica reabsorbible, el fosfato tricálcico, y un polímero natural, el quitosano, derivado de la quitina; y se pretende mostrar que al combinar estos 2 productos se puede tener un efecto sinérgico en el cual el fosfato tricálcico actuaría como elemento osteoconductor y, a la vez, sería una fuente de fosfato y calcio para el ensamblaje óseo. Por su parte, el quitosano optimiza el proceso regenerativo al participar en el aporte de colágeno tipo I, y sería fuente de glucosamina, la cual suministra materia prima para la elaboración de la matriz extracelular.
MÉTODOS
Esta investigación se realizó en 4 fases:
Primera fase: Obtención y caracterización del producto en el laboratorio de Ingeniería de la Universidad Autónoma, Cali, Colombia.
A. Obtención del biocompuesto
Los biocompuestos están formados por dos componentes: una fase sólida de material cerámico fosfato tricálcico, y una fase líquida compuesta por quitosana; las dos fases se combinan para obtener una mezcla homogénea, a la cual se le mide el pH, y cuando se convierte en una pasta moldeable y consistente, se procede a depositarla en moldes cilíndricos, con diámetro interno= 9 mm y altura de 18 mm13-15 diseñados con el fin de obtener probetas cilíndricas para ensayos de compresión. Se hicieron 100 mezclas a las cuales se les midió del pH, con el propósito de escoger un rango de mezclas óptimas; se realizó un análisis estadístico por diseño de mezclas, con componentes: formulación y relación P/L.
Finalmente se escogen las 4 mejores composiciones para efectuar ensayos de resistencia a la compresión y biocompatibilidad, con base en los criterios siguientes:
B. Observación para el tiempo de secado
Fue evaluado el tiempo de secado de las muestras preparadas; se asumió como tiempo de secado el momento en que se pierde la adherencia de la muestra sobre una superficie metálica (que no se sienta húmedo al contacto), esto se hace, provocando ligeras presiones del palo de madera sobre el cemento en forma de pasta, el tiempo de secado más corto debe estar entre 8 y 15 min, por contacto con una espátula.16
C. Estudio de pH
Se elaboraron 4 réplicas por muestra y se procedió a realizar la medición del pH, con un pHmetro (Accumetr Basic Ab15/15).
Mediante un modelo estadístico se evaluaron las formulaciones posibles que cumplieron con características de plasticidad, tiempo de endurecimiento, endurecimiento, temperatura, en las condiciones descritas anteriormente, pero además presentaran un pH que estuviera en un rango de 7 a 8.
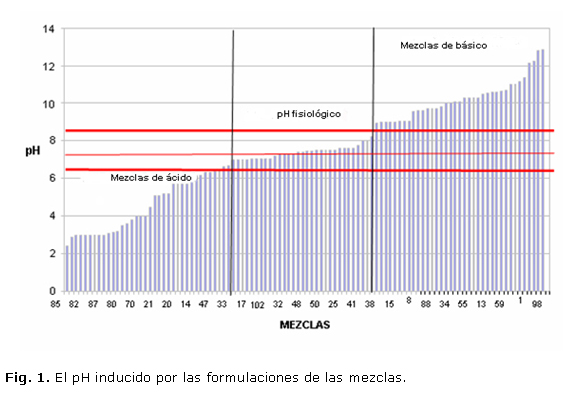
En la figura 1 se aprecia el rango de muestras que menores de 6,5 poseen un carácter acido, y mayores de 8,6 presentan un carácter básico, para nuestro interés se trabajaría con las mezclas que están dentro de este rango. Esta prueba se realizó a una temperatura de 22 ºC y una humedad relativa de 100 %.
D. Estimación de la resistencia a la compresión
Para determinar la resistencia a la compresión se prepararon probetas cilíndricas de los cuatro tipos seleccionados del biocompuesto, con un diámetro de 9 mm y 18 mm de altura, las que fueron incubadas a 37 ºC. Las probetas fueron sometidas al ensayo de compresión según la norma, utilizando una máquina universal de pruebas Instron [Modelo 3360 Software Serie IX/s], con una celda de 25 kN y a una velocidad de 1 mm/min.
Segunda fase: las muestras seleccionadas fueron implantadas en la tibia de 30 conejos machos de acuerdo a la norma ISO 10993-6, [6.4.1 Animals Test].17,18
Etapa prequirúrgica: Para la adecuación del bioterio, selección de los animales, y el aspecto ético de la investigación, se contó con la colaboración de profesional zootecnista.
Se determinó una muestra de 5 conejos (Orictolagus cuniculus), machos, raza New Zealand, de 3 meses de edad, de acuerdo con la norma.
Etapa quirúrgica:
1. Anestesia y sedación: Se utilizó tranquilán (maleato de aceptomicina), 0,3 mg por kg vía parenteral y ketalar (ketamicina), 0,5 mg por kg vía parenteral.
2. Procedimiento quirúrgico: Previa preparación del campo quirúrgico, y siguiendo protocolos universales, se procedió a realizar una incisión longitudinal en la tibia de cada conejo con unas dimensiones de 6 mm de largo por 3,5 mm de ancho y 4 mm de profundidad. Para la creación del defecto quirúrgico se utilizó un fisiodispenser Nouvag MD-10, con torque controlado, con pieza de mano 32:1 y fresas de titanio con irrigación interna y externa. En la secuencia de fresas: Redonda de 1,8 mm, TTPD de 2,3 mm, TTD 2,8 mm, y SVD de 3,2 mm.
3. Colocación del material: Se preparó el material y se colocó en la cavidad utilizando una espátula para injertos, se sostuvo en posición hasta que secó.
4. Confrontación de tejidos y cierre: Con sutura reabsorbible 4x0, en puntos simples.
5. Cuidados posquirúrgicos:
a) Analgésico: Tramal 0,25 mg
b) Antibiótico: Penicilina procaínica 400 000 UI .
c) Protección del área: Antibiótico tópico (gentamicina) y curagán aplicados localmente.
d) Elemento restrictivo: Cuello isabelino.
6. Sacrificio: Se realizó a los 60 días de la implantación del material de relleno óseo. El procedimiento (técnica de contusión y degollamiento) será realizado siguiendo la normatividad nacional e internacional y bajo la supervisión directa del zootecnista.
Tercera fase: Una vez obtenidas las muestras se realizaron pruebas en el departamento de patología de la Universidad del Valle (Colombia) con instrucción de realizar 3 cortes en cada espécimen uno a nivel crestal, otro a nivel medio, y el tercero en proximidad al canal medular y describir los hallazgos histológicos, sin informar al patólogo el tipo de material que se utilizó, tiempo de permanencia del material, ni el objetivo de la investigación.
RESULTADOS
A. Determinación del pH:
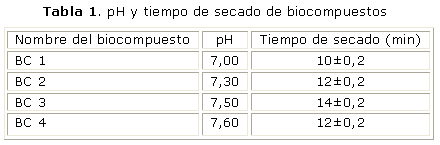
Los valores obtenidos oscilaron entre 6,5 y 8,5. Para las etapas siguientes se definió trabajar con 4 biocompuestos, con valores de pH neutro o ligeramente básico (tabla 1).
B. Resistencia a la compresión
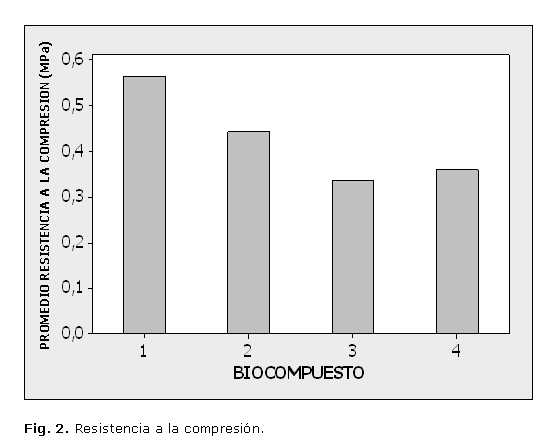
La figura 2 muestra la resistencia a la compresión de las muestras a 37 ºC y 98 % de humedad. Además, se observa que la composición del polvo y la resistencia compresiva de cada BC aumentan con el tiempo, al mismo tiempo la resistencia BC1 fue de (0,95) MPa.
La resistencia compresiva se obtuvo en el orden siguiente: BC1>BC2>BC3>BC4 (figura 2).
C. Resultados histológicos
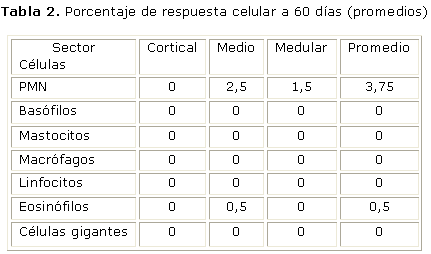
Los resultados histológicos e histomorfométricos a 60 días, muestran ausencia total de respuesta inflamatoria aguda, crónica o a cuerpo extraño (tablas 2 y 3).
DISCUSIÓN
El biocompuesto que presenta mejores características de biocompatibilidad es el BC1, tiene un tiempo de secado de 10 min y un valor de pH de 7,0.
El producto, obtenido mediante la combinación de un material cerámico bioactivo como es el fosfato tricálcico con un polímero biocompatible y biodegradable como el quitosano, presenta características fisicoquímicas que le permiten actuar como sustituto óseo.
Este biocompuesto está propuesto para ser aplicado en técnicas de regeneración ósea, por lo tanto, podrá tener aplicaciones concretas en el área de la odontología, en situaciones en las que el hueso de los maxilares, debido al trauma sufrido, o por el proceso fisiológico normal de reabsorción ósea, no sea suficiente para la colocación de los implantes dentales, o para mejorar la estética o la función de una prótesis dental. También se puede utilizar en traumatología y ortopedia, cuando debido al trauma hay pérdida considerable de tejido óseo, que haga necesaria la utilización de injertos o sustitutos óseos, y en cirugía ósea en el tratamiento de las secuelas de procesos patológicos o infecciosos, como los defectos causados por tumores benignos y malignos, así como la osteomielitis, en los cuales quedan cavidades óseas que difícilmente cicatrizarían en forma espontánea.
Este biocompuesto presenta buenas propiedades físicas y químicas que permiten una aplicación segura y facilitan su manejo in situ, ya que inicialmente es moldeable y luego endurece (fraguado) en un tiempo adecuado a las necesidades operatorias adquiriendo una consistencia rígida suficiente para permanecer en el sitio sin ser disuelto por los fluidos tisulares.
REFERENCIAS BIBLIOGRÁFICAS
1. Estrada C, Paz AC, López LE. Ingeniería de tejido óseo: Consideraciones básicas. Revista EIA (Escuela de Ingeniería de Antioquia). 2006;(5):93-100.
2. Ricci JL, Alexander H, Nadkarni P, Hawkins M, Turner J, Rosenblum S, et al. Biological mechanisms of malcium sulfate replacement by bone. En: Bone Engineering, Davies JE, ed. Toronto, Ont. Canada: Em2 Inc; 2000. Cap. 30. p. 332-44.
3. Jansen JA, Vercaigne S, Hulshoff G, Corten FGA, Brugge PJ, Naert I, et al. The effect of Surface Roughness and Calcium Phosphate Coating on Bone Regenerative Implant Surfaces. En: Bone Engineering. Toronto: Editorial Em2 Inc.; 2000. Cap. 31. p. 345-57.
4. Serna L, Rodríguez A, Alban F. Ácido poliláctico (PLA): Propiedades y Aplicaciones. Ingeniería y Competitividad, 2003;5 (1).
5. Batchelor, Andrew W. Service Characteristics of Biomedical Materials and Implants (Series on Biomaterials and Bioengineering, Volume 3). Singapore: Imperial College Press; 2004. p. 183.
6. Shoufeng Yang, Kah-Fai Leong, Zhaohui Du, Chee-Kai Chua. The Design of Scaffolds for Use in Tissue Engineering. Part I. Traditional Factors. Tissue Engineering. 2001; 7(6): 679-689.
7. Byung-Soo K, Mooney DJ. Development of biocompatible synthetic extra cellular matrices for tissue engineering. Trend in Biotechnology. 1998;16(5): 224-230.
8. Anders Linde. Per. Alberius. Christer Dahlin, et al. Osteopromotion: A Soft. Tissue Exclusión Principle Using a Membrane for Bone Healing and Bone Neogenesis. J periodontal. 1993;64:1116-28.
9. Qu Y, Wang P, Man Y, Li Y, Zuo Y, Li J. Preliminary biocompatible evaluation of nano-hydroxyapatite/polyamide 66 composite porous membrane. Int J Nanomedicine. 2010 Aug 9;5:429-35.
10.Temenoff JS, Lu l, Mikos AG. Bone-Tissue Engineering Using Synthetic Biodegradable Polymer Scaffolds. Editorial Em2 Incorporated. Toronto 2000. p. 454-61.
11. Laurencin CT, Lu HH. Polymer-Ceramic Composites for Bone-Tissue Engineering. Bone Engineering. Em Squared Incorporated. Toronto 2000. p. 462-72.
12. Benavides Cuéllar M. Quitina-quitosana: los polimeros del futuro. Informe del Servicio Nacional de Aprendizaje (SENA). Bogotá: Editorial SENA. CDT ASTIN; 2002. p. 7.
13. Prudden JF, Miguel P, Handson P, Friedrich L, Balassa L. The discovery of a potent pure chemical wound-healing accelerator. Amer J Surg. 1970;119:560-64.
14. Hin Teoh S. Engineering Materials for Biomedical Applications. Singapore: World Scientific Publishing Company, Incorporated; 2004. p. 330.
15. Hua L, Hong L, Wenjun Ch, Yuan Y, Minying Z, Changren Z. Novel injectable calciumphosphate/chitosan composites for bone substitute materials. Acta Biomaterialia. 2006; 2(5):557-65.
16. González Torres M. Preparación y caracterización de cementos de hidroxiapatita con alginato. Ciudad de La Habana: Universidad de La Habana, Centro de Biomateriales Facultad de Química; 2004.
17. Valencia Llano CH. Descripción de cambios histológicos en respuesta a una matriz de acido poliláctico implantada en tibias de conejo. Revista Odontos. 2007; 30:11-13.
18. Gutiérrez Ospina L, Montenegro Rosero M. Estudio de factibilidad técnica para la fabricación de cementos óseos acrílicos con aplicación en biomateriales. Universidad del Valle, Facultad de Ingeniería. Escuela de Ingeniería de materiales. Trabajo de Grado. Santiago de Cali. 2006.
Recibido: 3 de septiembre de 2011.
Aprobado: 26 de septiembre de 2011.
Sandra Arce Guerrero. Universidad Autónoma de Occidente. Calle 25 N° 115-85, Km 2, Vía Cali. Cali, Colombia. Grupo de Investigación en Nuevos Sólidos con Aplicación Industrial, GINSAI. Correo electrónico: sarce@uao.edu.co