INTRODUCCIÓN
El fósforo es un macronutriente muy importante para el crecimiento y desarrollo de las plantas. Sin embargo, más del 80% del P aplicado como fertilizante no está disponible debido a procesos de sorción, precipitación o inmovilización en el suelo (Roberts y Johnston, 2015; Zhu et al., 2018).
Diferentes microorganismos solubilizadores de fosfatos (MSF) se han aislado de fuentes naturales entre las que se encuentran el suelo y la rizosfera de las plantas (Hong-Yuan et al., 2015; El-Ghandour et al., 2018).
Específicamente, la solubilización de fosfatos por hongos filamentosos ha sido objeto de estudio en investigaciones que refieren a especies de los géneros: Alternaria, Aspergillus,Fusarium, Helminthosporium, Penicillium, Rhizopus, Sclerotium y Talaromyces, entre los se destacan Aspergillus y Penicillium (Chun-Chao et al., 2007; Pandey et al., 2008; Sharma et al., 2013; Alfat et al., 2018; Zhang et al., 2018; Zhu et al., 2018).
Los MSF pueden contribuir a incrementar la disponibilidad de P para las plantas principalmente mediante mecanismos tales como la disminución del pH por la producción de ácidos, formación de quelatos y la liberación de enzimas extracelulares (Illmer y Schinner, 1995; Shrivastava et al., 2018). Se ha comprobado que incrementan el crecimiento de las plantas, su productividad y la fertilidad del suelo. Se pueden aplicar como biofertilizantes (Hong-Yuan et al., 2015) y se consideran una alternativa ecológica y económicamente viable (Owen et al., 2015; Altaf et al., 2018).
En el cultivo de cafeto (Coffea spp.) se han informado resultados positivos en la fase de vivero por la aplicación de bioproductos que promueven el crecimiento de las plantas, principalmente las procedentes de semilla botánica (Bustamante et al., 2010; Barroso et al., 2015). Sin embargo, con plantas obtenidas por cultivo in vitro las investigaciones son escasas. Atendiendo a lo anterior el objetivo del presente trabajo fue determinar el potencial de cepas de Aspergillus y Penicillium, solubilizadoras de fosfatos in vitro, para promover el crecimiento de plantas de cafeto obtenidas por embriogénesis somática.
MATERIALES Y MÉTODOS
Los experimentos se desarrollaron en el Laboratorio de Microbiología aplicada del Instituto de Biotecnología de las Plantas (IBP).
Solubilización de fosfatos in vitro
Se evaluó la solubilización de fosfatos in vitro por cepas de hongos filamentosos pertenecientes a la Colección de Cultivos Microbianos del IBP. Se seleccionaron cepas de los géneros Aspergillus y Penicillium atendiendo a resultados de experimentos preliminares.
Cepas de Aspergillus spp. (7): CCIBP-Asp 22, CCIBP-Asp 29, CCIBP-Asp 31, CCIBP-Asp 32, CCIBP-Asp 33, CCIBP-Asp 36, CCIBP-Asp 37.
Cepas de Penicillium spp. (6): CCIBP-Pen 21, CCIBP-Pen 22, CCIBP-Pen 24, CCIBP-Pen 28, CCIBP-Pen 43, CCIBP-Pen 50.
Se tomaron discos de micelio de 5.0 mm de diámetro de colonias de cada una de las cepas crecidas en medio de cultivo Agar Papa y Dextrosa (PDA) e incubadas durante siete días a 28 °C a la oscuridad.
Un disco de micelio se colocó en el centro de una placa de Petri de 90 mm de diámetro con medio de cultivo de Pikovskaya (PVK) (Pikovskaya, 1948) al cual se adicionaron trazas de Rosa bengala para facilitar las evaluaciones. El pH se ajustó a 5.4 ± 2 previo a la esterilización por autoclave. Las placas se incubaron a 28 °C y oscuridad y después de siete días de incubación se midió el diámetro (mm) del halo traslúcido alrededor de la colonia indicativo de solubilización de fosfatos. Además, se calculó el índice de solubilización (IS) mediante fórmula IS=Diámetro de la colonia + halo de solubilización/ diámetro de la colonia (Edi-Premono et al., 1996). De cada cepa se hicieron tres réplicas y el ensayo se repitió dos veces.
Por otra parte, en tubos de ensayo (16.0 cm x 1.3 cm) con medio de cultivo NBRIP (Mehta y Nautiyal, 2001) o medio de cultivo líquido de Pikovskaya (sin agar) se inoculó un disco de micelio de 5.0 mm de diámetro. El pH de ambos medios de cultivo se ajustó a 5.4 ± 2 previo a la esterilización por autoclave. Las cepas se incubaron a 28 °C y oscuridad por 14 días. Transcurrido el tiempo se midió el pH del medio de cultivo. Tubos de ensayo con medio de cultivo sin inocular se utilizaron como control. Se emplearon tres tubos de ensayo por cepa y el ensayo se repitió dos veces. Se seleccionó una cepa de Aspergillus y otra de Penicillium atendiendo a los resultados.
Efecto sobre el crecimiento de plantas de cafeto
Material vegetal
Se emplearon plantas de Coffea arabiga cv. ‘Caturra rojo’ obtenidas por embriogénesis somática mediante el protocolo descrito por Barbón et al. (2003). Las plantas tenían como promedio 1 cm de altura, cuatro pares de hojas y sistema radical desarrollado.
Preparación del inóculo
De las cepas seleccionadas crecidas en medio de cultivo PDA e incubadas durante 7 días a 28 °C y oscuridad se tomaron discos de micelio de 12 mm de diámetro. Se inocularon Erlenmeyers que contenían 200 ml de medio de cultivo PVK líquido con cinco discos de micelio. Los Erlenmeyers se incubaron en condiciones estáticas a 28 °C y oscuridad durante 72 horas. Pasado este tiempo se eliminó el micelio por filtración y la suspensión de conidios (~2 x 107 conidios ml-1) en el filtrado de cultivo (FC) resultante se utilizó como inóculo.
Condiciones de cultivo
La plantación se efectuó en cajas con tubetes de polietileno de 52 mm de diámetro y 130 mm de largo que contenían 100 g de sustrato. Se utilizó un suelo Ferralítico Rojo lixiviado (Hernández et al., 2015), que se mezcló con compost de cachaza en proporción 3:1 (v:v). Las plantas se colocaron en cámara de crecimiento con 80% de humedad relativa, 24 °C, iluminación con lámparas fluorescentes con un fotoperiodo de 16 h luz y 8 h oscuridad. El riego se realizó de forma manual, diariamente, para mantener la humedad del sustrato.
Se utilizó un diseño de bloques al azar con tres tratamientos. Estos consistieron en el empleo de las suspensiones de conidios en los FC de las dos cepas seleccionadas y un control sin inocular. Previo a la plantación se aplicaron 10 ml de inóculo al sustrato de cada tubete y se utilizaron siete réplicas por tratamiento.
Las evaluaciones se realizaron a los 90 días posteriores a la plantación. Las variables evaluadas fueron:
-Altura de las plantas (cm) se midió con una regla graduada desde la base hasta la inserción del último par de hojas.
-Número de pares de hojas
- Masa seca de la biomasa (g) en cada tratamiento. Para ello, las plantas se lavaron para eliminar los restos de sustrato, se secaron con papel de filtro y se secaron a 60 °C hasta masa constante.
Análisis estadísticos
Los datos fueron analizados con el paquete estadístico PASW Statistics, versión 23, para Windows. Se verificaron los supuestos de normalidad mediante la prueba Shapiro Wilk y la homogeneidad de varianzas por la prueva de Levene. Los datos de índice de solubilización se analizaron a través de un ANOVA de clasificación simple y las medias se compararon por la prueba HDS Tukey para p≤0.05. Los datos de las variables evaluadas a las plantas se analizaron por las pruebas H de Kruskal Wallis y la prueba U de Mann Whitney (p≤0.05), previa comprobación de que los datos no cumplían los supuestos de normalidad y homogeneidad de varianza.
RESULTADOS Y DISCUSIÓN
Solubilización de fosfatos in vitro
Todas las cepas fúngicas crecieron en el medio de cultivo PVK. La presencia de un halo traslúcido alrededor de las colonias indicó cualitativamente la solubilización de los fosfatos. Este halo se observó desde las 24 horas de incubación y se incrementó con el tiempo (Figura 1) en todas las cepas.
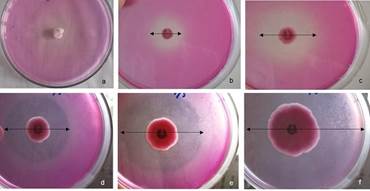
Figura 1 Colonias de Penicillium spp. CCIBP-Pen50 en medio de cultivo de Pikovskaya. (a) disco de micelio inoculado, (b) reverso de las colonias crecidas 24 horas, (c) 48 horas, (d) 72 horas, (e) 120 horas, (f) 7 días.
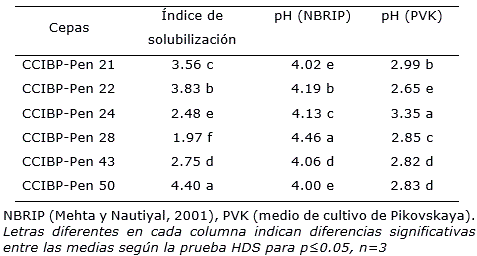
Se constató que el índice de solubilización varió con la cepa de Aspergillus y alcanzó el máximo valor (2.41) (p≤0.05) en CCIBP-Asp32 (Tabla 1). Varias especies de Aspergillus se han informado con resultados positivos en ensayos in vitro, entre las que se destaca Aspergillus niger (Li et al., 2015).
En las cepas de Penicillium spp., al igual que en Aspergillus, el índice de solubilización fue variable y se encontró entre 1.97 y 4.40. El máximo valor con diferencias significativas con el resto de las cepas se obtuvo en CCIBP-Pen50 (Tabla 2). La solubilización de varias fuentes de fosfato en medio de cultivo Pikosvkaya (Pikovskaya, 1948) es una prueba de laboratorio común y se emplea frecuentemente como el criterio inicial para el aislamiento de microorganismos con estas características.
En los dos medios de cultivo líquidos utilizados el pH descendió para todas las cepas con respecto al inicial (5.4 ± 2) después de 14 días de incubación (Tabla 1, Tabla 2). Además, se observó cambio de coloración del medio de cultivo (Figura 2). En general se observaron diferencias significativas entre las cepas de los dos géneros en ambos medios de cultivo. Se conoce que uno de los mecanismos de solubilización de fosfatos empleado por los hongos es la producción de diferentes ácidos orgánicos, tales como cítrico, oxálico, málico y glucónico (Chun-Chao et al., 2007; Shrivastava et al., 2018). Además, los resultados guardaron relación con los obtenidos por Zhang et al. (2018) quienes comprobaron que el pH del medio de cultivo se correlacionó con la capacidad de solubilización de fosfatos lo que sugirió que los hongos estudiados promovían la disolución de las fuentes de P mediante la segregación de ácidos orgánicos.

Figura 2 Solubilización de fosfatos en medio de cultivo Pikovskaya (líquido) por Aspergillus spp. CCIBP-Asp 32 (derecha) y control sin inocular (izquierda).
Los resultados de este estudio corroboraron hallazgos previos sobre la capacidad de cepas de Penicillium y Aspergillus de solubilizar fosfatos in vitro(Coutinho et al., 2012; Alfat et al, 2018; Zhang et al., 2018). Atendiendo a los resultados se seleccionaron las cepas CCIBP-Asp 32 y CCIBP- Pen 50 para evaluar su efecto sobre plantas de cafeto.
Efecto sobre el crecimiento de plantas de cafeto
A los 90 días de cultivo se observó que la aplicación al sustrato de inóculos de cepas fúngicas capaces de solubilizar fosfatos in vitro, puede tener efecto en el crecimiento de plantas de cafeto procedentes de embriogénesis somática (Tabla 3). Estos resultados fueron consistentes con los referidos por otros autores sobre la promoción del crecimiento en plantas inoculadas con cepas de Aspergillus y Penicillium que se atribuyen, además de la solubilización de fosfatos, a la producción de diferentes metabolitos secundarios (Hong-Yuan et al., 2015; Alfat et al., 2018; Shrivastava et al., 2018).
Tabla 3 Efecto de la inoculación de dos cepas solubilizadoras de fosfatos in vitrocrecidas en medio de cultivo Pikovskaya sobre el crecimiento de plantas de cafeto cv. ‘Caturra rojo’ a los 90 días de cultivo.
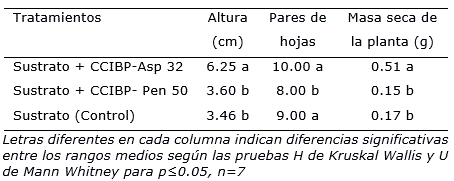
A pesar de alcanzar valores numéricos de índice de solubilización cercanos al doble de las cepas de Aspergillus, los resultados con Penicillium CCIBP-Pen 50 contrastaron con investigaciones previas donde se han informado resultados positivos en el crecimiento de plantas de otras especies (Patil et al., 2012; Radhakrishnan et al., 2014; Babu et al., 2015).
En contraposición, la cepa CCIBP-Asp32 incrementó significativamente la altura y la masa seca de las plantas. Una de las limitantes para la producción de semilla de cafeto por embriogénesis somática está en las pérdidas elevadas en la transferencia de las plantas a casa de cultivo (Georget et al., 2017). En este sentido, los resultados de este trabajo sientan las bases para profundizar en estudios que permitan seleccionar cepas fúngicas con actividad de promoción del crecimiento que impacten en mejorar los índices de eficiencia en esta fase.
Atendiendo a lo anterior CCIBP-Asp32 podría ser un candidato potencial para la formulación de un bioproducto que pueda utilizarse en casa de cultivo y en vivero. Se conoce que el crecimiento de plantas de cafeto se puede reducir en condiciones de baja disponibilidad de P (Neto et al., 2016). En este sentido, la aplicación del bioproducto en estas etapas sería una alternativa para hacer más eficiente el uso de las fuentes de fosfatos añadidas al sustrato. La actividad microbiana en el suelo tiene efecto sobre los patrones de enraizamiento de las plantas, los nutrientes que estas pueden utilizar y modifican los exudados radicales. Además, las formulaciones líquidas aplicadas directamente en el suelo tienen como ventaja una mayor concentración de estructuras fúngicas por unidad de área, entre otras (Alfat et al., 2018).
CONCLUSIONES
Cepas de Aspergillus spp. y Penicillium spp. de la Colección de Cultivos Microbianos del IBP solubilizan fosfatos in vitro y tienen uso potencial como promotores del crecimiento vegetal. La cepa CCIBP-Asp32 incrementa el crecimiento de plantas de cafeto cv. ‘Caturra rojo’ en casa de cultivo.