Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.27 no.3 Santiago de Cuba set.-dic. 2015
ARTICULOS
Aislamiento y caracterización de metabolitos de hojas de Croton linearis Jacq.
Isolation and characterization of metabolites from Croton linearis Jacq. leaves
Lic. Jesús García-DíazI, Dr. C. Julio C. Escalona-ArranzI, Dr. C. Mario G. do CarvalloII, MSc. Julio Rojas-VargasI, MSc. Roberto Machado-GarcíaI, Lic. Jorge de la Vega-AcostaIII
IFacultad de Ciencias Naturales, Universidad de Oriente, Santiago de Cuba, Cuba, jgadi@cnt.uo.edu.cu, jcea@cnt.uo.edu.cu, jarojas@cnt.uo.edu.cu, robertomg@cnt.uo.edu.cu
IIInstituto de Ciencias Exactas, Universidad Federal Rural de Río, Río de Janeiro, Brasil
IIICentro de Toxicología y Biomedicina, Universidad de Ciencias Médicas, Santiago de Cuba, Cuba, jitodelavega@gmail.com
RESUMEN
A partir de un extracto etanólico de las hojas de Croton linearis Jacq. se aislaron e identificaron un total de siete compuestos: dos alcoholes de cadena larga: 2-metil-tretradecan-2-ol (1) y el hexacosanol (3); un alcano lineal saturado: tetracosano (2); tres ácidos grasos: ácido esteárico (4), ácido 5,8-dien-tetradecanóico (6) y ácido oléico (7); así como una flavona trimetoxilada: 5-hidroxi-3,7,4'-trimetoxiflavona (5). Las estructuras de los compuestos se elucidaron utilizando técnicas espectroscópicas como la Resonancia Magnética Nuclear (1H y 13C) unidimensional y bidimensional, así como también Cromatografía Gaseosa/Espectrometría de Masas y los índices de retención de Kovats en casos necesarios. La posición de los sustituyentes se asignó por la combinación de los experimentos heteronucleares HMBC, HMQC y homonuclear 1H-1H COSY. Todos los compuestos identificados constituyen un primer reporte para la especie en estudio.
Palabras clave: Croton linearis, metabolitos, aislamiento, flavona.
ABSTRACT
From an ethanolic extract of Croton linearis Jacq. leaves were isolated and identified a total of 7 compounds: two long chain alcohols: 2-methyl-tretradecan-2-ol (1) y el hexacosanol (3); a linear saturated hydrocarbon: tetracosane (2); three fatty acids: stearic (4), 5,8-dien-tetradecanoic (6) and oleic acid (7); as well as a tri-methoxylated flavone: 5-hydroxy-3,7,4'-trimethoxyflavone (5). Structures of the compounds were elucidated by spectroscopic techniques as Nuclear Magnetic Resonance 1D and 2D (1H and 13C), as well as Gas Chromatography/Mass Spectrometry and Kovats retention indexes when necessary. The substituent positions were assigned based on combination of heteronuclear HMBC and HMQC as well as homonuclear 1H-1H-COSY experiments. All identified compounds constitute a first report for the specie in study.
Keywords: Croton linearis, metabolites, isolation, flavone.
INTRODUCCIÓN
Esta diversidad de propiedades medicinales es muestra de la alta diversidad de metabolitos reportados para las especies del Croton: terpenoides [7], aceites esenciales, alcaloides [8], y compuestos fenólicos como flavonoides y taninos [9].
En Cuba se ha reportado la existencia de 47 especies pertenecientes a este género, las cuales son empleadas con fines curativos por parte de la población [10]. Una de ellas resulta el Croton linearis Jacq, el cual es un arbusto naturalizado en Cuba que se encuentra distribuido en la región oriental y para el cual existen muy pocos estudios. En el Croton linearis se ha detectado la presencia de varios alcaloides y terpenos al igual que otras especies del género C. micradenus Urb y C. stenophyllus Griseb [11, 12]. Entre los alcaloides aislados en el C. linearis se encuentran Crotonosine, Hernovine, Jacularine, Nuciferine, Salutaridine, Wilsonirine, Crotonoside y Linearisine [13]; mientras que entre los terpenos aislados se encuentran el diterpeno 7-Hydroxy-1,6-cyclo-2,10, 14-phytatrien-4-one, con probada acción antinsecticida [14], el monoterpeno ácido angélico [13] y el sesquiterpeno Vomifoliol [15]. No obstante a estos informes, los estudios fitoquímicos de la especie han estado enfocados a la determinación solamente de este tipo de metabolitos y datan ya de varias décadas, careciendo de reportes relacionados con la especie que crece en Cuba.
Es por ello que en el presente trabajo nos proponemos caracterizar químicamente metabolitos aislados del extracto etanólico total de hojas de C. linearis Jacq. que crece en Cuba.
MATERIALES Y MÉTODOS
Material vegetal
Las hojas de C linearis Jacq fueron recolectadas en septiembre 2012 en la Reserva Ecológica Siboney-Juticí, Santiago de Cuba, Cuba. Una muestra del material fue identificada por el taxónomo Félix Acosta, siendo registrada con el número 21 659 en el Herbario del Centro Oriental de Ecosistema y Biodiversidad (BIOECO). El material vegetal se sometió a un proceso de secado a la sombra a temperatura ambiente durante 14 días hasta que se obtuvo un peso constante.
Extracción y aislamiento
Fueron sometidos 800 g de hojas secas de C. linearis a un proceso de extracción por maceración con recirculación cada 48 h del solvente etanol al 95 %, durante 6 días. Para ello la droga fue humectada con el menstruo de extracción por 2 h y luego se procedió a cargar el percolador de acero inoxidable. El extracto obtenido se concentró a presión reducida con control de la temperatura por debajo de los 50 °C hasta 150 mL.
El extracto blando fue acidificado con solución de ácido clorhídrico 0,1 M (HCl) y se extrajo con n-hexano hasta el agotamiento, verificándose la ausencia de alcaloides en la fase orgánica (negativo ante reactivo de Wagner). El extracto acuoso ácido se basificó con hidróxido de sodio al 5 % (NaOH) hasta pH = 10, y se sometió a extracción con n-hexano (fracción A) y 1,2-dicloroetano (fracción B). Ambas fracciones fueron evaluadas cualitativamente con el reactivo de Wagner y se concentraron a sirope a presión reducida con control de la temperatura por debajo de los 50 °C para la posterior separación por cromatografía de columna.
Las columnas cromatográficas fueron construidas a base de silica gel 60, 70-230 mesh. Para la elusión de las columnas se emplearon mezclas de n-hexano/1,2-dicloroetano (100:0, 80:20, 60:40, 40:60 y 20:80, v/v) y 1,2-dicloroetano-metanol (100:0, 90:10, 80:20 y 70:30). La colecta de las fracciones fue asistida por empleo de una lámpara ultravioleta WD.9403E (China) a las longitudes de onda de 254 y 363 ηm. De la columna de n-hexano se aislaron los compuestos 1, 2 y 3. Los compuestos 1 y 2 eluyeron con n-hexano, mientras que el compuesto 3 con la mezcla n-hexano/1,2-dicloroetano 60:40. De la columna de 1,2-dicloroetano fueron aislados los compuestos 4, 5, 6 y 7. El compuesto 4 eluyó con la mezcla n-hexano/1,2-dicloroetano 80:20, el 5 con la mezcla n-hexano/1,2-dicloroetano 60:40, mientras que los compuestos 6 y 7 eluyeron con el sistema n-hexano/1,2-dicloroetano 40:60.
Procedimientos experimentales generales
A los compuestos aislados se les determinaron sus espectros UV/Visible disueltos en cloroformo (CHCl3); se empleó para ello un espectrofotómetro Ray Leigh (China). Los espectros de resonancia magnética nuclear unidimensional protónica (1H) y de carbono (13 C-DEPT), así como los espectros bidimensionales (COSY, HSQC y HMBC) se obtuvieron por medio de un equipo Bruker a 500 MHz en CDCl3 (Departamento de Química, Instituto de Ciencias Exactas, Universidad Federal Rural de Rio de Janeiro, Brasil). El análisis por CG/EM se realizó en un equipo SHIMADZU GCMS-QP500 de procedencia japonesa, constituido por un cromatógrafo de gases Mega 2 series acoplado a un espectrómetro de masas cuadrupolar de impacto electrónico positivo a 70 eV (modo de ionización) y un intervalo de masas entre 10 y 500 u (Unidad de Análisis Instrumental de TOXIMED de la Facultad de Ciencias Médicas, Santiago de Cuba, Cuba). Las condiciones cromatográficas fueron: columna capilar DB-5MS (30 m x 0,32 mm x 1 µm) y helio como gas portador. El programa de temperatura empleado fue: 30 °C (3 min), 4 °C/min hasta 250 °C (10 min.). Las muestras fueron corridas con alcanos lineales C+2 desde C-8 hasta C-32 para la determinación de los índices de retención de Kovats en casos necesarios.
RESULTADOS Y DISCUSIÓN
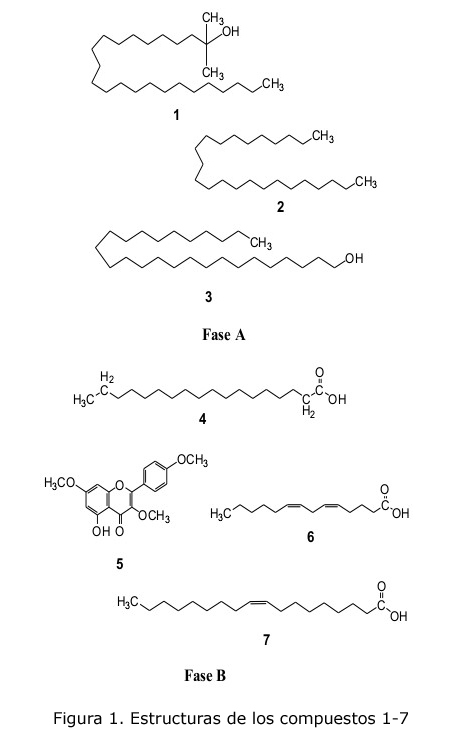
El extracto alcohólico concentrado de las hojas de C. linearis Jacq. fue sometido a una marcha separativa ácido-base, resultado de la cual se obtuvieron las fases de n-hexano (A) y de 1,2-dicloroetano (B). De la fase A se aislaron los compuestos 1, 2 y 3, mientras que de la fase B se aislaron los compuestos 4, 5, 6 y 7 (figura 1). La elucidación de cada estructura se realizó por la interpretación de la data de los espectros UV/Vis, 1D-RMN, 2D-RMN y CG-EM.
Compuesto 1: Residuo incoloro, no presenta absorción en la región del espectro UV-Visible en cloroformo. En el espectro RMN 1H, se observaron la señales a: δH 0,86 (m, J = 12,5 Hz) correspondiente al metilo terminal (-CH3), otra a δH 1,10 asignada a los protones de los grupos metilos (-CH3) enlazados al carbono cuaternario y una señal intensa a δH 1,23 (d, J = 5,9 Hz) correspondiente a los protones de los grupos metilenos (-CH2-). En el sentido inferior del espectro RMN 13C DEPT la señal a δC 15,48 corresponde al carbono del metilo terminal (-CH3), la señal a δC 32,58 quedó asignada a los otros dos carbonos metilos (-CH3) unidos al carbono cuaternario (δC 60,86 ) que porta el grupo hidroxilo (C-OH), ya que es la región característica de los alcoholes. Las restantes señales corresponden a los carbonos de los grupos metilenos (-CH2-) de la cadena lineal hidrocarbonada. Esta data indica que la estructura del compuesto 1 es un alcohol terciario lineal (figura 1). La definición final de la estructura se logra por el análisis del espectro de masas (EI = 70 eV), en el cual se observa, además del patrón de fraccionamiento normal característico de las cadenas hidrocarbonadas lineales y el ion molecular en m/z 369 [M+H]+, una pérdida de 73 unidades (368 - 295 = 73) característica de los alcoholes terciarios. El compuesto 1 fue nombrado 2-metil-tretradecan-2-ol.
Compuesto 2: Residuo incoloro, no presenta absorción en la región del espectro UV-Visible en cloroformo. En el espectro RMN 1H se observaron únicamente dos señales: una a δH 0,87 (t, J = 5,9 Hz) correspondiente a los metilos terminales (-CH3) y otra señal intensa a δH 1,24 perteneciente a los protones de los grupos metilénicos (-CH2). En el espectro RMN 13C, la señal en sentido inferior del espectro a δC 15,47 confirma la presencia de los grupos metilos terminal (-CH3). Mientras que, en sentido opuesto, las señales entre δC 24,03 y δC 33,27 fueron asignadas a los carbonos metilénicos (-CH2). En el espectro de masas (EI = 70 eV) se observó un patrón de fraccionamiento normal de cadenas hidrocarbonadas lineales con picos característicos en 183, 169 [(M+H) – CH3], 155, 141, 127, 113, 99, 85, 71, 57 y 43 u. Aunque el ion molecular no pudo ser detectado, la identificación de este alcano lineal se realizó por cálculo de su índice de retención de Kovats, el cual fue de 2 388, valor muy cercano al 2 400 que teóricamente debiera presentar un alcano lineal de 24 átomos de carbono. Estas razones permitieron identificar al compuesto 2 como tetracosano (figura 1) de fórmula molecular C24H50 y masa molecular en m/z 338 [M+.].
Compuesto 3: Polvo cristalino de color blanco, no presenta absorción en la región del espectro UV-Visible en cloroformo. El espectro RMN 1H presentó cinco señales: la primera a δH 3,63 (t, J = 6,5 Hz) asignada a los protones del grupo metilo unido a un hidroxilo (CH2OH); la segunda a δH 0,87 (t, J = 6,3 Hz), que corresponde a los protones del metilo terminal CH3); la tercera a δH 1,25 asignada a los protones de los grupos metilenos (-CH2-); la cuarta a δH 1,58 y la quinta a δH 1,47 quedaron asignadas a los protones de los grupos metilenos alfa y beta con respecto al grupo CH 2 -OH. En el espectro RMN 13C, la señal en sentido superior del espectro a δC 64,45 fue asignada al carbono unido al grupo hidroxilo (-CH2OH), mientras que las señales a δC 33,28 y δC 27,09 confirman la presencia de los carbonos alfa (α-CH2) y beta (ß-CH2). Las señales restantes fueron asignadas al resto de los carbonos metilenos (-CH2), mientras que la única señal en sentido inferior del espectro a δC 15,47 corresponde al grupo metilo terminal, lo que conlleva a establecer como patrón estructural un alcohol primario de larga cadena (figura 1). En el espectro de masas (EI = 70 eV) se observa el ion molecular en m/z 382 (M+.), un patrón de fraccionamiento normal de cadenas hidrocarbonadas lineales y la pérdida del hidroxilo y agua representados por los picos en m/z 365 y 364. Atendiendo al índice de retención de Kovats calculado IR = 2 884 y al ion molecular detectado se identificó el compuesto como el hexacosanol, de fórmula C26H54O compatible con el peso molecular detectado.
Compuesto 4: Polvo blanco amorfo, no presenta absorción en la región del UV-Visible en cloroformo. El espectro RMN 1H presentó señales en δH 2,36 (t, J = 7,5 Hz, 2H) y δH 1,65 ppm ( dd, J = 7,1 Hz, 2H) correspondientes a los protones metilenos alfa (α-CH2) y beta (ß-CH2) respecto al carbono carboxílico, confirmado por el acoplamiento mutuo observado en el espectro 1H-1H COSY. Por otro lado, la señal intensa a δH 1,27 corresponde a los grupos metilenos y la señal a δH 0,90 (t, J = 6.7 Hz, 3H) al grupo metilo terminal (-CH3) . El espectro RMN 13C (DEPT) muestra una señal δC 173,48 perteneciente al carbono carbonilo (C=O) de un grupo carboxilo, las restantes señales confirman lo observado en RMN 1H: δC 34,03 y δC 24,80 carbonos alfa y beta respecto al carboxilo, señales entre δC 22,70 y δC 31,93 correspondientes a los carbonos metilénicos y δC 14,11 asignada al carbono metilo terminal (-CH3). Estas asignaciones quedaron finalmente establecidas por las correlaciones mutuas directas entre C-H observadas en el espectro 1H-13C HSQC y las correlaciones a dos enlaces H-C-C establecidas en el espectro bidimensional 1H-13C HMBC. Sobre la base de la comparación de los datos reportados en la literatura y los reportes de esta sustancia para otras especies del género Croton [16, 17] se propuso al ácido esteárico como el compuesto 4.
Compuesto 5: Polvo de color amarillo claro. El espectro UV/Visible (CHCl3) mostró dos máximos de absorción a 270 nm y 307 nm, correspondientes a flavonoides, según lo reportado en la literatura [18]. Los valores obtenidos en el espectro RMN 1H (tabla 1) indican la presencia de tres sustituyentes metoxilos con desplazamientos químicos a δH 3,88 (3-OCH3); 3,89 (7-OCH3) y 3,92 (4'-OCH3). También muestra los dobletes a δH 7,05 (H-3' y H-5') y 8,10 (H-2' y H-6') con J = 8,9 Hz de un anillo C p -sustituido, demostrado, además, por análisis vecinal 1H-1H-COSY. Por último, se aprecian tres singletes, dos a δH 6,38 y 6,47, asignables a los protones H-6 y H-8, respectivamente, y uno desplazado a δH 12,68 correspondiente al protón del grupo OH en posición 5. Del RMN 13C (tabla 1) se obtuvieron 16 señales, coincidentes con un núcleo de flavona trimetoxi sustituida.
TABLA 1. DATOS DE RMN 1H y 13C UNIDIMENSIONAL Y BIDIMENSIONAL
(1H-1H COSY, 1H-13C HMBC) DEL COMPUESTO 4
| No | δC | δH | 1H-1H COSY | 1H-13C HMBC |
| 1 ' | 122,80 | - | - | - |
| 2 ' | 130,19 | 8,10 | 7,05 | 130,19 156,00 161,68 |
| 3 ' | 114,07 | 7,05 | 8,10 | 114,07 122,80 161,68 |
| 4 ' | 161,68 | - | - | - |
| 5 ' | 114,07 | 7,05 | 8,10 | 114,07 122,80 161,68 |
| 6 ' | 130,19 | 8,10 | 7,05 | 130,19 156,00 161,68 |
| 2 | 156,00 | - | - | - |
| 3 | 138,86 | - | - | - |
| 4 | 178,80 | - | - | - |
| 5 | 162,01 | - | - | - |
| 6 | 97,83 | 6,38 (s, 1H) | - | 165,41 162,01 106,05 92,16 |
| 7 | 165,41 | - | - | - |
| 8 | 92,16 | 6,47 (s, 1H) | - | 165,41 156,76 97,83 106,05 |
| 9 | 156,76 | - | - | - |
| 10 | 106,05 | - | - | - |
| OH | - | 12,68 (s, 1H) | - | 162,01 97,83 106,05 |
| 3-OMe | 60,17 | 3,88 (s, 9H) | - | 138,86 |
| 7-OMe | 55,82 | 3,92 (s, 9H) | - | 165,41 |
| 4'-OMe | 55,46 | 3,89 (s, 9H) | - | 161,68 |
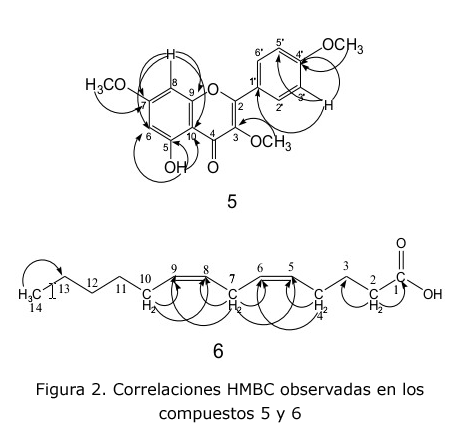
La posición de los sustituyentes (tres OCH3 y un OH) sobre el esqueleto de la flavona fue posteriormente confirmada vía HMBC (figura 2), lo que permitió definir los desplazamientos químicos de los carbonos que los sustentan, que son 3,88 (3-OCH3); 3,89 (7-OCH3) y 3,92 (4'-OCH3) y muestran correlación a tres enlaces con C-3 (δC 138,86), C-7 (δC 165,41) y C-4' (δC 161,68), respectivamente.
El protón del sistema aromático a δH 6,47 (H-8) muestra correlación a tres enlaces con C-6 (δC 97,83) y C-10 (δC 106,05) y a dos enlaces con C-9 (δC 156,76) y C-7 (δC 165,41), confirmando la posición de uno de los grupos metoxilos en C-7. Los protones a δH 8,10 (H-2'/H-6') exhiben correlación a tres enlaces con C-4' (δC 161,68), C-2'/C-6' (δC 130,19) y C-2 (δC 156,0), mientras que los H-3'/H-5' (δH 7,05) correlacionan a tres enlaces con C-1' (δC 122.80) y a dos enlaces con C-4' (δC 161,68) confirmando la presencia de un segundo grupo metoxilo en C-4'. La señal del protón del grupo OH (δH 12,68) correlaciona a tres enlaces con C-6 (δC 97,83) y C-10 (δC 106,05) y a dos enlaces con C-5 (δC 62,01) confirmando la posición sobre C-5 de este sustituyente, lo que impone al tercer metoxilo en posición C-3, confirmado por el espectro 1H-13C HSQC.
Los datos reportados para esta sustancia coinciden con los valores encontrados en la literatura para la 5-OH-3,7,4'-trimetoxiflavona [19]. La determinación de esta flavona en C. linearis resulta novedosa para la especie, aunque no para el género, pues anteriormente fue aislada en C. cajucara [20]. En el espectro de masas se observó el ion molecular en m/z 328 (M+), así como los picos en m/z 327 [M-H]+ y 299 [M-H-CO]+ característicos de flavonas y flavonoles. Además, aparecen los picos m/z 285 [M-CO-CH3]+ y m/z 135 característicos de 4'-metoxiflavonas, lo que confirma la estructura propuesta.
Compuestos 6 y 7: Fueron obtenidos en una mezcla en forma de residuo incoloro; se observa un máximo de absorción a 268 nm en su espectro UV/Visible (CHCl 3). Los datos de RMN (1 H y 13C) y 1H-1H-COSY, 1 H-13C-HMBC ) para los compuesto 6 y 7 se recogen en la tabla 2. Para el compuesto 6, en el espectro RMN 1H, la señal a δH 5,37 fue asignada a los protones olefínicos (H-5, H-6, H-8 y H-9). Las señales a δH 2,36; 1,65 y 0,90 corresponden a los protones H-2, H-3, y H-14, mientras que los protones H-11, H-12 y H-13 se asignaron a la señal en δH 1,27. La señal a δH 2,80 corresponde a los protones H-7, mientras que las señales a δH 2,05 corresponden a protones metilénicos H-4 y H-10. Del RMN 13C se extrajeron 14 señales, los desplazamientos a δC 179,95; δC 33,71; δC 24,70 y δC 14,11 se asignaron a los carbonos de los grupos C=O de grupo carboxilo, C-2, C-3, y C-14, respectivamente.
TABLA 2. DATOS DE RMN 1H y 13C UNIDIMENSIONAL Y BIDIMENSIONAL
(1H-1H COSY, 1H-13C HMBC) DE LOS COMPUESTOS 6 Y 7
| No |
| Compuesto 6 |
|
|
| Compuesto 7 |
| |
| δC | δH | H1-H1 | H1-C13 | δC | δH | H1-H1 | H1-C13 | |
| 1 | 179,95 | - | - | - | 179,88 | - | - | - |
| 2 | 33,71 | 2,36 | 1,65 | 24,70 | 34,06 | 2,36 | 1,65 | 24,70, 179,88 |
| 3 | 24,70 | 1,65 | 2,36 | 34,06 | 24,58 | 1,65 | 2,36 | 34,06, 179,91, |
| 4 | 26,70 | 2,05 (m, 4 H) | 5,37 | 128,07 129,73 | 29,04 | 1,27 (m) | - | - |
| 5 | 128,07 | 5,37 (m, 4 H) | 2,05 | - | 29,08 | 1,27 (m) | - | - |
| 6 | 129,73 | 5,37 (m, 4 H) | 2,80 | - | 29,15 | 1,27 (m) | - | - |
| 7 | 25,62 | 2,80 | - | 127,91 128,07 129,73 | 29,25 | 127 (m) | - | - |
| 8 | 127,91 | 5,37 (m, 4 H) | 2,80 | - | 27,16 | 2,05 (m, 4 H) | 5,37 | 130,02 |
| 9 | 130,21 | 5,37 (m, 4 H) | 2,05 | - | 130,02 | 5,37 (m, 2 H) | 2,05 | - |
| 10 | 27,22 | 2,05 (m, 4 H) | 5,37 | 127,91 130,21 | 130,02 | 5,37 (m, 2 H) | 2,05 | - |
| 11 | 29,45 | 1,27 (m) | - | - | 27,19 | 2,05 (m, 4H) | 5,37 | 130,02 |
| 12 | 31,53 | 1,27 (m) | - | - | 29,71 | 1,27 (m) | - | - |
| 13 | 22,70 | 1,27 (m) | 0,90 | 14,11 | 29,33 | 1,27 (m) | - | - |
| 14 | 14,11 | 0,90 | 1,27 | 22,70 | 29,60 | 1,27 (m) | - | - |
| 15 | - | - | - | - | 29,37 | 1,27 (m) | - | - |
| 16 | - | - | - | - | 31,93 | 1,27 (m) | - | - |
| 17 | - | - | - | - | 23,18 | 1,27 (m) | 0,90 | 15,78 |
| 18 | - | - | - | - | 15,78 | 0,90 | 1,27 | 23,18 |
Por otro lado, la presencia de las 4 señales en la parte inferior del espectro a δC 130,21; δC 129,73; δC 128,07 y δC 127,91 confirmó la existencia de dos dobles enlaces (C-5, C-6, C-8 y C-9), los cuales no se encuentran conjugados, pues la señal a δC 25,62 corresponde al C-7, lo cual fue confirmado por el experimento 1H-1H-COSY. Las dos señales a δC 26,7 y δC 27,22 fueron asignadas a C-4 y C-10, mientras que las otras tres señales restantes a δC 29,45; δC 31,53 y δC 22,70 corresponden a los carbonos metilénicos C-11, C-12 y C-13, respectivamente. Por vía de la interpretación de los espectros bidimensionales 1H-13C- HSQC, 1H-13C- HMBC (figura 2) y por comparación con los datos reportados para este compuesto [21], quedaron asignadas definitivamente cada una de las señales, por lo que el compuesto 6 fue nombrado como ácido tetradeca-5,8-dienoico.
Para el compuesto 7, en el espectro RMN 1H, las señales en δH 5,37; 2,36; 2,05; 1,65, 1,27 y 0,90 quedaron asignadas a los mismos patrones del compuesto 6. En el espectro RMN 13C, la señal a δC 179,88 corresponde al carbono carbonilo del grupo carboxilo (-COOH), mientras que a δC 34,06 y a δC 24,58 quedaron asignadas al carbono alfa (C-2) y beta (C-3), respectivamente. Por otro lado, la señal a δC 15,78 corresponde al C-18, mientras que una señal más intensa que las observadas en la misma región en el entorno de los carbonos olefínicos para el compuesto 6 a δC 130,02 confirma la presencia de un único doble enlace (-C=C-), permitiendo diferenciar a este compuesto del anterior. Las señales a δC 27,16 y a δC 27,19 fueron asignadas a los carbonos C-8 y C-11. Las señales que se encuentran desplazadas en la región de los carbonos metilenos que no fueron asignadas al compuesto 6 (10 señales) fueron tomadas como referencias y comparadas con los datos bibliográficos reportados para el compuesto 7. Los análisis de los espectros 1H-1HCOSY (tabla 2), 1H-13C- HSQC y 1H-13C- HMBC permitieron corroborar el patrón estructural de un ácido lineal insaturado, el cual fue nombrado ácido oleico, atendiendo a las coincidencias establecidas con los reportes bibliográficos [22].
CONCLUSIONES
La caracterización química de los compuestos aislados del extracto total de las hojas de la especie Croton linearis Jacq. que crece en Cuba permitió la identificación de 7 compuestos correspondientes a dos alcoholes de cadena larga, un hidrocarburo saturado lineal, tres ácidos grasos y una flavona trimetoxilada. Si bien la determinación de los mismos en la especie constituye un nuevo reporte para el Croton linearis, metabolitos de naturaleza química similar han sido aislados en otras especies de Croton, confirmando los patrones quimiotaxonómicos que caracterizan al género.
REFERENCIAS BIBLIOGRÁFICAS
1. BERRY, P. E.; HIPP, A. L.; WURDACK, K. J.; VAN EE, B.; RIINA, R., "Molecular Phylogenetics of the giant genus Croton and tribe Crotoneae (Euphorbiaceae sensu stricto) using its and TRNL-TRNF DNA sequence data", American Journal of Botany, 2005, 92(9), 1520-1534.
2. LIMA, S.; CITO, A.; LOPES, J.; NETO, J. ; CHAVES, M.; SILVEIRA, E., "Fixed and volatile constituents of genus Croton plants: C. adenocalyx Baill-Euphorbiaceae", Revista Latinoamericana de Química, 2010, 38(3), 133-144.
3. SALATINO, A.; SALATINO, M.; NEGRI, G., "Traditional uses, chemistry and pharmacology of Croton species (Euphorbiaceae)", Journal of the Brazilian Chemical Society, 2007, 18(1), 11-33.
4. SOCORRO, D. et al., "Essential Oil Composition of Croton palanostigma Klotzsch from North Brazil", Journal of the Brazilian Chemical Society, 2009, 20(6), 1188-1192.
5. MARCELINO, V. et al., "Phytochemistry of the Genus Croton", en GUPTA, Vijay Kumar; FERREIRA, Fernanda M.; BOSE, Anamika; PRYME, Ian F. (ed.), Natural Products: Research Reviews, vol. 1, New Delhi, Daya, 2012, 1, 221-370.
6. YAW, P., "Antibacterial Properties of Croton Species" [master's thesis], Joensuu, University of Eastern Finland, 2012.
7. CARDOSO, N. et al., "Antimicrobial and antibiofilm action of Casbane Diterpene from Croton nepetaefolius against oral bacteria", Archive of Oral Biology, 2012, 57(5), 550-555.
8. ARAÚJO-JÚNIORA, V. et al., "Muscicapines a New Class of Guaiane-Type Sesquiterpene Alkaloids from Croton muscicapa)", Journal of the Braziliam Chemical Society, 2005, 16(3b), 553-557.
9. LOPES, E. L.; NETO, M. A.; SILVEIRA, E. R.; PESSOA, O. D. L.; BRAZ, R., "Flavonoids and sesquiterpenes of Croton pedicellatus Kunth", Química Nova, 2012, 35(11), 2169-2187.
10. PAYO, A.; DOMINICIS, M.; MAYOR, J.; OQUENDO, M.; SARDUY, R., "Tamizaje fitoquímico preliminar de especies del género Croton L", Revista Cubana de Farmacia, 2001, 35(3), 203-206.
11. SÁNCHEZ, V.; SANDOVAL, D., "Alcaloides en especies cubanas del género Croton L. II. Contribución al estudio químico del C. stenophyllus Griseb", Revista Cubana de Farmacia, 1982, 16(), 45-55.
12. PAYO, A.; SANDOVAL, D.; VÉLEZ, H.; OQUENDO, M., "Alcaloides en la especie cubana Croton micradenus Urb", Revista Cubana de Farmacia, 2001, 35(1), 61-65.
13. FARNSWORTH, N. R.; BLOMSTER, R. N.; MESSMER, W. M.; KING, J. C.; PERSINOS, G. J.; WILKES, J. D., "A Phytochemical and biological review on the genus Croton", Lloydia, 1969, 32(1), 1-28.
14. IVOR, C. A.; KEITH, O.P.; MANCHARD, P.; LAWRENCE A. D. W., "An Insecticidal Diterpene from Croton linearis", Phytochemistry, 1991, 30(6), 1801-1803.
15. STUART, K. L.; ROBERTS, E. V.; WHITTLE, Y. G., "A general method for vomifoliol detection", Phytochemistry, 1976, 15(2), 332-333.
16. ASUZU, I. U.; GRAY, A. I.; WATERMAN, P. G., "The extraction, isolation and identification of the purgative component of Croton penduliflorus seed oil", Journal of Ethnophamacology, 1988, 23(2-3), 267-271.
17. RASHAD, M., "Phytochemical Investigation of Medicinally Important Croton Sparsiflorus and Ziziphora tenuior Plants" [tesis doctoral], Karachi, Pakistán, Universidad de Karachi, 2011.
18. ANDERSON, Ø. M.; MARKHAM, K. R. (ed.), Flavonoids: Chemistry, Biochemistry and Applications, USA, CRC Press / Taylor & Francis Group, Boca Ratón, Florida, 2006.
19. ALl-OQAIL, M.; HASSAN, W.; AHMAD, M. S.; AL-REHAILY, A. J., "Phytochemical and biological studies of Solanum schimperianum Hochst", Saudi Pharmaceutical Journal, 2012, 20(4), 371-379.
20. MACIEL, M. A. et al., "Ethnopharmacology, phytochemistry and pharmacology: a successful combination in the study of Croton cajucara", Journal Ethnopharmacology, 2000, 70(1), 41-55.
21. GOESE, M. et al., "Biosynthesis of Lipstatin. Incorporation of Multiply Deuterium-Labeled (5Z,8Z)-Tetradeca-5,8-dienoic Acid and Octanoic Acid", Journal Organic Chemistry, 2001, 66(13), 4673-4678.
22. VLAHOV, G.; KIPRONO CHEPKWONY, P.; NDALUT, P. K., "13C NMR Characterization of Triacylglycerols of Moringa oleifera Seed Oil: An «Oleic-Vaccenic Acid» Oil", Journal of Agricultural and Food Chemistry, 2002, 50(5), 970-975.
Recibido: 14/12/2014
Aceptado: 26/01/2015
Lic. Jesús García-Díaz, Facultad de Ciencias Naturales, Universidad de Oriente, Santiago de Cuba, Cuba, jgadi@cnt.uo.edu.cu