Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Química
versión On-line ISSN 2224-5421
Rev Cub Quim vol.28 no.3 Santiago de Cuba dic. 2016
ARTICULOS
Desproteinización de muestras de suero y plasma para el estudio analítico de carbamazepinan
Serum and plasma samples deproteinization for analytical studies of carbamazepine
MSc. Yamilé Heredia-DíazI, MSc. Roberto Machado-GarcíaI, Lic. Marllelyn Mendoza-SuárezII, Lic. Deylis Jardines-CalaIII, MSc. AlbisVázquez-DomínguezIV
IUniversidad de Oriente, Santiago de Cuba, Cuba, yherediad@uo.edu.cu
IIDirección Municipal de Salud Manuel Tames, Jamaica, Guantánamo, Cuba
IIICentro de Toxicología y Biomedicina, Santiago de Cuba, Cuba
IVHospital Docente Clínico Quirúrgico Ginecobstétrico "Juan Bruno Zayas", Santiago de Cuba, Cuba
RESUMEN
La determinación cuantitativa de carbamazepina en muestras de suero y plasma, requiere de tratamiento previo para eliminar las proteínas. Con el propósito de seleccionar el agente desproteinizante que garantice la mayor eficacia para removerlas se utilizaron metanol y ácido tricloroacético al 10 %. Las proporciones de suero/plasma-desproteinizante utilizadas fueron 1:2 para el metanol y 1:0,2 para el ácido tricloroacético. La evaluación de la eficiencia de la desproteinización se realizó aplicando la espectrofotometría UV, registrándose los espectros de las muestras desproteinizadas en un rango de absorbancia de 200-340 nm. El criterio de selección fue la disminución de la intensidad de absorbancia a las longitudes de onda de máxima absorción de las proteínas. El metanol garantizó una reducción de la absorbancia en la región espectral cercana a los 235 nm y 280 nm tanto en el suero como en el plasma. El ácido tricloroacético al 10 % no mostró efectividad para eliminar las proteínas.
Palabras clave: Carbamazepina, determinación cuantitativa, suero, plasma, espectrofotometría UV-Visible.
ABSTRACT
The quantitative determination of carbamazepine in human serum and plasma, it requires of a previous treatment to eliminate the proteins. In this study were used methanol and trichloroacetic acid to 10 %, with the purpose of selecting the protein precipitant that guarantees the biggest effectiveness to remove the proteins. The proportions serum/plasma-protein precipitant 1:2 for the methanol and 1:0,2 for the trichloroacetic acid were used. The evaluation of the efficiency of protein precipitation was carried out applying UV spectrophotometry; the spectra of the precipitated samples were registering in the range of 200-340 nm. The selection approach was the decrease from the absorbance intensity to the wave lengths of maximum absorption of the proteins. The methanol guaranteed a reduction of the absorbance in the region near at 235 nm and 280 nm as much in the serum as in the plasma. The trichloroacetic acid 10% didn't show effectiveness to remove the proteins.
Keywords: Carbamazepine, quantitative determination, serum, plasma, UV- spectrophotometry.
INTRODUCCIÓN
La carbamazepina (CBZ) es un antiepiléptico clásico (figura 1) derivado del iminoestilbeno relacionado químicamente con los antidepresivos tricíclicos del tipo de la imipramina. Se utiliza como antiepiléptico, analgésico y antimaníaco. Se metaboliza a 10-11 epoxicarbamazepina, que tiene efectos terapéuticos y tóxicos similares a los de la CBZ. La fenitoína, el fenobarbital y la primidona pueden reducir a la mitad los niveles de CBZ y aumentan los de su metabolito activo con riesgos de efectos tóxicos UV spectrophotometry [1].
El intervalo óptimo de niveles séricos de CBZ es de 6-12 mg/L aunque pueden ocurrir considerables variaciones [2].
Con el fin de determinar los niveles plasmáticos de carbamazepina se han desarrollado varios métodos cromatográficos: cromatografía gaseosa [3-5], cromatografía líquida de alta resolución [6-10] (CLAR) y la espectrofotometría ultravioleta (UV), combinada con métodos quimiométricos de análisis [11,12]. Los métodos cromatográficos requieren de una instrumentación costosa y del empleo de cantidades relativamente altas de disolventes orgánicos contaminantes. Los métodos espectrofotométricos son menos selectivos y las sustancias endógenas presentes en las matrices biológicas podrían interferir en el análisis, pero son más económicos y prácticos.
La determinación analítica de fármacos en fluidos biológicos requiere de varias etapas que van desde la colección de la muestra hasta el reporte final de resultados. Las etapas intermedias incluyen el almacenamiento, preparación, separación, identificación y cuantificación. La preparación de la muestra es esencial y tiene tres objetivos principales: la disolución del fármaco en un disolvente apropiado, remover las sustancias interferentes y pre concentrar el analito [13]. En la etapa de preparación se realizan varios pre-tratamientos que dependerán de la naturaleza de la muestra, y las características físicas, químicas y biofarmacéuticas del fármaco o metabolito. Entre los pre-tratamientos a desarrollar se incluyen: la desproteinización, hidrólisis de conjugados, homogeneización y liofilización [14]. Las muestras de plasma y suero contienen proteínas que pueden interferir en la determinación por espectrofotometría UV y, además, pueden deteriorar las columnas cromatográficas, por lo cual deben ser sometidas a tratamientos de desproteinización.
Se han desarrollado muy pocos estudios de desproteinización para la determinación cuantitativa de carbamazepina empleando espectrofotometría UV acoplada a métodos quimiométricos.
Por ello en este trabajo se estudió la desproteinización del suero y el plasma utilizando metanol y ácido tricloroacético (TCA), para realizar el pretratamiento en la etapa de preparación de muestras. La técnica aplicada para evaluar la efectividad del agente desproteinizante fue la espectrofotometría UV.
FUNDAMENTACIÓN TEÓRICA
Monitorización farmacocinética clínica de los niveles de fármacos en la sangre
La cuantificación de los niveles de fármaco en sangre, como estudio de rutina, fue introducida en el laboratorio médico por Ch. Pippenger, hace poco tiempo: su desarrollo y difusión abarca el último tercio del siglo XX. Hoy se sabe que la eficacia terapéutica de muchos fármacos depende de su concentración sanguínea. Esta no depende solo de la dosis administrada, sino de varios factores que determinan una amplia variabilidad interindividual. Por ello, la determinación cuantitativa de los niveles de fármacos en la sangre resulta imprescindible para un tratamiento eficaz y para minimizar el riesgo de aparición de manifestaciones tóxicas. El objetivo que se persigue con la cuantificación de los medicamentos en sangre es optimizar el tratamiento, mediante la individualización de las dosis [15]. Los métodos analíticos aplicados en la determinación cuantitativa de fármacos en muestras biológicas han sido muy diversos y entre ellos se destacan los espectroscópicos, cromatográficos y las técnicas de inmunoanálisis.
Métodos analíticos para el estudio de fármacos en muestras biológicas
Los métodos analíticos para la determinación de los niveles de fármacos en sangre, requieren ser muy sensibles, específicos, exactos y reproducibles, además de rápidos.
La espectrofotometría UV durante algunas décadas fue el método más empleado. Su principal ventaja radicaba en que estaba al alcance de cualquier laboratorio que contara con un espectrofotómetro. Este método tiene como inconvenientes la escasa sensibilidad y la relativa falta de especificidad, lo que obliga a un engorroso y largo proceso de extracción previo [15].
En general, los métodos empleados en la actualidad son los cromatográficos y lo métodos de inmunoensayo. El empleo de rutina de los métodos cromatográficos como la Cromatografía Gaseosa y la Cromatografía Líquida de Alta Resolución (CLAR) para el monitoreo de los fármacos en la sangre está limitado por su baja productividad, pues son variantes en general engorrosas y consumen mucho tiempo.
Teniendo en cuenta las técnicas que están al alcance de los laboratorios clínicos en Cuba, el empleo de la espectrofotometría UV acoplada a métodos quimiométricos constituye una alternativa económica y práctica. La literatura especializada reporta varias técnicas aplicando las herramientas quimiométricas. La determinación de carbamazepina en muestras de suero de pacientes por un procedimiento asistido completamente por herramientas quimiométricas fue propuesta por Cámara M. S. et al., [11] el cual aplicó calibración multivariada usando el método de regresión por cuadrados mínimos parciales (PLS) sobre los espectros UV de la segunda derivada.
En el estudio de recuperación no se encontraron diferencias estadísticamente significativas, pudiéndose concluir que no influyeron errores sistemáticos. La región elíptica de confianza contiene el punto (1,0) indicando que no hay error constante ni proporcional. Los resultados obtenidos mostraron la potencialidad de la metodología estudiada para la monitorización farmacocinética de pacientes tratados con este anticonvulsivante. Un método espectrofotométrico UV para la determinación simultánea de carbamazepina y fenitoína en plasma aplicando regresión por cuadrados mínimos parciales fue desarrollado por Rezaei y col. en el 2005 [12]. Se demostró que el método PLS propuesto luego de la extracción líquido-líquido de los fármacos resultó ser apropiado, logrando predecir las concentraciones de carbamazepina con un porcentaje medio de recobrado de 98,4.
Las muestras biológicas más ampliamente utilizadas para la determinación analítica de carbamazepina han sido, plasma y suero [11, 12].
Características de la muestra de sangre
La sangre está compuesta por dos fracciones bien diferenciables que son las células sanguíneas y el plasma sanguíneo. Las células constituyen del 40 al 50 % del volumen total de la sangre; el volumen restante corresponde al plasma, en el que está presente una gama de compuestos químicos. Las células sanguíneas son de tres tipos: eritrocitos o glóbulos rojos, especializados en la transportación de oxígeno y dióxido de carbono; leucocitos o glóbulos blancos, centrados en el sistema inmune para la defensa contra las infecciones; y las plaquetas, que intervienen en el proceso de coagulación de la sangre. El plasma sanguíneo está compuesto por un 90 % de agua y un 10 % de solutos, de los cuales el 10 % son sales iónicas, 20 % moléculas orgánicas pequeñas, y el 70 % proteínas.
Entre las sales inorgánicas se encuentran el cloruro de sodio, bicarbonato, fosfato, cloruro de calcio, cloruro de magnesio, cloruro de potasio y sulfato de sodio. Entre las moléculas orgánicas y productos residuales contiene, glucosa, aminoácidos, lactato, piruvato, cuerpos cetónicos, citrato, urea y ácido úrico. Las principales proteínas del plasma son: inmunoglobulinas, albúmina sérica, apolipoproteínas involucradas en el transporte de lípidos, transferina para el transporte de hierro, y proteínas de la coagulación como el fibrinógeno y la protrombina. La sangre contiene otras sustancias siempre en cantidades de trazas que incluyen otros metabolitos como las enzimas, hormonas, vitaminas y pigmentos biliares [16].
Cuando la sangre se coagula antes de la separación de los elementos celulares el líquido amarillo pálido remanente es una fracción del plasma sanguíneo denominado suero sanguíneo [17]. El suero sanguíneo en su composición no presenta las proteínas de la coagulación, como el fibrinógeno y la protrombina, pues estas intervienen en el proceso de coagulación que concluye con la retracción del coágulo, pero sí contiene la proteína principal que es la albúmina sérica.
Desproteinización de muestras de plasma y suero
Uno de los problemas principales que se encuentran para el análisis de los fármacos en el plasma o el suero utilizando métodos espectrofotométricos UV es el solapamiento espectral de las señales del fármaco y las proteínas presentes. La presencia de proteínas en el plasma puede interferir en las determinaciones realizadas por métodos espectroscópicos y cromatográficos como la CLAR. Las proteínas presentan máximos de absorción en la región ultravioleta a la longitud de onda 235 nm debido a la propiedad que tienen los enlaces peptídicos de absorber en esta región. La señal a 280 nm se debe a la presencia de los residuos aromáticos de tirosina y triptófano característicos de las proteínas, los cuales también son responsables de la absorción al UV [18]. Por tanto, estas propiedades espectrales pueden interferir en el estudio analítico de fármacos como la carbamazepina en muestras de plasma y suero, pues la carbamazepina exhibe un máximo de absorción a 285 nm. Por ello es necesario desproteinizar las muestras para realizar estudios analíticos de este fármaco empleando la espectrofotometría UV.
En la desproteinización de las muestras biológicas se utilizan disolventes orgánicos miscibles en agua, ácidos orgánicos [13] y sales iónicas [16].
Disolventes orgánicos como el metanol, acetona, acetonitrilo y etanol han sido ampliamente utilizados en bioanálisis debido a su compatibilidad con las fases móviles utilizadas en CLAR. Estos disolventes actúan disminuyendo la solubilidad de las proteínas y tienen una efectividad inversamente proporcional a su polaridad. Las proteínas que están en su forma catiónica a pH bajos forman sales insolubles con los ácidos. Para la desproteinización en medio ácido, soluciones de 5-20 % de los mismos generalmente son suficientes y los mejores resultados pueden obtenerse utilizando los reactivos fríos [13]. Ácidos tales como, ácido tricloroacético (TCA) y ácido perclórico son muy eficientes.
Los procedimientos de desnaturalización de las proteínas también incluyen el efecto salino, utilizando sales, pues la mayoría de las proteínas son menos solubles a concentraciones elevadas de sal. La concentración de sal a la cual una proteína precipita difiere de una proteína a la otra. Por ejemplo, el sulfato de amonio 0,8 mol/L precipita el fibrinógeno, mientras que para precipitar la albúmina sérica se requiere una concentración de 2,4 mol/L [16].
En la literatura científica son muy pocos los reportes relacionados con estudios de desproteinización de muestras de sangre para el análisis cuantitativo de CBZ.
Bugamelli evalúo dos procedimientos de pretratamiento para el estudio de seis anticonvulsivantes, entre ellos carbamazepina y fenobarbital, en plasma humano; uno de ellos fue la precipitación de proteínas con ácido perclórico, el cual permitió el análisis de carbamazepina y fenobarbital, pero no de los metabolitos de carbamazepina 10-11 dihidro y 10-11 epoxicarbamacepina [19].
Estudios en otros fármacos como el lorazepam demostraron que el tratamiento con etanol en proporciones Plasma-Etanol (1:4) seguido de centrifugación a 2 500 rpm, durante 10 min y posterior filtración por papel de filtro Whatman, permitió obtener un sobrenadante claro y se comprobó que el método espectrofotométrico UV acoplado a quimiometría fue capaz de cuantificar el lorazepam en plasma humano [20].
En un estudio comparativo de dos métodos de desproteinización se mostró que la precipitación de proteínas con acetonitrilo a pH fisiológico permitió la detección de más metabolitos de bajo peso molecular y concentraciones superiores utilizando la espectroscopía de resonancia magnética nuclear protónica, constituyendo esto una gran ventaja ya que el procedimiento resultó muy sencillo y rápido [21].
La desproteinización con metanol permitió obtener valores de recobrados superiores a los obtenidos para el ácido fórmico en la determinación cuantitativa diclorodifeniltricloroetano y su metabolito asegurando una excelente precisión en el estudio [22].
MATERIALES Y MÉTODOS
Los espectros fueron registrados en un espectrofotómetro UV-VIS, RayLeigh, de procedencia China. En los distintos ensayos se utilizaron cubetas de cuarzo de 1 cm de paso óptico y 4 mL de volumen interno.
Fueron utilizados los reactivos: Metanol (Uni-Chem); ácido tricloroacético (Uni-Chem) y Carbamazepina (Sigma)
Para la preparación de la disolución madre de CBZ de concentración 10 mg/mL (SM1) se pesaron 250 mg y se disolvieron en 25 mL de metanol. Se conservó a temperatura de 2-8°C, (Disolución madre de CBZ- SM1).
Para la preparación de la disolución de trabajo de carbamazepina de concentración 6 µg/mL (ST) a partir de SM1 se tomó una alícuota de 15 µL que fueron diluidos con agua destilada en volumétricos de 25 mL. Se registró el espectro UV en el rango de 200-340 nm.
Preparación de la muestra de suero y plasma sin desproteinizar
El suero y el plasma congelado y libre de fármacos, para el estudio de selección del agente desproteinizante, se obtuvo del laboratorio clínico del Hospital Docente Clínico Quirúrgico Ginecobstétrico "Juan Bruno Zayas". Las muestras se conservaron a temperatura de -20 ºC hasta el momento del análisis. Previa descongelación en el momento de análisis se midieron 2 mL de suero o plasma y se añadieron 4 mL de agua, se enfrió en baño de hielo y se centrifugó a 2 500 rpm durante 15 minutos.
Preparación de la muestra de suero y plasma cargada con analito
A partir de la disolución de CBZ de concentración 10 mg/mL se tomó un volumen de 0,09 mL, se añadieron 2 mL de plasma o del suero y se agitó durante 5 minutos.
Para la selección del agente desproteinizante se compararon los espectros UV en el rango de 200-400 nm de muestras de suero y plasma libre de fármaco sin desproteinizar, muestras de suero y plasma libre de fármaco desproteinizadas; y muestras de suero y fármaco enriquecidas con CBZ desproteinizadas. Se utilizaron dos agentes desproteinizantes para el pretratamiento de la muestra: metanol y TCA al 10 %. Las proporciones suero o plasma y agente desproteinizante utilizadas fueron 1:2 para el metanol y 1:0,2 para el TCA.
A la muestras sometidas a desproteinización se les añadieron los volúmenes correspondiente del agente desproteinizante y se completó con agua destilada hasta 6 mL. Para el tratamiento con metanol se añadieron 4 mL y con el TCA al 10 % 0,4 mL.
Se agitó durante 5 minutos, se colocó en un baño de hielo durante 5 minutos y se centrifugó a 2 500 rpm por un tiempo de 15 minutos. Se decantó para obtener el sobrenadante claro. A partir del cual se midió un volumen de 1 mL y se enrasó con agua destilada a volumen exacto en volumétricos de 25 mL.
La evaluación de la efectividad de la desproteinización para cada agente desproteinizante estudiado se realizó teniendo en cuenta como criterios de selección, la disminución de las intensidades de absorbancia obtenidas a las longitudes de onda de 235 y 280 nm.
RESULTADOS Y DISCUSIÓN
Comportamiento espectral de las muestras de plasma, suero y de la carbamazepina en el rango ultravioleta del espectro electromagnético
La determinación cuantitativa de la carbamazepina en el suero y el plasma requiere de un adecuado tratamiento previo, para lo cual será necesario seleccionar las condiciones adecuadas de preparación de la muestra biológica utilizando procedimientos analíticos que permitan eliminar la mayor cantidad de sustancias endógenas de la matriz, como las proteínas plasmáticas y aminoácidos, que pueden interferir en la determinación analítica. Por lo que fue necesario seleccionar el agente desproteinizante que garantizara una precipitación eficiente de las proteínas séricas y plasmáticas, que son sustancias endógenas que podrían interferir en la determinación de la CBZ por espectrofotometría ultravioleta visible a la longitud de onda reportada para su estudio analítico de 285 nm.
Para la desproteinización de muestras biológicas en el estudio analítico de carbamazepina la literatura ha reportado el uso del ácido perclórico 1,5 mol/L para la desproteinización del plasma [16], con este tratamiento se obtuvieron buenos resultados para la carbamazepina, pero no para sus metabolitos.
No existen reportes acerca del uso del metanol ni del TCA como desproteinizante para el pretratamiento de muestras de plasma y suero en el análisis de carbamazepina. Para evaluar la efectividad del tratamiento de desproteinización en este estudio se aplicó la espectrofotometría UV.
La espectrofotometría de absorción ultravioleta visible es una herramienta muy versátil que permite realizar toda una gran variedad de determinaciones a la hora de estudiar las proteínas. Así el registro de la absorbancia a las longitudes de onda características de las proteínas servirá para detectarlas. Por ello se selecciona esta técnica para estudiar la desproteinización de las muestras de suero y plasma.
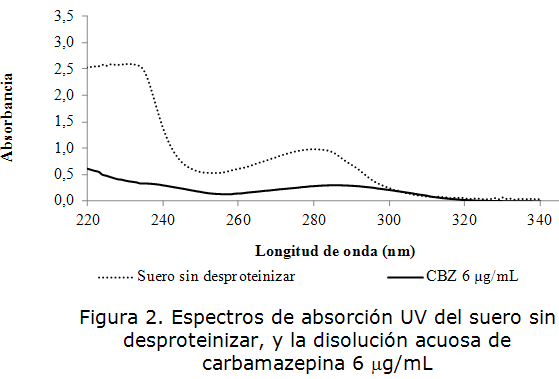
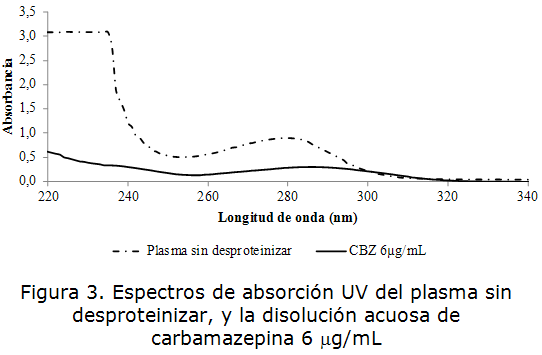
En las figuras 2 y 3 se muestran los espectros de absorción en el rango UV del suero y plasma sin desproteinizar (SD), y la disolución acuosa de carbamazepina de concentración 6 µg/mL. Se obtuvo que las muestras de suero y plasma sin desproteinizar exhibieron una banda de absorción por debajo de los 250 nm centrada sobre los 210 a 220 nm [23], correspondiente a la presencia de las proteínas séricas y plasmáticas debido a la propiedad de los enlaces peptídicos de absorber en esta región.
Algunos de los enlaces de las cadenas laterales de aminoácidos como fenilalanina, tirosina, triptófano, glutetimida, glicina, arginina, aspartato, aspargina, e histidina también pueden absorber luz de longitud de onda cerca de los 210 nm.
Las bandas de absorción más significativas de las cadenas laterales de los aminoácidos proteicos se encuentran en el intervalo de longitudes de onda comprendido entre 230 y 300 nm y concretamente corresponden a la absorción de las cadenas laterales de los aminoácidos aromáticos y de la cistina. La cistina produce una banda centrada alrededor de los 250 nm con un coeficiente de extinción molar muy pequeño que apenas puede considerarse. Los residuos aromáticos correspondientes a la fenilalanina, triptófano y tirosina absorben entorno a los 260-290 nm. La fenilalanina sólo absorbe de 250 a 260 nm y su contribución es muy pequeña. Por tanto la señal a 280 nm es debido a los residuos aromáticos de tirosina y triptófano, los cuales poseen grupos aromáticos, responsables de la absorción al UV [18].
La carbamazepina mostró un máximo de absorción a 285 nm, lo cual se corresponde con lo reportado en la literatura [3], debido a la presencia del núcleo iminoestilbeno en su estructura, por tanto la presencia de las proteínas séricas y plasmáticas constituyen una interferencia en la determinación analítica de carbamazepina por espectrofotometría UV.
Selección del agente desproteinizante para el tratamiento previo del suero sanguíneo
Para este estudio se seleccionaron dos agentes desproteinizantes, el metanol y el ácido tricloroacético al 10 %. El metanol fue seleccionado porque es uno de los solventes orgánicos que ha sido utilizado en bioanálisis para remover proteínas, es ampliamente utilizado en la Cromotagrafía Líquida de Alta Resolución por su compatibilidad con las columnas cromatográficas y además es transparente en el rango UV a partir de los 210 nm. Los ácidos, son muy eficientes para precipitar las proteínas [13], pero algunos fármacos son susceptibles a degradarse en este medio, por tanto es importante evaluar la estabilidad del fármaco en este medio.
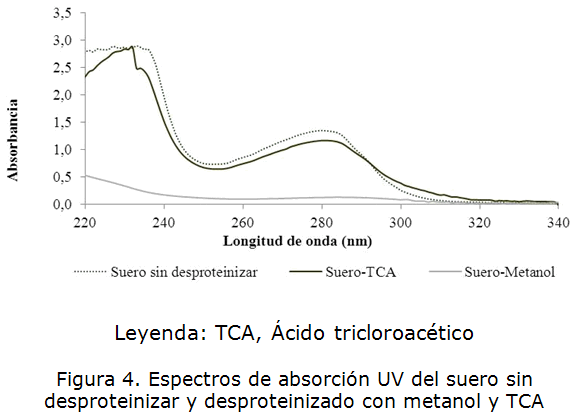
Se demostró que, el metanol permite una reducción considerable de la absorbancia de la muestra de suero en la región espectral cercana a los 235nm. A la longitud de onda de 280 nm también se aprecia una reducción de la intensidad de la señal analítica, lo que demuestra la eficiencia del tratamiento para remover las proteínas presentes en el suero. El ácido tricloroacético no resultó eficiente para eliminar las proteínas séricas, ya que los máximos de absorción a la longitud de onda 280 y por debajo de los 250 nm se mantienen con una intensidad muy similar a la observada para la muestra sin desproteinizar (figura 4). En la tabla 1 se muestran los valores de absorbancia obtenidos antes y después de la desproteinización.
TABLA 1. VALORES DE ABSORBANCIA OBTENIDOS PARA LAS MUESTRAS DE SUERO
SIN DESPROTEINIZAR Y DESPROTEINIZADAS
| Muestra | Absorbancia ( λ=235 nm) | Absorbancia ( λ=280 nm) |
| Suero sin desproteinizar | 2,827 | 1,348 |
| Suero-Metanol | 0,237 | 0,127 |
| Suero-TCA | 2,431 | 1,166 |
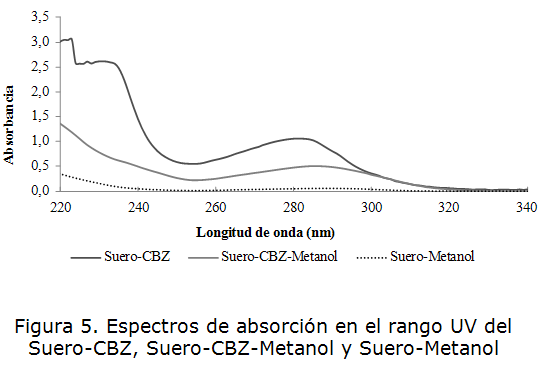
La figura 5 muestra la comparación de los espectros de absorción en el rango UV de 200-340 nm del suero sin desproteinizar, el suero cargado con analito que fue sometido a desproteinización con metanol y el suero sin analito desproteinizado con metanol. Se puede corroborar que el metanol garantiza la precipitación de las proteínas pues se aprecia una disminución significativa del máximo de absorción a la longitud de onda de 280 nm. En el espectro de la muestra de suero cargada con analito y desproteinizada se observó un desplazamiento del máximo de absorción hacia la longitud de onda de 285 nm el cuál es característico de la carbamazepina demostrando esto la capacidad del metanol para remover las proteínas séricas, lo cual se sustenta además con la desaparición del máximo de absorción a 280 nm para la muestra de suero desproteinizada sin analito. Los valores de absorbancia observados a las longitudes de onda características de las proteínas, 235 y 280 nm; y de la carbamazepina a 285 nm se muestran en la tabla 2.
TABLA 2. VALORES DE ABSORBANCIA PARA LAS MUESTRAS DE SUERO CON CBZ AÑADIDA, SOMETIDAS
DESPROTEINIZACIÓN O NO, Y DEL SUERO DESPROTEINIZADO CON METANOL
| Muestra | Absorbancia (λ=235 nm) | Absorbancia (λ=280 nm) | Absorbancia (λ=285 nm) |
| Suero-CBZ | 2,482 | 1,058 | 1,025 |
| Suero-CBZ-Metanol | 0,619 | 0,477 | 0,506 |
| Suero-Metanol | 0,086 | 0,051 | 0,057 |
Selección del agente desproteinizante para el tratamiento previo del plasma sanguíneo
El estudio analítico de fármacos también puede realizarse en muestras de plasma. El plasma es una de las muestras biológicas de mayor interés para el estudio de fármacos y se prefiere generalmente debido a la presencia de mayor cantidad de fármaco. Está constituido por un 90 % de agua y 10 % de solutos. Contiene una gran variedad de proteínas, lipoproteínas, nutrientes, metabolitos, productos de degradación, iones inorgánicos y hormonas disueltos o suspendidos. Más del 70 % de los solutos se corresponden a proteínas plasmáticas principalmente inmunoglobulinas, albúmina sérica, apolipoproteínas involucradas en el transporte de lípidos, transferina y proteínas de la coagulación tales como el fibrinógeno y la protrombina. Los componentes inorgánicos son: cloruro de sodio, bicarbonato, fosfato, cloruro de calcio, cloruro de magnesio, cloruro de potasio y sulfato de sodio. Entre las moléculas orgánicas contiene: glucosa, aminoácidos, ácido acetilacético, ácido láctico, ácido úrico, ácidos grasos, amoníaco, bilirrubina, colesterol, ésteres de colesterol, creatinina, fenilalanina, grasas, lípidos, ácido pirúvico, urea, alanina, cistina, ácido glutámico y glutamina. Las proteínas mayoritarias del plasma son: la albúmina, alfa globulinas, beta globulinas y gamma globulinas. Otros metabolitos se encuentran en niveles de trazas como las hormonas, vitaminas y pigmentos biliares [16].
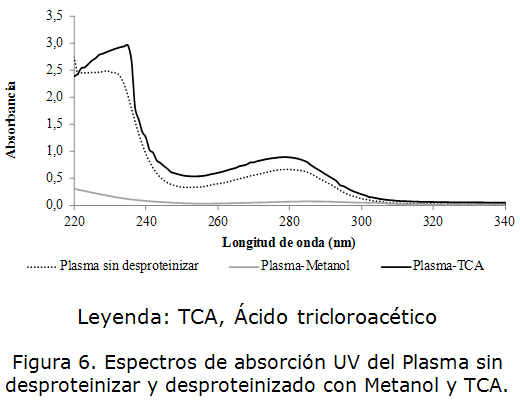
Debido al elevado contenido de proteínas se requerirá la desproteinización previa del plasma para eliminar interferencias en el análisis. Se demostró que, el metanol permite una reducción considerable de la absorbancia en la región espectral cercana a los 235nm. A la longitud de onda de 280 nm también se aprecia una reducción de la intensidad de la señal analítica, lo que demuestra la eficiencia del tratamiento para remover las proteínas presentes en el plasma. El ácido tricloroacético no mostró efectividad en la desnaturalización de las proteínas ya que el espectro de absorción mantiene la señal característica de los residuos aromáticos de tirosina, triptófano y fenilalanina a 280 nm, la cual interfiere en la determinación de carbamazepina a 285 nm. (figura 6). Los valores de absorbancia observados a las longitudes de onda características de las proteínas, 235 y 280 nm; y de la carbamazepina a 285 nm se muestran en la tabla 3.
TABLA 3. VALORES DE ABSORBANCIA OBTENIDOS PARA LAS MUESTRAS DE PLASMA
SIN DESPROTEINIZAR Y DESPROTEINIZADAS
| Muestra | Absorbancia (λ=235 nm) | Absorbancia (λ=280 nm) |
| Plasma sin desproteinizar | 2,034 | 0,672 |
| Plasma-Metanol | 0,126 | 0,077 |
| Plasma-TCA | 2,965 | 0,896 |
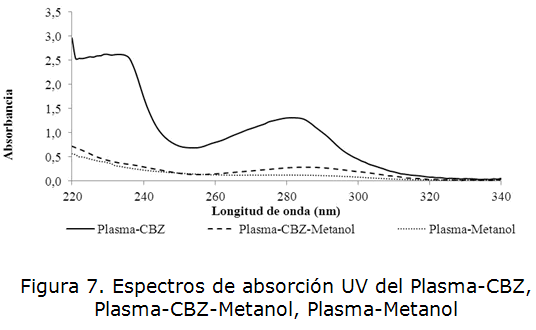
La figura 7 muestra la comparación de los espectros de absorción en el rango UV de 200-340 nm del plasma sin desproteinizar, el plasma cargado con analito que fue sometido a desproteinización con metanol y el plasma sin analito desproteinizado con metanol. Se comprobó que el metanol garantizó la precipitación de las proteínas ya que disminuyó significativamente el máximo de absorción a la longitud de onda de 280 nm. En el espectro de la muestra de plasma enriquecida con analito y desproteinizada se observó un desplazamiento del máximo de absorción hacia la longitud de onda de 285 nm el cuál es característico de la carbamazepina demostrando esto la capacidad del metanol para desproteinizar el plasma (ver tabla 4).
TABLA 4. VALORES DE ABSORBANCIA PARA LAS MUESTRAS DE CBZ AÑADIDA, SOMETIDAS
DESPROTEINIZACIÓN O NO, Y DEL PLASMA DESPROTEINIZADO CON METANOL
| Muestra | Absorbancia (λ=235 nm) | Absorbancia (λ=280 nm) | Absorbancia (λ=285 nm) |
| Plasma-CBZ | 2,599 | 1,305 | 1,277 |
| Plasma-CBZ-Metanol | 0,355 | 0,272 | 0,287 |
| Plasma-Metanol | 0,281 | 0,124 | 0,122 |
El agente desproteinizante que mostró mayor eficacia para remover las proteínas en el tratamiento previo de las muestras de suero y plasma fue el metanol.
El espectro UV de carbamazepina en metanol reportado en la literatura, exhibe un máximo de gran intensidad a 285 nm y el fármaco es estable en este medio. Además el metanol posee transparencia en la región UV a partir de 210 nm [3], lo cual evita interferencias por efecto del disolvente. El tratamiento de las muestras biológicas con este disolvente permite obtener un sobrenadante claro y transparente luego de la centrifugación.
Se decide proponer el suero como muestra biológica de trabajo ya que su obtención, a partir de la sangre, no requiere la adición de un anticoagulante.
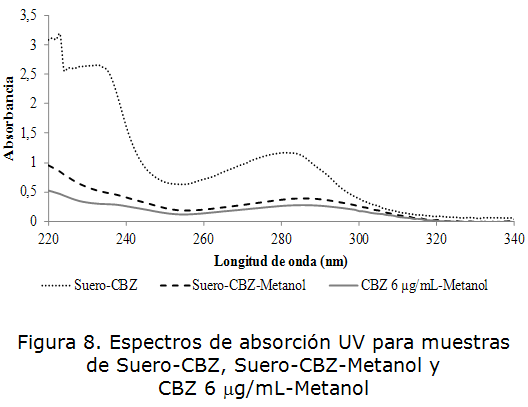
En la figura 8 se observa que la muestra de suero, con el fármaco añadido, mostró un pico de máxima intensidad a 285 nm luego de la desproteinización con metanol a bajas temperaturas.
Como se puede apreciar en la tabla 5, el suero desproteinizado con metanol exhibe un máximo de absorción superior al mostrado por la disolución patrón de CBZ de concentración 6 μg/mL, por lo que podemos inferir que aún están presentes otras sustancia interferentes y será necesario emplear otros procedimientos de purificación de la muestra para poder aplicar la espectrofotometría UV.
TABLA 5. VALORES DE ABSORBANCIA OBTENIDOS PARA LAS MUESTRAS DE SUERO
ANALIZADAS Y EL PATRÓN DE CBZ DE CONCENTRACIÓN 6 μg/mL
| Muestra | Absorbancia (λ=285 nm) |
| Suero-CBZ | 1,128 |
| Suero-CBZ-Metanol | 0,388 |
| CBZ-Metanol 6 m g/mL | 0,274 |
Se propone diseñar un procedimiento de extracción líquido-líquido para lograr una mayor purificación de la muestra de suero luego de la desproteinización con el metanol.
CONCLUSIONES
Teniendo en cuenta los resultados obtenidos se propone la desproteinización de la muestra de suero utilizando una proporción muestra biológica-metanol (1:2), enfriando en baño de hielo durante 10 min y posterior centrifugación durante 15 minutos a 3500 rpm.
Se recomienda emplear el metanol como agente desproteinizante para el tratamiento previo de la muestra de suero en el estudio analítico de carbamazepina por espectrofotometría UV y por Cromatografía Líquida de Alta Resolución con detección UV a 285 nm. Para el análisis por espectrofotometría UV se sugiere la combinación con el procedimiento de extracción líquido-líquido para garantizar una mayor purificación de la muestra y mejorar la selectividad.
REFERENCIAS BIBLIOGRÁFICAS
1. ARMIJO, J. A. "Fármacos antiepilépticos y anticonvulsivos". En: Farmacología Humana. FLÓREZ, J. (Director), 3ra Edición. España: Masson, S.A., 1997, pp. 493-97.
2. MCNAMARA J. O. "Pharmacotherapy of the epilepsies". En: Goodman and Gilman's the Pharmacological Basis of Therapeutics. BRUNTON, L. L., (Editor). 11na Edición. New York: McGraw-Hill, 2006. ISBN: 0-07-146804-8.
3. GALICHET L. Y. Clarke's isolation and identification of drug in pharmaceutical, body fluids, and post-morten material. 3ra Edición. London: The Pharmaceutical Press, 2005.
4. KÜLPMANN, W. R. y OELLERICH, M. "Monitoring of therapeutic serum concentrations of antiepileptic drugs by a newly developed gas chromatographic procedure and enzyme immunoassay (EMIT): a comparative study". Journal of Clinical Chemistry and Clinical Biochemistry. 1981, 19(5), 249-58.
5. KÜLPMANN , W. R. "A gas-chromatographic method for the determination of carbamazepine, phenobarbital, phenytoin and primidone in the same extract of serum". Journal of Clinical Chemistry and Clinical Biochemistry. 1980, 18(4), 227-232.
6. RAINBOW, S. J.; DAWSON, C. M.; TICKNER, T. R. "Direct serum injection high-performance liquid chromatographic method for the simultaneous determination of phenobarbital, carbamazepine and phenytoin". Journal of Chromatography. 1990, 527(2), 389-396.
7. ROJAS, J. H.; SIERRA, N. "Estandarización y validación de una metodología analítica para la determinación de carbamazepina en plasma mediante extracción en fase sólida y cromatografía líquida de alta eficiencia", Revista Colombiana de Ciencias Química Farmacéutica. 2007, 36(1), 55-69.
8. MANDRIOLI, R.; ALBANI, F.; CASAMENTI, G., et al., "Simultaneous high-performance liquid chromatography determination of carbamazepine and five of its metabolites in plasma of epileptic patients". Journal of Chromatography B: Biomedical Sciences and Application. 2001, 762, 109-116.
9. MARTINAVARRO-DOMÍNGUEZ, A., et al., "Therapeutic drug monitoring of anticonvulsant drugs by micellar HPLC with direct injection of serum samples". Clinical Chemistry. 2002, 48(10), 1696-1702.
10. KISHORE, P., et al., "Validated high performance liquid chromatographic methods for simultaneous determination of phenytoin, phenobarbital and carbamazepine in human serum". Arzneimitteln-Forschung/Drug Res. 2003, 53(11), 763-768.
11. CÁMARA, M. S.; MASTRANDEA, C.; GOICOCHEA, H. C. "Chemometrics-assisted simple UV-spectroscopic determination of carbamaz epine in human serum and comparison with references methods". Journal of Biochemical and Biophysical Methods. 2005, 64, 153-166.
12. REZAEI, Z., et al.,"Simultaneous spectrophotometric determination of carbamazepine and phenytoin in serum by PLS regression and comparison with HPLC". Talanta. 2005, 65, 21-28.
13. BIDDLECOMBE, B.; SMITH G. "Sample preparation techniques". Evans G. (Editor). En: A Handbook of Bioanalysis and Drug Metabolism. Florida: CRC Press LLC, 2004.
14. SMITH, R. V.; STEWART, J. T. "Textbook of Biopharmaceutical Analysis". 3era Edición. Philadelphia: Lea & Febiger, 1981, p. 279. ISBN: 0-8121-0770-3.
15. SUARDÍAZ, J. H. P. "Monitoreo de los niveles de medicamentos en la sangre. En: Laboratorio Clínico. SURDÍAZ J. P., CRUZ C.R., COLINA A. R. La Habana: Editorial Ciencias Médicas, 2004, p. 194-199. ISBN: 959-212-120-6.
16. NELSON, D. L.; COX, M. M. "Lehninger. Principles of Biochemistry". 5ta Edición. New York: WH Freeman and Company, 2008, p. 921. ISBN: 10:0-7167-7108-X.
17. MANAHAN, S. E. "Toxicological Chemistry and Biochemistry". 3era Edición. Florida: CRC Press LLC, 2003, p. 424. ISBN: 1-56670-618-1.
18. CHÁVEZ, M. A., et al., "Temas de enzimología". Tomo II. La Habana: ENPES, 1990, p. 280.
19. BUGAMELLI, F., et al.,"Simultaneous analysis of six antiepileptic drugs and two selected metabolites in human plasma by liquid chromatography after solid-phase extraction". Analytica Chimica Acta 2002, 472, 1-10.
20. GHASEMI, J.; NIAZI, A. "Two and three-way chemometrics methods applied for spectrometric determination of lorazepam in pharmaceutical formulations and biological fluids". Analytica Chimica Acta . 2005, 533, 160-177.
21. DAYKIN, C.A., et al., "The comparison of plasma deproteinization methods for the detection of low-molecular-weight metabolites by 1 H nuclear magnetic resonance spectroscopy". Analytical Biochemistry . 2002, 304, 220-230.
22. SMEREK, A. L.; HEAD, S. L.; NEEDHAM, L. L. "Comparison or Two Deproteinization Methods for the Determination of DDT and DDT Metabolites in Serum". Analytical. Letters. 1981, 14(2), 81-96.
23. GARCÍA-SEGURA J. M. S., et al., Técnicas Instrumentales de Análisis en Bioquímica. España: Editorial Síntesis S.A, 1996, pp. 398. ISBN: 84-7738-429-0.
Recibido: 27/01/2016
Aceptado: 6/05/2016
MSc. Yamilé Heredia-Díaz, Universidad de Oriente, Santiago de Cuba, Cuba, yherediad@uo.edu.cu