Introducción
A lo largo de los años, el estudio de los productos vegetales naturales ha ido en aumento, llevando a la identificación y mejora de los productos vegetales beneficiosos para la humanidad. La Moringa oleifera Lam (Moringáceae) se conoce como “árbol milagroso”, por su riqueza de nutrientes, minerales, vitaminas y aceites esenciales, y ha sido identificada como una planta versátil multifuncional con enormes potenciales económicos, nutricionales y de salud.
Es un árbol de clima tropical y subtropical. Se originó en Agra y Oudh en la región noroeste de la India, que se encuentra al sur del Himalaya y se extiende en varios países del sur de Asia desde el norte de Pakistán hasta el norte de Bengala Occidental y la India, y en las zonas tropicales de África.1 El árbol tiene una gran valoración en casi todas sus partes (raíz, corteza, hoja, flores, vainas, semillas, aceite de semilla) por sus propiedades nutricionales, medicinales y otros fines industriales.2
Entre las 13 especies conocidas, la Moringa oleifera es una planta de alto valor, versátil, adaptable, fácil de cultivar y autopropagada con una tasa de crecimiento muy rápida. En Cuba, se encuentran diversos ecotipos como Supergenius, Plain, Nicaragua y Criolla, distribuidos en todo el territorio nacional, cultivados bajo las condiciones climatológicas de cada región.3,4
A partir de los ecotipos antes mencionados se realizó la caracterización fisicoquímica del aceite de semillas, extraído por diferentes métodos. Estos aceites, con una composición y porcentaje de ácidos grasos similares a las encontradas en variedades foráneas, fueron empleados en la elaboración de productos de aseo.4,5
Todas las partes de la planta se han empleado para diferentes propósitos; las hojas, tallos, semillas y raíces del árbol de Moringa son comestibles, las ramas se aprovechan como combustible vegetal y el aceite de la semilla lo utilizan en ensaladas, lubricantes de máquinas, de relojes, para perfumes, jabones, cosméticos e ingredientes de productos para el cabello.2,4,5
Dentro del campo de la medicina, se puede utilizar para combatir una gran variedad de enfermedades: diabetes, cáncer, inflamación, entre otras, especialmente por su capacidad antioxidante en la eliminación de radicales libres. Por otro lado, las semillas exhiben actividad coagulante en el tratamiento de contaminantes del agua, así como metales en suspensión, incluso contra bacterias plaguicidas que están presentes en el agua. Los ácidos grasos de las semillas también la hacen útil para producir biodiesel, que sería una forma de combustible renovable y favorable con el medio ambiente.6
Por la variedad de beneficios que aporta esta especie a la humanidad en materia de usos, es importante realizar estudios del ecotipo Plain aclimatado en Cuba, no solo del aceite extraído de las semillas, sino también de sus hojas y cáscara, que permitan corroborar la riqueza nutricional de la planta, y contar con un poderoso recurso natural para múltiples aplicaciones. De ahí que el objetivo de este trabajo es determinar y cuantificar el contenido de polifenoles totales, flavonoides y alcaloides en extractos hidroalcohólicos de hojas, y las propiedades fisicoquímicas del aceite vegetal y cáscara de la Moringa oleifera ecotipo Plain aclimatado en Cuba.
Materiales y métodos
La investigación experimental se desarrolló en áreas de las Facultades de Ingeniería Mecánica y Química de la Universidad Tecnológica de la Habana, “José Antonio Echeverría.” Para ello se emplearon hojas recolectadas después de los 90 días de establecido el cultivo y semillas de Moringa oleifera ecotipo Plain suministradas por el Centro Internacional de Salud La Pradera, sito en La Habana.
Caracterización de las hojas
Las hojas se mantuvieron en bolsas de polietileno negras selladas hasta su posterior utilización. La masa total de hojas disponibles a procesar fue de 1 kg; se procedió a lavar mediante un flujo continuo de agua potable hoja por hoja y se dejó escurrir. El secado se realizó a temperatura ambiente, por un tiempo de 7 días, hasta eliminar la humedad.7 La determinación de humedad se efectúa por diferencia de pesadas, utilizando una balanza analítica, modelo SARTORIUS BS 124S. La temperatura para el secado se fija por debajo de 60 °C en estufa modelo DHG-9146ª. Luego se tritura con un molino marca Retsch S200, Alemania, y se obtuvieron valores del tamaño de partículas de la droga seca cercanos a 1·10-3 m, con el fin de aumentar la superficie de contacto al momento de interaccionar con el disolvente, y así optimizar la extracción de los metabolitos secundarios, con etanol al 70 % como disolvente.8
Se realizó la elección de etanol como disolvente de extracción, lo que se justifica por la composición fitoquímica de las hojas, que contienen, principalmente, sustancias hidrosolubles como compuestos fenólicos, flavonoides, vitamina C y minerales.
Para el tamizaje fitoquímico, el material vegetal se maceró con etanol empleando una relación 1:3 (m:v) por 48 h. El extracto obtenido de las hojas se filtró y se hizo reaccionar con el reactivo correspondiente, obteniendo como respuesta cambio de color o formación de precipitado. Estas reacciones se caracterizan porque son selectivas para las clases de compuestos que se investigan, son simples y rápidas, detectan la mínima cantidad presente de los mismos.9
Posteriormente los alcaloides fueron cuantificados empleando el método espectrofotométrico basado en la reacción con verde de bromocresol. La absorbancia del complejo en cloroformo se midió a 470 nm frente al blanco. Los flavonoides fueron determinados en un espectrofotómetro (SHIMADSU UV160-A) mediante el método colorimétrico del tricloruro de aluminio.7 El método se basó en la formación de un complejo flavonoide-aluminio. La muestra (0,1 mL) en metanol se mezcló con 0,2-1 mL de nitrato de sodio al 5 %, luego se dejó reaccionar durante 5 min. Se añadió 0,2 mL de tricloruro de aluminio en metanol (10 %) y 1 mL de hidróxido de sodio (1 mol/L) y se dejó reposar a temperatura ambiente durante 15 min. La absorbancia se leyó a 510 nm contra el reactivo en blanco. La cantidad de flavonoides se calculó a partir de la curva de calibración de rutina. El resultado es expresado en mg/g, calculado como rutina.
Para la extracción de polifenoles, se empleó como método la extracción por maceración, utilizando como disolvente una mezcla hidroalcohólica agua-etanol (30-70) en una relación soluto-disolvente de 20 mL/g. Para hallar el porcentaje de sólidos totales, se tomó 1 mL de extracto hidroalcohólico de las hojas de Moringa oleifera, se llevó a una cápsula previamente tarada a 105 °C, se evaporó en una plancha modelo IKA C- MAG HP10, hasta que el residuo quedó aparentemente seco. Se pasó a una estufa modelo DHG-9146ª, china y se dejó secar hasta peso constante (3 h). Luego se retiró la capsula de la estufa, se enfrió y se pesó.
La concentración de polifenoles de los extractos obtenidos se determinó utilizando el reactivo de Folin -Ciocalteu según el método modificado.10 El método de Folin-Ciocalteau se basa en una reacción óxido-reducción entre el reactivo Folin-Ciocalteu y los polifenoles de la muestra. El reactivo Folin-Ciocalteu contiene una mezcla de wolframato sódico y molibdato sódico en ácido fosfórico. Este reactivo de color amarillo, al ser reducido por los grupos fenólicos da lugar a un complejo de color azul intenso, cuya intensidad se mide espectrofotométricamente a 765 nm para evaluar el contenido en polifenoles.
Para cada muestra se hicieron dos réplicas, se mezclaron en el siguiente orden: 1 mL de muestra, 2,5 mL de Folin-Ciocalteau y 2 mL de carbonato de sodio 7,5 %(p/v). Se realizó un blanco de muestra, sin el reactivo Folin-Ciocalteau, y además un autocero con todos los reactivos, pero sin la muestra. En el momento en el que se añade el carbonato sódico, comienza la reacción. Transcurridos 20 min de reacción en oscuridad a temperatura ambiente, se midió el color de la muestra a 765 nm. Para cuantificar los compuestos fenólicos obtenidos en las muestras se realizó una curva patrón de ácido gálico siguiendo el mismo método colorimétrico. Los resultados se expresaron en mg de equivalentes de ácido gálico por gramo de muestra.
Caracterización de semillas y cáscara
Las semillas se encontraban almacenadas en sacos blancos de polietileno a temperatura ambiente; se prepararon para la extracción mecánica, separando primero las cáscaras de los cotiledones en una descascaradora modelo Agro 01 de fabricación nacional. La extracción mecánica por prensado se realizó en un molino marca Komet, tipo DD85. Terminado el proceso de prensado, el aceite pasa a través de un filtro prensa modelo 2FIN 20-20, eliminando partículas que quedan disueltas en el mismo, para posteriormente ser almacenado en un tanque de acero inoxidable de 5 L.
La cáscara, fue tamizada de acuerdo con la Norma Cubana Minerales-Análisis granulométrico por tamizado.11 Para la operación, según la norma, se tomaron muestras representativas de 15 g de cáscara, las cuales fueron secadas a 105°C durante 24 h en una estufa modelo DHG-9146ª. El juego de tamices que se utilizó pertenece a la escala americana ASTM y sus diámetros (entre 0,125.10-3 y 2.10-3 m)
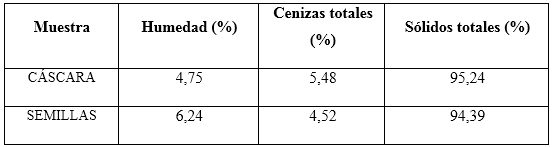
A las semillas y cáscara se les determinaron humedad relativa, sólidos totales, cenizas totales, según los procedimientos reportados por.12-16 La determinación de humedad (g/100g de muestra) se efectuó de acuerdo con el método convencional en estufa modelo DHG-9146ª por diferencia de pesadas, utilizando una balanza analítica, modelo SARTORIUS BS 124S, hasta alcanzar un porcentaje de humedad cercano a cinco. La temperatura para el secado de las semillas se fijó por debajo de 60 °C para evitar la desnaturalización de las proteínas presentes en las mismas.
El valor de cenizas totales (g/100g de muestra) se determinó mediante la destrucción de la materia orgánica presente en la muestra por calcinación a 550 0C, y posterior determinación gravimétrica del residuo.
Se determinó, además, el contenido de calcio, magnesio, y otros minerales, mediante espectrometría de emisión atómica de plasma acoplado inductivamente (ICP-OES) en un equipo marca: Perkin Elmer, modelo: Optima 4300 DV (con visión dual) para producir electrones excitados e iones que emiten radiación electromagnética en longitudes de onda característica de un elemento particular. Las determinaciones se realizaron por triplicado para cada muestra en el Centro de Estudios de Ingeniería de Procesos (CIPRO) y en el Centro de Investigaciones para la Industria Minero-Metalúrgica (CIPIMM).
A las semillas también se les determinó el contenido de fenoles totales siguiendo el procedimiento descrito anteriormente para las hojas.
Caracterización de los aceites
Se determinaron los índices de: saponificación, acidez, iodo, peróxido y refracción; además del grado de acidez, pH y densidad, como se reportan en los trabajos.12-16
La determinación de la composición del aceite extraído se realizó utilizando un cromatógrafo de gases. 7890A (Agilent, EE.UU.), con detector de ionización por llama y una columna capilar BPX-70 (30 m x 0,53 mm, 1 µm Df, SGE, Australia, (Institute for Nutraceutical Advancement). Los análisis se realizaron por triplicado. Los patrones de AG (Sigma, EE. UU.), demás reactivos y disolventes (Merck, Alemania), fueron puros para análisis. Para el análisis cuantitativo, se identificaron los ésteres metílicos de los ácidos grasos para la muestra de ensayo, por comparación de los tiempos de retención de cada componente con los tiempos de los ésteres metílicos patrones obtenidos en el mercado. Además, se utilizó para este análisis, el método del patrón interno.
La determinación de los coeficientes de absorción se realizó en un espectrofotómetro UV-Visible marca: Shimadzu modelo UV-1603, debido a que durante la autooxidación de los ácidos grasos poliinsaturados se forman hidroperóxidos los cuales absorben radiación en torno a una longitud de onda de 232 nm. Estos compuestos evolucionan con el tiempo dando lugar a otros como las diacetonas. Los productos secundarios, procedentes de la degradación de los hidroperóxidos, tienen la característica de absorber radiación UV entorno a los 270 nm.
Resultados y discusión
De acuerdo con los ensayos realizados a las hojas de Moringa oleifera ecotipo Plain en la determinación de taninos usando el FeCl3, el extracto etanólico de las hojas de moringa dio positivo a taninos, dando una coloración azul oscura, lo cual es un indicativo de la presencia de taninos hidrolizables o gálicos. En el ensayo de la determinación de flavonoides usando el método de Shinoda, el extracto etanólico de hojas de moringa dio una coloración carmesí que demostró la presencia de flavononas. Luego en el ensayo de la determinación de alcaloides usando el método de Dragendorff, el extracto etanólico de hojas moringa dio positivo a alcaloides con la aparición de turbidez definida y un precipitado color rojo ladrillo.
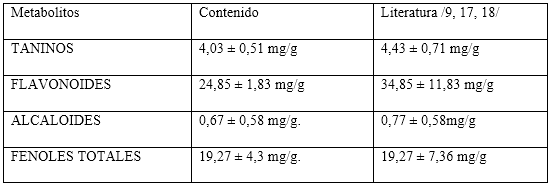
Los valores de la cuantificación de los metabolitos en los extractos hidroalcohólicos de las hojas de Moringa se muestran en la tabla 1.
Estos resultados son inferiores a los reportados en la literatura 9,17,18 con muestras procedentes de países con diferentes climas y temperaturas como China, India, Ecuador. Además, en estos estudios los tiempos de recolección, maduración y almacenamiento del material vegetal fueron menores a los analizados en este trabajo, pero similares a los reportados por 3 en ecotipos aclimatados en Cuba.
El valor promedio del porcentaje de humedad en otras especies aclimatadas en Cuba 5 es de 5,8-8,9 %, y para las cenizas de 5,46-6,63 %, y de acuerdo con la literatura 12-14,19,20 los porcentajes se encuentran en el intervalo de 5,72-9,00 %, por lo que resultan satisfactorios para este ecotipo.
Tabla 3 Composición de las muestras analizadas (%) calculadas a partir de los valores obtenidos por ICP de los elementos más representativos (en ppm)
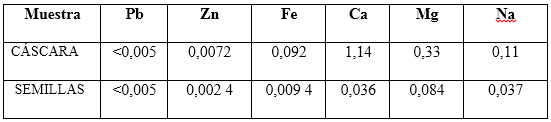
En los resultados de las semillas reportados en la tabla 3, se observa una similitud respecto a los que aparecen en la literatura especializada en cuanto a los contenidos determinados, excepto el magnesio que no aparece en la literatura consultada.12,14,21-23 No se encontraron referencias respecto a la cáscara.
La determinación de los elementos presentes en las muestras se realiza por su importancia, porque pueden beneficiar la salud del hombre, si se recomienda su ingestión por especialistas en nutrición.24
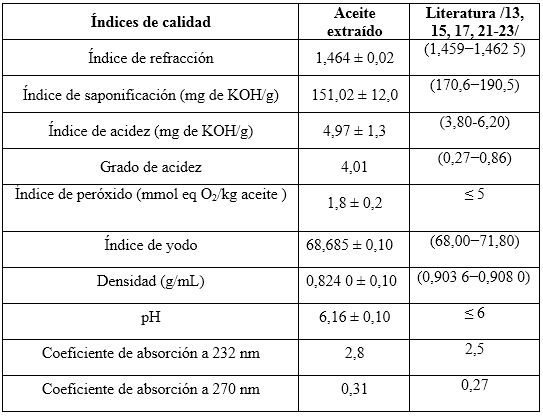
El aceite de las semillas de Moringa oleifera ecotipo Plain resultó ser de color amarillo, con olor y apariencia característico de este aceite. Los valores del análisis del aceite se exponen en la tabla 4.
El índice de acidez obtenido es superior al que se encuentra reportado en la literatura.7,17,19,21,23,25. Esto es debido a la autolisis de los triglicéridos presentes en la semilla que se transforman en ácidos libres y glicerina, en función del tiempo y las condiciones de almacenamiento, que fueron cinco años a temperatura ambiente.
El índice de saponificación en comparación con el de la literatura es bajo, por la misma razón anteriormente descrita, demostrando que existe una correspondencia entre ambos valores. El índice de peróxidos tiene un valor promedio de 1,8 mmol eq O2/kg aceite, el cual se asemeja al reportado en la literatura, lo que demuestra que el aceite obtenido no ha presentado rancidez. El límite para dicha aceptación es de 5 mmol eq O2/kg.10
Respecto al índice de iodo es un aceite monoinsaturado. El índice de refracción del aceite es el adecuado según la literatura señalada en la tabla 4.
La densidad del aceite es de 0,823 8 g/cm3, encontrándose dentro del intervalo permitido para aceites vegetales. El potencial de hidrógeno se corresponde con lo reportado por la literatura en casos similares.4,13,15
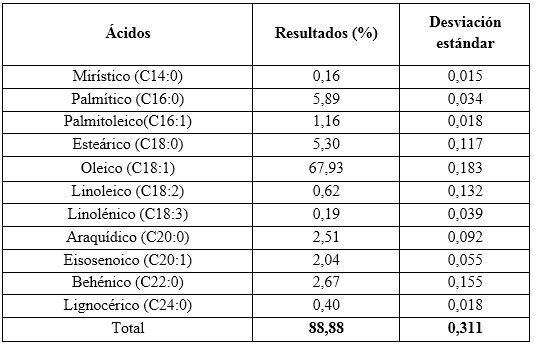
Se determinaron los contenidos de ácidos grasos AG (%), cuantificados como ésteres metílicos de los ácidos grasos.
De estos resultados se corrobora que el componente fundamental en este aceite es el ácido graso oleico. Además, se observan otros como los ácidos palmítico, esteárico, behénico, araquídico, palmitoleico y el eisosenoico que contribuyen, de manera importante, a su composición.5
Los resultados de polifenoles totales de las muestras de aceite de moringa analizadas fueron de 43,4 mg/g expresado en ácido gálico. Estos valores son similares a los reportados por Ogbunugafor 26, quienes obtuvieron un valor de 40,17 mg/g de polifenoles totales presentes en el aceite de moringa, con la diferencia que el método de extracción fue por solvente y las muestras eran procedentes de Nigeria.
Conclusiones
Se logró identificar y cuantificar los taninos hidrolizables, flavonoides y alcaloides presentes en las hojas de los extractos etanólicos de Moringa oleifera ecotipo Plain. Se determinó la concentración de fenoles totales por el método Folin-Ciocalteu, obteniendo en el extracto etanólico de las hojas 19,27 mg AG/g, y en el aceite de las semillas 43,4 mg AG/g. Las propiedades físico-químicas del aceite de semilla de Moringa oleifera ecotipo Plain determinadas, indicaron un aceite de buena calidad, demostrándose que el ácido oleico es el mayoritario y es semejante a otros aceites de su tipo, reportados en la literatura consultada. Las determinaciones realizadas a la cáscara y a las semillas aportan indicios de su calidad, posibilitando el empleo de estas en la alimentación