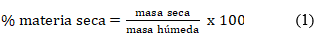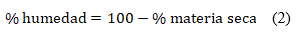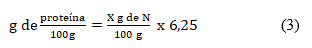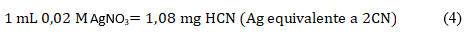Introducción
La yuca (Manihot esculenta), es una importante fuente de carbohidratos que es consumida de diferentes formas; es considerada el cuarto producto básico más importante después del arroz, el trigo y el maíz.1 Se utiliza para la producción de harinas; el producto más importante elaborado con base de yuca es el almidón. La obtención de harina de yuca para la utilización en productos alimenticios y la posible sustitución total o parcial de otras harinas (básicamente del trigo), con lo cual se podrían sustituir importaciones, con el consiguiente beneficio económico, se ha expandido.2) En Cuba se ha comenzado a utilizar harina y el almidón de yuca en la industria alimentaria para la confección de dulces, confituras y productos cárnicos.
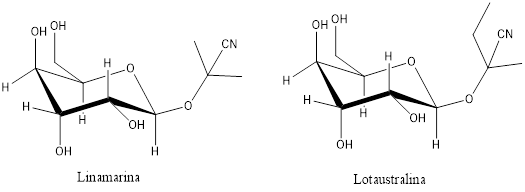
La yuca acumula dos glucósidos cianogénicos en las raíces y hojas: linamarina y lotaustralina (proporción de 93:7), según se aprecia en la figura 1. Esos dos glucósidos son capaces de generar ácido cianhídrico (HCN), de forma que la concentración de cianuro y el uso de yuca como alimento están condicionados a una hidrólisis enzimática de esos dos glucósidos cianogénicos.
Las variedades de yuca son normalmente clasificadas por el contenido de cianuro (CN) en la pulpa de la raíz, en dulces (˂ 100 mg HCN/Kg) y agrias (˃ 100 mg HCN/Kg).3) La mayor parte de la yuca de mesa (dulce) es comercializada de forma fresca, siendo consumida después del uso de técnicas de preparado más simples (pelado, cocción, asado, etc.). Por otro lado, variedades industriales son utilizadas en la obtención de harinas, fécula o polvillos, siendo solamente consumidas después de algún tipo de procesamiento industrial detoxificante.4 El procesamiento adecuado es suficiente para reducir las concentraciones aceptables de cantidades de cianógenos tóxicos, existiendo etapas básicas para el procesamiento de harina de yuca. El límite máximo de ácido cianhídrico en la harina de yuca aceptado por la FAO-OMS para consumo humano es 10 ppm.5 Siempre que se utilice yuca o subproductos de esta en la elaboración de alimentos, es necesario cuantificar la cantidad de cianuro en los alimentos elaborados con esta materia prima y sus derivados, para garantizar la inocuidad de los mismos.
Los glicósidos cianogénicos son, generalmente, cuantificados a través de métodos: titrimétricos, electroquímicos o colorimétricos. La selección del procedimiento dependería sólo de la concentración de cianuro en la muestra. Según Pohlandt et al. 6, con el método fotocolorimétrico se puede determinar concentraciones tan bajas como 20 µg/L.
En este trabajo se describe la determinación de cianuro en yuca y algunos subproductos obtenidos a partir de este tubérculo. La información que se obtuvo en este estudio será crucial para la extensión del uso seguro de la yuca y sus derivados en la industria alimentaria y otros organismos reguladores, respecto a la toxicidad de esta especie vegetal.
Materiales y métodos
Se utilizó 1 kg de yuca (variedad CENSA 74-6329), a la que previamente se le retiró la corteza. Para la fabricación de harina, la yuca se dividió en pequeños trozos, y se secó al sol durante una semana. El material parcialmente deshidratado, se trituró en un molino de laboratorio de la marca IKA. El producto resultante, se tamizó hasta lograr un polvo fino (no se detecta al frotar entre los dedos los granos de harina). El almidón se preparó a partir de yuca fresca, la que fue molida y prensada durante 24 h. El filtrado se dejó en reposo toda la noche y se decantó el líquido sobrenadante; el precipitado resultante se secó al sol durante 72 h.
La determinación de materia seca y humedad se realizó por el método gravimétrico, usando una balanza analítica marca Satorius y una estufa con control de temperatura WSU 400 de procedencia alemana. Se partió en todos los casos de 200 g de muestra. Se emplearon las siguientes ecuaciones:
El contenido de proteínas se determinó mediante el método Kjeldahl a partir de 5 g de cada muestra. Para la destilación, se utilizó un destilador Vapodest de procedencia alemana. Como factor para la determinación del porcentaje de nitrógeno se utilizó 6,25; que es el establecido para muestras vegetales.7
El contenido de nitrógeno en las muestras se determinó pesando 1,21 g. Tras la digestión, la disolución resultante se alcalinizó con un exceso de NaOH; se destiló con vapor de agua, y el NH3 liberado se recogió sobre 50 mL de H3BO3, y posteriormente fue valorado con H2SO4 0,3 N, consumiéndose 17,7 mL del mismo.
El porcentaje de proteínas se calculó según la ecuación (3):
La cuantificación de cianuro se realizó por dos métodos, el de la titulación alcalina y el espectrofotométrico.
Método de la titulación alcalina 8
El material vegetal se tamizó lográndose un tamaño de partícula de 1 mm. Se colocaron 10 g de la muestra en el balón de destilación; se añadieron 200 mL de agua, dejando reposar por 4 h (con el equipo conectado y listo para el proceso de destilación). Se recogieron 150 mL del destilado en una solución de NaOH (0,5 g en 20 mL de agua destilada) y se diluyó a un volumen definido (200 mL). A 100 mL de la mezcla fueron añadidos 8 mL de NH4OH 6 M, 2 mL de KI al 5 %, y se tituló con AgNO3 0,02 M. El punto final es tenue, pero de turbidez permanente y puede ser fácilmente reconocido. El cálculo de la concentración de HCN se realiza mediante la ecuación (4):
Método espectrofotométrico
Para la determinación de cianuro en las muestras, se partió en todos los casos de 50 g. La masa de la muestra se trató con 100 mL de agua destilada bajo la acción de ultrasonido durante 30 min, usando un equipo SB-3200TD de procedencia China. Después de dejar reposar por 1 h, se filtró. Se empleó 1 mL de cada muestra para las mediciones espectrofotométricas.
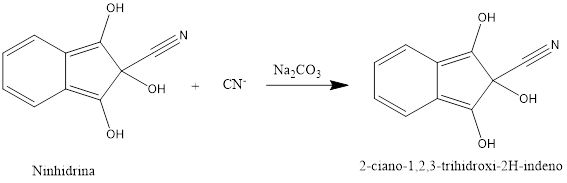
Se usó una modificación del método de la ninhidrina propuesto por Surleva et al., en el que se forma un compuesto coloreado, el 2-ciano-1,2,3-trihidroxi-2H indeno, que se determina espectrofotométricamente a 485 nm, usando un espectrofotómetro FT Rayleigh UV-2100 de procedencia China.9 Para construir la curva de calibración se prepararon patrones de KCN a 5; 15; 25; 35 y 45 μg/mL. Como reactivo desarrollador de color se empleó ninhidrina 0,5 mg/mL en Na2CO3 al 2 %. La solución de ninhidrina se usó recién preparada. La mezcla se dejó reaccionar durante 15 min bajo agitación a temperatura ambiente para que se desarrolle el color.
Los reactivos empleados fueron de calidad pura y analítica, de la marca Sigma-Aldrich. Todos los experimentos se realizaron por triplicados. Los datos fueron analizados con el empleo del software Statgraphics Centurion XV. Se realizó un análisis Anova. Cuando se encontraron diferencias significativas, se usó la prueba de rangos múltiples LSD de Fisher para identificar diferencias entre los tratamientos.
Resultados y discusión
Determinación de materia seca y humedad
El agua es uno de los componentes más importantes de los alimentos y afecta a todas sus propiedades físicas. La forma cómo afecta las propiedades de la harina y el almidón de yuca se explica por la interacción entre el agua y el medio, que rodea la estructura física, también la composición química de los diversos solutos incluido polímeros y coloides como partículas dispersas.10
Los resultados de la determinación de humedad y materia seca se muestran en la tabla 1.
Tabla 1 Contendido de materia seca y humedad en las muestras
| Muestra | Materia seca (%) | Humedad (%) |
|---|---|---|
| Yuca | 35,25 ± 0,08 | 64,75a |
| Harina | 84,58 ± 0,03 | 15,42b |
| Almidón | 78,60 ± 0,05 | 17,40b |
| Leyenda: Letras diferentes en una misma columna, representa que existen diferencias estadísticamente significativas |
La humedad inicial de las raíces es una de las variables que determina la cantidad de raíces frescas (yuca) que se necesita para producir cierta cantidad de harina refinada. En este caso, los modelos financieros han demostrado que la humedad inicial es un aspecto determinante que se debe manejar cuidadosamente para obtener una buena rentabilidad del proceso. El hecho de conocer el contenido de agua y poder modificarlo tiene aplicaciones como: saber cuál es la composición centesimal del producto, controlar las materias primas en el área industrial y facilitar su elaboración, prolongar su conservación impidiendo el desarrollo de microorganismos. No se puede almacenar harina de yuca con más de un 14 % de humedad, debido al crecimiento de hongos y la imposibilidad de mantener su textura y consistencia.11
Como se observa en la tabla 1, el mayor porcentaje de humedad lo tiene la yuca (64,75); este resultado era esperado, debido a que se partió de material fresco al que se le retiró la corteza y se dividió en pequeños trozos, sin someterlo a otro proceso de secado o molienda. El alto contenido de humedad en la yuca fresca, explica la necesidad de secar previamente el material vegetal para la producción de harina. No existieron diferencias estadísticamente significativas en cuanto al porcentaje de humedad de la harina y el almidón, sin embargo, llama la atención la mayor humedad detectada en el almidón (17,40) respecto a la harina (15,42), lo que puede explicarse por el diferente proceso usado en la preparación de cada uno. En el caso de la harina, el material de partida se secó al sol durante una semana, el almidón se preparó a partir de yuca fresca; se eliminó el agua por prensado y posterior secado al sol durante 72 h. Se debe tener en cuenta que una de las características del almidón es su capacidad de retención de agua, por lo que resulta difícil lograr altos niveles de deshidratación.12 Por otra parte, la menor humedad de la harina y el almidón respecto a la yuca fresca significa, que parte del cianuro al ser soluble en agua, se eliminó mediante lixiviación.
Determinación de nitrógeno total
Uno de los factores que pueden interferir en la determinación de cianuro es la presencia de otros compuestos nitrogenados, por esta razón en este trabajo se determinó el nitrógeno total mediante el método Kjeldahl.7
Según la FAO, desde la introducción del sistema proximal de análisis, los valores de las proteínas brutas se han calculado multiplicando el nitrógeno total (N) por un factor determinado. Este factor es 6,25; tomando como base la hipótesis de que las proteínas contienen un 16 % de N.13,14
Los resultados de la determinación de nitrógeno total se muestran en la tabla 2.
En el método Kjeldahl, el nitrógeno de las proteínas y otros compuestos se transforman en sulfato de amonio por medio de la digestión con ácido sulfúrico en ebullición. El residuo se enfría, se diluye con agua y se le agrega hidróxido de sodio. El amonio presente se desprende, se destila y se recibe en una solución de ácido bórico, que luego es titulada con ácido clorhídrico estandarizado. Generalmente, mediante esta vía se determina el nitrógeno proteico. Los aminoácidos reaccionan con la ninhidrina, dando compuestos coloreados que absorben en la región visible del espectro. Una cantidad abundante de proteínas en la muestra podría interferir en la determinación de cianuro. Las tres muestras estudiadas tienen un contenido bajo de nitrógeno proteico.
Cuantificación de cianuro
La yuca contiene dos principios antinutricionales, dos glucósidos cianogénicos conocidos como lotaustralina y linamarina, que se hidrolizan en presencia de linamaraza para dar ácido cianhídrico (HCN) en cantidades que pueden llegar a ser mortales. Aproximadamente el 90 % del ion cianuro se encuentra en forma de glucósido (linamarina o cianuro ligado). El porcentaje restante está constituido, principalmente, por el cianuro libre y lotaustralina. La reacción que libera el HCN ocurre comúnmente cuando la estructura celular del tejido de la base se rompe por acción mecánica al momento de la cosecha y troceado.
Las “yucas dulces” son variedades que presentan bajos contenidos de HCN (menos de 180 ppm), por eso son las más recomendables para el mercado fresco.3 Sin embargo, las variedades en “rango intermedio” (entre 180 y 300 ppm) o las “yucas amargas” (más de 300 ppm), no se consumen frescas, pero sí pueden ser utilizadas en la producción de harina, ya que durante el procesamiento, las raíces sufren transformaciones fisicoquímicas que pueden reducir el contenido de HCN hasta niveles inocuos.
En el trabajo se empeló una variedad de yuca (CENSA 64-7329) clasificada como dulce y apta para el consumo humano, pero como se está utilizando cada vez más la harina y el almidón de yuca en diferentes producciones y existen diferentes procesos artesanales e industriales de secado y preparación, es necesario conocer el contenido de cianuro en estas materias primas.15
Cuantificación de cianuro por el método de titulación alcalina
Titulación alcalina
El método de determinación de cianuro establecido por la AOAC, es la titulación básica con AgNO3.
Este método se basa en la hidrólisis de glucósidos en medio básico, liberándose ácido cianhídrico, el que es destilado y titulado con AgNO3; el ácido cianhídrico forma el complejo soluble Ag(CN)2, el final del punto de la valoración se caracteriza por la aparición de turbidez debido a la formación de AgI.
En la tabla 3 se muestran los resultados de las titulaciones.
Tabla 3 Concentraciones de cianuro en las muestras vegetales, mediante el método de titulación básica
| Muestras | Volumen consumido de AgNO3 | Concentración de cianuro (μg/mL) |
|---|---|---|
| Yuca | 17,611 ± 0,371 | 19,02a |
| Harina | 12,231 ± 0,252 | 13,21b |
| Almidón | ND | ND |
| Leyenda: Letras diferentes en una misma columna, representa que existen diferencias estadísticamente significativas. X : media, ND: no determinado |
Si se tiene en cuenta que la máxima cantidad de cianuro permitida en los alimentos es 10 ppm (10 mg/kg), se puede considerar que el contenido de cianuro en las muestras es bajo, encontrándose en el orden de los μg/mL. Según la tabla 2, existen diferencias estadísticamente significativas entre las cantidades de cianuro de la yuca y la harina. Estos resultados pueden explicarse si tenemos en cuenta que el tratamiento dado a cada muestra fue diferente; la harina se obtuvo a partir de yuca que se secó durante una semana al sol, período en el que se elimina gran cantidad de cianuro.16,17 Mediante el método utilizado, no se pudo cuantificar cianuro en el almidón.
Método espectrofotométrico
De acuerdo con la tabla 2, el contenido de nitrógeno es bajo, incluso no fue posible determinarlo en el almidón mediante titulación alcalina. Estos resultados demuestran que se debe utilizar otro método para la determinación de cianuro en variedades de “yuca dulce”. Mediante el método de la ninhidrina, se puede determinar espectrofotométricamente pequeñas cantidades de cianuro minimizando las interferencias de otros compuestos nitrogenados que puedan reaccionar con el reactivo desarrollador de color (figura 2.18 Por otra parte, el compuesto formado por la reacción de la ninhidrina con cianuro (2-ciano-1,2,3-trihidroxi-2H indeno) tiene su máximo de absorción a 485 nm, longitud de onda a la que se realizó la medición, lo que pudiera eliminar cualquier interferencia.19
Curva de calibración
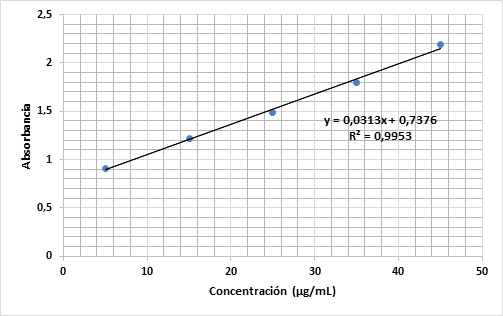
A partir de los diferentes patrones de KCN, se desarrolló la curva de calibración que se muestra en la figura 3.
De acuerdo con Pohland, mediante el método colorimétrico es posible detectar concentraciones de cianuro del orden de 20 µg∙L−1. Al no poder cuantificar cianuro en el almidón por el método de titulación alcalina, se decidió usar la determinación espectrofotométrica. Después de la medición experimental de la absorbancia de cada muestra y a partir de la curva de calibración, se calcularon las concentraciones de cianuro en la yuca fresca, harina y almidón.
La espectroscopía UV-visible es un método versátil para la determinación de cianuro, en este estudio se utilizó la alta selectividad de la reacción entre la ninhidrina y el cianuro en medio alcalino para determinar trazas del ion.20 Los resultados se muestran en la tabla 4.
Tabla 4 Resultados de la determinación de cianuro en las tres muestras
| Muestras | Concentración de cianuro (μg/mL) | |
|---|---|---|
| Yuca | 1,289 ± 0,015 | 17,616a |
| Harina | 1,090 ± 0,020 | 11,258b |
| Almidón | 0,967 ± 0,020 | 7,329c |
| Leyenda: Letras diferentes en una misma columna, representa que existen diferencias estadísticamente significativas. 𝑋 : media |
Como se observa en la tabla 4, existen diferencias estadísticamente significativas entre las concentraciones de cianuro de las tres muestras. La menor cantidad del ion en la harina y el almidón demuestran que, en el tratamiento de la yuca para obtener estos dos productos, se elimina parte del cianuro. En el caso del almidón se detectó la menor concentración de cianuro, esto se explica porque en el proceso de prensado se elimina gran cantidad de agua, la que arrastra el cianuro. En cambio, para la obtención de la harina, aunque se pierde mayor cantidad de agua (tabla 1), esta se elimina por evaporación al sol, quedando un remanente de cianuro en la muestra. El método espectrofotométrico permitió cuantificar cianuro en concentraciones tan bajas como 7,32 μg/mL.
No se pudieron comparar estadísticamente los resultados de ambos métodos, debido a que mediante la titulación alcalina no fue posible detectar cianuro en el almidón.
Conclusiones
La variedad de yuca estudiada presenta un contenido de cianuro entre 19-7,32 μg/mL, valores que se encuentran por debajo de los límites establecido por la FAO-OMS.5 De los procedimientos analíticos utilizados, el método espectrofotométrico que emplea ninhidrina como desarrollador de color fue el de mejores resultados, permitiendo detectar cianuro en el almidón en concentraciones de 7,32 μg/mL.