Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Cirugía
versión On-line ISSN 1561-2945
Rev Cubana Cir v.42 n.1 Ciudad de la Habana ene.-mar. 2003
Artículos de revisión
Hospital Clinicoquirúrgico Docente "Joaquín Albarrán"
Shock, ¿qué hay de nuevo?
Dra. Marta Sofía López Rodríguez1 y Dr. Alejandro Jesús Areu Regateiro2
Resumen
El shock es un síndrome común de diversas causas que se inicia por una disminución de la perfusión hística, donde la microcirculación tiene una función crítica. En estudios recientes se profundiza en la terapéutica que debe ser inmediata, pues amenaza la vida e incluye: soporte respiratorio, soporte circulatorio, monitoreo metabólico, hemodinámica y tratamiento específico. El uso de cristaloides versus coloides es controversial y depende del criterio del médico. Se evidencia la utilidad de la amrinona (ionotropo), sobre todo en pacientes en shock séptico, y como vasopresor la vasopresina. El monitoreo de la concentración plasmática del ácido láctico es necesario por su relación con la mortalidad por shock. La mortalidad del shock séptico, a pesar de múltiples investigaciones, continúa elevada. Los inhibidores de la óxido-nítrico sintasa (S metil-isiotiourea) de reciente utilización, parece alentador al inhibir la isoforma inducible (iNOS) y de igual forma la inmunoterapia, pero se necesitan de nuevos estudios para evaluar su eficacia clínica.
DeCS: SHOCK/mortalidad; SHOCK/terapia; SHOCK SEPTICO/mortalidad; SHOCK SEPTICO/terapia; RELACION VENTILACION-PERFUSION; TERAPIA COMBINADA; COLOIDES/uso terapéutico; INMUNOTERAPIA.
El término shock se empleó originalmente por el médico francés Henry Francois Ledran en 1773, para describir la evolución clínica de pacientes después de un traumatismo por herida de arma de fuego.
Tomas Latta en 1883, describe su tratamiento en un caso de hipovolemia por cólera; este concepto evoluciona hasta la actualidad para definirlo como una insuficiencia circulatoria asociada con determinados procesos, cuyo denominador común es la existencia de hipoperfusión e hipoxia hística en diferentes órganos sistemas, que de no corregirse rápidamente produce lesiones celulares irreversibles y fallo multiorgánico.
Mecanismos de producción del Shock
Para garantizar una presión sanguínea adecuada es imprescindible que exista un flujo sanguíneo a través del sistema circulatorio, por lo que cualquier enfermedad o alteración que produzca un descenso significativo de la presión sanguínea también compromete la perfusión de órganos vitales.1
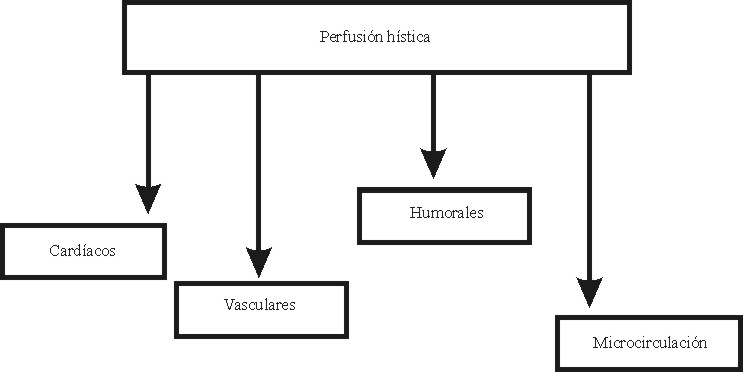
El inicio del shock es consecuencia de una inadecuada perfusión hística, por lo que debemos conocer los factores determinantes de la perfusión hística, los que podemos dividir en cardíacos, vasculares, humorales y de la microcirculación (figura).
Fig. Factores determinantes de la perfusión hística.
La alteración de cada uno de ellos puede producir o contribuir al shock.
Factores cardíacos
Gasto cardíaco: producto de la frecuencia cardíaca y el volumen sistólico. El volumen sistólico depende de 3 factores precarga, contractilidad y poscarga.
Precarga: longitud inicial del músculo antes de la contracción, es determinada por el
volumen telediastólico ventricular.
Poscarga: es la presión o fuerza ventricular requerida para vencer la resistencia a la eyección, determinada por la presión diastólica aórtica y la resistencia vascular periférica.
Contractilidad: capacidad intrínseca de la fibra miocárdica para contraerse.
Frecuencia cardíaca: ritmicidad intrinseca del nodo sinoauricular que dispara de forma coordinada y conducida hacia el ventrículo.
Factores vasculares
La distribución del flujo sanguíneo depende de la regulación intrínseca de sus resistencias y el control neurohumoral extrínseco.
La resistencia al flujo es proporcional a la longitud del vaso y a la viscosidad e inversamente proporcional al radio del vaso, por lo tanto el área transversal del vaso es el determinante de la resistencia al flujo.
El tono arteriolar se regula por factores extrínsecos (regulación neurohumoral) y factores intrínsecos (respuesta miogénica, autorregulación metabólica, regulación mediada del endotelio). Las arteriolas de resistencia reciben estímulos vasoconstrictores desde el sistema nervioso simpático el cual es regulado por los barorreceptores.
Respuesta miogénica: los vasos pueden contraerse o relajarse por cambios de la presión transmural y mantener flujo constante con cambios de presión de perfusión.
Autorregulación metabólica: liberación de vasodilatadores (adenosina y prostaglandina vasodilatadora) que incrementan el flujo sanguíneo en respuesta al aumento de la actividad metabólica.
Modulación endotelial del tono vascular: se liberan una serie de mediadores con importante acción local que incluyen el factor de relajación del endotelio vascular (óxido nítrico), los eucosanoides, el péptido vasoconstrictor de la endotelina-1, angiotesina II y los radicales libre de oxígeno.2,3
Factores de la microcirculación
El fallo en la microcirculación es el aspecto crítico en la patogénesis del shock. La adhesión de leucocitos, plaquetas y las células endoteliales dañadas pueden causar aglutinación, oclusión de la microvasculatura, activación del sistema de coagulación con depósitos de fibrina y acumulación de microtrombos, lo que contribuye también a la oclusión microvascular.
El flujo en la microcirculación depende del equilibrio entre presión colidosmótica y la presión hidrostática del capilar, lo que determina el balance entre el líquido intravascular y extravascular. La estimulación simpática contrae el esfínter precapilar, decrece la presión hidrostática y favorece el paso del líquido del extravascular al intravascular, pero también se contrae el esfínter poscapilar, la hipoxia y la acidosis se añaden, lo que trae como consecuencia una caída de la respuesta arteriolar vasoconstrictora mediada por el simpático, pero persiste la contracción del esfínter poscapilar y se extravasa el fluido en el intersticio. En adición, las toxinas circulantes y los leucocitos activados incrementan la permeabilidad capilar, y aumentan el edema. Este proceso puede exacerbarse por la pérdida de proteínas plasmáticas en el intersticio, y ocurrir reducción de la presión coloidosmótica, del volumen intravascular y la perfusión de los tejidos.
Factores humorales
La liberación de mediadores renina, vasopresina, prostaglandina, citoquinas (interleucina 1 y factor de necrosis tumoral), factor atrial natriurético, catecolaminas, efectos celulares de la isquemia, toxinas y mecanismos immunológicos tienen un importante papel en la homeostasis cardiovascular.4
Clasificación del shock basada en las alteraciones de la perfusión hística:
- Shock cardiogénico
- Infarto agudo del miocardio.
- Miocardiopatía dilatada.
- Depresión miocárdica en el shock séptico.
- Mecánica.
- Egurgitación mitral.
- Defecto ventricular septal.
- Aneurisma ventricular.
- Obstrucción a la salida del ventriculo izquierdo (estenosis aórtica, cardiomiopatía hipertrófica).
- Arritmias.
- Shock extracardíaco obstructivo
- Taponamiento pericárdico.
- Embolismo pulmonar (masivo).
- Hipertensión severa pulmonar (primaria o Eisenmenger).
- Shock hipovolémico
- Hemorragia.
- Deplesión de fluidos.
- Shock distributivo
- Shock séptico.
- Productos tóxicos (sobredosis de drogas).
- Anafilaxia.
- Shock neurogénico.
- Shock endocrinológico.
Las manifestaciones clínicas
- Etiología.
- Momento evolutivo.
- Aparición o no de complicaciones.
- Terapéutica empleada anterior.
- Estado de salud previo.
- Coexistencia de varios shock.
El diagnóstico de shock se basa en la anamnesis, la presencia de signos y síntomas de hipoperfusión periférica expresada como taquicardia, hipotensión (PAM < 70 mmHg), alteración del nivel de conciencia, oliguria, frialdad, livideces cutáneas, la evaluación hemodinámica, así como por los exámenes complementarios.
La valoración clínica del gasto cardíaco nos permitirá clasificarlo en 2 grupos con gasto cardíaco bajo (hipodinámico) y con gasto cardíaco (GC) elevado (hiperdinámico).
Si el GC está elevado el pulso es amplio con presión diastólica baja, extremidades calientes, rellene capilar rápido e hipertermia, lo que sugiere la existencia de un proceso séptico (consecuencia de la respuesta inflamatoria del huésped a los microorganismos).
Por el contrario si el GC es bajo, caracterizado por un pulso débil, filiforme, palidez, frialdad cutánea, cianosis distal, relleno capilar lento e hipotermia, debemos buscar como está la volemia y la suficiencia cardiovascular. Si existen signos de insuficiencia debemos pensar en un origen cardíaco, de lo contrario debemos buscar por anamnesis y exploración clínica, pérdidas sanguíneas o de líquidos, lo cual sería consecuente con la hipovolemia.
Tratamiento
La terapéutica debe ser inmediata, pues en un proceso que amenaza la vida existen situaciones que requieren tratamiento urgente, sin el cual es imposible revertir la situación del shock (taponamiento cardíaco, neumotórax a tensión, tromboembolismo pulmonar masivo):
- Soporte respiratorio: permeabilidad de la vía aérea, ventilación y oxigenación adecuada.
- Soporte circulatorio: acceso endovenoso para reposición de volumen, independiente del tipo de shock se debe optimizar la precarga con la administración de fluidos.
Continúa la controversia del tipo de fluidos que se deben emplear (cristaloides, coloides, sangres o derivados). Los coloides mantienen la presión oncótica, lo que resulta ventajoso, mientras que los cristaloides reponen las pérdidas del intersticio; la eleccióm dependerá del criterio del médico.5,6
Recientemente se ha utilizado la solución hipertónica de cloruro de sodio al 7,5 % en el shock hipovolémico. Para el llene vascular se requieren volúmenes más pequeños que cuando se emplean soluciones isotónicas; mejora la microcirculación, deshidrata los glóbulos rojos, contrae el endotelio capilar, recupera agua desde el intersticio, produce constricción de venas periféricas y pulmonares (aumenta la precarga), dilatación de los esfínteres precapilares (reduce la poscarga); sin embargo, su utilización produce incrementos de la natremia y la osmolaridad plasmática, hipocalemia, deshidratación cerebral y convulsiones, así como fallo cardíaco en pacientes con cardiopatía, por lo que no se recomienda su uso generalizado.
En estudios de animales in vitro atenúa la respuesta inflamatoria producida en el shock y disminuye la respuesta citotóxica de receptores mediados por neutrófilos por inhibición del factor activador plaquetario (PAF), lo cual es de gran importancia en la génesis del fallo múltiple de órganos.7
En relación con los coloides el hidroetilalmidon ofrece ventajas, pues sus características son similares a la albúmina, aumenta en 150 % la volemia, a las 3 h de infundido se degrada por hidrólisis, tiene una vida media plasmática de 17 días y se excreta por la orina y heces. Raramente produce reacciones anafilactoides, no altera la tipificación de grupo sanguíneo, pero al igual que los dextranos interfiere en la actividad plaquetaria y su uso está contraindicado en la insuficiencia renal. Su dosis aconsejada es de 10 a 20 mL/kg/día en 4 a 6 horas.
Diversos estudios plantean que 7g/dL es el nivel inferior para el adecuado transporte de oxígeno, por lo que se deben reponer las pérdidas sanguíneas con sangre cuando sobrepase el 30 % de la volemia, por las desventajas que presenta la utilización de ésta.8
Se ha descrito la utilización de soluciones transportadoras de oxígeno, como el estroma celular eritrocitarios (HB cruzada con diapirina) la que mejora la saturación venosa central y la saturación hística de oxígeno.9
Fármacos cardiovasculares
Las catecolaminas son las más empleadas y en dependencia de la dosis a la cual se administra, su efecto predominante será alfa o beta; dentro de ellas se encuentran adrelanina, noradrenalina, dopomina, dobutamina.
La vasopresina es una hormona sintetizada en los núcleos supraópticos y paraventriculares del hipotálamo, es transportada a la parte posterior de la glandula pituitaria y sale a la circulación con cambios en la presión arterial o en la osmolaridad plasmática, pero también produce náuseas y dolor abdominal intenso. Regula el balance de líquidos sobre la base de su acción antidiurética mediada por los receptores V2 (riñón), y el aumento de la presión arterial es provocado por los receptores V1 localizados en el músculo liso vascular V1a y V1b que se encuentran en la adenohipófisis.
En la sepsis se han demostrado niveles bajos de vasopresina y problemas con la secreción.10
En estudios experimentales la infusión de vasopresina en bajas dosis aumentaron la presión arterial, aumentaron el flujo a las carótidas lo que reafirma ser un excelente vasopresor.11
Se deben administrar 50 unidades de vasopresina en 250 cc de solución salina e iniciar el goteo a 5 cc/h y aumentarlo hasta que la presión arterial media sea mayor de 60 mmHg. Si el paciente está recibiendo dopamina, disminuir ésta a dosis renales.
Las complicaciones de su utilización son: necrosis del tubo digestivo desde el esófago hasta el recto, disrritmias, infarto del miocardio, insuficiencia renal aguda y muerte.
La milrinona y la amrinona son inhibidoras de la fosfodiesterasa, con actividad ionotropa positiva, vasodilatadoras y débil cronotropismo.1
La milrinona se utiliza en dosis de ataque de 50 mcg/kg seguida de infusión de 0,375 a 0,75 mcg/kg/min.
La amrinona se administra a 0,75 mg/kg lenta en bolo durante 2 ó 3 min y se mantiene con una infusión de 5 a 10 mcg/kg/min.
En estudios llevados a cabos en ratas sugieren que el shock séptico el TNF alfa induce un defecto en la respuesta b-adrenérgica en los miocitos cardíacos, además el TNF alfa aumenta la respuesta ionotropa del músculo cardíaco a los inhibidores de la fosfodiesterasa, a través de mecanismos independientes de la generación AMPc, lo cual sería de gran utilidad en el shock séptico refractario a las catecolaminas.12
El monitoreo hemodinámico y metabólico adecuado permitirá una correcta terapéutica y evolución de los pacientes.
Se observará frecuencia cardíaca y ritmo por electrocardiografía continua; presión arterial media como valor de referencia y para determinar la resistencia vascular periférica y la resistencia vascular pulmonar y presión venosa central (PVC) para la valoración de la volemia eficaz.
Se utilizará catéter Swan y Ganz en la arteria pulmonar para medir PVC, presión sistólica, diastólica, y media de arteria pulmonar, así como la presión de oclusión en dicha arteria. Actualmente se cuenta con catéteres sofisticados con los que se pueden medir gasto cardíaco, fracción de eyección y la saturación de oxígeno de la sangre venosa mixta.
- Diuresis horaria
- Pulsoximetría no útil cuando la presión de pulso es baja
En una concentración plasmática de ácido láctico existe correlación entre estos y la mortalidad de los pacientes en shock.
Una tonometría gástrica con pH bajo es de mal pronóstico y se relaciona con fallo multiorgánico.
Tratamiento específico
Hipovolémico
Hemorrágico: Localización precoz del foco de sangrado y control de este e infundir rápidamente ringer lactato en uso limitado, porque aunque incrementa el transporte de 02 al aumentar la precarga provoca hemodilución con disminución del contenido arterial de oxígeno. Si pese a estas medidas la inestabilidad hemodinámica y los signos de hipoperfusión persisten se deberá administrar sangre sin olvidar que por cada 5 unidades de concentrados de hematíes se deberá administrar una unidad de plasma fresco y una unidad de concentrado de plaquetas por cada 10 kg de peso corporal.
No hemorrágico: Corrección rápida de la hipovolemia, pues si se retrasa una o 2 horas las posibilidades de éxito de la resucitación se reducen drásticamente.
Séptico: Remoción del foco séptico y antibioticoterapia empírica hasta tener el resultado microbiológico. Administración de fluidos si no mejora la situación hemodinámica, se indica el uso de ionotropos y vasopresores.
Otros agentes terapéuticos
Inhibidores de la cicloxigenasa. Se ha demostrado en animales que cuando su producción se bloquea por los inhibidores se revierte la hipotensión, aumenta el gasto cardíaco, mejora la hipoxemia, disminuye el agua extravascular pulmonar, pero no existen estudios claros en el shock séptico en humanos.13,14
Naloxona en fases tempranas del shock cuando los niveles de endorfinas son más elevados y en ausencia de acidosis e hipotermia, pues éstas disminuyen los niveles de endorfinas.15,16
Antagonistas de la bradikinina: Disminuyen los efectos deletéreos de las liposacaridasas.17
Inhibidores de la óxido nítrico sintasa.
El óxido nítrico (NO) es un radical libre gaseoso que se sintetiza in vivo por las enzimas sintasas (NOS). Estas enzimas catalizan la reacción entre el aminoácido L-arginina y el oxígeno y producen NO y L-citrulina. En el músculo cardíaco se han identificado por lo menos 3 isoformas de las NOS.5 Dos de ellas son constitutivas (cNOS1 y cNOS3) Ca2+/calmodulina-dependientes y solo producen NO cuando existe elevación del calcio. La isoforma (NOS2 o INOS) es inducible e insensible al calcio y se enduce por la liberación endógenas de citoquinas proinflamatorias y endotoxinas. Una vez expresada es capaz de producir grandes cantidades de NO y originar consecuencias patológicas en el shock séptico y la endotoxemia.
El S-metil-isiotiourea es un potente inhibidor de la óxido nítrico sintasa con relativa selectividad por la isoforma inducible. En estudios en ratas con endotoxemia se ha demostrado un efecto beneficioso en la oxigenación el flujo sanguíneo, al inhibir la iNOS y se considera una terapéutica útil en el shock séptico.18,19
Inmunoterapia con anticuerpos anti-endotoxina, anti TNF alfa, Anti-IL6 e IL8. El tratamiento con anticuerpos monoclonales tiene la ventaja de su disponibilidad, proteger a los pacientes del efecto tóxico de las endotoxinas y reducir la mortalidad por shock séptico o de líquidos, lo cual sería consecuente con la hipovolemia.
En recientes estudios de pacientes politraumatizados en los cuales se utilizaron anticuerpos monoclonales CD18* (rhuMab CD18) 0,5-2mg/kg en el episodio hipotensivo y en no más de 6 h de ocurrido el trauma, excepto el trauma craneal, se verifico el 90 % de saturación de los receptores neutrofílicos CD18 por aproximadamente 48 h en pacientes bajo resucitación del shock, no produjo aumento de la infección en estos casos comparado con el placebo.
Aunque son resultados alentadores se deberá seguir investigando sobre la eficacia clínica de esta terapéutica.20-22
Inhibidores de las proteinasas: melatoproteinasa inhibe la liberación del factor de necrosis tumoral.23
Hormona estimulante a melanocitica: melatonina es una neurohormona pineal que potencia la inmunoterapéutica en infecciones víricas y bacterianas.24
Antagonistas del factor plaquetario (Bakkenolide G) El PAF participa en la reacción inflamatoria, shock endotóxico, enfermedades alérgicas y la agregación plaquetaria, por lo que los antagonistas desempeñan papel importante.25
Eliminadores de radicales libres de oxígeno: xantina oxidasa útil como barredor de radicales libres en el shock séptico.26
La N acetil-cisteína antioxidante atenúa la respuesta que da la lesión hística en pacientes sépticos.27
Debemos mencionar también como agentes terapéuticos a la pentoxifilina y al ketoconazol.
A pesar de nuemerosas investigaciones acerca de la fisiopatología del shock séptico y de nuevos agentes terapéuticos para reducir la mortalidad, la investigación en esta esfera debe continuar, pues no hay evidencias suficientes para emplearlos.
Cardiogénico
Obstructivo extracardíaco: pericardicentesis si existe taponamiento cardíaco, terapia trombolítica o embolectomía en un tromboembolismo de origen.
Intracardíaco: combinación de agentes ionotropos en caso de IMA, se ha valorado la angioplastia coronaria.
Anafiláctico: epinefrina, antihistamínicos, fluídos y esteroides.
Neurogénico: restituir volumen y vasopresores
Summary
Shock is a commom syndrome originated by different causes that starts with a decrease of histic perfusion, where macrocirculation has a critical function. In recent studies, emphasis has been made on the fact that therapeutics should be immediate in the face of this life menace and should include respiratory support, circulatory support, metabolic monitoring, hemodynamics and specific treatment. The use of crystalloids versus colloids is controversial and depends on the medical criterion. The usefulness of amrinone (ionotrope), mainly in patients with septic shock, and of vasopressin as a vasopressor is proved. The monitoring of the plasmatic concentration of the lactic acid is necessary due to its relation with mortality from shock. The mortality from septic shock is still high, in spite of the multiple investigations made. The recent utilization of nitric oxide synthase (S methyl-isothiourea) inhibitors seems to be encouraging on inhibiting the inductible isoform (iNOS), the same as immunotherapy, but new studies are necessary to evaluate its clinical efficiency.
Subject headings: SHOCK/mortality; SHOCK/therapy; SHOCK, SEPTIC/mortality; SHOCK, SEPTIC/therapy; VENTILATION-PERFUSION RATIO; COMBINED MODALITY THERAPY; COLLOIDS/therapeutic use; IMMUNOTHERAPY.
Referencias bibliográficas
- Hollenberg SM, Kaviski CJ, Parrillo JF. Cardiogenic shock. Ann Inter Med 1999;31(1):47-59.
- Kharb S, Singh V, Ghalaut PS, Sharma A, Singh G. Role of oxygen free radicals in shock. J Assoc Physic India 2000;48(10):956-7.
- Martín G, Vila P. Rol y mecanismo del óxido nítrico en la regulación de la contractilidad miocárdica. Rev Fed Arg Cardiol 2000;29:501-7.
- Mattuschak GM. Multiple systems organ failure: clinical expression, pathogenesics and therapy. En: Hall SB, Schmidt GA, Wood LDH eds. Principles of Critical Care 1992.p.614-36.
- Chio Pt-L, Yip G, Quiñones LG. Crystalloids vs. Colloids in fluid resuscitation: a systematic review. Crit Care Med 1999;27:200-10.
- Waikar SS, Chertow GM. Crystalloids versus colloids for resuscitation in shock. Curr Opin Nephrol Hypertens 2000;9(5):501-4.
- Ciesla DJ, Moore EE, González RJ, Biffl WL. Hypertonic saline inhibits neurtrophil (PMN) priming via attenuation of p 38 MAPK signaling. Shock 2000;14(7):265-9.
- Carpenter RJ. Transfusión de sangre y componentes sanguíneos. En: Varon J, Manuales prácticos de cuidados intensivos. Mosby Doyma eds; 1995. p. 207-9.
- Frankel H, Nguyen H, Donohue T. Diaspirina cross-linked hemoglobin in efficacious in gut resuscitation as measured by GI Tract optode. J Trauma 1996;40:231.
- Landry DW. Vasopressin deficiency contributes to the vasodilation of septic shock. Circulation 1997;95:1122.
- Voelckel WG, Lurie KG, Lidner KH. Vasopressin improves survival after cardiac arrest in hypovolemic shock. Anesth Analg 2000;91(3):627-34.
- Kumar A, Kosuri R, Kandula P. Effect of epinephrine and amrinone on contractility and cyclic adenosine monophosphate generation of tumor necrosis factor alpha-exposed cardiac myosytes. Crit Care Med 1999;27(2):286-92.
- Freeman BD, Natanson C. Anti-inflammatory therapies in sepsis and septic shock. Expert Opin Investig Drugs 2000;9(7)1651-63.
- Van Dissel JT. Anti-inflammatory cytokine profile and mortality in febrile patients. Lancet 1998;351:950.
- Napolitano L, Chernow B. Endorphins in circulatory shock. Crit Care Med 1988;16:566-7.
- Napolitano L. Naloxone therapy in shock: the controversy continues. Crit Care Med 2000;28:887-8.
- Bentley KR, Jarrott B. Lipopolysaccharide decreases bradykinin receptor-induced acidification responses in cultured bovine aortic endothelial cells. Eur J Pharmacol 2000;402(1-2):11-8.
- Saetre T, Hoiby EA, Aspelin T, Lermark G, Egeland T, Lyberg T. Aminoethyl-isothiourea, a nitric oxide synthase inhibitor and oxygen radical scavenger, improves survival and counteracts hemodynamic deterioration in a porcine model of streptococcal shock. Crit Care Med 2000;28(8):3081-2.
- Rosselet A. Selective iNOS inhibition is superior to norepinephrine in treatment of rat endotoxic shock. Am J Rep Crit Care Med 1998;157(1):162-70.
- Rhee P, Morris J, Durban R, Hauser C. Recombinant humanized antibody against CD 18 (rhuMabCD 18) in traumatic hemorrhagic shock: result of a phase II clinical trial traumatic shock group. J Trauma 2000;49(4):611-9.
- Abraham E. Double-blind randomised controlled trial of monoclonal antibody to tumor necrosis factor in treatment of septic shock. Lancet 1998;351:929.
- Vincent JL. Commentary: Search for effective immunomodulating strategies against sepsis. Lancet 1998;351:922.
- Yamada K, Yoshino K, Sekikawa K, Madarame H, Yagita H, Nakane A. Effect of a matrix metalloproteinase inhibitor on host resistance against Listeria monocytogenes infection. FEMS Immunol Med Microbiol 2000;29(3):187-994.
- Maestroni GJ. The immunotherapeutic potential of melation. Expert Opin Investig Drugs 2001;10(3):467-76.
- Lia Ch, Ko FW, WU TS, Bakkelolide G. A Natural PAF-receptor antagonist. J Pharm Pharmacol 2000;49(12):1248-53.
- Nemeth I, Boda D. Xanthine oxidase activity and blood glutathione redox ratio in infants and children with septic shock syndrome. Intensive Care Med 2001;27(1):216-21.
- Heller AR, Groth G, Heller SC, Breitkreutz R, Nebe T, Quintel M, et al. Acetylcysteine reduces respiratory burst but augments neutrophil phagocytosis in intensive care unit patients. Crit Care Med 2001;29(2):272-6.
Recibido: 10 de abril de 2002. Aprobado: 6 de mayo de 2002.
Dra. Marta Sofía López Rodríguez. Calle 43, número 1111, entre 36 y Kolhy, Nuevo Vedado, municipio Plaza de la Revolución, Ciudad de La Habana, Cuba. E-mail: marlesof@infomed.sld.cu
1 Especialista en Anestesiología y Reanimación. Asistente.
2 Especialista en Medicina Interna. Diplomado en Cuidados Intensivos.