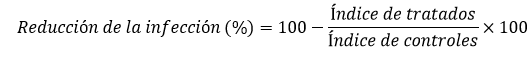La leishmaniasis es una parasitosis causada por protozoos del género Leishmania, transmitidos entre mamíferos hospederos por la picadura de un insecto vector flebótomo. Las manifestaciones clínicas de la enfermedad se distinguen fundamentalmente en dos síndromes: leishmaniasis visceral (LV, también conocida como kala-azar) y leishmaniasis cutánea (LC).1) Entre estas, la LC se identifica como pequeños eritemas en el sitio de inoculación, que evolucionan a una pápula y luego a úlceras que varían en duración y gravedad. Una proporción de estas infecciones son asintomáticas y sin dolor, aunque se pueden presentar en diversas formas incluyendo la LC localizada, difusa, diseminada y mucocutánea. Cada año se reportan entre 0,7-1,2 millones de casos de LC.2 Recientemente, se ha incrementado la tasa de incidencia de LC en el Medio Oriente y en las Américas, asociado a conflictos bélicos y a factores ambientales.3
El tratamiento actual se basa en la quimioterapia con un reducido número de medicamentos registrados,4 que presentan elevada toxicidad, administración parenteral, largos periodos de tratamiento, desarrollo de resistencia y alto costo, todo lo cual afecta su uso en las áreas endémicas.5 Sin nuevos medicamentos eficaces se espera un incremento en la incidencia de esta enfermedad debido a factores como el cambio climático, la urbanización global y el aumento de trastornos inmunosupresores.6,7 En este sentido, la Organización Mundial de la Salud (OMS) considera la leishmaniasis como un problema de salud global preocupante y una enfermedad tropical desatendida,2 por lo que la búsqueda de nuevos tratamientos es un reclamo persistente.8
El reposicionamiento o reciclaje farmacológico permite identificar y desarrollar nuevos usos para fármacos aprobados en la clínica contra otras afecciones, lo cual permitiría ahorrar tiempo y recursos.9 Se han explorado fármacos antimaláricos por su posible actividad antileishmanial,10 grupo en el que se ha incentivado el estudio de la artemisina frente a diferentes especies de Leishmania.11,12,13,14,15,16 Recientemente, nuestro grupo demostró que la artemisina inhibe el crecimiento in vitro de L. amazonensis y que es capaz de controlar el desarrollo de la infección por vía intralesional en ratones BALB/c experimentalmente infectados.16 Con el objetivo de reunir nuevas evidencias sobre la eficacia in vivo de la artemisina frente a la LC experimental (LCE), se decidió comparar los efectos de la administración oral e intralesional de la artemisina en ratones BALB/c y C57BL/6 infectados con L. amazonensis. Con tal propósito se utilizó un esquema de tratamiento similar al empleado con anterioridad.16
Parásitos: Se utilizó una cepa de referencia de L. amazonensis (MHOM/77/LTB0016) donada por el Departamento de Inmunología de la Fundación Oswaldo Cruz, FIOCRUZ, RJ, Brasil. La cepa fue mantenida en ratones BALB/c, de los cuales se realizó un aspirado y se mantuvieron los parásitos en medio de cultivo Schneider (SIGMA, St. Louis, MO, EE. UU.), suplementado con 200 UL de penicilina sódica y 200 µg/mL de estreptomicina) (SIGMA, St. Louis, MO, EE. UU.) y al 10 % de suero fetal bovino (SIGMA, St. Louis, MO, EE. UU.).
Fármacos: Se utilizó la artemisina suministrada por Sigma-Aldrich (Bornem, Amberes, Bélgica) con una pureza ≥ 98 % y diluida en dimetilsulfóxido (BDH, Poole, Inglaterra) a 40 mM. Como fármaco de referencia se empleó el Glucantime® (Rhône-Poulenc Rorer, Ciudad de México, México), el cual quedó disuelto en solución salina fisiológica estéril (Imefa, La Habana, Cuba) a 82 mM.
Animales: Se emplearon ratones BALB/c y C57BL/6 jóvenes-adultos hembras sanas, proporcionados por el Centro Nacional de Producción de Animales de Laboratorio (CENPALAB, Mayabeque, Cuba), con su correspondiente certificado de calidad y un peso corporal entre 18-22 g. Los ratones se mantuvieron en condiciones sanitarias convencionales con un régimen de 12-12 h de luz-oscuridad, con abastecimiento de alimento (pienso concentrado para roedores, suministrado por CENPALAB) y agua (6,0 ≤ pH ≤ 8,0) para ser consumidos libremente.
La experimentación con animales, que se describe a continuación, se realizó bajo supervisión del Comité de Ética del Instituto de Medicina Tropical Pedro Kourí (CEI-IPK 16-16) y según las guías establecidas para el uso y cuidado de los animales de laboratorio, con el objetivo de disminuir su sufrimiento.
Evaluación del tratamiento con la artemisina por vía oral e intralesional en ratones BALB/c y C56BL/6 infectados experimentalmente con L. amazonensis: A partir de un cultivo de promastigotes de L. amazonensis en fase metacíclica, se infectaron los ratones en los cojinetes plantares de la extremidad posterior derecha en vista ventral, por vía subcutánea a razón de 5 × 106 promastigotes/50 µL de solución salina fisiológica estéril, lo que se consideró el día 0 posinfección. La línea BALB/c es sensible a la infección, mientras que los animales C57BL/6 son resistentes. El día 30 posinfección los ratones se distribuyeron aleatoriamente en siete grupos de ocho animales de la misma línea animal (tres grupos BALB/c y cuatro grupos C57BL/6), momento a partir del cual comenzaron a recibir el tratamiento con artemisina (oral o intralesional): 50 µL a razón de 30 mg/kg, cinco dosis cada cuatro días.
Dos grupos experimentales (uno de cada línea animal) fueron tratados con artemisina por vía oral y un grupo de animales C57BL/6 fue tratado con artemisina vía intralesional. Para cada línea murina se consideró un grupo control (sin tratamiento) y un grupo tratado con fármaco de referencia (Glucantime®) por vía intralesional con el mismo régimen de administración.
Los animales se revisaron diariamente y se reportaron las muertes de estos. Cada siete días se midieron ambas extremidades posteriores (derecha e izquierda) en dirección dorsoventral de todos los animales con un cutímetro (Krœplin Längenmesstechnick, Alemania) y se determinó el peso corporal por grupo utilizando una balanza técnica (Sartorius, Goettingen, Alemania). A partir de los datos se calcularon las variaciones en el peso corporal teniendo en cuenta las diferencias entre el inicio del tratamiento y final del experimento; mientras que el tamaño de las lesiones se determinó por la diferencia entre la extremidad infectada y no infectada.
En los días 44 y 72 posinfección se determinó la carga parasitaria mediante el método de microtitulación en placas de 96 pozos.17 Las muestras tomadas de tejido subcutáneo infectado de tres animales por grupo se pesaron en una balanza analítica (Sartorius, Goettingen, Alemania) y se homogenizaron en 4 mL de medio Schneider. Dentro de un gabinete de seguridad (Flufrance, Equipements Scientifiques Industriels, Francia) se realizaron diluciones seriadas (1:4) en placas de 96 pozos, las cuales fueron incubadas a 26 ºC durante 15 días. Entonces, fueron examinadas con un microscopio invertido a 400 X (Olympus, Tokyo, Japón) y se determinó el título final teniendo en cuenta la última dilución, donde se observó al menos un promastigote móvil. La carga parasitaria por gramo (g) se calculó de forma similar al estudio previo.16 Además, se determinó el porciento de reducción de la infección respecto al control no tratado, teniendo en cuenta el tamaño de la lesión y la carga parasitaria, mediante la fórmula siguiente:
donde el índice se determina por la multiplicación del tamaño de la lesión por la carga parasitaria de cada grupo en el día 72 posinfección. Para identificar diferencias significativas (p< 0,05) entre los grupos experimentales, se utilizó el programa STATISTICA para Windows, versión 4.5, 1993, mediante un análisis de varianza de clasificación doble con mediciones repetidas (ANOVA), seguido de la prueba de comparación múltiple o comparación planificada (Post Hoc Comparison Test).
Luego de seguir el diseño experimental propuesto se constató que los tratamientos no causaron mortalidad. La ganancia en el peso corporal entre los días 30 posinfección (inicio del tratamiento) y 72 posinfección (final del experimento) estuvo entre 0,7-5 % y 0,7-4,1 % para los grupos BALB/c y C57BL/6, respectivamente. Como no se observó pérdida en el peso corporal promedio de los grupos infectados y tratados con artemisina, se corrobora que la administración de la artemisina puede resultar segura.
La evolución del tamaño de la lesión se muestra en la figura 1. En modo general, en los ratones C57BL/6 se registraron tamaños de lesión inferiores a los observados en BALB/c. En relación con los grupos BALB/c (Fig. 1A), a partir del día 44 posinfección, los animales tratados con artemisina mostraron un tamaño promedio de la lesión menor que el grupo control (p < 0,05) y similar al tratado con Glucantime® (p > 0,05). En el caso de los grupos C57BL/6 (Fig. 1B), a partir del día 55 posinfección, el tratamiento con artemisina (oral e intralesional) controló el tamaño de la lesión con respecto al grupo infectado sin tratamiento (p < 0,05), sin observarse diferencias significativas (p > 0,05) con respecto al fármaco de referencia. En este modelo, el tratamiento oral con artemisina permitió el control de las lesiones hasta el final del experimento (72 días posinfección).
El comportamiento de la carga parasitaria se muestra en la figura 2. En el caso de los grupos BALB/c (Fig. 2A), en el día 44 posinfección, un ratón del grupo tratado con artemisina mostró una carga parasitaria indetectable. Mientras que en el día 72 posinfección, la carga parasitaria promedio detectada en este grupo fue inferior (p < 0,05) respecto al control y similar a la determinada en los animales tratados con Glucantime® (p > 0,05). Por su parte, los grupos C57BL/6 (Fig. 2B), en el día 44 posinfección, para un animal de cada grupo tratado con artemisina (oral e intralesional) no se detectó carga parasitaria. En promedio, estos grupos exhibieron una carga parasitaria inferior a los controles (p < 0,05). Los animales que recibieron Glucantime® no mostraron diferencias (p > 0,05) respecto a los tratados con artemisina y los no tratados. En el día 72 posinfección no se detectó carga parasitaria en las lesiones analizadas de estos grupos experimentales.
A partir de las observaciones realizadas se determinó el porciento de reducción de la infección al final del experimento (día 72 posinfección). Al comparar los resultados entre ratones BALB/c y C57BL/6, se apreció una mayor reducción en la línea BALB/c. En los grupos BALB/c, se obtuvieron valores de reducción de la infección de 71,1 % y 74,3 % para los animales tratados con artemisina (oral) y Glucantime® (intralesional), respectivamente.
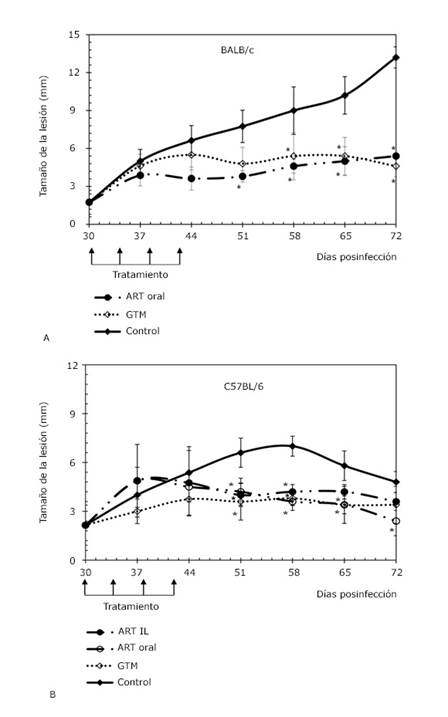
Fig. 1 Evolución del tamaño de la lesión en ratones infectados con L. amazonensis. A. Ratones BALB/c. B. Ratones C57BL/6. Los tratamientos se realizaron a una dosis de 30 mg/kg en 50 μL cada cuatro días hasta completar cinco administraciones. La administración de artemisina (ART) por vía oral se utilizó en un grupo de cada línea animal; mientras que la vía intralesional (IL) se empleó en un grupo C57BL/6. En ambas líneas animales se incluyó a grupos controles que fueron infectados, pero no recibieron tratamiento y grupos tratados con Glucantime® (GTM) por vía intralesional, fármaco de referencia. *: Representa diferencias significativas respecto al control infectado no tratado (p < 0,05).

Fig. 2 Carga parasitaria en lesiones de ratones infectados con L. amazonensis. A. Ratones BALB/c. B. Ratones C57BL/6. Los tratamientos se realizaron a una dosis de 30 mg/kg en 50 μL cada cuatro días hasta completar cinco administraciones. La administración de artemisina por vía oral se utilizó en un grupo de cada línea animal, mientras que la vía intralesional se empleó en un grupo C57BL/6. En ambas líneas animales se incluyó a grupos controles que fueron infectados, pero no recibieron tratamiento y grupos tratados con Glucantime® por vía intralesional, fármaco de referencia. Los símbolos rellenos y sin rellenar corresponden a los días 44 y 72 posinfección, respectivamente; en tanto, las barras horizontales continuas y discontinuas representan el promedio por grupo en los días 44 y 72 posinfección, respectivamente.
Para el análisis del porciento de reducción de la infección en los grupos C57BL/6 el día 72 posinfección, solo pudo tenerse en cuenta el tamaño de la lesión, ya que la carga parasitaria fue indetectable por el método utilizado el día 72 posinfección. Al final del experimento se obtuvieron valores de 50; 25 y 29 % para los ratones C57BL/6 tratados con artemisina oral, intralesional y Glucantime® intralesional, respectivamente.
Considerando estos resultados y observaciones previas de nuestro grupo,16 donde se obtuvo una reducción de la infección del 54,7 % en animales BALB/c tratados con artemisina intralesional, se puede afirmar que el tratamiento con artemisina por vía oral logra una mayor reducción de la infección con respecto a sus contrapartes por vía intralesional, tanto en BALB/c como en C57BL/6.
La eficacia oral de la artemisina solo se había estudiado con anterioridad en un modelo de LV; en este caso los ratones BALB/c infectados con Leishmania donovani fueron tratados con dosis de 10 mg/kg y 25 mg/kg. Como resultado, se logró una reducción parasitaria del 82,6 % y 86 %, respectivamente.13
Relacionado con las artemisinas, en otro trabajo se resaltó la eficacia oral del artemeter en un modelo de LC inducida por L. major en ratones BALB/c. En ese estudio, la administración de dosis diarias de 50 mg/kg y 200 mg/kg disminuyó significativamente la carga parasitaria en comparación con los controles.11 El potencial antileishmanial in vivo del artemeter también se estudió en un modelo de LV inducido por L. infantum en ratones BALB/c, los cuales se trataron con dosis de 0,625 mg/kg de forma oral o intraperitoneal. Aunque ambas formas de administración se reconocieron como eficaces, se resaltó la vía oral porque permitió reducir significativamente la carga parasitaria en el hígado y el bazo.18
A pesar de que al final de nuestro experimento no se observó una cura total de la lesión en los animales BALB/c tratados, el análisis de los resultados indica que el tratamiento oral con artemisina puede resultar eficaz frente a la LCE en esta línea animal. En este sentido, además de cumplir con la regla de Lipinski (o de los cinco) que describe las propiedades fisicoquímicas que se asocian a la biodisponibilidad de los fármacos tras la administración oral;19,20 la artemisina se encuentra disponible para su uso en la clínica por vía oral.21
El modelo de infección basado en la línea BALB/c ha sido tradicionalmente empleado para evaluar la eficacia antileishmanial de nuevos fármacos. Su uso resulta muy atractivo porque es altamente reproducible, consistente y se encuentra disponible en la mayoría de los laboratorios. Sin embargo, su empleo no es el más recomendado porque: (1) se trata de una línea muy susceptible a la leishmaniasis, que demanda (2) una dosis efectiva mucho mayor para curar la infección, la cual se acompaña de (3) la aparición de metástasis que pueden llevar a la muerte del animal; por lo que (4) el tiempo para seguir la evolución de la enfermedad es limitado. A pesar de las desventajas señaladas, los resultados en este modelo sugieren la eficacia de la artemisina en complejos escenarios clínicos.22
Las evidencias que confirman la eficacia de fármacos administrados por vía oral son de gran interés, sobre todo en modelos de infección de LC con mayor capacidad predictiva. A pesar de que no existen modelos animales validados para la LC, C57BL/6 es una de las líneas murinas recomendadas con este propósito. En estos animales, la enfermedad se manifiesta como pequeñas úlceras y finaliza con una cura completa, por lo que es posible encontrar una mayor similitud con el humano inmunocompetente en cuanto a los síntomas clínicos, características histopatológicas y cura de la lesión.23 La capacidad de autocuración de los C57BL/622,24 implicó que exhibieran una menor susceptibilidad a la infección con respecto a los BALB/c, por lo que se necesitan métodos más sensibles para poder cuantificar la carga parasitaria. No obstante, a partir de las observaciones realizadas en el presente estudio, se pudo corroborar que la elevada susceptibilidad de los ratones BALB/c contribuyó a que el tratamiento lograra controlar el desarrollo de la enfermedad; mientras que la capacidad de los animales C57BL/6 de autorresolución22,24 determinó que el tratamiento influyera en acelerar el control de la infección.
En conclusión, en este trabajo se demuestra por primera vez la actividad oral de la artemisina en dos modelos de LCE basados en L. amazonensis-BALB/c y L. amazonensis-C57BL/6, y se presentan adicionalmente en este último los efectos de la administración intralesional. Los resultados derivados de la utilización de estos modelos, ampliamente empleados en la evaluación de fármacos con demostrada actividad in vitro, resaltan la eficacia de la administración oral de la artemisina. Estudios futuros para el diseño y evaluación de nuevos medicamentos, basados en la artemisina, pudieran proveer una nueva alternativa terapéutica contra la leishmaniasis. Teniendo en cuenta que este fármaco ya está disponible en la clínica como antimalárico, su desarrollo como antileishmanial podría ser en un menor tiempo y a menor costo, en correspondencia con las ventajas del reposicionamiento farmacológico.25