Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MediSur
versión On-line ISSN 1727-897X
Medisur vol.13 no.5 Cienfuegos sep.-oct. 2015
ARTÍCULO ORIGINAL
Identificación del polimorfismo c.2448-25G>A en pacientes con diagnóstico clínico de la enfermedad de Wilson
Identification of the c.2448-25G>A Polymorphism in Patients Clinically Diagnosed with Wilson’s Disease
Yulia Clark FeoktistovaI , Caridad Ruenes DomechII , Elsa F García BacallaoII , Teresa Collazo MesaI , Zoe Robaina JiménezI , Hilda Roblejo BalbuenaI
I Centro Nacional de Genética Médica, La Habana, La Habana, Cuba, CP: 11300
II Instituto de Gastroenterología, La Habana, La Habana, Cuba
RESUMEN
Fundamento: La enfermedad de Wilson se caracteriza por la acumulación de cobre en hígado, cerebro y córnea. La causa molecular que la provoca son las mutaciones en el gen atp7b. Se han informado en la literatura varios polimorfismos en el gen atp7b.
Objetivo: identificar los cambios conformacionales en el fragmento intrón 9-exón 10 para la detección del polimorfismo c.2448-25G>A en el gen atp7b de pacientes cubanos con diagnóstico clínico de enfermedad de Wilson.
Métodos: se realizó un estudio descriptivo, en el Centro Nacional de Genética Médica, durante el período 2008-2012, que incluyó 100 pacientes con diagnóstico clínico de enfermedad de Wilson. Para la amplificación del fragmento de interés, se utilizó la técnica de Reacción en Cadena de la Polimerasa y para identificar los cambios conformacionales se aplicó la técnica de Polimorfismo Conformacional de Simple Cadena, en la región intrón 9-exón 10 del gen atp7b. La presencia del polimorfismo c.2448-25G>A fue identificada por secuenciación del fragmento analizado.
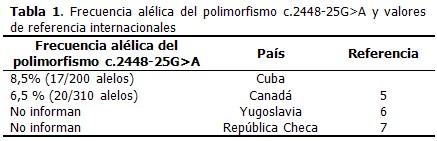
Resultados: el cambio conformacional denominado b, correspondió al polimorfismo c.2448-25G>A en estado heterocigótico. La frecuencia alélica del polimorfismo c.2448-25G>A en 100 pacientes cubanos diagnosticados clínicamente con la enfermedad de Wilson, fue de 8,5 %. Las manifestaciones más frecuentes en los pacientes que presentaron este polimorfismo, fueron las hepáticas.
Conclusión: se identificó por primera vez en Cuba el polimorfismo c.2448-25G>A, lo cual posibilitará hacer estudios moleculares por métodos indirectos.
Palabras clave: genes, degeneración hepatolenticular, polimorfismo genético, cuba.
ABSTRACT
Background: Wilson’s disease is characterized by copper accumulation in the liver, brain and cornea. It is caused by mutations in the ATP7B gene. Several polymorphisms in the ATP7B gene have been reported in the literature.
Objective: to identify conformational changes in the fragment comprising intron 9-exon 10 for detecting the c.2448-25G> A polymorphism in the ATP7B gene of Cuban patients clinically diagnosed with Wilson’s disease.
Methods: a descriptive study including 100 patients with clinical diagnosis of Wilson’s disease was conducted at the National Medical Genetics Center from 2008 to 2012. The polymerase chain reaction was used to amplify the fragment of interest and the single-strand conformation polymorphism was applied in the intron 9-exon 10 region of the ATP7B gene to identify conformational changes. Presence of the c.2448-25G> A polymorphism was detected by sequencing this fragment.
Results: the conformational change called b corresponded to the c.2448-25G> A polymorphism in heterozygous state. The allele frequency of the c.2448-25G> A polymorphism in 100 Cuban patients clinically diagnosed with Wilson’s disease was 8.5%. The most common manifestations in patients with this polymorphism were related to the liver.
Conclusion: the c.2448-25G> A polymorphism was identified in Cuba for the first time, which will enable molecular studies by indirect methods.
Key words: genes, hepatolenticular degeneration, polymorphism, genetic, cuba Limits: human, adult.
Este estudio es el resultado del trabajo conjunto del Centro Nacional de Genética Médica, la Universidad de Ciencias Médicas de La Habana y el Centro Colaborador de la OMS para el desarrollo de enfoques genéticos en la promoción de salud.
INTRODUCCIÓN
La enfermedad de Wilson (EW, MIM 27790) es un trastorno hereditario que presenta un patrón de herencia autosómico recesivo. Constituye un problema de salud mundial. Dentro de las enfermedades genéticas raras es tratable, sin embargo, si no se atiende, puede provocar daños irreversibles en el hígado y en el cerebro que pueden llevar a la muerte del paciente. Se caracteriza por la acumulación de cobre, fundamentalmente en hígado, en cerebro y córnea. El diagnóstico clínico de esta enfermedad es complejo.1 Se caracteriza por daños en el hígado, que pueden manifestarse mediante la elevación de los niveles séricos de transaminasas, cirrosis, e incluso una hepatitis fulminante. Los pacientes con esta enfermedad pueden presentar afectaciones a nivel cerebral (desde temblores hasta Parkinson). Además, pueden presentar trastornos psiquiátricos como depresión, tendencias suicidas, entre otras. La causa molecular que la provoca son las mutaciones en el gen atp7b (MIM 606882), el cual presenta 21 exones y se han reportado más de 380 mutaciones hasta la actualidad.2 Además, se han identificado más de 139 polimorfismos que están distribuidos en todo el gen atp7b y en los intrones, los exones más polimórficos reportados son: 2, 8 y 16.2 En la actualidad, el diagnóstico molecular de la EW se lleva a cabo, en la mayoría de los casos, por secuenciación directa. El estudio molecular y la identificación de mutaciones en el gen atp7b ayudan al diagnóstico clínico, pues confirman la enfermedad. Ofrecen la posibilidad del diagnóstico y el asesoramiento genético a los familiares.3-4 El polimorfismo c.2448-25G>A se encuentra localizado en el intrón 9 del gen atp7b. Este se ha identificado en diversas poblaciones, en países como: Canadá, Yugoslavia, República Checa, entre otros.5-7 Para la determinación del espectro mutacional y la identificación de polimorfismos en el gen atp7b, se requiere una adecuada tecnología de cribaje. Una de las técnicas más utilizadas para este propósito es el Polimorfismo Conformacional de Simple Cadena (SSCP, del inglés Single-Strand Conformation Polymorphism). Se basa en la relación que existe entre la movilidad electroforética de la simple cadena de ADN y su estructura conformacional. Un cambio en la secuencia de ADN provoca un cambio conformacional, que a su vez provoca un cambio de movilidad en la electroforesis detectable. Considerando que en Cuba no ha sido establecido el diagnóstico molecular de EW, es objetivo de este estudio identificar los cambios conformacionales en el fragmento intrón 9-exón 10 y detectar el polimorfismo c.2448-25G>A en el gen atp7b de pacientes cubanos con diagnóstico clínico de esta enfermedad.
MÉTODOS
Se realizó un estudio descriptivo, en el Centro Nacional de Genética Médica, durante el período 2008-2012, que incluyó 100 pacientes (40 mujeres y 60 hombres) con diagnóstico clínico de EW, los cuales asistían a la consulta del Instituto Nacional de Gastroenterología. Estos pacientes dieron su consentimiento para participar en la investigación, de acuerdo con los principios éticos de la declaración de Helsinki. Las variables analizadas fueron: frecuencia alélica del polimorfismo c.2448-25G>A (cambio conformacional a para la variante normal y cambio conformacional b para la presencia del polimorfismo c.2448-25G>A en estado heterocigótico) y manifestaciones clínicas (hepáticas, neurológicas, psiquiátricas e hipertransaminasemia). La evaluación de las manifestaciones clínicas fue realizada por un equipo multidisciplinario (gastroenterólogos, genetistas, neurólogos, bioquímicos), siguiendo los criterios de diagnóstico de la enfermedad. Se seleccionó el fragmento intrón 9-exón 10 del gen atp7b, para la detección de cambios conformacionales y la identificación del polimorfismo c.2448-25G>A. A todos los pacientes se les tomó una muestra de ADN, mediante el método de precipitación salina8 a partir de 10 ml de sangre periférica con ácido etildiaminotetraacético (EDTA, del inglés Ethylene DiamineTetra Acetic Acid) (56 mg/ml). Las condiciones para la amplificación del fragmento intrón 9-exón 10 mediante la técnica de Reacción en Cadena de la Polimerasa (PCR, del inglés Reverse Transcription Polymerase Chain Reaction) fueron: 100ng de ADN, 10 pmoles/ml de cada oligonucléotido del exón 10: (F) 5'-AGT CGC CAT GTA AGT GAT AA-3' y (R) 5'-CTG AGG GAA CAT GAA ACA A-3', 1mM de dNTPs (Boehringer), 10X tampón PCR, 15mM de MgCl2, 1u de Taq polimerasa (Amplicen), en un volumen de 25 µl.9 Posteriormente se realizó la electroforesis SSCP. Se mezcló 3,5µl con una solución de parada de bromofenol azul (0,05 % BFA, 10mM NaOH, 95 % formamida, 20mM EDTA) y 1 µl del producto amplificado, en un volumen final de 7µl. Se aplicó en un gel de acrilamida comercial (GeneGel Excel 12,5/24 Kit). La visualización del ADN se realizó por el método de tinción con plata, siguiendo las instrucciones del juego comercial: kit PlusOne DNA Silver Staining (Amersham Biosciences, 2007). Se procedió a la secuenciación del patrón alterado por SSCP. El secuenciador utilizado fue ALF-Express. Un paso crítico y decisivo fue la purificación del producto de PCR, el cual se realizó con el juego comercial de la Quigen (QIAquick, PCR Purification Kit).
RESULTADOS
Se identificó el cambio conformacional denominado b con el uso de la técnica SSCP. El cambio conformacional denominado a correspondió a la variante normal. El cambio conformacional b correspondió a la presencia del polimorfismo c.2448-25G>A en estado heterocigótico. De los 100 pacientes cubanos con diagnóstico clínico de la enfermedad de Wilson, se identificaron 17 pacientes heterocigóticos para el polimorfismo c.2448-25G>A por las técnicas SSCP y secuenciación. La frecuencia alélica del polimorfismo c.2448-25G>A en los 100 pacientes cubanos estudiados en esta investigación es de un 8,5%. (Tabla1). Entre las principales manifestaciones clínicas en los pacientes que presentaron el polimorfismo c.2448-25G>A, fueron más frecuentes las hepáticas (88 %), entre las que se encontraron: ictericia, esplenomegalia, ascitis, hepatomegalia, cirrosis hepática, entre otras. (Tabla 2).
DISCUSIÓN
Se han informado más de 139 polimorfismos en el gen atp7b en pacientes con la enfermedad de Wilson.2 En Cuba se comienza a realizar la detección de polimorfismos en el gen atp7b en el año 2008. Un paso previo a la búsqueda de mutaciones y polimorfismos en este gen es la detección de cambios conformacionales. El cambio de guanina por adenina en el intrón 9 del gen atp7b provoca un cambio en la secuencia, que como consecuencia provoca un cambio en la movilidad electroforética de la simple cadena del ADN y de su estructura conformacional, el cual es detectado mediante la técnica de SSCP. En esta investigación correspondió al cambio conformacional denominado b y se identificó en el 17% de los pacientes estudiados. El polimorfismo c.2448-25G>A fue identificado utilizando la técnica de secuenciación. Este no afecta la función de la proteína transportadora de cobre, ATP7B en humanos y se ha identificado en diversas poblaciones con una frecuencia mayor que el 1 %.5-6 Por primera vez en Cuba se detecta y se establece la frecuencia alélica del polimorfismo c.2448-25G>A en pacientes cubanos con diagnóstico clínico de la enfermedad de Wilson. La frecuencia del polimorfismo c.2448-25G>A fue de 8,5 %. Es notorio que la frecuencia en Canadá es similar a la de nuestro estudio, y como se esperaba, mayor que el 1 %. En Yugoslavia y en la República Checa se ha identificado la presencia del polimorfismo c.2448-25G>A, sin embargo, no informan la frecuencia alélica,6-7 por lo que no se pudo comparar con los resultados obtenidos. En estudios moleculares realizados en España, Brasil, Egipto, Irán, Rumania y Dinamarca, no se ha informado la presencia del polimorfismo c.2448-25G>A.9-16 En los 100 pacientes cubanos estudiados, las manifestaciones hepáticas fueron las más frecuentes, por lo que se esperaba que fueran estas las más frecuentes en los pacientes heterocigóticos para el polimorfismo c.2448-25G>A. De los 17 pacientes heterocigóticos para este polimorfismo, el 88 % presentó manifestaciones hepáticas. En la literatura internacional se informan bajas frecuencias de pacientes con la combinación de las manifestaciones hepáticas y psiquiátricas.17-20 En nuestro estudio no se identificaron heterocigóticos con manifestaciones neurológicas, ni con la combinación de manifestaciones hepáticas y psiquiátricas que presentaran el polimorfismo c.2448-25G>A. Fueron estandarizadas por primera vez en Cuba las técnicas para el estudio molecular (PCR, SSCP y secuenciación) en la identificación del polimorfismo c.2448-25G>A ubicado en el intrón 9-exón 10 del gen atp7b. Se determinó la frecuencia del polimorfismo c.2448-25G>A en un total de 100 pacientes cubanos con diagnóstico clínico de la enfermedad de Wilson. Las manifestaciones hepáticas fueron las más frecuentes en los pacientes con el polimorfismo c.2448-25G>A. Se dispone así de una herramienta molecular para la introducción del diagnóstico molecular en pacientes con la enfermedad de Wilson en Cuba, lo que posibilitará en un futuro realizar estudios moleculares por métodos indirectos.
REFERENCIAS BIBLIOGRÁFICAS
1. Kumar SS, Kurian G, Roberts EA. Genetics of Wilson’s disease: a clinical perspective. Indian J Gastroenterol. 2012;31(6):285-93
2. Kenney SM, Cox DW. Sequence Variation Database for the Wilson Disease Copper Transporter, ATP7B. Hum Mutat. 2007;28(12):1171-77
3. Badenas Orquin C. Avances en el diagnóstico molecular de la enfermedad de Wilson. Gastroenterol Hepatol. 2011;34(6):428-33
4. Li XH, Lu Y, Ling Y, Fu QC, Xu J, Zang GQ, et al. Clinical and molecular characterization of Wilson’s disease in China: identification of 14 novel mutations. BMC Med Genet. 2011;12:6
5. Cox D, Prat L, Walshe J, Heathcote J, Gaffney D. Twenty-four Novel Mutations in Wilson Disease Patients of Predominantly European Ancestry. Hum Mutat. Mutation in Brief. 2005;26(3):829-31
6. Loudianos G, Kostic V, Solinas P, Lovicu M, Dessì V, Svetel M, et al. Characterization of the molecular defect in the ATP7B gene in Wilson disease patients from Yugoslavia. Genet Test. 2003;7(2):107-12
7. Vrabelova S, Letocha O, Borsky M, Kozak L. Mutation analysis of the ATP7B gene and genotype/phenotype correlation in 227 patients with Wilson disease. Mol Genet Metab. 2005;86(1-2):277-85
8. Miller SA, Dykes DD, Polesky HF. A simple salting out procedure for extracting DNA from human nucleated cells. Nucleic Acids Res. 1988;16(3):1215
9. Margarit E, Bach V, Gómez D, Bruguera M, Jara P, Queralt R, Ballesta F. Mutation analysis of Wilson disease in the Spanish population –identification of a prevalent substitution and eight novel mutations in the ATP7B gene. Clin Genet. 2005;68(1):61-8
10. Peña Quintana L, García Luzardo MR, García Villarreal L, Arias Santos MD, Garay Sánchez P, Santana A, et al. Manifestations and Evolution of Wilson Disease in Pediatric Patients Carrying ATP7B Mutation L708P. J Pediatr Gastroenterol Nutr. 2012;54(1):48-54
11. Deguti MM, Genschel J, Cancado EL, Barbosa ER, Bochow B, Mucenic M, et al. Wilson disease: novel mutations in the ATP7B gene and clinical correlation in Brazilian patients. Hum Mutat. 2004;23(4):398
12. Bem RS, Muzzillo DA, Deguti MM, Barbosa ER, Werneck LC and Teive HA. Wilson’s disease in southern Brazil: a 40-year follow-up study. Clinics (Sao Paulo). 2011;66(3):411-6
13. Abdelghaffar TY, Elsayed S, Elsobky E, Bochow B, Buttner J, Schmidt H. Mutational analysis of ATP7B gene in Egyptian children with Wilson disease: 12 novel mutations. J Hum Genet. 2008;53(8):681-7
14. Zali N, Mohebbi S, Esteghamat S, Chiani M, Haghighi M, Hosseini-Asl SM. Prevalence of ATP7B gene mutations in Iranian patients with Wilson disease. Hepat Mon. 2011;11(11):890-4
15. Iacob R, Iacob S, Nastase A, Vagu C, Ene AM, Constantinescu A, et al. The His1069Gln mutation in the ATP7B gene in Romanian patients with Wilson’s disease referred to a tertiary Gastroenterology Center. J Gastrointestin Liver Dis. 2012;21(2):181-5
16. Møller LB, Horn N, Jeppesen TD, Vissing J, Wibrand F, Jennum P. Clinical presentation and mutations in Danish patients with Wilson disease. Eur J Hum Genet. 2011;160(9):935-41
17. Tatsumi Y, Hattori A, Hayashi H, Ikoma J, Kaito M, Imoto M, et al. Current state of Wilson disease patients in central Japan. Inter Med. 2010;49(9):809-15
18. Nicastro E, Ranucci G, Vajro P, Vegnente A, Lorio R. Re-evaluation of the diagnostic criteria for Wilson disease in children with mild liver disease. Hepatology. 2010;52(6):1948-56
19. Nuzhat C, Mamun A, Shafiqul I. Wilson’s disease: A brief review. KMJ. 2011;3(1):24-7
20. Wang L, Huang Y, Shang X, Su Quan-Xi, Xiong Fu, Yu QY, et al. Mutation analysis of 73 southern Chinese Wilson’s disease patients: identification of 10 novel mutations and its clinical correlation. J Hum Genet. 2011;56(9):660-5
Recibido: 30 de marzo de 2015.
Aprobado: 24 de septiembre de 2015.
Yulia Clark Feoktistova. MSc. en Bioquímica. Mención Biología Molecular. Investigador Agregado Correo electrónico: yuliacf@cug.co.cu