Introducción
El género Zanthoxylum L., perteneciente a la familia Rutaceae, cuenta con aproximadamente 250 especies distribuidas de forma pantrópica.1 Varias especies de Zanthoxylum presentan usos etnobotánicos con fines antipirético, analgésico, antimicrobiano, antiinflamatorio, antiplasmódico y citotóxico, entre otros. Estudios fitoquímicos realizados a estas especies, han demostrado la presencia de alcaloides, lignanos, amidas, cumarinas, terpenos, flavonoides, esteroles, cromonas, entre otros, a los cuales se le han atribuido un amplio espectro de actividades biológicas.2
En Cuba, el género Zanthoxylum se encuentra representado por 25 especies de las cuales 15 son endémicas.3Zanthoxylum pseudodumosum Beurton, conocida popularmente como Ayúa dumosa, es una planta aromática endémica de Cuba, la cual cuenta con ejemplares distribuidos en el occidente, centro y oriente del país. Debido a su endemismo, los compuestos bioactivos de esta planta han sido poco estudiados. La literatura consultada 4 reporta la presencia de aminas, taninos, cumarinas, fenoles, flavonoides y alcaloides en los tallos y las hojas. Sin embargo, en estos trabajos no se hace referencia a la actividad biológica de estos compuestos.
Alternaria solani es el agente causal del tizón temprano en la papa (Solanum tuberosum L.) y el tomate (Solanum lycopersicum L.), una de las enfermedades foliares en Solanáceas más conocida a nivel mundial, ya que puede llegar a disminuir los rendimientos de producción entre un 20 y 30%. Este hongo fitopatógeno puede sobrevivir en el suelo, en residuos de cultivos infestados, en la maleza, en semillas y puede ser dispersado por el viento, el agua, insectos e incluso mediante los trabajadores y maquinarias agrícolas. A. solani penetra a la planta por contacto directo con las hojas, frutos, tubérculos o a través de heridas y/o aperturas naturales. Una vez establecido en la misma, se desarrolla y produce esporangios que pueden llegar a infectar otros tejidos de órganos sanos.5
Tradicionalmente, en el control del tizón temprano se implementan medidas agrotécnicas tales como: la realización de rotaciones de los cultivos de papa o tomate con otros cultivos no hospedantes de A. solani, la eliminación de los restos del cultivo infectado mediante un arado profundo, el uso de semillas y plántulas sanas, la introducción de variedades resistentes, entre otras. También con el propósito de eliminar la enfermedad o retardar su desarrollo se emplean numerosos fungicidas químicos como Clorotalonil, Mancozeb, Propineb, Zoxamida, Boscalid, Pyraclostrobin, Difenocoazole, entre otros.6 Sin embargo, a pesar de que el uso de los fungicidas contribuye al control efectivo de la enfermedad, el uso prolongado de los mismos provoca una elevada contaminación ambiental, daños severos a la salud humana y la aparición de resistencia por parte del hongo.7 Debido a esto, es creciente la tendencia mundial hacia el uso de “productos verdes”, con el interés de emplear cada vez menos aditivos sintéticos y productos que afecten al medio ambiente, por lo que el uso de extractos de origen vegetal se amplía en la actualidad. En este sentido, extractos de Z. pseudodumosum, pudieran constituir una alternativa para el manejo agroecológico del tizón temprano.
Según lo antes expuesto, el objetivo de este trabajo fue estudiar la composición química de diferentes extractos preparados a partir de hojas de Z. pseudodumosum, así como evaluar la actividad antifúngica “in vitro” frente a A. solani.
Materiales y métodos
Colecta del material vegetal y procesamiento
Las hojas de Z. pseudodumosum se colectaron en su hábitat natural en el poblado “El Hormiguero”, carretera a Camajuaní, Santa Clara, Cuba, en septiembre de 2018. La identificación taxonómica del material vegetal se realizó en el lugar de la colecta por especialistas pertenecientes al Centro de Estudios Jardín Botánico de la Universidad Central “Marta Abreu” de Las Villas, donde se registró con el número 12414 ULV. Las hojas se secaron en una estufa (YLD-6000) con circulación de aire a 40 °C y luego se molieron en un molino (KMF 10 basic IKA WERKE, Alemania) para facilitar los procesos extractivos.
Obtención de los extractos y el aceite esencial
Los extractos se prepararon por el método de maceración en la oscuridad durante siete días, cambiando el disolvente cada 48 hs para facilitar el proceso de extracción y alcanzar buenos rendimientos.
Para obtener el extracto hexánico (EHex) se mezclaron 20 g de material vegetal con 200 mL de n-hexano (relación s/l 1:10). Posteriormente se filtró la fase hexánica obtenida, y se concentró a presión reducida en un rotovaporador (IKA WERKE RV10BS1, Alemania). Se obtuvo un extracto de color verde y consistencia gomosa con un rendimiento del 0.68 % m/m.
Para el extracto hidroalcohólico (EHA) se mezclaron 20 g de material vegetal con etanol 75% (relación s/l 1:10). Se filtró la fase hidroalcohólica resultante y se concentró a presión reducida, obteniéndose un extracto de color pardo con un rendimiento del 16,8 % m/m.
El aceite esencial se extrajo de las hojas mediante el método de hidrodestilación, empleando una trampa tipo Clevenger.8 Se pesaron 80 g del material vegetal y se mezclaron en un balón con 1200 mL de agua destilada, deteniéndose el calentamiento cuando el volumen de aceite permaneció constante en el tiempo (3 h).
El aceite se separó del hidrodestilado extrayéndolo con n-hexano, se secó con Na2SO4 anhidro y se conservó en refrigeración para su posterior análisis. El producto así obtenido fue menos denso que el agua, presentó una coloración amarilla y un olor cítrico agradable. La extracción se realizó por triplicado con un rendimiento promedio de 0,46% ± 0,021 m/m.
Identificación de metabolitos secundarios en los extractos mediante tamizaje fitoquímico
Para la identificación de metabolitos en los extractos se empleó el método de tamizaje fitoquímico reportado por Selvaraj.9
Ensayo de Dragendorff: Se aplica para la detección de alcaloides. Se tomó 1 mL de cada extracto y se depositó en dos tubos de ensayos respectivamente. Estos se evaporaron en baño de agua para eliminar el solvente. Los residuos se redisolvieron en 1 mL de HCl (1%). Se calentó la mezcla ligeramente y luego se añadieron tres gotas del reactivo de Dragendorff. Se consideró positivo si apareció opalescencia (+), turbidez definida (++) o precipitado (+++).
Ensayo de Wagner: Se utilizó para la detección de alcaloides. Se partió al igual que en el caso anterior de la disolución ácida, luego se añadieron 2-3 gotas de disolución alcohólica de I2/KI. Se clasificó el ensayo de igual manera que el anterior.
Ensayo de Baljet: Se emplea para la detección de cumarinas. Una alícuota del extracto hexánico se sometió a calentamiento ligero para evaporar el solvente, el extracto etanólico se utilizó sin necesidad de evaporar el solvente. Paralelamente se prepararon dos soluciones, una de NaOH al 10 % y otra de ácido pícrico al 1% en etanol, se mezclaron volúmenes iguales de estas y se adicionó 1 mL de esta última a las muestras. Se consideró positivo la aparición de coloración (+) o un precipitado (++).
Ensayo de Borntrager: Se emplea para la detección de quinonas. Se evaporó 1 mL de cada extracto y el residuo se redisolvió en cloroformo, se adicionó 1 mL de KOH al 5 % en agua. Se agitaron las fases y se dejó en reposo. Se consideró positivo si la fase acuosa alcalina se coloreó de rosado a rojo.
Ensayo de Liebermann-Burchard: Se utilizó para detectar triterpenos y/o esteroides. Al igual que en el ensayo anterior se empleó la mezcla clorofórmica. Se adicionó 1mL de anhídrido acético y se agitó. Se dejaron caer lentamente 2-3 gotas de H2SO4 concentrado sin agitar. Se consideró positivo al ocurrir un cambio de coloración.
Ensayo de catequinas: Se aplicó una gota de cada extracto sobre el papel de filtro y sobre la mancha se aplicó una gota de disolución de Na2CO3. Se consideró positiva la aparición de una mancha verde-carmelita a la luz UV.
Ensayo de resinas: Se adicionaron 10 mL de agua a 2 mL de cada extracto. Se consideró positiva la aparición de un precipitado.
Ensayo de Fehling: Se usó para la detección de azúcares reductores. Se tomó 1 mL del extracto etanólico y se evaporó el solvente. El residuo se redisolvió en 1-2 mL de agua. Se adicionaron 2 mL del reactivo de Fehling y se calentó en baño de agua. El ensayo se consideró positivo si la disolución se colorea de verde-naranja (+) o la aparición de un precipitado rojizo (+++).
Ensayo de espuma: Se utilizó para la detección de saponinas. Se tomó 1 mL del extracto etanólico y se diluyó en cinco veces su volumen de agua. La mezcla se agitó fuertemente durante 5-10 minutos. El ensayo se consideró positivo al aparecer espuma de más de 2 mm de espesor o altura en la superficie del líquido.
Ensayo del cloruro de hierro (III): Permite reconocer compuestos fenólicos y/o taninos. Una alícuota de cada extracto se calentó para evaporar el solvente y se le adicionaron 3 gotas de una disolución de FeCl3 al 5%. Se consideró positivo un cambio de coloración.
Ensayo de ninhidrina: Posibilita reconocer la presencia de aminoácidos libres o de aminas en general. Se tomó una alícuota de cada extracto, se calentó ligeramente para eliminar el disolvente y se mezcló con 2 mL de la disolución de ninhidrina al 2 %. La mezcla se calentó durante10 minutos en baño de agua. Este ensayo se consideró positivo si se desarrolla un color violáceo.
Ensayo de Shinoda: Contribuye a reconocer los flavonoides. Una alícuota de cada extracto se calentó para evaporar el solvente, se diluyó con 1 mL de HCl concentrado y se adicionó un pedacito de cinta de magnesio metálico. Después de la reacción, se añadió 1 mL de alcohol isoamílico, se agitó y se dejó reposar hasta que las fases se separaron. El ensayo se consideró positivo si el alcohol isoamílico se coloreó de amarillo, naranja, carmelita o rojo, intensos en todos los casos.
Ensayo de Antocianidinas: Permitió la identificación en los extractos de estas sustancias. Se calentaron 2 mL del extracto etanólico para eliminar el solvente y se adicionó 1 mL de HCl concentrado. Se dejó enfriar y se adicionó 1 mL de agua y 2 mL de alcohol isoamílico. Se agitó y se dejaron separar las dos fases. Se consideró positiva la aparición de un color rojo a marrón en la fase isoamílica.
Ensayo de Kedde: Posibilita la identificación de glicósidos cardiotónicos. Se mezclaron a volúmenes iguales disoluciones de ácido 3,5-dinitrobenzoico al 2% en metanol y de KOH al 5% en agua. Una alícuota del extracto etanólico se mezcló con 1 mL de la disolución reactiva y se dejó reposar durante 5-10 minutos. Se consideró un ensayo positivo en el que se desarrollara una coloración violácea, persistente durante 1-2 horas.
Cromatografía de Capa Delgada (CCD)
Para determinar los posibles metabolitos presentes, el aceite y los extractos obtenidos se analizaron en placas cromatográficas con fase estacionaria sílica gel F254. Se evaluaron como fase móvil diferentes disolventes y mezclas de ellos: cloroformo, acetato de etilo y tolueno. Se aplicaron en cada placa las tres muestras (1-aceite esencial, 2- extracto hexánico y 3-extracto etanólico) y se escogió el sistema que permitiera una mejor separación de los compuestos presentes.
Las cromatoplacas se revelaron con luz UV a 254 nm y 365 nm (Lámpara UV, WD-9403E) y con los reveladores químicos que se especifican en la tabla 1 según aparecen referenciados en la literatura 10:
Tabla 1 Reveladores cromatográficos utilizados
| Revelador utilizado | Metabolitos que detecta |
| Vapores de yodo | Compuestos lipofílicos o con dobles enlaces conjugados |
| Permanganato de potasio | Compuestos oxidables |
| Vainillina-ácido sulfúrico | Terpenoides, fenilpropanoides y esteroles |
| Reactivo de Liebermann-Burchard | Esteroles, terpenoides, lignanos |
| Reactivo de Dragendorff | Alcaloides y compuestos heterocíclicos nitrogenados |
| Ácido fosfomolíbdico | Terpenos, alcoholes terpénicos y sus ésteres, vitaminas y esteroides |
Evaluación de la actividad antifúngica de los extractos
El aislado de A. solani se cultivó en el medio de cultivo Agar Papa Dextrosa (PDA), en oscuridad, a 27 °C, durante 7 días. Posteriormente, discos de micelio de 0,6 cm de diámetro fueron transferidos al medio de cultivo Caldo Papa Dextrosa (PDB) y se dejaron crecer en constante movimiento en una zaranda (Gerhardt, Alemania) a 120 rpm, 27 °C durante 72 h. Luego, 1 g de A. solani, crecido en estas condiciones, se trituró en un homogenizador Ultra-Turrax T25 (Rose Scientific Ltd, Canadá) y se ajustó la concentración a 5 x 105 fragmentos de micelios/mL en cámara de Neubauer (Brand, Alemania).
La concentración mínima inhibitoria (CMI) de los extractos de Z. pseudodumosum se determinó por el método de microdilución. Los extractos fueron resuspendidos en dimetisulfóxido (DMSO) 5 % y se evaluaron a concentraciones de 4 000, 2 000, 1 000 y 500 μgmL-1. El ensayo se realizó en microplacas de ELISA de 96 pocillos (ThermoScientific, EE.UU.). Se añadió en cada pocillo 100 μL de medio de cultivo Caldo Papa Dextrosa (PDB), excepto el primer pocillo de cada fila a la cual se le colocaron 190 μL de PDB. Luego se le añadió al primer pocillo de cada fila 10 μL del extracto previamente resuspendido en DMSO, para obtener un volumen final de 200 μL y una concentración final del extracto de 8 000 μgml-1. A partir de esa concentración se realizaron tres diluciones seriadas de 100 μL y posteriormente se añadió a cada pocillo 100 μL de la suspensión de 5 x 105 fragmentos de micelios/mL de A. solani y el extracto quedó a la concentración final a evaluar.
Como control de crecimiento se utilizó A. solani en el medio de cultivo PDB. Como control de actividad antifúngica se empleó A. solani en medio de cultivo PDB con DMSO 40%. Como control de solvente se utilizó A. solani en medio de cultivo PDB con DMSO 5%. Como control de esterilidad se empleó el medio de cultivo PDB sin A. solani. Para cada extracto y controles se realizaron tres réplicas y el experimento se repitió una vez. Las placas se incubaron en oscuridad, a 27 °C, durante 7 días. El crecimiento micelial se observó a partir de 72 h de incubación, cada 24 h, durante 7 días. La CMI fue definida como la concentración mínima a la que el extracto fue capaz de inhibir el crecimiento del hongo.
Análisis y discusión de resultados
Tamizaje fitoquímico de extractos de Z. pseudodumosum
Los resultados del tamizaje fitoquímico realizado a extractos de hojas de Z. pseudodumosum se reflejan en la tabla 2.
La determinación cualitativa de metabolitos (Tamizaje fitoquímico) indica que son mayoritarios en el extracto n-hexánico los flavonoides y triterpenos, mientras que en el hidroalcohólico aparecen los compuestos fenólicos, triterpenos y esteroides, así como alcaloides y flavonoides. En el aceite esencial sólo se detectaron triterpenos, metabolitos comunes en estos productos.
Varios de estos tipos de compuestos han sido detectados en otras especies del género Zanthoxylum. Diversos autores han realizado tamizajes fitoquímicos a otras especies endémicas cubanas pertenecientes a este género, así se estudiaron las especies Z. pimpinelloides (Lam.) D.C., Z. dumosum A. Rich., Z. duplicipunctatum Wright y Z. rolandii Beurton. En los extractos etanólicos y hexánicos de estas especies se detectan en abundancia triterpenos y esteroides; particularmente en Z. dumosum, Z. duplicipunctatum y Z. pimpinelloides. También es muy elevada la presencia de fenoles y/o taninos en todas estas especies, con excepción de Z. rolandii. La presencia de flavonoides y compuestos reductores fue detectada en mayor concentración en Z. pimpinelloides, mientras que en ninguna de ellas se encontraron saponinas.11 La especie Z. pseudodumosum era considerada como Z. dumosum hasta que Beurton en1987 la clasificó como tal.4
En la bibliografía consultada 2, aparece que en estas plantas se han identificado diversas estructuras alcaloidales, incluyendo mayormente compuestos que presentan el nitrógeno en forma terciaria y cuaternaria.
En extractos etanólicos de madera de Z. caribaeum se han identificado estructuras esteroidales como el colesterol, estigmasterol y sitoesterol.12 Por otra parte, compuestos polifenólicos como los flavonoides quercetina, afzelina, quercitrina y rutina también han sido aislados de extractos etanólicos de hojas de Z. bungeanum.13 Las cumarinas, que fueron detectadas en el extracto hexánico de nuestra planta, son metabolitos que poseen un agrupamiento lactónico en su estructura y se han encontrado en diversos órganos de las especies Z. avicennae y Z. zanthoxyloides (Lam.) B. Zepernich donde se reportan variadas estructuras de este tipo en fracciones de distinta polaridad.14,15 Igualmente, antraquinonas han sido detectadas en estudios fitoquímicos de la especie Z. zanthoxyloides.16
Tabla 2 Metabolitos detectados en el tamizaje fitoquímico de extractos de Z. pseudodumosum
| Nombre de ensayo / metabolito | Extracto n-hexánico | Extracto etanólico | Aceite esencial |
|---|---|---|---|
| Ensayo de Dragendorff / alcaloides | - | ++ | - |
| Ensayo de Wagner / alcaloides | + | ++ | - |
| Ensayo de Na2CO3 / catequinas | + | + | - |
| Ensayo de FeCl3 / fenoles-taninos | + | +++ | - |
| Ensayo de Baljet / cumarinas | + | - | - |
| Ensayo de Borntrager/ quinonas | - | + | - |
| Ensayo de Liebermann-Burchard / triterpenos y/o esteroides | ++ | ++ | + |
| Ensayo de resinas | + | ++ | - |
| Ensayo de saponinas | - | - | - |
| Ensayo de azúcares reductores | - | ++ | - |
| Ensayo de ninhidrina / aminoácidos | - | - | - |
| Ensayo de Shinoda / flavonoides | +++ | ++ | - |
| Ensayo de antocianidinas | - | + | - |
| Ensayo de Kedde / glicósidos cardiotónicos | - | - | - |
| (-) no presencia (+) poco abundante, (++) abundante, (+++) muy abundante |
Cromatografía de Capa Delgada (CCD)
Para profundizar en las características de los extractos obtenidos, incluido el aceite esencial, decidimos estudiar los perfiles de sus cromatogramas de capa delgada bajo diferentes condiciones.
De los sistemas de disolventes evaluados como fases móviles, el constituido por tolueno-acetato de etilo permitió una mejor resolución de las mezclas. Se observó durante el desarrollo de la cromatografía, que al aumentar la polaridad de la misma la separación de los componentes en el aceite esencial y extractos decrecía notablemente, por lo que finalmente se seleccionó el sistema tolueno-acetato de etilo 8:2 para continuar el trabajo. Estos resultados, que coinciden con lo reportado por otros autores 10, nos proporcionan información para un posible fraccionamiento de los extractos mediante cromatografía de columna.
La apariencia general de los cromatogramas revelados con vapores de yodo y otros reveladores más específicos, se corresponde con lo esperado para los productos estudiados. En todos los casos se observa que se trata de mezclas complejas; las del aceite esencial y extracto n-hexánico presentan las principales manchas a valores de Rf superiores a 0,6 y se corresponden con la menor polaridad que presentan los componentes de estas fracciones. Por su parte en el extracto hidroalcohólico, que posee compuestos de mayor polaridad, hay una distribución a lo largo de todo el recorrido con las manchas más intensas en el rango de Rf entre 0,3 y 0,5. (figura 1A)
Como parte de este estudio las placas fueron visualizadas sin usar revelador químico, primero a la luz visible y luego expuestas a la luz UV con longitudes de onda de 254 y 365 nm. Para el aceite sólo se tuvo un resultado positivo al irradiar con luz a 254 nm, pues se observó una zona oscura bien definida a Rf de 0,8, que según la literatura consultada 10 corresponde a derivados del fenilpropano, constituyentes comunes en estos productos.
En el caso de los extractos n-hexánico e hidroalcohólico, el comportamiento fue similar. Al observar los cromatogramas bajo la luz visible, se apreciaron manchas de colores verde y amarillo a valores de Rf de 0,78, 0,85 y 1 para el extracto hexánico y valores de Rf de 0,10, 0,60, 0,65 y 0,85 para el extracto hidroalcohólico debidas a la presencia de pigmentos que también se aprecian al utilizar luz ultravioleta.
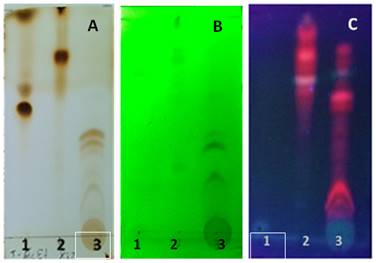
Fig. 1 Cromatoplacas reveladas con vapores de yodo (A), por exposición a luz UV 254 nm (B) y luz UV 365 nm (C)
En el extracto hexánico no se observaron nuevos compuestos al evaluar la cromatoplaca bajo luz UV 254 nm, por el contrario, el extracto hidroalcohólico reveló la presencia de nuevas manchas cuando se reveló mediante este método, las cuales aparecieron a valores de Rf entre 0,3 y 0,5.
Por último, al visualizar con luz UV-365 nm se detectaron en ambos extractos (figura 1B) manchas con fluorescencia roja características de derivados del antraceno, como las antraquinonas, las cuales mostraron fluorescencia roja tras asperjarse con disolución de KOH al 5 %. Además, se visualizaron manchas azul celeste, propias de cumarinas 17,18, aunque este tipo de metabolito no fue detectado en el extracto hidroalcohólico por medio del tamizaje fitoquímico. Ambas clases de metabolitos fueron encontrados a valores de Rf superiores en el extracto hexánico mientras que en el extracto hidroalcohólico el recorrido de las manchas fue menor, lo cual está en concordancia con la naturaleza de los extractos.
Si bien las cumarinas no destacan entre los metabolitos más importantes en la fitoquímica del género, en estudios realizados a extractos de variada polaridad de Z. avicennae y Z. zanthoxyloides (Lam.) B. Zepernichse reportan diversas estructuras de este tipo.(14, 15) Antraquinonas también han sido detectadas mediante la técnica de HPTLC en extractos etanólicos de Z. rhetsa (Roxb.) DC.19 La presencia de varios de estos compuestos en diferentes especies de Zanthoxylum pudiera indicar que los mismos son propios del género.
El empleo de reveladores químicos fue útil para ampliar la información sobre la composición de estos productos. El uso de una disolución de permanganato de potasio para la visualización permitió corroborar resultados anteriores al observarse cromatogramas muy parecidos a los obtenidos utilizando vapores de yodo (figura 2A), mientras que el revelado con vainillina-ácido sulfúrico (figura 2B), específico para terpenoides, fenilpropanoides y esteroides, mostró en el aceite esencial manchas violetas coincidentes con las más intensas para este producto que fueron observadas antes en el revelado con yodo a valores de Rf de 0,5 y 0,6, mientras una tercera mancha corre con el frente del solvente. En el extracto n-hexánico se evidenció algo similar pues con vainillina-ácido sulfúrico también se visualizan las dos manchas más intensas, mientras en el hidroalcohólico sólo la que aparece a Rf de 0,3.
Con la aparición de manchas de diversos colores, los resultados obtenidos con este último revelador fueron corroborados con el uso del reactivo de Lieberman Burchard (figura 2C) y del ácido fosfomolíbdico, también específicos para esteroides y terpenoides. En estos casos es necesario destacar el hecho de que en el extracto hidroalcohólico aparecen un grupo de manchas cercanas a la aplicación con Rf cercanos a 0,3, que anteriormente no habían sido visualizadas.

Fig. 2 Cromatoplacas reveladas con disolución de permanganato de potasio (A), vainillina en ácido sulfúrico (B) y reactivo de Liebermann-Burchard (C)
Para la visualización de alcaloides, al emplear el reactivo de Dragendorff se observaron solamente en el extracto hidroalcohólico algunas manchas de colores naranja y pardo a valores de Rf entre 0.3 y 0.5, lo cual es concordante con los resultados alcanzados en el tamizaje fitoquímico. Estas zonas se produjo un oscurecimiento en la fluorescencia a 254 nm, característico de alcaloides tipo indol, quinolina, isoquinolinas y purinas.10
Evaluación de la actividad antifúngica de las fracciones
De los extractos evaluados de hojas de Z. pseudodumosum el extracto hexánico fue el que presentó mayor actividad antifúngica ya que inhibió el crecimiento de A. solani a una concentración de 1000 μg/mL (tabla 3.).
Tabla 3 Concentración Mínima Inhibitoria (CMI) de los extractos de hojas de Zanthoxylum pseudodumosum
| Extractos | CMI (µg/mL) |
|---|---|
| Aceite esencial | 2000 |
| Extracto hidroalcohólico | > 4000 |
| Extracto hexánico | 1000 |
| DMSO |
< 500 |
| DMSO |
> 4000 |
Debido a la importancia de A. solani para la economía a nivel mundial, se han realizado diversos estudios con extractos o aceites esenciales de plantas en los que se determina la CMI a la que presentan actividad antifúngica frente a este hongo. Por el método de microdilución en agar los extractos clorofórmicos de hojas de Chrysanthemum coronarium L. (Garland), metanólicos de raíces de Muntingia calabura L. y metanólicos de hojas de Haplophyllum tuberculatum (Forsskal) A. Juss. presentaron actividad antifúngica frente a A. solani a una CMI de 1 000 μg/mL 20,21, igual CMI que la obtenida con el extracto hexánico de hojas de Z. pseudodumosum obtenido en esta investigación. Además, por ese mismo método, el extracto metanólico de frutos de Vinca rosea L. presentó actividad antifúngica frente a A. solani a una concentración mínima de 2 000 μg/mL 22, igual CMI que la obtenida por el aceite esencial de hojas de Z. pseudodumosum. Según estos autores, los extractos de C. coronarium, M. calabura, H. tuberculatum y V. rosea a estas concentraciones presentaron una buena actividad antifúngica frente a A. solani, por lo que este extracto y el aceite esencial de hojas de Z. pseudodumosum podría considerarse promisorio como alternativa antifúngica frente a este hongo.
La determinación cualitativa de metabolitos (Tamizaje fitoquímico) indicó que en el extracto hexánico fueron mayoritarios los flavonoides y triterpenos, compuestos con probada actividad antifúngica 23-26, por lo que la actividad de este extracto pudiera deberse en gran medida a la presencia de estos compuestos. Estos resultados son de gran importancia ya que pudiera constituir una alternativa para ser incluida en un sistema de manejo integrado para el control del Tizón temprano en la papa y el tomate.
Conclusiones
Se obtiene el aceite esencial, así como los extractos hexánico e hidroalcohólico de las hojas de Zanthoxylum pseudodumosum y se determinan las condiciones para el estudio de los mismos mediante CCD. Esta técnica junto al tamizaje fitoquímico permite la detección de triterpenos y derivados del fenilpropano en el aceite esencial, así como de flavonoides y/o compuestos fenólicos, triterpenos y esteroides en los extractos. También indistintamente han dado positivos ensayos que identifican alcaloides, cumarinas y antraquinonas en estos productos, lo que coincide con estudios fitoquímicos reportados en la literatura para este género. Desde el punto de vista de los resultados biológicos, el extracto hexánico y el aceite esencial presentan la mayor actividad antifúngica frente a Alternaria solani, por lo que resultan promisorios para el control agroecológico del tizón temprano














