Introducción
El envejecimiento o senescencia es el conjunto de modificaciones morfológicas y fisiológicas que aparecen como consecuencia de la acción del tiempo sobre los seres vivos. Este supone una disminución de la capacidad de adaptación en cada uno de los órganos, aparatos y sistemas, además de la capacidad de respuesta a los agentes lesivos que inciden en el individuo.1
Durante las últimas décadas se ha incrementado a nivel global la cifra de personas que sobrepasan los 65 años y con ello el diagnóstico de las enfermedades ligadas al envejecimiento. Según el informe “Perspectivas de la Población Mundial” de 2017, se espera que el número de personas con 60 años o más, se duplique para 2050 y triplique para 2100. Se estima un incremento de esta cifra de 962 millones en 2017 a 2100 millones en 2050 y a 3100 millones en 2100. A nivel mundial, este grupo de población crece más rápido que el de personas más jóvenes.2
En Cuba, el aumento de la esperanza de vida y la baja tasa de fecundidad y natalidad se comportan de manera similar. El aumento del porcentaje de adulto mayor en la población fue de un 15,7 % en el año 2005 y de un 20,8 % en el año 2019, según reseña el anuario estadístico de salud más reciente. Al cierre de 2018 en Cuba, el 20,4 % de la población tenía 60 años o más, y para el año 2030 se prevé que llegue al 30,1 %. 3 Este comportamiento confirma el acelerado proceso de envejecimiento demográfico que vive hoy nuestro país.
En el área macular, la senectud se manifiesta mediante de la disminución del número y densidad de fotoreceptores, hiperpigmentación del epitelio pigmentario de la retina (en lo adelante EPR), formación de gránulos de lipofuscina y modificaciones de los vasos coroideos que afectan la nutrición de la retina externa. Aunque muchas de estas transformaciones no se identifican clínicamente,4 la progresión de las mismas conlleva a la aparición de la degeneración macular asociada a la edad (en lo adelante DMAE). Maculopatía degenerativa más frecuente después de los 55 años de edad. Es la principal causa de ceguera entre las personas de edad avanzada en los países occidentales y es la tercera causa de ceguera en el mundo. Se han informado muchos factores de riesgo para la progresión de la DMAE que amenaza la visión y los drusen son unos de los precursores típicos.5
A partir del año 1990, en que se describen por vez primera, se introduce en la literatura el término: drusen reticulares; refiriéndose a una variedad de drusen visibles con “blue reflectance photography”.6 En la clasificación de Wisconsin se les denominó de esta manera, aunque también son conocidos como pseudodrusen reticulares (en lo adelante PDR) o enfermedad macular reticular.7
En esta nueva acepción, el material se acumula por encima del EPR entre las microvellosidades que envuelven los segmentos externos de los fotorreceptores e incluso en la capa nuclear externa. Por tal motivo difieren fenotípicamente de los drusen subepiteliales hasta ahora descritos. La prevalencia de estos drusen varía según la modalidad escogida para el estudio. La mayoría de los estudios coinciden en que la presencia de los PDR aumenta en tres veces las probabilidades de presentar DMAE en la población más envejecida. También se han descrito en fondos de ojos con otras enfermedades como el pseudoxantoma elástico, la distrofia macular de Sorsby y la viteliforme del adulto.8
La etiología de los drusen reticulares aún es controversial. Basado en análisis histológicos y la modalidad enface de la tomografía de coherencia óptica (OCT, por sus siglas en inglés), los pseudodrusen han sido atribuidos a las variaciones anatómicas de la vasculatura coroidea y en particular, a la disminución de la capa media de la coroides. En contraste con esto, la disfunción del EPR se le ha adjudicado a los PDR por la localización subretinal de los mismos observada en el OCT de dominio espectral (del inglés, SD-OCT).9
Aunque los drusen lipídicos y los pseudodrusen tienen algunas similitudes en su composición (lípidos neutros, colesterol, amiloide, factor del complemento y residuos membranosos), tienen diferencias significativas en sus componentes. Los pseudodrusen reticulares tienen una mayor concentración de colesterol no esterificado, vitronectina que incluyen opsinas, aglutinina y pigmentos de los fotorreceptores. Los pseudodrusen son ricos en células inmunes, mayoritariamente macrófagos y microglía inmunorreactivas; lo que confirma el rol desempeñado por la inflamación. Sin embargo, la composición precisa de los pseudodrusen reticulares no se ha esclarecido aún.8
El diagnóstico positivo y la caracterización de los PDR se apoya en las imágenes multimodales: retinografía en color, imagen infrarroja (IR) y autofluorescencia. En la retinografía a color aparecen como lesiones amarillentas en una amplia red mal definida localizadas preferencialmente superior al área macular y que tienden a ser más pequeñas a medida que se acercan a la fóvea. La capacidad diagnóstica de este estudio es limitada debido a la baja sensibilidad, pero su identificación resulta altamente confirmatoria.10
La tomografía de coherencia óptica con protocolo de adquisición line horizontal muestra una discreta hiperrreflectividad debido al material depositado encima del EPR y en el espacio subretiniano. Se le considera un medio diagnóstico excelente y confiable en la identificación de los PDR.11
Aunque no se dispone de un protocolo estandarizado de imágenes para este diagnóstico, hay otras pruebas que aportan información adicional como la angiografía fluoresceínica y con verde indocianina. Los PDR pueden asociarse con alteración en la circulación coroidea, e implica un alto riesgo de neovascularización.8
En la práctica clínica el diagnóstico de pacientes con PDR se ha incrementado en los últimos años. Hasta el presente continuamos sin conocer con exactitud su vinculación con la DMAE. La presente investigación se realizó para identificar la relación de los PDR con la degeneración macular asociada a la edad mediante imágenes tomográficas.
Métodos
Se realizó un estudio observacional descriptivo y transversal en pacientes con diagnóstico de PDR a través de tomografía de coherencia óptica, atendidos en consulta de retina de Instituto Cubano de Oftalmología “Ramón Pando Ferrer” desde enero de año 2009 y hasta diciembre de 2014.
La población de estudio estuvo constituida por 69 pacientes de 55 años o más, que cumplieron con los siguientes criterios diagnóstico para PDR en uno o ambos ojos: acúmulo de material hiperreflectivo encima del EPR en el espacio subretiniano por OCT, coalescencias hiporreflectivas en el área macular, cercanas a esta o peripapilares en la imagen IR.
Las variables de estudio fueron: edad en años cumplidos, sexo biológico y bilateralidad de la lesión según afectación de uno o ambos ojos; presencia de degeneración macular asociada a la edad según las categorías del Age-Related Eye Disease Study (AREDS).12
Para su mejor comprensión esta variable se operacionalizó en: DMAE no avanzada (categorías temprana e intermedia) y avanzada (incluyó atrofia geográfica central y neovascularización coroidea: tipo I, II y III).13
El grosor coroideo se definió como la distancia vertical entre la superficie externa del EPR y la línea hiperreflectiva de la interfase esclerocoroidea.14
La información se obtuvo de una base de datos contenida en el software Heidelberg Eye Explorer, versión 1.9.10.0 del equipo Heidelberg Engineering GmbH Spectralis HRA+OCT modelo 12 217-001_Rev00. Se revisaron las imágenes tomográficas del line macular horizontal, vertical y las imágenes IR. Las imágenes fueron examinadas por tres oftalmólogos expertos especializados en retina. Los resultados se muestran en tablas de contingencias donde se resume la información con el fin de abordar los objetivos planteados, analizar el fenómeno estudiado y arribar a conclusiones.
Resultados
En la caracterización demográfica todos los casos diagnosticados con PDR en uno o ambos ojos fueron mayores de 60 años y predominó el rango de edad entre los 70 y 79 años (49,3 %). El sexo femenino resultó ser el más frecuente así como la presencia de los PDR en ambos ojos con el 76,8 %. Hubo 7 casos de los 16 unilaterales (23,2 %) en los que no fue posible determinar la bilateralidad: 4 ojos únicos y 3 con calidad de imagen insuficiente para diagnóstico en uno de los ojos por razones médicas; por lo cual, 9 de los 16 pacientes presentaron los depósitos subretinales en las imágenes de uno de los dos ojos presentes (tabla 1).
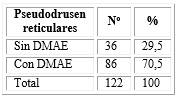
De los 131 ojos estudiados, en 122 se constataron los PDR. De ellos, en el 70,5 % se comprobó algún signo de DMAE, representado por 86 ojos. En los 36 ojos (29,5 %) restantes no se demostró ningún signo de la enfermedad (tabla 2).
Tabla 2 - Relación de ojos con pseudodrusen reticulares y degeneración macular asociada a la edad (DMAE)
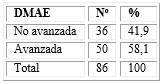
La mayoría de los ojos con PDR y DMAE presentaron la forma avanzada de esta última (58,1 % de los 86 ojos con DMAE). En el resto quedaron incluidas las categorías temprana e intermedia que resultó en el 41,9 % de todos los ojos con esta maculopatía degenerativa (tabla 3).
Tabla 3 - Relación de ojos con pseudodrusen reticulares según estadio de la degeneración macular asociada a la edad
De los 50 ojos con degeneración macular asociada a la edad avanzada, 46 (92,0 %) presentaron membrana neovascular. En 4 ojos (8,0 %) se identificó atrofia geográfica que involucraba la fóvea. La membrana neovascular situada por encima del epitelio pigmentario de la retina (tipo II) fue la más frecuente con el 58,0 % (tabla 4).
Tabla 4 - Relación de ojos con pseudodrusen reticulares y degeneración macular asociada a la edad avanzada

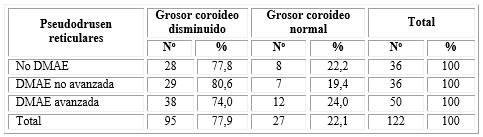
El espesor coroideo se halló disminuido en el 77,9 % de los ojos con PDR, con representación mayoritaria de los ojos con degeneración macular no avanzada (80,6 %). El grosor coroideo estuvo conservado en 27 ojos (22,1 %).
De los 36 ojos con pseudodrusen que no tienen signos de DMAE, solo 8 mantienen el grosor coroideo normal. Los otros 28 ojos representados por el 77,8 % de esos 36 ojos, lo muestran por debajo de los valores considerados como normales. No se encontró asociación entre los niveles de DMAE en pseudodrusen reticulares y la disminución del grosor coroideo (X2= 0,25, p=0,8824) (tabla 5).
Discusión
La ausencia de pacientes menores de 60 años con pseudodrusen reticulares en esta investigación, concuerda con la baja incidencia reportada por la literatura a esa edad. En la población de Bridlington, Reino Unido, la edad media para los sujetos con pseudodrusen fue de 81,1 años. La prevalencia de los PDR se incrementa con la edad; desde 1,18 % en el grupo de 65 a 69 años, hasta un máximo de 27,27 % en los que tienen 90 años y más. La mayoría de ellos tenían afectados ambos ojos, 105 (76,6 %). El total de los 114 pacientes con PDR eran mujeres (64,8 %). Estadísticamente, las féminas tienen unamayor prevalencia, significativa si se compara con el sexo masculino (5,9 % versus 4,0 %, p=0,014).17
Según Gil,7 de los 88 participantes en el estudio, el mayor número también correspondió al sexo femenino y la edad media fue de 75,57 ± 7,05 años.
El estudio de Mingui Kong y otros16 encontró que el promedio de edad para los pseudodrusen reticulares difusos fue del 74,76 ± 4,52 años (rango, 65-81), 72,47 ± 9,13 años (rango, 55-91) en los del tipo intermedio y 70,26 ± 7,77 años (rango, 61-89) en los que se hallaban localizados.
Rabiolo y otros afirman que los PDR son bilaterales en 50 % a 84 % de los casos;8 similares a los hallazgos de esta investigación.
El predominio de los pseudodrusen en el sexo femenino se le atribuye al aumento de la prevalencia de enfermedades inflamatorias del sistema autoinmune en la mujer,17 y a la disminución del papel protector de los estrógenos en las pacientes mayores.
El alto porcentaje de ojos con pseudodrusen donde se hallaron signos de DMAE confirma que la presencia de los protagonistas aumenta la probabilidad de desarrollar degeneración macular asociada a la edad como lo reflejan los resultados investigativos publicados recientemente. Tan es así, que se le atribuye un papel importante a los mencionados pseudodrusen en la progresión de la misma. La base científica para esto aún no ha sido dilucidada con certeza, pero ya se especulan algunas hipótesis que se exponen más adelante.
En la mayoría de los ojos con PDR aparece alguna manifestación de DMAE, y en un 50 % de los casos se asocia con neovascularización coroidea (NVC). Varios estudios clínicos también demostraron una fuerte asociación entre pseudodrusen y el desarrollo de DMAE más tardíamente.18
La evaluación de la asociación entre pseudodrusen y el desarrollo tardío de DMAE en el ojo contralateral es clínicamente importante porque los pacientes con membrana neovascular unilateral tienen un alto riesgo de desarrollar DMAE tardía en el ojo contraparte, y este riesgo puede aumentar significativamente por la presencia de pseudodrusen.18
Estudios como el de Sarks18 notó signos tempranos de la degeneración macular en los ojos con pseudodrusen y una fuerte asociación de estos a la neovascularización coroidea con un 52,1 %.
Se añade también que Smith y otros percibieron que el 74 % de los pacientes con PDR presentó DMAE avanzada con MNVC, con predominio del tipo II, lo que coincide con esta investigación.19
Puede que la migración de las células del EPR hacia las aéreas dañadas como parte del proceso de reparación-cicatrización sea la razón por la cual el detrimento del EPR siga a la NVC.18
Aunque la membrana neovascular y la atrofia geográfica son dos formas de DMAE avanzada con diferentes patogénesis, algunos autores refieren que los pseudodrusen están más fuertemente asociados a la atrofia geográfica que a la membrana neovascular. Este hallazgo es consistente con las dos estructuras afectadas que incluyen el espacio subretinal secundado por la coroides; pues el adelgazamiento de esta última ha sido formalizado como camarada de los pseudodrusen.5 Aunque en nuestro estudio predominaron las membranas, puede ser que en otro momento de la investigación la evolución natural de las mismas a la cicatrización conlleve a un resultado diferente.
El estudio Kaszubski y otros11 halló que durante el período investigativo (seguimiento durante 23,5 ± 5.0meses), 12 de los 31 ojos estudiados desarrollaron NVC y 4 ojos terminaron en atrofia geográfica. El 52 % no evolucionó a DMAE avanzada.
McLeod y otros estudiaron coroides posmorten y demostraron que primero se produce la atrofia del EPR seguida de la involución de la coriocapilar en ojos con atrofia geográfica.20 Ellos postulan que la contracción de los vasos coroideos puede deberse a la carencia del factor de crecimiento endotelial vascular secretado por las células del EPR. Es probable que este evento acontezca en ojos con PDR dada la relación de los mismos con la atrofia geográfica.21
En otro estudio realizado por Schmitz-Valckenberg, el 62 % de los pacientes con atrofia geográfica presentaron las lesiones reticulares en imágenes oftalmoscópicas.22
El metanálisis sobre pseudodrusen en ojos de pacientes con degeneración macular neovascular unilateral publicado en febrero de 2016 se refiere a la incidencia anual de atrofia geográfica en ojos con pseudodrusen entre los tres estudios sobre atrofia geográfica en el rango de 5,8 a 11,2 %; muy superior al 2 % de los ojos sin pseudodrusen. En el análisis combinado, la atrofia geográfica aparece en 50 (19,8 %) de 253 pacientes con pseudodrusen y en 20 (6,2 %) de 323 pacientes sin pseudodrusen.5
Esto se debe probablemente a los cambios que experimentan los pseudodrusen y que han sido abordados por varios autores.
Xu y otros21 encontraron que la forma más frecuente de atrofia geográfica, la multilobular, está altamente asociada a los pseudodrusen, su arquitectura recuerda los lóbulos coroideos. Estos pseudodrusen y la mencionada atrofia geográfica pueden estar fuertemente relacionadas porque ambas son manifestaciones del mismo proceso subyacente.
Se sabe que el espesor coroideo disminuye con la edad y en algunas enfermedades como el glaucoma, la miopía y la DMAE.23 La coroides es uno de los tejidos másvascularizados del cuerpo, tiene una tasa metabólica muy alta y suministra oxígeno a los fotoreceptores jugando un papel importante en enfermedades maculares como la DMAE.24
La no disminución del grosor coroideo puede deberse a que la alteración básica de esta enfermedad se encuentra a nivel del complejo coriocapilar-membrana de Bruch/EPR, como dijimos anteriormente, y no en las otras capas de la coroides.
Una característica adicional sobre los PDR propone el concepto de que el cambio inicial en la coroides o la vasculatura coroidea contribuye al surgimiento de estos, aunque la evidencia es controversial.25Arnold y otros contribuyentes reportaron una pérdida significativa de la coriocapilar y un incremento del espacio entre los vasos, sugiriendo que la fibrosis del estroma coroideo y la disminución de la vasculatura es responsable por el desarrollo de los pseudodrusen reticulares y se propuso a los mismos como un marcador de la isquemia coroidea.23,25
Chatziralli evaluó los cambios cualitativos que experimenta la coriocapilar en presencia de pseudodrusen y observó, en el 13 % de los pacientes con PDR, vasos fantasmas en las áreas de no perfusión de la coriocapilar. Además, en los 23 pacientes con PDR, hubo correlación entre la coriocapilar sin perfusión y el área donde se localizaron estos.26
Los pseudodrusen parecen estar localizados específicamente en zonas avasculares de la coroides, sugestivo de que la hipoperfusión coroidea está implicada en su patogénesis. Aparentemente, el patrón reticular está relacionado a los problemas del llenado coroideo en ojos con PDR. Por lo cual, la enfermedad macular reticular puede ser resultado del daño del EPR secundario a la insuficiencia coroidea. De hecho, en la DMAE temprana, el adelgazamiento coroideo peripapilar es más prevalente en ojos con PDR difusos comparado a los que tienen la distribución localizados o a ojos sin PDR.25,27 Por lo tanto, se deduce que la disminución de la coroides está presente en ojos con una mayor extensión de los pseudodrusen.
Varios estudios también muestran la reducción significativa del grosor coroideo en las imágenes del EDI-OCT (del inglés, enhanced depth imaging) los ojos con PDR, confirmado en el SS-OCT (del inglés, swept-source). Es más pronunciado en la capa de Sattler, en contraste a lo que sugieren los desvaríos en la perfusión de la coriocapilar en presencia de los PDR.25
En discrepancia con lo planteado anteriormente, un estudio retrospectivo que investigó la relación entre el grosor coroideo y los PDR en pacientes mayores de 60 años con miopía elevada, halló que los ojos con miopía alta y por consiguiente adelgazamiento coroideo significativo, no desarrollaron pseudodrusen. Por tanto, los autores de la investigación concluyeron que la evidencia al respecto no es suficiente para establecer la relación causal directa entre el desarrollo de los PDR y el adelgazamiento coroideo; punto a favor de que los factores genéticos expliquen estos hallazgos.25
Vongkulsiri argumenta que debe abandonarse el concepto de que la coroides está involucrada en la patogénesis de los pseudodrusen; en correspondencia con Spaide, quien reporta la no extensión de las alteraciones de la coriocapilar en las imágenes de pacientes con PDR del SD-OCT en face.25
Atravesando las divergencias, la evidencia más ratificada hasta la fecha señala que la disminución de la coroides y los pseudodrusen forman un binomio indisoluble en cuanto a DMAE se trata, aunque no se ha descifrado la verdad absoluta detrás de la dependencia entre ambos.
Los pseudodrusen reticulares son más frecuentes en nuestro medio de lo que en realidad se diagnostican. Mantienen una relación directa con la degeneración macular asociada a la edad e influyen en la gravedad de la misma. La disminución del grosor coroideo pudiera contribuir a la génesis de estos.