Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.21 no.4 Ciudad de la Habana oct.-dic. 2016
ARTÍCULO ORIGINAL
A citotoxicidade e a avaliação da atividade antiprotozoária de Melissa officcinalis L (CIDRO-MELISA)
Actividad citotóxica y evaluación antiparasitaria de Melissa officcinalis L. (CIDRO-MELISA)
The cytotoxicity activity and evaluation of antiprotozoa Melissa officcinalis L (CIDRO-MELISA)
Adrielle Rodrigues CostaI, Pedro Silvino PereiraII, Luiz Marivando BarrosI, Antônia Eliene DuarteI, Maria Celeste Vega GomezIII, Miriam RolónIII, Carlos Alberto Soares VidalI, Ana Josicleide MaiaI, Maria Flaviana Bezerra Morais BragaIV, Henrique Douglas CoutinhoIV
ILaboratório de Microscopia (LABOMIC) da Universidade Regional do Cariri - URCA. Crato, CE, Brasil.
IIDepartamento de Antibióticos. Universidade Federal de Pernambuco - UFPE. Recife, PE, Brasil.
IIICentro de desenvolvimento de Investigação Científica (CEDIC). Fundación Moisés Bertoni/Laboratórios Diaz Gill. Asuncíon. Paraguay.
IVLaboratório de Microbiologia e Biologia Molecular da Universidade Regional do Cariri - URCA. Crato, CE. Brasil.
RESUMO
Introdução: as Leishmanioses correspondem a um complexo de doenças tropicais causada por mais de vinte diferentes espécies de protozoários intracelulares pertencentes ao gênero Leishmania. A Doença de Chagas é uma doença que representa um dos principais problemas de saúde pública em vários países, afetando sobretudo a população carente e rural. Melissa officinalis L., é uma erva perene, uma planta exótica, cuja família é Lamiaceae, que tem sido amplamente utilizada na medicina popular com finalidades terapêuticas. O seu óleo essencial tem sido usado como antioxidante, antimicótica, antifúngica, sedativa e antivirótica.
Objetivo: avaliar a citotoxicidade, composição química e atividade antiparasitária do óleo essencial da espécie M. officinalis.
Métodos: M. officcinalis foi coletada no município do Crato, CE, Brasil, e foi depositada no herbário da Universidade Regional do Cariri URCA. A análise da composição química do óleo essencial de M. officcinalis, foi realizada através de Cromatografia Gasosa acoplada à Espectrometria de Massas. No estudo da atividade leishmanicida in vitro, utilizou-se formas promastigotas de L. braziliensis e epimastigotas de Trypanosoma cruzi. Para a atividade citotóxica utilizou-se a linhagem de fibroblastos de mamífero NCTC clone 929.
Resultados: a través da análise do óleo essencial de M. officcinalis feita por CG/EM, foi possível identificar 12 constituintes que totalizavam 99,83 %, dentre os quais alguns foram majoritários: Geranial, Z Citral, 1- Limonene e Carvone. Foi verificado baixa toxicidade contra os fibroblastos. M. officcinalis exibiu maior capacidade para impedir a replicação contra a forma promastigota do protozoário, nas concentrações testadas.
Conclusão: a espécie pode ser uma fonte importante na busca de agentes novos e seletivos para o tratamento de doenças tropicais causadas por protozoários, cujas propriedades necessitam ser investigadas quanto aso seus mecanismos.
Palavras-chave: Melissa officcinalis L; Leishmania; atividade antiparasitária; fitoterápico; doenças tropicais; Lamiaceae.
RESUMEN
Introducción: Leishmaniasis corresponde a un complejo de enfermedades tropicales causadas por más de veinte especies diferentes de protozoos intracelulares que pertenece al género Leishmania. La enfermedad de Chagas es una enfermedad que es uno de los principales problemas de salud pública en muchos países, que afectan especialmente a la población pobre y rural. Melissa officinalis L., es una hierba perenne, una planta exótica, cuya familia Lamiaceae, ha sido ampliamente utilizado en la medicina popular para fines terapéuticos. Su aceite esencial se ha usado como un antioxidante, antimicótico, antifúngica, antiviral y sedante.
Objetivo: evaluar la citotoxicidad, la composición química y la actividad antiparasitaria del aceite esencial de la especie M. officinalis.
Métodos: M. officinalis se recogió en el municipio de Crato, CE, Brasil, y fue depositado en el herbario de la Universidad Regional del Cariri URCA. El análisis de la composición química del aceite esencial de M. officcinalis se realizó por espectrometría de masa de cromatografía de gas. En el estudio de la actividad invitro leishmanicida se utilizó promastigotes L. braziliensis y Trypanosoma cruzi. Para la actividad citotóxica se utilizó la cepa de fibroblastos de mamífero NCTC clon 929.
Resultados: a través de análisis de aceite esencial de M. officinalis hizo por GC/ EM se identificó un total de 12 constituyentes 99,83 %, entre los cuales algunos eran mayoría: geranial, Z citral, limoneno y carvona 1. Se comprobó una baja toxicidad contra fibroblastos. M. officcinalis exhibió mayor capacidad para evitar la replicación contra la forma promastigote de parásito, a las concentraciones ensayadas.
Conclusión: la especie puede ser una fuente importante en la búsqueda de nuevos agentes y selectivos para el tratamiento de enfermedades tropicales causadas por protozoos, cuyas propiedades deben ser investigados con respecto a sus mecanismos.
Palabras clave: Melissa officcinalis L; Leishmania; actividad antiparasitaria; enfermedades tropicales; Lamiaceae.
ABSTRACT
Introduction: Leishmaniasis is a complex of tropical diseases caused by more than twenty different species of intracellular protozoa from the genus Leishmania. Chagas disease is one of the main public health problems in many countries. It mostly affects the poor, rural population. Melissa officinalis L. is a perennial herb, an exotic plant from the family Lamiaceae which has been widely used in folk medicine for therapeutic purposes. Its essential oil has been used as antioxidant, antifungal, antiviral and sedative.
Objective: Evaluate the cytotoxicity, chemical composition and antiparasitic activity of essential oil of the species M. officinalis.
Methods: M. officinalis specimens were collected from the municipality of Crato, CE, Brazil, and deposited in the herbarium at the Regional University of Cariri (URCA). Analysis of the chemical composition of essential oil of M. officinalis was performed by gas chromatography / mass spectrometry. L. braziliensis and Trypanosoma cruzi promastigotes were used for the study of in vitro leishmanicidal activity. Mammalian fibroblast strain NCTC clone 929 was used to evaluate cytotoxic activity.
Results: Analysis of essential oil from M. officinalis by GC / MS led to identification of a total 12 constituents 99.83%, among which some were a majority: geranial, Z citral, limonene and 1-carvone. Toxicity against fibroblasts was found to be low. M. officinalis displayed greater capacity to avoid replication against the promastigote form of the parasite at the concentrations assayed.
Conclusion: The species may be an important source of new agents and selective media for the treatment of tropical diseases caused by protozoa, whose properties should be studied with respect to their mechanisms.
Keywords: Melissa officinalis L; Leishmania; antiparasitic activity; tropical diseases; Lamiaceae.
INTRODUÇÃO
A busca incessante por novos medicamentos a base de plantas tem se tornado relevante nos últimos tempos. O interesse em compostos naturais tem crescido expressivamente.1
Os protozoários do gênero Trypanosoma e Leishmania pertencem à família Trypanosomatidae, inserida na ordem Kinetoplastidae,2,3 caracterizada por reunir protozoários parasitas e flagelados, apresentando uma única mitocôndria.4
As Leishmanioses correspondem a um complexo de doenças tropicais, causadas por mais de vinte diferentes espécies de protozoários intracelulares pertencentes ao gênero Leishmania (Kinetoplastidae, Trypanosomatidae). Encontram-se entre seis endemias consideradas prioritárias no mundo.5,6 É considerada uma doença endêmica em 98 países, afetando principalmente países subdesenvolvidos, cujos sintomas clínicos, podem ser, na forma cutânea, mucocutânia e visceral, exibindo duas formas evolutivas principais: promastigota e amastigota.7,8 Sua transmissão se da por insetos dípteros do gêneroLutzomyia (novo mundo) e Phlebotomus (velho mundo).9 Os medicamentos atuais no tratamento de leishmaniose incluem pentavalentes, anfotericina B, pentamidina, e antimoniato de meglumina.10,11
A Doença de Chagas ou tripanossomíase americana é uma doença causada pelo Trypanosoma cruzi, transmitido principalmente por via vetorial, ocasionada pela picada de insetos hematófagos do gênero Triatoma, (Reduviidae).12 Tem infectado cerca de 7 a 8 milhões de pessoas no mundo, mesmo confinada as Américas, tem se espalhado em outros continentes.13 Apesar deste contexto é considerada uma doença negligenciada. O Benzonidazol e nifurtimox são os principais compostos usados como antiparasitários para a tripanossomíase americana, contudo estes fármacos não são tão eficazes, além disso têm efeitos secundários graves, incluindo a toxicidade renal e cardíaca.14,15
Devido à dificuldade de descobrir medicamentos eficazes na terapia e seguros para os seres humanos, os produtos naturais têm sido investigados. Muitas espécies vegetais têm sido investigadas por apresentar atividades leishmanicida e tripanocida.16,17
M. officinalis é uma planta exótica, conhecida como erva-cidreira verdadeira, pertence à família Lamiaceae, a qual, detém uma posição privilegiada entre a diversidade imensa existente de plantas aromáticas cultivadas mundialmente, de origem asiática e europeia e foi introduzida no Brasil há mais de um século, sendo atualmente cultivada em todo o país. Esta espécie é utilizada popularmente para controlar crises nervosas, taquicardia, melancolia, histerismo, problemas de agitação nervosa, insônia, queixas gastrointestinais e ansiedade. Além disso, atualmente está ganhando atenção no tratamento de distúrbios cognitivos em idosos, tais como a doença de Alzheimer.18,19
Neste contexto, a identificação de novos agentes terapêuticos seguros e mais eficientes, com ação antiparasitária é desejável, de modo que as plantas consideradas constituem alternativas viáveis. Objetivou-se com este estudo, avaliar a citotoxicidade, composição química e atividade antiparasitária do óleo essencial da espécie Melissa officinalis L.
MÉTODOS
Material vegetal
M. officcinalis foi coletada no município do Crato, estado do Ceará, e foi depositada no Herbário Carirense Dárdano de Andrade-Lima da Universidade Regional do Cariri URCA sob o voucher de número #3106.
Análise da Composição Química do óleo essencial
A análise das composição química do óleo essencial da M. officinalis, foi realizada através de Cromatografia Gasosa acoplada à Espectrometria de Massas (CG/EM), utilizando um equipamento Shimidzu, Série QP2010. A coluna capilar usada foi do tipo Rtx-5MS, medindo 30 mm de comprimento por 0,25 mm de diâmetro e 0,25 mm de espessura do filme. O gás hélio foi usado como carreador a uma velocidade de 1,5 mL/min. A temperatura do injetor foi de 250 °C, e no detector, foi de 290 °C. A temperatura da coluna variou inicialmente de 60 a 180° aumentando 5 °C/min, em seguida variou de 180 a 280 °C aumentando 10 °C/min.
O óleo essencial foi diluído na proporção de 1:200 em clorofórmio sendo 1 μL injetado. O espectrofotômetro de massas foi ajustado para uma energia de ionização de 70eV. A identificação dos componentes individuais foi baseada na sua fragmentação de espectro e massa de acordo com a sua biblioteca espectral NIST Mass 08, índices de retenção e comparação com dados publicados.20,21,22
Linhagens celulares utilizadas
No estudo da atividade leishmanicida in vitro, utilizou-se formas promastigotas de L. braziliensis e epimastigotas de Trypanosoma cruzi (MHOM/CO/88/UA301) a 26 °C em meio Schneider's (para inseto) suplementado à 10 % (v/v) de soro fetal bovino inativado pelo calor, 2 % de urina humana normal (v/v) mais penicilina e estreptomicina.
Ensaio de citotoxicidade contra fibroblastos
A medição de viabilidade celular foi avaliada com resarzurina seguindo o método colorimétrico descrito por Rolón.23 Fibroblastos NCTC 929 foram semeados (5 x 104 células/poço) em placas de microdiluição de fundo chato de 96 poços com 100 µL de meio RPMI 1640. Posteriormente deixou-se que as células aderissem as placas por 24 h a 37 ºC e atmosfera de 5 % de CO2. O meio foi substituído por diferentes concentrações das drogas em 200 µL do meio e incubados por mais 24 h. Controles de crescimento foram incluídos. Logo após, um volume de 20 µL da solução 2 mM de resazurina foi adicionado e as placas devolvidas à incubadora por mais 3 h para avaliar a viabilidade celular. A redução da resazurina foi determinada por mrdida de absorbância do comprimento de onda a 490 nm e 595 nm. Cada uma das concentrações foi testada três vezes. Durante a realização dos testes, Meio e drogas controle foram 32 usados em cada teste como branco. A citotoxicidade de cada composto foi estimada através do cálculo do percentual de citotoxicidade (C%). A atividade tripanocida e a citotoxicidade foram testadas em paralelo, enquanto que a atividade leishmanicida foi testada nas concentrações em que não foram tóxicas às células fibroblásticas. Foi adicionado óleo essencial nas concentrações de 500, 250, 125, 62,5, 31,5 e 15,62 μg/mL.
Ensaio para formas epimastigotas do Trypanosoma cruzi
Os ensaios de rastreamento foram realizados em placas de microdiluição de 96 poços, com culturas que não atingiram a fase estacionária, como descrita por Veja e colaboradores (2005). As formas epimastigotas foram semeadas a 1 × 105 por mililitro em 200 µL, as placas foram incubadas com os extratos a 28 ºC por 72 h. Posteriormente foram adicionados 50 µL de solução CPRG, para dar a concentração final de 200 μM, as placas foram incubadas a 37 °C por mais 6 h adicionais e lidas a 595 nm em espectrofotômetro. Foi utilizada como droga de referência o Nifurtimox. Todas as concentrações foram testadas em triplicata. Cada experimento foi realizado duas vezes separadamente. O percentual de inibição (%AE) foi calculado como segue: %AE= [(AE _AEB)/(AC _ACB)] × 100, onde AE= absorbância do grupo experimental; AEB= branco de compostos; AC= grupo controle de absorbância; ACB= branco de meio de cultura. O óleo essencial foi previamente solubilizado em DMSO.
Ensaio para formas promastigotas de Leishmania brasiliensis
O ensaio foi realizado utilizando-se o método descrito por Mikus e Steverding com modificações.29 A atividade do óleo foi avaliada em triplicata. Formas promastigotas (2,5 × 105 parasitas/poço) foram cultivadas em placa de 96 poços de plástico. As amostras foram dissolvidas em dimetilsufóxido (DMSO). Diferentes diluições dos compostos de até 200 mL de volume final foram adicionados. Após 48 h a 26 °C, 20 µL de solução de resazurina foi adicionado e a oxidação-redução foi quantificada a 570 a 595 nm. Para cada ensaio utilizou-se como controle de referência a droga glucantime. As porcentagens antipromastigotas (%AP) foram calculadas. Foi determinada a eficácia de cada composto.
Análise estatística
Todas as análises foram realizadas em triplicata. Os dados são expressos como média ± desvio padrão (DP).
RESULTADOS
Composição química do óleo essencial de M. Officcinalis
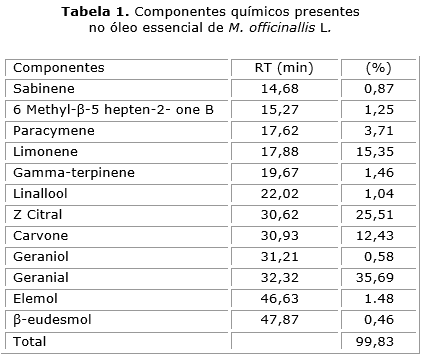
Através da análise do óleo essencial de M. officinallis, feita por CG/EM, foi possível identificar 12 constituintes que totalizaram 99,83 %. Os constituintes majoritários foram: Geranial (35,69 %), Z Citral (25,51 %), 1- Limonene (15,35 %) e Carvone (12,43 %) (tabela 1).
Citotoxicidade
Nossos resultados quanto à citotoxicidade de M. officcinalis, demonstram que nas concentrações de 125, 62.5 e 31,25 µg/mL, houve baixa toxicidade para os fibroblastos (tabela 2).
Atividade antiparasitária
Observou-se um percentual de atividade parasitária de 90,9 % e 82,18 % respectivamente, contra a forma promastigota de L. brasiliensis, para as concentrações 125 µg/mL e 62,5 µg/mL. A partir de 250 µg/mL constatou-se atividade contra T. cruzi, de 75,85 % (tabela 3).
DISCUSSÃO
O surgimento de parasitas resistentes às quimioterapias atuais evidenciam a necessidade de novos agentes antiparasitários, como por os óleos essenciais de plantas, os quais são produzidos pelas plantas como metabólitos secundários, aos quais desempenham forte papel na proteção das plantas, podendo ser sintetizados por vários órgãos.24-27 Os óleos essenciais são descritos na literatura por apresentarem varias atividades, dentre elas, antiprotozoa.28,45 Relatos da literatura apontam que óleos essenciais de diferentes plantas têm mostrado promissora atividade antiparasitária contra T. cruzi e Leishmania sp.23,29,30
Neste estudo o óleo essencial apresentou 12 constituintes, tendo sido o geranial e o Z Citral, majoritários. Tal resultado está de acordo com estudos anteriores, que demonstraram que o óleo essencial de M. officcinalis continha 23 constituintes para a planta seca e fresca, e os seus constituintes majoritários eram: neral, geranial e citronelal.31 Outros estudos relatam que óleo essencial de M. officinallis L. é constituído por: neral, geranial citral, citronelal, giraniol, cânfora, mucilagem, taninos, saponinas e resinas, em que alguns são princípios ativos para produção de medicamentos e cosméticos.32
Na M. officcinalis os óleos estão presentes nos tricomas secretores das folhas e flores, onde apresentam os compostos α e β citral, derivados do isopreno, como majoritários, cuja ação é relaxante e indutora do sono, sendo os compostos majoritários do óleo essencial de maior interesse pelas indústrias farmacêuticas.33
Observou-se que houve uma atividade elevada contra formas epimastigotas e amastigota de T. cruzi, com um IC50 de 5,5 µg/mL, com óleo essencial da Lippia alba, apresentando algumas diferenças na composição química do óleo essencial, quando comparação aos resultados da composição química apresentados nesse estudo.34
Em estudo realizado, o carvone apresentou atividade antiespasmódico, protozoário causador da malária, causando uma mortalidade elevada desse parasita.35 O citral demonstrou-se relevante na morte leishmanicida, a qual promoveu a morte celular programada, afetando a membrana nuclear e a condensação da cromatina nuclear.36 Apresentando-se relevante, com elevado potencial anti-leishmanicida. Por outro lado, o geranial tem demonstrado eficácia na inibição da expressão dos mediadores pró-inflamatórias, mostrando-se ser não toxico as células, e bom na cicatrização da pele causada por agentes externos infecciosos.37
Com relação à atividade antipromastigota, as concentrações de 125 e 62,5 µg/mL de M. officcinalis, exibiram maior capacidade para impedir a replicação do protozoário. Observou-se que o óleo essencial de M. officcinalis mostrou-se mais eficaz mesmo em concentrações menores, de toxicidade reduzida. A atividade antipromastigota contra L. brasiliensis, pelo óleo essencial investigado, demonstrou um percentual de inibição ≥ 48,48 % em todas as concentrações testadas. Este dado é considerado relevante, por apresentar 90,9 % de atividade, para uma concentração de 125 μg/mL.
Contra a forma epimastigota de T. cruzi verificou-se percentual de inibição expressivo, a partir da concentração ≤ 250 μg/mL, com 71,34 % de atividade, tendo resultado similar para as concentrações de 125 µg/mL e 62,5 µg/mL e mostrou uma atividade moderada em concentrações inferiores a 31,25 µg/mL. Tais resultados podem ser explicados pela capacidade que os terpenos presentes no óleo apresentam contra os parasitos.
Muitas espécies de plantas da família Lamiaceae, apresentam potencial inibitório no crescimento de microrganismos, nos quais mecanismos de atuação de óleos e extratos se devem a natureza química de alguns dos seus componentes38 ressaltando que os óleos essenciais são substâncias conhecidos por apresentarem moléculas de baixo peso molecular e voláteis, que se acumulam em diferentes órgãos da planta, com potenciais de suma importância para a pesquisa cientifica.39,46
Os principais aspectos negativos das terapias para Leishmaniose e doença de Chagas são a alta toxicidade e os altos índices de desenvolvimento de resistência pelos parasitos.40 A resistência observada in vitro,40,41,47 pode estar associada a um decréscimo do potencial da membrana mitocondrial, com redução do acúmulo do fármaco em terapias prolongadas.42,49 Por tanto, as drogas utilizadas para parasitos como T. cruzi e L. braziliensis apresentam uma alta toxicidade, visto que os metabólitos produzidos, comprometem tecidos do hospedeiro devido a sua alta reatividade.43 Desse modo, torna-se urgente a triagem de produtos naturais, na busca de novas terapias Produtos naturais podem servir como modelos na busca de fármacos bioativos.44
Diante do exposto nesta pesquisa conclui-se que os constituintes majoritários do óleo essencial de M. officcinalis, foram o Geranial, Z Citral, 1- Limonene e Carvone; que o óleo de M. officcinalis apresentou relevante atividade contra Leishmania brasiliensis na concentração de 250 µg/mL e moderada, contra T. cruzi; que a maior inibição do crescimento de promastigotas foi obtido a partir da concentração de 125 µg/mL; as concentrações de 125 e 100 µg/mL resultaram em baixa toxicidade (14,57 e 7,28 %) para fibroblastos. Esses dados são promissores para estudos envolvendo atividade antiparasitária com óleos essenciais.
AGRADECIMENTOS
URCA, UFSM, CEDIC, CNPQ e CAPES.
Contribución de autores
AE Duarte procedeu à concepção e ao desenvolvimento da pesquisa. PS Pereira e LM Barros contribuíram com a redação do artigo. AR Costa participou no processo de coleta de dados e pesquisa de campo. MFBM Braga e HDM Coutinho auxiliaram na interpretação e na análise dos dados. C Veja, M Rolón e CAS Vidal realizaram os experimentos. AJ Maia realizou a redação final do artigo.
CONFLITOS DE INTERESSES
Os autores declaram que não há Conflitos de Interesses.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Barros L, Dueñas M, Dias MI, Sousa MJ, Santo-Buelga C, Ferreira ICFR. Phenolic profiles of cultivated, in vitro cultured and commercial samples of Melissa officinalis L. infusions. Food Chemistry. 2013;136(1):1-8.
2. Das A, Dasgupta A, Sengupta T, Majumder HK. Topoisomerases of kinetoplastid parasites as potential chemotherapeutic targets. Trends in Parasitology. 2004;20(8):381-7.
3. Luize OS, Tiuman TS, Morello LG, Maza PK, Ueda-Nakamura T, Filho BPD, et al. Effects of medicinal plant extracts on growth of Leishmania (L.) amazonensis and Trypanosoma cruzi. Brazilian Journal of Pharmaceutical Sciences. 2015;41(1):85-94.
4. Sun X, Wang Z, Kadouh H, Zhou K. The antimicrobial, mechanical, physical and structural properties of chitosan-gallic acid films. LWT-Food Science and Technology. 2014;57(1):83-9.
5. Croft SL, Sundar S, Fairlamb AH. Drug resistance in leishmaniasis. Clinical Microbiology Reviews. 2006;19(1):111-26.
6. Pinheiro RO, Rossi-Bergmann B. Interferon-gamma is required for the late but not early control of Leishmania amazonensis infecton in C 5 713 1/6 mice. Memórias do Instituto Oswaldo Cruz. 2007;102(1):79-82.
7. Genaro O, Michalick, MSM. Leishmaniose visceral Americana. In: Neves, D.P. et al., Editores. Parasitologia Humana, 11aed. São Paulo: Atheneu; 2005.
8. Genaro O, Reis AB. Leishmaniose Tegumentar Americana. In: Neves, D.P. et al., Editores. Parasitologia Humana, 11aed. São Paulo: Atheneu; 2005.
9. Morais-Braga MFB, Souza TM, Santos KKA, Guedes GMM, AndradeJC, Veja C, et al. Phenol composition, cytotoxic and anti-kinetoplastidae activities of Lygodium venustum SW. (Lygodiaceae). Experimental Parasitology. 2013;134(2):178-82.
10. Taylor VM, Cedeño DL, Robledo SM. Phototherapy in treatment of cutaneous leishmaniasis. Infectio. 2011;15(4):277-88.
11. Rath S, Trivelin LA, Imbrunito TR, Tomazela DM, Jesus MN, Marzal PC, et al. Antimoniais empregados no tratamento da leishmaniose: estado da arte. Quimica Nova. 2003;26(4):550-3.
12. Lana M, Tafuri WL. Trypanosoma cruzi e a doença de Chagas. In: Neves, D. et al, Editores. Parasitologia humana, 11aed. São Paulo: Atheneu; 2005.
13. WHO-World Health Organization Neglected tropical diseases. France. 2009, p. 1-16.
14. Caetano LC, Zucoloto S, Kawasse LM, Toldo MP, Do Prado JC. Influence of Trypanosoma cruzi chronic infection in the depletion of esophageal neurons in Calomys callosus. Digestive Diseases and Sciences. 2006;51(10):1796-00.
15. Ruiz PG, Garavito G, Acebey CL, Arteaga L, Pinzon R, Gimenez TA. Actividad leishmanicida y tripanocida de algunas plantas reportadas como medicinales en Colombia. Biofarbo. 2004;12(12):27-30.
16. Mesquita MLD, Desrivot J, Fournet A, Paula JED, Grellier P, Espindola LS. Antileishmanial and trypanocidal activity of Brazilian Cerrado plants. Memórias do Instituto Oswaldo Cruz. 2005;100(7):783-7.
17. Coro J, Pérez R, Rodríguez H, Suárez M, Veja C, Rolón M, et al. Synthesis and antiprotozoan evaluation of new alkyl-linked bis (2-thioxo-[1,3,5] thiadiazinan-3-yl) carboxylic acids. Bioorganic & Medicinal Chemistry. 2005;13(10):3413-21.
18. PDR for Herbal Medicines. New Jersey: Medical Economics Company. 1998. pp. 967-9.
19. Haber LL, Luz JMQ, Arvati Dóro LF, Santos, JED. Concentrações de solução nutritiva para o cultivo de Mentha piperita e Melissa officinalis. Horticultura Brasileira. 2005;23(4):1006-09.
20. Adams, R. Identification of Essential Oils Comnponents by Gas Chromatography/Mass Spectroscopy. Allured Publishisng, 2001.
21. Ogunwande IA, Olawore NO, Adeleke KA, Ekundayo O, Koenig WA. Chemical composition of the leaf volatile oil of Psidium guajava L. growing in Nigeria. Flavour and Fragance Journal. 2003;18(2):136-8.
22. Silva JD, Luz AIR, Silva MHL, Andrade EHA, Zoghbi MGB, Maia JGS. Essential oils of the leaves and stems of four Psidium SSP. Flavour and Fragance Journal. 2003;18(3):240-3.
23. Rolón M, Seco E, Vega C, Nogal JJ, Escario JA, Gómez-Barrio A, et al. Selective activity of polyene macrolides produced by genetically modified Streptomyces on Trypanosoma cruzi. International Journal of Antimicrobial Agents. 2006;28(2):104-09.
24. Bakkali F, Averbeck S, Averbeck D, Idaomar M. Biological effects of essential oils - A review. Food and Chemical Toxicology. 2008;46(2):446-75.
25. Schelz Z, Molnar J, Hohmann J. Antimicrobial and antiplasmid activities of essential oils. Fitoterapia. 2006;77(4):279-85.
26. Bassolé IHN, Juliani HR. Essential Oils in Combination and Their Antimicrobial properties. Molecules. 2012;17(4):3989-06.
27. Borges AR, Aires JRA, Higino TMM, Medeiros MGF, Citó AMGL, Lopes LAD, et al. Trypanocidal and cytotoxic activities of essential oils from medicinal plants of Northeast of Brazil. Experimental Parasitology. 2012;132(2):123-8.
28. Solórzano-Santos F, Miranda-Novales, MG, Essential oils from aromatic herbs as antimicrobial agents. Current Opinion in Biotechnology. 2012;23(2):136-41.
29. Mikus J, Steverding D. A simple colorimetric method to screen drug cytotoxicity against Leishmania using the dye Alamar Blue. Parasitology International. 2000;48(3):265-9.
30. Anthony JP, Fyfe L, Smith H. Plant active components- a resource for antiparasitic agents? Trends Parasitology. 2005;21(10);462-8.
31. Sodré, ACB. Biomassa, rendimento e composição de óleo essencial de Melissa officinalis em função de adubação orgânica e mineral [dissertação]. Universidade Federal de Uberlândia: Minas Geral; 2007.
32. Blank AF, Fontes SM, Mendonça MC, Silva- Mann R, Arrigoni-Blank MF. Produção de mudas, altura e intervalo de corte em melissa. Horticultura Brasileira. 2005;23(3):780-4.
33. Sadraei H, Ghannadi A, Malekshahi K. Relaxant effect of essential oil of Melissa officinalis and citral on rat ileum contractions. Fitoterapia. 2003;74(5):445-52.
34. Escobar P.H. Chemical composition and antiprotozoal activities of Colombian Lippia spp essential oils and their major components. Memórias do Instituto Oswaldo Cruz. 2010;105(2):184-90.
35. Souza FV, Rocha MB, Souza DP, Marca RM. (−)-Carvone: Antispasmodic effect and mode of action. Fitoterapia. 2013;85(1):20-4.
36. Machado M, Pires P, Dinis AM, Santos-Rosa M, Alves V, Salgueiro L, Cavaleiro C, Sousa MC. Monoterpenic aldehydes as potential anti-Leishmania agents: Activity of Cymbopogon citratus and citral on L. infantum, L. tropica and L. major. Experimental Parasitology. 2012;130(3):223-31.
37. Pei-Chun L, Tsung-Shi Y, Ju-Ching C, J ie C, Shu-Ching L, Yueh-Hsiung K, et al. Antiinflammatory activity of neral and gerania isolated from fruits of Litsea cubeba Lour. Journal of Functional Foods. 2015;19(1):248-58.
38. Nascimento GGF, Locatelli J, Freitas PC, Silva GL. Antibacterial activity of plant extracts and phytochemicals on antibiotic-resistant bacteria. Brazilian Journal of Microbiology. 2000;31(4):247-56.
39. Knaak N, Fiuza LM. Potential of essential plant oils to control insects and microorganisms. Neotropical Biology and Conservation. 2010;5(2):120-32.
40. Plano D, Baquedano Y, Moreno-Mateos D, Font M, Jiménez-Ruiz A, Palop J, et al. Selenocyanates and diselenides: A new class of potent antileishmanial agents. European Journal of Medicinal Chemistry. 2011;46(8):1-9.
41. Jordan R, Sacerdoti-Sierra N, Voller J, Havlíček L, Kráčalíková, Nowicki MW, et al. Anti-leishmanial activity of disubstituted purines and related pyrazolo[4,3-d] pyrimidines. Bioorganic & Medicinal Chemistry Letters. 2011;21(14):4233-7.
42. Glinma B, Gbaguidi A. F., Kpoviessi S. D., Fatondji H. R., Poupaert, J., Accrombessi C. G. Characterization and antiparasitic activity of benzophenone thiosemicarbazones on Trypanosoma brucei brucei. St. Cerc. St. CICBIA. 2011;12(1):33-40.
43. Dias LC, Dessoy MA, Silva JJN, Thiemann OH, Oliva G, Andricopulo AD. Chemotherapy of Chagas' Disease: State of the art and perspectives for the development of new drugs. Química Nova. 2009;32(9):2444-57.
44. Lagnika L, Attioua B, Vonthron-Senecheau C, Kaiser M, Lobstein A, Sanni A, et al. In vitro preliminary study of antiprotozoal effect of four medicinal plants from Benin. Journal of Medicinal Plants Research. 2013;7(10):556-60.
45. Barros LM, Duarte AE, Morais-Braga MFB, Waczuk, EP, Vega C, Leite NF, et al. Kamdem JP. Chemical Characterization and Trypanocidal, Leishmanicidal and Cytotoxicity Potential of Lantana camara L. (Verbenaceae) Essential Oil. Molecules. 2016;21(2):1-9.
46. Lagnika L, Attioua B, Vonthron-Senecheau C, Kaiser M, Lobstein A, Sanni A, et al. In vitro preliminary study of antiprotozoal effect of four medicinal plants from Benin. Journal of Medicinal Plants Research. 2013;7(10):556-60.
47. Jordan R, Sacerdoti-Sierra N, Voller J, Havlíček L, Kráčalíková, Nowicki MW, et al. Anti-leishmanial activity of disubstituted purines and related pyrazolo[4,3-d] pyrimidines. Bioorganic & Medicinal Chemistry Letters. 2011:21(14):4233-7.
Recebido: 23 de junio de 2015.
Aprobado: 21 de octubre de 2016.
Pedro Silvino Pereira. Universidade Federal de Pernambuco-UFPE, Recife, PE, Brasil. Correo electrónico: pedro.sillvino@gmail.com