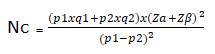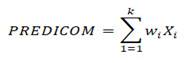INTRODUCCIÓN
La cardiopatía isquémica es una de las problemáticas médico-sanitaria de la medicina actual. Representa la primera causa de mortalidad en el mundo y la que provoca el mayor número de fallecidos.1 A nivel mundial 32,4 millones de pacientes padecen de infarto agudo de miocardio (IAM). Teniendo cifras 2,4 millones de fallecidos en Estados Unidos, alrededor de 4 millones en Europa, además de provocar en países subdesarrollados cifras cercanas al 30 %.2
En Cuba, la cardiopatía isquémica constituye la primera causa de muerte, y dentro de ella, cerca de un 40 % es por IAM. Al finalizar el 2020 fallecieron 7804 pacientes con IAM, lo que representa el 6,94 % del total de fallecidos en el país.3
Según De Winter,4 identificar pacientes con elevado riesgo de complicaciones y mortalidad es el principal objetivo de la estratificación de riesgo en los pacientes con IAM. Por lo que de cierta manera reducir estudios invasivos en pacientes de bajo riesgo, así como planificar la conducta posterior luego del egreso hospitalario.
Se han elaborado diversas escalas predictivas basadas en elementos de riesgo en fase aguda, además de diferente capacidad predictiva, tales como la Global Registry of Acute Coronary Events (GRACE) -la más difundida- y la Thrombolysis in Myocardial Infarction (TIMI), de baja predicción en cuanto a pronósticos, aunque su simplicidad la convierte en una escala útil.5
En Cuba se reflejan algunas publicaciones basadas en la elaboración de predicciones de riesgo en pacientes con infarto agudo de miocardio.6
Por lo reportado en la literatura, se pudieran pronosticar cifras elevadas de morbilidad y mortalidad por IAM, de ahí la importancia de apostar por estrategias de estratificación de riesgo en la predicción de eventos adversos mayores, además de la inexistencia de una escala predictiva para la estratificación de riesgo de complicaciones intrahospitalaria basada en elementos clínicos y ecocardiográficos.
El objetivo de esta investigación es validar una escala predictiva de complicaciones cardiacas en infarto agudo de miocardio con enfoque clínico-ecocardiográfico en el Centro de Cardiología y Cirugía Cardiovascular del Hospital Provincial Clínico Quirúrgico Docente Saturnino Lora Torres, de Santiago de Cuba.
MATERIALES Y MÉTODOS
Se realizó un estudio analítico, observacional tipo de casos y controles. Se utilizaron dos grupos: el A, muestra de análisis, y el B para validar el puntaje de riesgo: muestra de validación.
El grupo de análisis fue seleccionado de los pacientes atendidos en la Unidad Cuidados Coronarios del Centro de Cardiología y Cirugía Cardiovascular adjunto al Hospital Provincial Clínico Quirúrgico Docente Saturnino Lora Torres, de Santiago de Cuba. Estuvo constituido por los 1303 pacientes ingresados por infarto agudo de miocardio, del 2019 al 2021.
El tamaño de la muestra se calculó con el paquete estadístico EPIDAT versión 4.2, a lo cual se calculó el tamaño mínimo muestral de los casos, basado en la fórmula descrita por Soto et al.7
Donde,
Nc = número de casos y número de controles sin ajuste
p1 = proporción esperada entre los casos (0,30)8
q1 = 1-p1
p2 = proporción esperada entre los controles (0,20)
q2 = 1-p2
Za=1,96 y Zβ = 0,84
Estos valores son obtenidos de la distribución normal estándar en función de la seguridad de un 95 % y un poder estadístico del 80 %; además, se tuvo en cuenta el odds ratio a detectar -1,5- y, teniendo presente que existe una relación desigual entre casos y controles, es decir diferente de 1, se realiza un ajuste para el tamaño de la muestra: na = nc. 1+c 2c , donde: na = número de controles ajustado, nc = número de controles sin ajuste, y c = cociente de dividir los controles entre los casos. Se compuso el grupo de control de 200 casos (complicados), y los controles por 600 pacientes que no tuvieron complicación cardiaca.
En el grupo de validación se incluyeron los pacientes atendidos en el mencionado centro, de enero a junio de 2022. Se conformó con 198 sujetos (66 casos y 132 controles).
En ambas grupos fueron incluidos los pacientes atendidos con el diagnóstico de infarto agudo de miocardio, con elevación del segmento ST, en los períodos seleccionados.
Se excluyeron los pacientes con presencia de bloqueo completo de rama izquierda nuevo o presumiblemente nuevo; aquellos a los que no se les pudo recoger todas las variables del estudio; con cirugías no cardiacas en las últimas 24 horas, previas al diagnóstico del infarto agudo de miocardio, y los que presentaran complicaciones no cardiacas durante el ingreso. La decisión de excluir a los pacientes con presencia de bloqueo completo de la rama izquierda nuevo o presumiblemente nuevo, se realizó con el objetivo de evitar posibles sesgos de selección.9
Se definieron las complicaciones basadas en lo referido por Baquero y Sabatel,10 agrupadas en complicaciones derivadas de la disfunción ventricular (insuficiencia cardíaca, shock cardiogénico, infarto de ventrículo derecho); complicaciones mecánicas (insuficiencia mitral aguda, rotura de septo interventricular, rotura de la pared libre del ventrículo izquierdo); complicaciones eléctricas (arritmias ventriculares, fibrilación auricular, bradiarritmias-trastornos de conducción); complicaciones pericárdicas (pericarditis peri-infarto, derrame pericárdico, síndrome de Dressler), y otras (trombo en ventrículo izquierdo, complicaciones hemorrágicas).
Debido al interés por validar una escala para estimar el riesgo de complicaciones cardiacas en el paciente con diagnóstico de infarto agudo de miocardio, la muestra se dividió, de forma aleatoria, en dos partes: una (grupo de análisis), que sirvió para realizar el análisis estadístico bivariado y estimar la función de regresión logística binaria -publicada en la Revista Habanera de Ciencias Médicas-;11 y la otra (grupo de validación), con 198 pacientes para validarlo. En esta publicación abarcamos ambas muestra de estudio.
Variables
Demográficas:
Edad: mayor de 65 años; menor o igual de 65 años.
Sexo: masculino; femenino.
Clínicas:
Antecedentes de diabetes mellitus: presencia o ausencia.
Antecedentes de cardiopatía isquémica: presencia o ausencia.
Tensión arterial sistólica al ingreso: ≥ 90 mmHg o < 90 mmHg.
Tensión arterial diastólica al ingreso: ≥ 60 mmHg o < 60 mmHg.
Topografía IMA: infarto agudo de miocardio topografía inferior; infarto agudo de miocardio topografía anterior.
Terapéutica:
Aplicación de terapia trombolítica: presencia o ausencia.
Variables ecocardiográficas (se definieron como el tipo específico de enfermedad o alteración según los hallazgos de las imágenes):
Fracción de eyección de ventrículo izquierdo (FEVI): ≤ de 40 % (valor patológico); > de 40 % (valor permisible).
Presión de aurícula izquierda (PAI): > de 15 mmHg (valor patológico); ≤ de 15 mmHg (valor normal).
TDI de anillo mitral velocidad de S: < 6,5 cm/s (valor patológico); ≥ 6,5 cm/s (valor normal).
Función sistólica ventrículo derecho (FEVD): se determinó por velocidad pico de la S del doppler tisular pulsado del ventrículo derecho (TDI VD); se tomó como valor normal TDI VD > 9,5 cm/s; TDI VD ≤ 9,5 cm/s (valor patológico).
Volumen de aurícula izquierda (volumen AI): volumen AI ≤ 34 ml/sc (valor normal) o > 34 ml/sc (valor patológico).
Índice motilidad parietal (IWS): ≤ 1,5 puntos (valor adecuado); > 1,5 puntos (valor patológico).
Las variables independientes edad, sexo, tensión arterial sistólica y diastólica al ingreso, diagnóstico clínico-electrocardiográfico, terapéutica trombolítica, fracción de eyección de ventrículo izquierdo; presión de aurícula izquierda (PAI); función sistólica ventrículo derecho (FEVD): TDI anillo S < 6,5 cm/s; volumen de aurícula izquierda (volumen AI), e índice motilidad parietal; fueron tratadas como variables continuas, según presencia o ausencia del valor patológico.
La variable dependiente fue tener al menos una de las complicaciones cardiacas intrahospitalarias.
Para la obtención del dato primario se utilizaron los registros de estadística del centro hospitalario (fuentes primarias) y la revisión de historias de salud familiar e historias clínicas individuales de cada paciente (fuentes secundarias). Además, se realizaron entrevistas a pacientes y/o familiares para conocer aspectos relacionados con los factores de riesgo cardiovascular. En ambos grupos -A y B (análisis y validación)- se realizó estudio ecocardiográfico en las primeras 24-48 horas del ingreso hospitalario, acorde a las recomendaciones de la American Society of Echocardiographic.12 Todos fueron analizados e interpretado por dos ecocardiografistas experimentados.
A los pacientes del grupo de validación, se les aplicó la escala de riesgo creada, de la cual 66 casos fueron evaluados como alto riesgo (≥ 8 puntos) y 132 de bajo riesgo (< 8 puntos). De acuerdo con el resultado, se correlacionó con la aparición de complicaciones cardiacas durante el ingreso.
En el procesamiento estadístico se utilizó el paquete SPSS versión 22.0 en la muestra de análisis (grupo A). El análisis descriptivo de las variables cualitativas se realizó mediante porcentajes, medias, medianas y frecuencias absolutas. Se aplicó la prueba Ji cuadrado de independencia con un nivel de confianza del 95 % para determinar asociaciones entre la variable dependiente y cada una de las variables independientes.
Posteriormente, se realizó un análisis de regresión logística binaria. Si en la variable dicotómica paciente con presencia de complicaciones cardiacas (sí/no), la probabilidad de que un paciente presente al menos una complicación cardiaca durante IAM. Para estimar la calidad del ajuste se empleó el coeficiente de determinación R2 de Nagelkerke. Posteriormente, se aplicó en análisis de regresión logística binaria para conocer la relación entre la variable dependiente complicaciones cardiacas (sí/no) y las variables independientes o explicativas, con el objetivo de obtener una estimación ajustada de la probabilidad de ocurrencia. La bondad de ajuste se determinó a través de la prueba de Hosmer y Lemeshow. Se identificaron las variables cuyos coeficientes en el modelo ajustado fueron diferentes de 0 (p < 0,05). Se obtuvo la relación de cada una de las variables de análisis con la variable a predecir, a través de la determinación del odds ratio (OR), con un índice de confianza del 95 %. Se determinó el nivel de significación de las variables y se fueron eliminando durante el proceso, utilizando como umbral el valor de 0,05.
Para la construcción de la escala se asumió un modelo aditivo, donde las variables implicadas fueron las que resultaron estadísticamente significativas en el análisis anterior, ponderadas con su correspondiente coeficiente en la regresión aproximado al entero menor. De manera que la escala predictiva (PREDICOM) queda determinada por la siguiente expresión:
Donde: w i es el peso de la i-ésima variable y k el total de variables estadísticamente significativas en el modelo de regresión logístico ajustado.
Hasta este paso se creó una variable cuantitativa; sin embargo, desde el punto de vista práctico, es preferible obtener una variable ordinal que ofrezca categorías o niveles de riesgo; de esta manera, la estratificación del riesgo del paciente es más sencilla y comprensible.
Se tomó como punto de corte el valor con mayor índice de Youden en la valoración de la curva ROC por puntos de corte, de conjunto con el valor de la razón de verosimilitud positiva (RV+) más alta y el valor de razón de verosimilitud negativa (RV-) más cercana a cero. Si el valor es mayor o igual que el punto de corte, se consideró riesgo alto. En el grupo de validación se determinó la sensibilidad, la especificidad, el valor predictivo positivo y el negativo. Para determinar la capacidad predictiva del modelo obtenido, se calculó la curva operativa del receptor (COR) y el área bajo la curva (AUC). La elaboración y validación de la escala se realizó según las recomendaciones de la guía Transparent Reporting of a Multivariable Prediction Model for Individual Prognosis or Diagnosis (TRIPOD).13 Se desarrolló una validación por jueces de la propuesta de escala predictiva de complicaciones cardiacas mediante una encuesta elaborada con preguntas de opción múltiple y abierta para agregar comentarios personales. Se aplicó el método Delphi14 de consenso de expertos, el cual es la utilización sistemática del juicio intuitivo de un grupo de expertos para obtener un consenso de opiniones informadas. Por lo que se consideró metodológicamente dos cuestiones fundamentales: la elaboración del cuestionario y la selección del grupo de expertos a encuestar.
Para determinar el grado de acuerdo entre los expertos y su valor p para elegir entre dos hipótesis opuestas en función de sus datos recopilados, se tuvieron como hipótesis de investigación:
Ho (hipótesis nula): no existe concordancia entre los expertos.
Ha (hipótesis alternativa): existe concordancia entre los expertos.
Se contemplaron como posibles candidatos a expertos aquellos que reunieran tres o más de los siguientes requisitos: 1) ser especialistas de segundo grado en Cardiología o de primer grado con más de diez años de graduado, 2) ser doctor en Ciencias Médicas, 3) ser profesor titular o auxiliar, 4) tener categoría como investigador titular o auxiliar, 5) poseer Maestría en Urgencias Médicas.
Se calculó el coeficiente de concordancia W de Kendall.15 Cada ítem de la escala fue evaluado de manera independiente por cada experto y se equipararon categorías y puntajes,16 dividiéndose en las siguientes categorías: AA (altamente adecuada), con 5 puntos; MA (muy adecuada), con 4; A (adecuada), con 3 puntos; PA (poco adecuada), con 2, e I (inadecuada), con 1 punto. Se consideró como buena la validez de contenido si las variables obtuvieron las dos primeras categorías (AA o MA), luego de determinar el coeficiente de concordancia W de Kendall, empleado para medir el grado de acuerdo entre varios expertos, con valores válidos superiores a p ˂ 0,05. La consistencia interna se evaluó mediante el coeficiente de alfa de Cronbach para las dimensiones y el total del cuestionario de jueces.17
La investigación se fundamenta en el cumplimiento de los principios éticos de la Declaración de Helsinki de la Asamblea Médica Mundial,18 y fue aprobada por el Consejo Científico de la institución donde se realizó el estudio.
Los autores declaran su compromiso de confidencialidad y protección de la información recogida y el uso de ellos solo con fines investigativos, además de asegurar la veracidad de los datos y las buenas prácticas investigativas.
RESULTADOS
De los 800 pacientes estudiados, 348 (43,5 %) correspondieron al sexo femenino, mientras 452 (56,5 %) al masculino. La edad media de los pacientes fue de 57,4 años, con una desviación estándar ± 8,5. En cuanto a diagnóstico topográfico, 254 (33 %) presentaron topografía anterior y 148 (18,5 %) tenían antecedentes de diabetes mellitus.
El análisis multivariado exhibió 10 factores predictores, con influencia independiente en el desarrollo de complicaciones cardiacas en el infarto agudo de miocardio; resaltan: la edad mayor o igual de 65 años (OR = 2,739; IC 95 % = 1,053-4,207; p = 0,001); el antecedente de diabetes mellitus (OR = 2,753; IC 95 % = 1,042-7,275; p = 0,041); el volumen de AI (OR = 7,071; IC 95 % = 4,034-12,394; p = 0,001) y el índice de motilidad parietal (OR = 11,576; IC 95 % = 5,307-25,252; p = 0,001). La prueba de Hosmer y Lemeshow demostró que los datos se ajustan al modelo (p = 0,321). (Tabla 1)
Tabla 1 Variables incluidas en el modelo de regresión logística para la predicción de complicaciones cardiacas
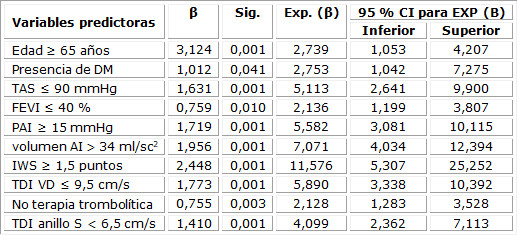
Prueba de Hosmer y Lemeshow: χ2 = 9,260; p = 0,321. β: coeficiente β; Exp. Β = Odds Ratio; DM: diabetes mellitus; TAS: tensión arterial sistólica; FEVI: fracción de eyección del ventrículo izquierdo; PAI: presión de aurícula izquierda; IWS: índice de motilidad parietal; TDI: imagen de doppler tisular; VD: ventrículo derecho.
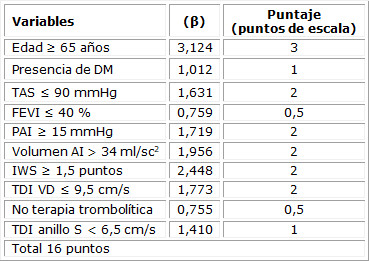
En la tabla 2 se presenta la escala con cada uno de los ítems y sus ponderaciones desarrollada con la muestra de análisis. En el caso de la edad mayor de 65 años (3 puntos), TAS ≤ 90 mmHg (1 punto), presencia de terapia trombolítica y la función sistólica del ventrículo izquierdo ≤ 40 % (0,5 puntos), se decidió ponderar de esa manera, respectivamente. El resto se redondeó al valor entero superior, es decir, antecedentes de diabetes mellitus (1 puntos), TDI VD < 9,5 cm/s (2 punto), TDI anillo < 6,5 cm/s (1 punto), volumen de aurícula izquierda ≥ 34 ml/sc (2 puntos), PAI ≥ 15 mmHg (2 punto), índice de motilidad parietal ≥ 1,5 puntos (2 punto), por lo que el rango posible de la escala sería de 0-16 puntos.
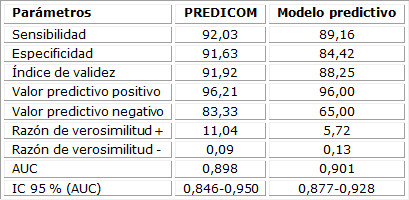
Este estudio tomó para la determinación del punto de corte de la escala la curva de ROC y el índice de Youden, delimitados en: de bajo riesgo: < 8 puntos y de alto riesgo; ≥ 8 puntos. De esta manera, se llegó a la propuesta de una escala predictiva, clasificándose como una variable ordinal, con dos categorías de menor a mayor riesgo (categoría I: bajo riesgo y categoría II: alto riesgo). Además, en la relación discriminación y calibración entre escala creada y modelo predictivo que le dio origen, no se observan diferencias significativas entre ambos, con un área bajo la curva de 0,898 en la escala creada y de 0,901 del modelo predictivo, en ambos casos. Lo anterior evidencia la excelente capacidad predictiva. La prueba Hosmer-Lemeshow revela una adecuada calibración. (Tabla 3)
Con las opiniones emitidas por los expertos en cuanto a las variables que componen la escala predictiva y la relación con las complicaciones cardiacas intrahospitalaria, fue posible clasificar esa relación. Seis de las variables se consideraron muy adecuada (MA), y su relación con el constructo que se pretende medir con la escala para el resto de las variables se consideró bastante adecuada (BA). La confiabilidad de los ítems-test, según la respuesta dada por los expertos, fue calculada con el coeficiente alfa de Cronbach (0,702); existió un consenso significativo entre los expertos, con valor de coeficiente W de Kendall de 0,75. (Tabla 4)
Tabla 4 Valoración de los expertos de las variables analizadas
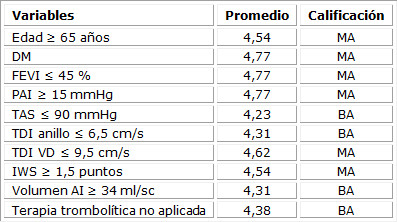
Coeficiente W de Kendall: 0,75; significación 0,001; alfa de Cronbach = 0,702. DM: diabetes mellitus; TAS: tensión arterial sistólica; FEVI: fracción de eyección del ventrículo izquierdo; PAI: presión de aurícula izquierda; IWS: índice de motilidad parietal; TDI: imagen de doppler tisular; VD: ventrículo derecho.
DISCUSIÓN
Los estudios predictivos se pueden fragmentar en diferentes categorías: para determinar pronósticos o diagnósticos, de validación de modelos predictivos sin validación externa, y de desarrollo de modelos de predicción e impacto de los modelos.19
La escala de riesgo en cuestión, con solo dos estratos, debido a que los investigadores consideran que el cambio en la atención del paciente con IMA depende de que fueran clasificados como alto riesgo, lo cual genera acciones asistenciales diferenciadas durante su estancia hospitalaria.
Chan Pin et al.20 alegan que las escalas realizadas a través de registros multicéntricos tienen más eficacia que las que se relacionan con ensayos clínicos y estudios unicéntricos. En este punto, autores como Santos et al.21 aportan que la escala GRACE es un ejemplo de elevada capacidad predictiva, pues, luego de obtenerse el registro multicéntrico, ha sido validada en varios países. Sin embargo, según estudios realizados en Cuba, esta escala no evidencia resultados similares.22 No obstante, estos estudios no se han realizado en una muestra lo suficientemente grande como para realizar conclusiones acerca de su validez o no en la población cubana.
Existen varias formas de realizar la ponderación de variables en la escala predicción. Autores como Hierrezuelo et al.23 escogen el valor de la exponencial beta por su coincidencia con el odds ratio. Valdés-Ramos y Álvarez-Aleaga24 expresan que los coeficientes de regresión “son el peso escogido” para cada ítem; sin embargo, su número decimal y pequeño obliga a amplificarlo. Esto difiere de lo realizado en el presente estudio, donde se utilizó el valor de beta del modelo de predicción, redondeando al número entero inferior.
En cuanto a la capacidad de discriminación y calibración, el valor de área de la curva de PREDICOM alcanzó una excelente capacidad discriminativa. Escalas creadas para similares propósitos, como las propuestas por Hierrezuelo et al.,23 presentan área bajo la curva (AUC) similares. Otras, como el ProACS risk score25 mostró valores algo más inferiores (AUC 0,796). Por su parte, Santos et al.21 aportan que GRACE y TIMI Risk Score tuvieron baja especificidad, y las escalas ICR (Instituto Cardiovascular de Rosario), InTIME (Intravenous nPA for Treatment of Infarcting Myocardium Early) y GRACE presentaron baja capacidad predictiva en su población de estudio. Esto pudiera deberse a la población de estudio donde se realizó la validación interna y externa de los estudios antes citados.21,23,25
La validez de contenido fue explorada mediante la consulta de expertos, donde la bibliografía consultada26 refleja que valores ≥ 0,70 por alfa de Cronbach dan una confiabilidad adecuada. En ese mismo punto, Herrera Masó et al.17 refieren que la confiabilidad es el grado de consistencia en que un instrumento es válido en una muestra de población e infiere el grado que una medida está libre de errores. Peña y López27 mostraron un consenso de expertos adecuado con un coeficiente W de Kendall de 0,650 (p < 0,0001), lo cual es relativamente adecuado entre los expertos y una baja variabilidad en cada uno de los predictores.
Finalmente, el estudio tiene como principales limitaciones no contar con tecnología ecocardiográfica avanzada, que pudiera evaluarse en próximas investigaciones.
Se construyó la escala para pronosticar el riesgo de complicaciones cardiacas en el infarto agudo miocardio, constituida por diez predictores. Con esta herramienta se logra estratificar el riesgo en no alto y alto. Mostró buen rendimiento y se realizó su validación interna, de constructo, de contenido y de criterio, con buenos resultados.