1. INTRODUCCIÓN
Las arcillas son minerales, filosilicatos en su mayor parte, cuyas propiedades físico químicas dependen de su estructura y su tamaño granular; se clasifican en dos grandes grupos atendiendo a sus usos: arcillas industriales y arcillas específicas.
Las arcillas son aluminosilicatos hidratados, pertenecientes a la familia de los filosilicatos, donde la unidad estructural básica es el (Si2O5)2- dispuesto en forma de capas, y con frecuentes sustituciones isomórficas de cationes en su estructura, lo que hace muy difícil asignarles una fórmula estequiométrica “real” y las fórmulas teóricas asignadas solo tienen un valor aproximado. Las arcillas, resultado de procesos geológicos de degradación de las rocas, aparecen siempre contaminadas con impurezas de minerales no arcillosos, residuos orgánicos y otros.
Existen numerosos tipos y clasificaciones para las arcillas, basándose estas en general en el tipo y proporción de los cationes presentes y el ordenamiento de las unidades (Si2O5)2-, siendo este uno de los grupos minerales con mayor variedad y más difícil estudio desde el punto de vista estructural. De acuerdo a su tipo o clasificación, las arcillas presentan diversos comportamientos como intercambiadoras o adsorbentes de cationes, oscilando desde las muy poco intercambiadoras/adsorbentes como la caolinita, hasta las que presentan mayor capacidad como las montmorillonitas y bentonitas (Grim, 1962).
Las características que potencian su uso están condicionadas por la presencia de iones intercambiables como sodio y potasio. Los iones Ca2+ no favorecen el hinchamiento ya que el ion mencionado ejerce una fuerza de unión entre las láminas de la arcilla considerable. Con el objetivo de mejorar las propiedades de la arcilla en cuanto a intercambio iónico y propiedades de hinchamiento (Drits, 2003), (Heller-Kalloai, 2006), (Muller, 2005) se realiza una activación ácida. Por tanto, el objetivo del presente trabajo es determinar los parámetros químico - físicos que describen la cinética de adsorción de iones hidronio en el sistema heterogéneo de masa solución ácida-arcilla en condiciones estáticas.
2. MATERIALES Y MÉTODOS
2.1. Técnicas empleadas en la caracterización parcial del adsorbente
Se determinan una serie de parámetros físicos como densidad picnométrica, aparente, aparente por aprisionamiento, compresibilidad, porosidad, velocidad de flujo, tortuosidad y superficie específica. Además, se determinan los contenidos de los elementos en forma de óxidos.
El análisis de difracción de Rayos X se realiza con el equipo D8 Advance de la firma Bruker que presenta las siguientes condiciones: Geometría Bragg - Brentano (θ - 2θ), línea Kα del Cu (1,54183 Å), filtro de Ni, la potencia de la fuente de rayos X es de 2 400 W, amperaje de la fuente de rayos X de 40 mA, voltaje de la fuente de rayos X: 30 kV, el tipo de detector es detector de área (conocido como ojo de Lince), paso de barrido: Δ2θ = 0,025°, intervalo angular de medición: 2θ = 5 - 60°, tiempo de medición 0,5 s.
Para el análisis térmico se utiliza un analizador termogravimétrico: TGA Q 5000 de la firma TA Instruments, termopares Pt (Pt / Rh), crisoles de cerámica, como referencia (atmósfera estática) crisol vacío. TG = 100 mg, ATD = 250 μV, velocidad de calentamiento de 10 °C / min. La temperatura de trabajo es de 1000°C y la masa de la muestra 100 mg.
Para el análisis por espectrofotometría infrarroja se utiliza el equipo FTIR Bruker Vector 22 con software OPUS equipado con una celda de temperatura Eurotherm. Las muestras se hicieron según el método de discos de KBr, puro para espectroscopia, a una dilución del 1% de la muestra en el KBr. Se emplea una bomba de vacio durante la confección del disco para minimizar la influencia de factores ambientales. Se realiza un blanco con KBr para corregir la influencia de dichos factores.
2.2. Estudio cinético
Se prepara una disolución acuosa de 122 mg/L del ion hidronio. De esta se toman 500 mL y se le añaden 5g de bentonita pulverizada. Posteriormente, se toman alícuotas de 5mL en intervalos de 3, 6, 9, 12, 15, 18, 21, 30, 40 y 50 minutos a las temperaturas de 20, 30 y 40oC y se determina la concentración de iones H+ mediante valoración ácido-base. Se realizan cinco replicas por cada punto cinético obtenido. A ese conjunto de puntos se le determinan algunos parámetros estadísticos que describen las características de las curvas cinéticas como mediana, media, desviación estándar del gráfico inclusiva, asimetría gráfica inclusiva y la curtosis (Spiegel, 1977).
2.3. Modelos cinéticos y difusivos empleados
Los modelos cinéticos y difusivos evaluados son los modelos de seudoprimer orden (SPO), seudosegundo orden (SSO), Elovich (ME), difusión intrapartícula (DPL), difusión en los poros según Bangham (MB), difusión en la película líquida (DPL), Además, se determina la energía de activación del sistema heterogéneo, la variación de entropía y entalpía "aparente" del complejo activado de adsorción y el calor isostérico involucrado en el proceso adsortivo (Azizian, 2004), (Ejikeme et al., 2011) (Foo y Hameed, 2001), (Stoeckli, 2001), (Chun-I y Li-Hua, 2008), (Eyring et al.,1949).
3. RESULTADOS Y DISCUSIÓN
A continuación, las características físicas del adsorbente, aspecto importante en cuanto a las propiedades físicas, que influyen en el comportamiento químico:
Tabla 1 Parámetros físicos del adsorbente
| Parámetros físicos | Valores |
|---|---|
| Tamaño de partícula(mm) | ≤ 0,002 |
| Densidad aparente (g/cm3) | 0,84 ± 0,030 |
| Densidad aparente por aprisionamiento (g/cm3) | 1,09 ± 0,025 |
| Densidad picnométrica (g/cm3) | 2,024± 0,023 |
| Velocidad de flujo (mg/s) | 0 |
| Porosidad (%) | 58,00 ± 0,63 |
| Compresibilidad (%) | 46,00 ± 0,028 |
| Superficie específica(m2/g) | 44,23± 0,73 |
Desde el punto de vista físico es un material silícico de baja densidad, gran porosidad, lo que justifica su nula velocidad de flujo. Su compresibilidad es elevada. Presenta una superficie específica baja.
Desde el punto de vista químico la tabla 2 refleja la composición química en forma de óxidos, expresados en por cientos:
Tabla 2 Composición Química de la Fracción Ø ≤ 0,002 mm (%)
| Óxidos | % | Óxidos | % |
|---|---|---|---|
| SiO2 | 57,74 | MnO | 0,12 |
| Al2O3 | 18,71 | Cr2O3 | 0,01 |
| Fe2O3 | 7,07 | CuO | 0,01 |
| Na2O | 2,68 | Ga2O3 | 0,00 |
| K2O | 0,65 | NiO | 0,01 |
| MgO | 1,80 | SrO | 0,01 |
| CaO | 1,85 | WO3 | 0,04 |
| BaO | 0,04 | Y2O3 | 0,00 |
| SO3 | 0,02 | ZnO | 0,01 |
| P2O5 | 0,07 | ZrO2 | 0,01 |
| TiO2 | 0,58 |
Estos resultados se ajustan a los obtenidos según las normas de laboratorio aplicadas en el Instituto Politécnico Federal de Lausana enmarcado dentro del proyecto conjunto con la Universidad Central "Marta Abreu" de Las Villas “Development of Ecomaterials for Low Cost Housing”.
Se puede observar la presencia de un relativo alto valor porcentual de sílice, que se debe a la posible sílice libre acompañante (cristobalita), seguido de alúmina y óxido de hierro, el cual influye en la coloración de la muestra y en la aglomeración de las partículas arcillosas. No se descarta su participación en la lámina octaédrica. Los óxidos de magnesio y calcio son menores porcentualmente que los de potasio y sodio; esto no está en correspondencia con la importancia que debería tener el magnesio en la formación de las capas octaédricas.
En cuanto al análisis de difracción de rayos X (DRX), para la fracción de tamaño de partícula más pequeña, la fase mineralógica predominante es una montmorillonita de capas irregulares (Brown, 1961). Las montmorillonitas se encuentran dentro de los tipos de arcillas más estudiadas con vistas a su utilización como adsorbentes, dada su alta capacidad de intercambio catiónico. Las montmorillonitas manifiestan un alto carácter expansivo y capacidad de intercambio de iones en su estado natural, propiedad que pierden luego de un tratamiento térmico a temperaturas elevadas. Como todos los filosilicatos, presenta una estructura de capas, cuyo ordenamiento puede ser regular o no. Entre las capas de silicatos pueden incluirse cationes divalentes o monovalentes, comúnmente, Ca2+ o Na+, que pueden ser intercambiados por otros cationes presentes en el medio. Otra de las fases arcillosas identificadas son illitas.Las illitas son arcillas poco expansivas y con baja capacidad de intercambio iónico. También dentro de esta fracción de tamaño de partícula más pequeño se encuentran, como minerales acompañantes, cuarzo y feldespato (albita) (Sagar y Singh, 2007). Estas fases, presentes en pequeñas cantidades, tienen alta cristalinidad y no contribuyen a la capacidad de adsorción, pese a su pequeño tamaño de partícula. Dentro de la fracción de mayor tamaño de partícula, las fases claramente predominantes son el cuarzo y la albita como feldespato.
Los valores que se obtienen en el análisis de DRX posibilita la construcción del difractograma que verifica la presencia de montmorillonita (72%) como componente mayoritario, cristobalita (22%), feldespato (3%), Fe2O3 (3%) e illita (2%).
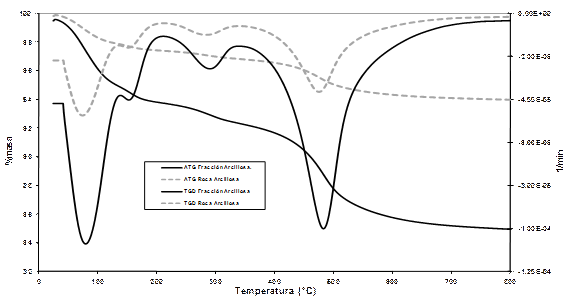
El análisis térmico diferencial y el análisis térmico gravimétrico (ATD-TG) se aprecian en la curva de ATD y TG (Figura 2) para la roca arcillosa y la fracción de menor tamaño de partícula se observa en ambos casos los efectos típicos para una arcilla del tipo montmorillonita.
El primer efecto térmico corresponde a la pérdida del agua absorbida entre las capas de la arcilla. Este efecto, presente por debajo de los 300°C, tiene carácter reversible. La forma de doble pico de este primer efecto es característica de la presencia de un catión divalente entre las capas de la montmorillonita, probablemente Ca o Mg. Entre los 500 y los 800°C se observa un efecto endotérmico muy acentuado, acompañado de un incremento en la pérdida de masa. Es aquí donde ocurre, de manera irreversible, la desoxhidrilación de la arcilla, perdiéndose los OH- que se encuentran entre las capas y quedando la estructura en un estado altamente desordenado y reactivo (Ramachandran, 2002).
De la relación entre las pérdidas de masa para la roca arcillosa y la fracción de menor tamaño de partícula, puede calcularse la cantidad real de arcilla en la roca, con un resultado de aproximadamente un 70%, ligeramente inferior al porcentaje que representa la fracción de menor tamaño de partícula en la roca, lo cual confirma la presencia en esta de fases térmicamente inertes, pero de pequeño tamaño de partícula.
Las características del desarrollo de la curva ATG se corresponden aceptablemente a un mineral arcilloso del tipo montmorillonítico en la muestra en estudio. En la figura 2 es posible observar el primer pico endotérmico, característico del agua adsorbida fundamentalmente en la superficie de las partículas de la montmorillonita en 49,11 ˚C y otros menos acentuados antes de 180 ˚C presentes en la montmorillonita de estudio. Estos efectos térmicos indican desprendimiento de moléculas de H2O unidas, con diferentes energías, a cationes divalentes; el desprendimiento a temperaturas mayores corresponde a moléculas de la primera esfera de coordinación de la hidratación del catión. La deshidratación completa del catión concluye a 180 ˚C. A los 633,13 ˚C, el efecto térmico revela una reacción endotérmica que indica la etapa de destrucción de la red estructural de la montmorillonita, es decir, la destrucción del carácter irreversible del proceso de hidratación. La pérdida de peso es alrededor del 16 %. Las diferencias con la pérdida de agua reportada en la figura se deben fundamentalmente a los distintos grados de hidratación del agua adsorbida físicamente en el momento del análisis.
El análisis estructural se completa con espectroscopía infrarroja. El espectro tiene el aspecto característico de los minerales arcillosos. Las bandas entre 1120 y 461 cm-1 corresponden a estructuras de filosilicatos (Madejová, 2003).
Se observan tres regiones bien diferenciadas. En la zona de más altos números de onda (3600-3400 cm-1) se identifican vibraciones de estiramiento de OH de la capa octaédrica que se asigna a la deformación de los enlaces OH, puntualmente en 3421,29 cm-1 se observa una banda ligeramente ancha que denota la presencia de agua absorbida, que se confirma en la zona central (1655 cm-1), donde se identifica una banda que denota la vibración de deformación del agua interlaminar (Madejová, 2003). A los 1038,8 cm-1 se muestra una banda debida a la vibración fundamental Si-O-Si. La zona de menores valores de onda (518-461 cm-1) indica las vibraciones características de tensión de Si-O-Me (518 cm-1) y de deformación Si-O-Si (461 cm-1), (Sagar y Singh, 2007).
3.1. Resultados del estudio cinético
A continuación se expresan los coeficientes de determinación para los modelos cinéticos empleados.
Tabla 3 Coeficientes de determinación de los modelos cinéticos empleados
| Temperatura (oC) | SSO | SPO | ME | DIP | DPL | MB |
|---|---|---|---|---|---|---|
| 20 | 0,940 | 0,991 | 0,851 | 0,891 | 0,985 | 0,969 |
| 30 | 0,813 | 0,959 | 0,947 | 0,988 | 0,962 | 0,999 |
| 40 | 0,804 | 1 | 0,998 | 0,990 | 1 | 0,978 |
Se aprecia que el modelo que mejor se ajusta es el de seudoprimer orden. Esto se puede considera como si el ion hidronio interactuara con un punto del adsorbente. A partir de los valores de kads para las tres temperaturas: 0,143, 0,541 y 0,695 min-1 se puede establecer la dependencia ln kads vs 1/T y obtener el valor Ea = 1,59 kJ/mol, lo cual refleja la facilidad con que puede ocurrir el proceso, dado lo bajo del valor de la energía de activación. El factor pre-exponencial es de 5,72·1018 min-1.
Al establecer la dependencia ln Ce vs 1/T se determina el calor isostérico cuyo valor de 0,19 kJ/mol, demuestra su poca relevancia, lo cual responde a la baja heterogeneidad energética superficial.
Al recurrir a la ecuación de Eyring se obtienen los siguientes valores:
El proceso de activación conlleva a una liberación de energía y a una disminución de la aleatoriedad del sistema adsorbente/adsorbato. A partir de estos valores es posible afirmar que el proceso es posible a bajas temperaturas
Al establecer el estudio de los diferentes modelos cinéticos es adecuado considerar la difusión del ion hidronio en la película de líquido a 20oC, en cambio a 30oC debe considerarse la difusión interpartícula y, además el llenado de microporos como etapa determinante en el proceso de adsorción, dado el alto coeficiente de correlación bilineal que corresponde al modelo de Bangham (MB). La situación a 40oC es más compleja a partir de este análisis ya que, además de considerar que la adsorción obedece a un modelo de seudoprimer orden, el elevado valor del coeficiente de correlación bilineal muestra la posibilidad de una reacción química según el modelo de Elovich, condicionado por una difusión en la película de líquido y una difusión intrapartícula, todo lo cual responde al aumento de la temperatura en el proceso adsortivo.
4. CONCLUSIONES
A partir de los valores de kads para las tres temperaturas: 0,143, 0,541 y 0,695 min-1 se puede establecer la dependencia ln kads vs 1/T y obtener el valor Ea = 1,59 kJ/mol. El factor pre-exponencial es de 5,72·1018 min-1.
El proceso de activación de la adsorción de iones hidronio es un proceso de naturaleza física, que conduce a una disminución del desorden del sistema.
El proceso de adsorción de iones hidronio posee bajo calor isostérico (0,19 kJ/mol) involucrado. El curso de la adsorción conduce a una disminución de energía libre tipo de adsorción.