INTRODUCCIÓN
Según La Organización de las Naciones Unidas (ONU), 13 millones de toneladas de plástico llegan a los mares de todo el mundo y se pronostica que en 2050 habrá más plástico que organismos marinos (Aldana-Aranda y col., 2022). Los modelos de riesgo indican un alto nivel total de plásticos para esta área y en particular macroplásticos, los que al fragmentarse originan micro y nanoplásticos (Tambutti y Gómez, 2022).
La ingestión de los microplásticos provoca desbalances de la microbiota intestinal e inflamación interna en los organismos marinos (Choi y col., 2018). La ingesta de estos y de macroplásticos ocasiona obstrucciones intestinales; y pueden transferirse a lo largo de la cadena trófica y junto a estos, otras sustancias tóxicas (Acosta-González y col., 2022). Los macroplásticos conducen a atrapamientos, enmallamientos y muerte de organismos marinos y otros del ecosistema (Baulch y Perry, 2014); proporciona nuevos hábitats, impactando a diversos ecosistemas (Anderson y col., 2016) y provoca la sofocación del fondo al reducir la penetración de la luz (Viehman y col., 2011).
Cinco de las siete especies conocidas de tortugas marinas se encuentran en la plataforma cubana. La tortuga verde (Chelonia mydas), la caguama (Caretta caretta) y el carey (Eretmochelys imbricata) anidan y se alimentan regularmente en esta (Moncada-Gavián y col., 2011). La mayor parte de la anidación se concentra en la costa sur, siendo la Península de Guanahacabibes una de las áreas de mayor actividad en su protección. Cada año se establecen campamentos para la investigación, protección y vigilancia tanto de las hembras como de los nidos y se liberan crías al mar (Moncada-Gavián y col., 2011). Según la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza, (IUCN, 2022), Chelonia mydas se halla “En Peligro”; Caretta caretta en estado “Vulnerable” y Eretmochelys imbricata en “Peligro Crítico”.
La iniciativa “Costas Limpias” del Parque Nacional Guanahacabibes (PNG), forma parte de su Plan de Manejo (Márquez-Llauger y col., 2013). Como parte de esta se ejecutó la presente investigación en la playa “El Holandés” con el objetivo de determinar el riesgo de impacto ecológico de basura recalada en la playa “El Holandés” del Parque Nacional Guanahacabibes sobre la biota animal.
MATERIALES Y MÉTODOS
En la Figura 1 se muestra la zona de investigación. La basura presente en la playa llega por recalo.
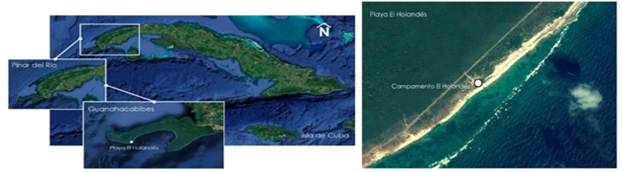
Figura 1 Ubicación geográfica y microlocalización de la playa “El Holandés”. Parque Nacional Guanahacabibes, Cuba. Fuente: Google Earth Pro, versión 7.1.8.3036. Servidor kh.google.com
2.1 Recolección, clasificación y conteo de la basura marina
El muestreo se realizó el 26 de marzo de 2023; habiéndose realizado la última recogida de basura del 15 al 19 de agosto de 2022. Se conformaron dos áreas de muestreo al este y dos al oeste del campamento base, mirando desde el mar. Cada una se definió tomando como referencia la línea de pleamar, en la que se midieron 100 m con una cinta métrica. Se determinaron las coordenadas y altura sobre el nivel del mar (m s.n.m.) de cada punto inicial y final con el empleo de un equipo GPS Garmin etrex Legend C. Se recolectó la basura detectada por observación visual que se encuentra a 1m a cada lado de la línea de pleamar, según el procedimiento de recolección por transeptos orientado en el Protocolo arenas SER (Proyecto PLASTIMARMED, 2023).
Además, se determinaron aspectos señalados en la aplicación MARNOBA 5.2.2 para móvil, tales como: Clima (intensidad y dirección del viento) y Mar (intensidad y dirección del oleaje), ambos por apreciación visual y seleccionando la opción cualitativa entre las propuestas dadas.
También se realizaron observaciones del entorno que pudieran explicar las posibles diferencias en el peso total de basura acopiada en bolsas de nylon de polietileno en cada área, el cual fue medido con una Balanza de bolsillo Salter, Model 3 Pocket.
Se contabilizó el número de piezas y fragmentos totales que se recolectaron en cada área, y según clasificación por material, posible función, y en el caso de los envases su posible fuente. Se contabilizaron las piezas de plástico o sus fragmentos con biota asociada. Además, se contabilizaron las piezas de plástico o sus fragmentos por color, según apreciación visual.
2.2 Riesgo del impacto de la basura marina en la biota del área de estudio
Se incluyeron las tortugas marinas que desovan cada año en el área, como principal organismo con riesgo de daño por la basura marina, no siendo la época de este proceso durante la recolección de basura realizada.
Se identificaron especies macroorganismos marinos y del ecosistema acuático, fotografiados durante la estancia. Para eso se contó con la colaboración de especialistas de Centro de Estudios y Servicios Ambientales de Villa Clara, Cuba (CESAM, VC). Se buscó información bibliográfica sobre los peces asociados al arrecife coralino.
RESULTADOS Y DISCUSIÓN
3.1 Recolección, clasificación y conteo de la basura marina
Las coordenadas de las áreas de muestreo se indican en la Tabla 1.
Tabla 1 Caracterización de las áreas de recolección de basura. Coordenadas y altura sobre el nivel del mar. Playa “El Holandés”, Península de Guanahacabibes, Cuba. 26/03/2023
| Área | Punto inicial | Punto final |
|---|---|---|
| HE1 | N 21° 49' 21,00" W 84° 46' 48,50"/8m | N 21° 49' 23,40" W 84° 46' 46,20"/9m |
| HE2 | N 21° 49' 25,50" W 84° 46' 43,80"/9m | N 21° 49' 27,90" W 84° 46' 41,20"/6m |
| HW1 | N 21° 49' 17,20" W 84° 46' 53,90"/4m | N 21° 49' 14,80" W 84° 46' 56,10"/6m |
| HW2 | N 21° 49' 11,20" W 84° 46' 1,00"/6m | N 21° 49' 09,40" W 84° 47' 0,41"/6m |
Las áreas son identificadas usando la letra H (por playa “El Holandés”), E o W (al este u oeste del campamento, mirando desde el mar) y números consecutivos al alejarse de este.
En todas las áreas, durante la recolección de basura, la intensidad del viento fue fuerte y en dirección sureste; así como la intensidad del oleaje media y su dirección sureste.
En las áreas ubicadas al este del campamento (HE1 y HE2) se observó una acumulación abundante de sargazo, conteniendo algunos restos de pasto marino; siendo menor en las ubicadas al oeste (HW1 y HW2). Una posible explicación es que, en determinadas condiciones ambientales, la marea sea más alta y al chocar con un farallón cercano a la línea de costa existente al oeste del campamento, arrastre parte de los residuos de vuelta al mar.
En el Plan de Manejo del PNG se refiere a Thalassia testudinum (Familia Hydrocharitaceae) como planta fanerógama que forma pastos marinos predominantes en la zona (Márquez-Llauger y col., 2013). Según los especialistas del CESAM, VC, esta es la planta observada. Torres-Conde y Martínez-Daranas, (2017) hallaron a esta especie en 20 de las 24 estaciones de muestreo establecidas en el PNG.
La presencia de nueve especies del género Sargassum se reporta como normal en el PNG, según Márquez-Llauger y col., (2013). A niveles habituales es beneficiosa, al ser hábitat y alimento para un gran número de especies marinas (Brooks y col., 2018) como las tortugas (Azanza-Ricardo y Pérez-Martín, 2016) y algunas especies costeras de peces (Hallett, 2011). Son trampas estabilizadoras de las arenas arrastradas por el viento (Colombini y col., 2003) y se descomponen liberando nutrientes influyendo positivamente a toda la pirámide trófica costera (Rodríguez-Martínez y col., 2016).
De acuerdo con Maurer y col., (2015), el sargazo ha proliferado fuera del Mar de los Sargazos, especialmente en el Golfo de México, al parecer influenciado por el aporte de nutrientes del río Amazonas (Gower y col., 2006). Se han reportado floraciones de sargazo en 2011 y 2015 en el Caribe y Cuba (Johnson y col., 2011; Azanza-Ricardo y Pérez-Martín, 2016). Según Azanza-Ricardo y col., (2023) su acumulación en las playas, afecta una anidación exitosa de las tortugas y que las crías lleguen al mar. Estos autores refieren la afluencia de Sargassum fluitans masiva en el PNG desde junio de 2015. Estas arribazones han sido referidas en el norte occidental de Cuba (Arencibia-Carballo, 2020); en Cienfuegos (Moreira y Alfonso, 2013) y Santiago de Cuba (Blanco-Ojeda y col., 2016).
En el PNG, se abren brechas a fin de que los animales adultos entren, depositen sus huevos y salgan; así como facilitar la salida de los neonatos. Este procedimiento es más apropiado que la retirada total de los depósitos de sargazo que conduce a la pérdida de volúmenes y superficies de playas y dunas (Roig-Munar y col., 2022).
Se observaron de restos de basura, en particular plástico, enredada en el pasto marino y sargazo, lo que es perjudicial para la macrobiota del área (Smith y col., 2016). En la Tabla 2 aparecen el peso, cuantificación y clasificación de basura por materiales.
Tabla 2 Peso total de basura recolectada en áreas de la playa “El Holandés” y número de piezas o sus fragmentos clasificados por material. Península de Guanahacabibes, Cuba. 26/03/2023
| Área | Peso total (kg) | Plástico | Vidrio | Textil | Metal | Madera | Total |
|---|---|---|---|---|---|---|---|
| HE1 | 3,5 | 257 | 0 | 1 | 0 | 0 | 258 |
| HE2 | 4,0 | 216 | 1 | 2 | 1 | 0 | 220 |
| HW1 | 1,0 | 87 | 0 | 0 | 0 | 0 | 87 |
| HW2 | 2,0 | 56 | 2 | 0 | 2 | 0 | 60 |
| Total | 10,5 | 616 | 3 | 3 | 3 | 0 | 625 |
Las áreas son identificadas usando la letra H (por playa “El Holandés”), E o W (al este u oeste del campamento, mirando desde mar) y números consecutivos al alejarse de este.
El fragmento de textil hallado en el área HE1 es parte de un calzado y los del área HE2 fueron dos fragmentos de bolsas. En ambos casos, ligeros. El de vidrio encontrado en la primera es de un tamaño pequeño; en la segunda se halló un bulbo de un medicamento, con su retapa metálica de seguridad. Los dos fragmentos de metal que estaban en el área HW2 fueron tapas de dos frascos (dos botellas de vidrio que pesaron 0,9 kg). Se llegó a igual conclusión a la referida para explicar la menor cantidad de pasto marino y sargazo en el oeste del campamento. En la Tabla 3, se muestran los resultados de la cuantificación y posibles funciones de las piezas de material plástico en cada área.
Tabla 3 Número de piezas plásticas o sus fragmentos recolectados en áreas de la playa “El Holandés” y sus posibles funciones. Península de Guanahacabibes, Cuba. 26/03/2023
| Clasificación | HE1 | HE2 | HW1 | HW2 | Total |
|---|---|---|---|---|---|
| Envases | 34 | 48 | 12 | 11 | 105 |
| Tapas | 93 | 84 | 13 | 16 | 206 |
| Calzado o sus restos | 8 | 7 | 3 | 4 | 22 |
| Fragmentos de cuerdas | 3 | 5 | 5 | 3 | 16 |
| Restos de nylon | 23 | 14 | 6 | 3 | 46 |
| Fragmentos de espuma de goma | 11 | 3 | 9 | 6 | 29 |
| Fragmentos de juguetes | 2 | 0 | 0 | 0 | 2 |
| Restos de tuberías | 1 | 2 | 0 | 0 | 3 |
| Fragmentos de lapiceros | 0 | 1 | 1 | 0 | 2 |
| Palitos de chupa chupa | 1 | 2 | 1 | 0 | 4 |
| Juntas | 0 | 1 | 1 | 0 | 2 |
| Restos de útiles del hogar | 8 | 10 | 5 | 3 | 26 |
| Tornillos | 0 | 1 | 0 | 0 | 1 |
| Carretes para cuerda de pescar | 0 | 3 | 0 | 0 | 3 |
| Asociados a la salud | 3 | 5 | 2 | 0 | 10 |
| No identificados | 70 | 30 | 29 | 10 | 139 |
| Total | 257 | 216 | 87 | 56 | 616 |
Las áreas son identificadas usando la letra H (por playa “El Holandés”), E o W (al este u oeste del campamento, mirando desde el mar) y números consecutivos al alejarse de este.
Los útiles del hogar hallados fueron cubiertos, fosforeras, una horquilla (palito de tendedera) y un fragmento de lo que parece ser una mecedora para bebé. Asociados a la salud, una jeringuilla. Aquellos cuya función no fue identificada se fragmentaron dando lugar a micro y nanoplásticos. En la Tabla 4 aparece el color de las piezas o fragmentos hallados.
Tabla 4 Número de piezas plásticas o sus fragmentos recolectados en áreas de la playa “El Holandés” y su color. Península de Guanahacabibes, Cuba. 26/03/2023.
| Color | HE1 | HE2 | HW1 | HW2 | Total |
|---|---|---|---|---|---|
| Azul | 66 | 60 | 21 | 12 | 159 |
| Rojo | 21 | 19 | 2 | 4 | 46 |
| Blanco | 84 | 62 | 29 | 16 | 191 |
| Verde | 19 | 10 | 5 | 1 | 35 |
| Negro | 16 | 21 | 1 | 2 | 40 |
| Rosado | 2 | 3 | 4 | 3 | 12 |
| Amarillo | 10 | 8 | 4 | 3 | 25 |
| Violeta | 5 | 2 | 1 | 0 | 8 |
| Gris | 0 | 0 | 1 | 0 | 1 |
| Transparente | 34 | 31 | 19 | 15 | 99 |
| Total | 257 | 216 | 87 | 56 | 616 |
Las áreas son identificadas usando la letra H (por playa “El Holandés”), E o W (al este u oeste del campamento, mirando desde el mar) y números consecutivos al alejarse de este.
En la Tabla 5 aparece la clasificación de los envases según su posible fuente.
Tabla 5 Número de envases plásticos o sus fragmentos y su posible fuente, recolectados en áreas de la playa “El Holandés”. Península de Guanahacabibes, Cuba. 26/03/2023
| Envases | HE1 | HE2 | HW1 | HW2 | Total |
|---|---|---|---|---|---|
| Asociados a la industria alimentaria | 6 | 18 | 4 | 5 | 33 |
| Lubricantes | 0 | 1 | 1 | 0 | 2 |
| Envases asociados al sector de la salud | 3 | 5 | 0 | 0 | 8 |
| Cosméticos | 1 | 1 | 0 | 0 | 2 |
| Asociados a la limpieza | 1 | 3 | 3 | 1 | 8 |
| Asociados a la higiene personal | 1 | 3 | 1 | 2 | 7 |
| No identificado | 22 | 17 | 3 | 3 | 45 |
| Total | 34 | 48 | 12 | 11 | 105 |
Las áreas son identificadas usando la letra H (por playa “El Holandés”), E o W (al este u oeste del campamento, mirando desde el mar) y números consecutivos al alejarse de este.
Entre los envases asociados a la industria alimentaria predominan los de bebidas y frascos pequeños de salsas que suelen usarse en el servicio en cubiertas de embarcaciones. Los dedicados a la limpieza fueron de hipoclorito y a la higiene personal desodorantes. Los residuos de cosméticos fueron envases de un shampoo y una crema. Por último, los envases asociados al sector de la salud fueron: portadores de amalgama de uso estomatológico, envases de semisólidos y un bulbo de un medicamento inyectable.
Se hallaron seis piezas de plástico con biota asociada, observándose en cinco, tubos de poliquetos (Clase Polychaeta, Phyllum Annelida). Estos son alimento de otros invertebrados y de aves migratorias y peces (Elías y col., 2021). En una pieza se encontraba vivo en espécimen del Phyllum Mollusca. Se han registrado más de 335 grupos diferentes en plásticos marinos (Kiessling y col., 2015).
3.2 Riesgo del impacto de la basura marina en la biota del área de estudio
El enmallamiento en basura plástica altera el comportamiento y la flotabilidad de las tortugas marinas, favorece la malnutrición, una reducción de las tasas de crecimiento y un aumento de la mortalidad (Santos y col., 2015). Los restos plásticos ingeridos se acumulan en su sistema digestivo (Eastman y col., 2020), conduciendo al ahogamiento, obstrucción y perforación intestinal (Colferai y col., 2017).
Las tortugas marinas ingieren residuos plásticos que confunden con sus alimentos. Por ejemplo, la caguama y la tortuga verde consumen basura flotante que confunden con medusas. Los colores encontrados con mayor frecuencia en su sistema gastrointestinal son los transparentes, blancos, azules y negros (Maldonado-Saldaña y col., 2022).
Según López-Martínez y col., (2021) el proceso de clasificación del color es subjetivo por lo que recomiendan el uso de paletas estandarizadas de color. Además, estos autores mencionan el empleo de programas computacionales para definir con mayor precisión el color, según recomiendan Marti y col., (2020).
Se identificó la presencia frecuente de Calidris alba (zarapico blanco), Arenaria interpres (revuelvepiedras) y Pelecanus occidentalis (pelícano o alcatraz). Las tres se citan en el listado de especies presentes en el PNG por Márquez-Llauger y col., (2013). El pelícano se reporta como “Abundante” y las otras dos como “Poco abundantes”. En opinión de los autores del presente artículo científico, el principal impacto de la basura que llega a la playa es la ingesta o entrampamiento de los picos.
Por último, existe una lista de especies de peces asociadas fundamentalmente al arrecife coralino, inventariadas hasta los 20 m de profundidad en el Parque Nacional Guanahacabibes, compuesta por 201 especies pertenecientes a 101 géneros y 50 familias, las que también son vulnerables al efecto negativo de la presencia de basura en el área (Cobián-Rojas y col., 2012).
CONCLUSIONES
La basura presente en la playa constituye un riesgo para la vida de las tortugas marinas, aves y peces presentes en la zona; por lo que es preciso mantener e incrementar su recogida sistemática.
Se cuenta con un referente de cantidad de piezas y fragmentos de basura en la playa “El Holandés” del PNG, clasificados según material, posible función y color; lo que constituye una línea base de comparación para futuros muestreos.
La basura recala preferentemente en el área ubicada en la zona este del campamento.
La presencia de sargazo es también motivo de preocupación y ocupación, porque contribuye al arrastre de basura proveniente del mar y debido a su impacto en la entrada y salida de las tortugas marinas.














