Introducción
El Nimotuzumab es un anticuerpo monoclonal (AcM) humanizado que bloquea la unión de los dos ligandos principales: el factor de crecimiento epidérmico (EGF) y el factor de crecimiento transformante alfa (TGF-α) al receptor del EGF-R (EGF-R) y por tanto, inhibe el crecimiento de células tumorales de origen epitelial in vitro e in vivo y posee efecto anti-angiogénico, anti-proliferativo y pro-apoptótico en aquellos tumores que sobre expresan el receptor.1 Este AcM se produce en el Centro de Inmunología Molecular (CIM) en Cuba desde el año 1997 2 y se comercializa como CIMAher®, TheraCIM h-R3®, Theraloc® en varios países del mundo.
En la industria biofarmacéutica los productos obtenidos por métodos de recombinación genética exigen la disponibilidad de Materiales de Referencia (MR) confiables que permitan el control de la calidad y aseguramiento de las producciones de dichos medicamentos. Los MR constituyen medios para evaluar cuantitativa y cualitativamente diferentes características de la composición y desempeño de ingredientes farmacéuticos activos, compuestos relacionados, productos de degradación, materias primas y formas farmacéuticas, y establecen la trazabilidad del resultado obtenido o la asignación del valor de la muestra de ensayo.3,4
Los MR deben tener valores certificados trazables al Sistema Internacional de Unidades (SI) y ser adecuados para el uso específico para el que fueron concebidos. Deben reunir requisitos indispensables como: ser suficientemente homogéneos; estables por un espacio de tiempo aceptable bajo condiciones de almacenamiento, transportación y uso; estar constituidos por matrices similares a la de las muestras. Por último, requieren de una rigurosa caracterización que permita establecer el valor real de la propiedad de interés y su intervalo de incertidumbre.5 Su certificación consta de cuatro componentes fundamentales: una cuidadosa preparación y envasado del material, las pruebas de homogeneidad utilizando un diseño optimizado para dar una prueba positiva, las pruebas de estabilidad y la asignación de valor de la característica al lote candidato a MR.6
Debido al elevado precio en el mercado mundial de los Materiales de Referencia Internacionales o Certificados (MRC), su escasez y la insuficiente disponibilidad de reactivos comerciales, se hace necesario establecer en Cuba un programa para el desarrollo de MR propios, al alcance de los laboratorios de control de la calidad y en las cantidades requeridas para su uso de rutina. Entre las fortalezas para implementar este programa, se encuentran la prioridad que otorga el Estado cubano a los problemas de la industria farmacéutica, el disponer de recursos humanos competentes para desarrollarlos y la existencia de una regulación relacionada con su elaboración y certificación para medicamentos (CECMED).7 Recientemente, el CIM creó un Grupo que tienen como objetivo central implementar un programa para la elaboración y certificación de MR de alta confiabilidad y calidad.8 Adicionalmente, se elaboran nuevos lotes para sustituir los vigentes con tiempo suficiente antes del agotamiento y caducidad de los existentes. Es de suma importancia establecer una comparación de los resultados obtenidos en la caracterización de los MR con los brindados por otros laboratorios nacionales, internacionales o propios de la institución que lo acredita, para así asegurar una correcta trazabilidad e incertidumbre en las mediciones.9,10
El presente trabajo tiene como objetivo realizar una caracterización conformacional, mediante dicroísmo circular (CD) y espectroscopía de emisión de fluorescencia. Se comparará el nuevo candidato a material de referencia de trabajo químico-físico y biológico MRT (QFB) hR3/1906 para el Nimotuzumab con el MRT (QFB) hR3/1605 (vigente hasta abril del 2020).
Materiales y métodos
Anticuerpos monoclonales
El Nimotuzumabes una inmunoglobulina (Ig) que pertenece a la subclase de IgG1 con un peso molecular de 150 kDa y se produce mediante cultivo de células de mieloma murino no secretoras (NSO/H7) 1, cepa recombinante adaptada a crecer en medio libre de suero. Se encuentra formulado como una solución estéril, transparente, en un volumen de 10 mL de tampón salino. Cada bulbo contiene 50 mg del CIMAher, 4,5 mg de fosfato de sodio monobásico, 18,0 mg de fosfato de sodio dibásico, 86,0 mg de cloruro de sodio, 2,0 mg de polisorbato 80 y agua para inyección en cantidad suficiente para completar 10 mL. Las muestras evaluadas fueron:
Medición de la concentración de proteínas por Espectrofotometría
Para la realización de los ensayos correspondientes a dicroísmo circular y fluorescencia fue necesario medir la concentración de proteínas en las muestras en varios momentos.
La concentración de proteínas se determinó mediante la lectura de absorbancia a 280 nm. Se utilizó un espectrofotómetro de doble haz modelo Jasco V-730 (Jasco Corporation, Japón) y cubetas de cuarzo de 1 cm de paso óptico. Los espectros se analizaron con el programa Spectra Analysis contenido en el software Spectra Manager v2 y la concentración de proteínas fue calculada de la siguiente forma:
Ecuación 1: Concentración (mg/mL) = Absorbancia 280 nm x 1/ξ x dilución;
donde:
1/ξ (hr3): inverso del coeficiente de extinción molar del AcMNimotuzumab (0,712).
Dicroísmo circular
Los espectros de CD-UV lejano (190-250 nm) y CD-UV cercano (250-350 nm) fueron medidos en un espectropolarímetro Jasco J-1500 (Jasco Corporation, Japón) previamente calibrado con ácido d-10-camforsulfónico, equipado con controlador de temperatura Jasco PTC-510 Peltier y mini-baño de circulación de agua Jasco MCB-100. Los registros de los espectros se midieron con un ancho de banda de 1 nm y 0,1 nm de intervalos. En la tabla 1 se mencionan las condiciones adicionales que se emplearon en cada caso.
Tabla 1 Condiciones empleadas para realizar las mediciones por CD en el UV-lejano y UV-cercano.
| Aspectos | CD-UV lejano | CD-UV cercano |
| Concentración de proteínas (mg/ml) | 0,1 | 1,25 |
| Cubetas de cuarzo (paso óptico, cm) | 0,1 | 1 |
| Línea Base | agua bidestilada | tampón de formulación |
| Número de acumulaciones | 15 | 3 |
| Tiempo de respuesta (segundos) | 1 | 16 |
| Velocidad de escaneo (nm/min) | 100 | 10 |
Para realizar las mediciones tanto del CD-UV lejano como del CD-UV cercano, se escogió un bulbo al azar del candidato a MRT (QFB) hR3/1906 y otro del MRT (QFB) hR3/1605, dividiendo cada bulbo en tres réplicas para posteriormente obtener su promedio.
En el caso del CD-UV lejano, las muestras para estudiar fueron desaladas antes de realizar la medición, se cambió de fosfato de sodio/NaCl (tampón de formulación) a agua bidestilada. Este procedimiento se efectuó en columnas PD-10 conservadas en alcohol al 20%.
Las lecturas de elipticidad para cada longitud de onda (θλ) fueron presentadas como elipticidad molar media por residuo [θ]λ de acuerdo con la siguiente ecuación:
Ecuación 2: [θ]λ = 100 θλ / C n L;
donde:
θλ es la elipticidad (en mdeg);
n es el número de residuos de aminoácidos;
C concentración de proteína (en mmol/L) y
L paso óptico (en cm). El valor de [θ]λ está expresado en deg.cm2.dmol-1.
El contenido de estructura secundaria de las proteínas fue estimado por el análisis de la deconvolución de los espectros obtenidos del CD-UV lejano, de acuerdo con el algoritmo CONTIN-LL, usando la base de datos de proteínas de referencia SP175 en el servidor Dichroweb. Para analizar los resultados obtenidos en las mediciones de CD-UV lejano y CD-UV cercano se utilizó el programa Origin-v8.0 (OriginLabCorporation, EUA).
Temperatura de desnaturalización térmica por dicroísmo circular
La temperatura de fusión (Tm, del inglés meltingtemperature) de desnaturalización térmica fue determinada por la variación del valor de absorbancia en el espectro de CD-UV lejano a 208 nm con incrementos de la temperatura. El rango de temperatura de 25-85 0C fue generado con un controlador de temperatura Jasco PTC-510 Peltier y mini-baño de circulación de agua Jasco MCB-100 en intervalos de 1oC. Se utilizó un espectropolarímetro Jasco J-1500 (Jasco Corporation, Japón) previamente calibrado con ácido d-10-camforsulfónico, a velocidad constante de 100 nm/min con 1 s de tiempo de respuesta, a intervalos de 0,1 nm, ancho de banda de 1 nm y 15 acumulaciones empleando una cubeta de cuarzo de 0,1 cm de paso óptico. La concentración de proteínas fue de 0,1 mg/ml para ambos MRT. Para realizar las mediciones se escogió un bulbo al azar del candidato a MRT (QFB) hR3/1906 y otro del MRT (QFB) hR3/1605, dividiendo cada bulbo en tres réplicas para posteriormente obtener su promedio. La línea base fue corregida en todos los experimentos usando como referencia el agua bidestilada.
Las curvas de transición fueron normalizadas para la fracción de la proteína plegada usando el programa Origin-v8.0 (OriginLabCorporation, EUA) por la ecuación estándar:
Ecuación 3: (% CD-desnaturalización= ((θ25- θ temp) / (θ25- θ85))*100);
donde:
θ25 y θ85 representan los valores de la elipticidad para las especies completamente plegadas y desplegadas, respectivamente;
θ temp representa la elipticidad observada a 208 nm.
Los valores de Tm fueron calculados como la temperatura a la cual se observa el máximo de la primera derivada del porcentaje de cambio de elipticidad a una longitud de onda de 208 nm contra la temperatura. Esta estimación se realizó mediante un ajuste no lineal por el método de Boltzmann, donde el valor del punto de inflexión de la curva se corresponde con el valor de Tm.
Espectroscopia de emisión de fluorescencia
Los espectros de fluorescencia se registraron en un espectropolarímetro Jasco-1500 (Jasco Corporation, Japón) equipado con un monocromador de fluorescencia Jasco FMO 522 (detector de fluorescencia Jasco FDT-538), controlador de temperatura Jasco PTC-510 Peltier y mini-baño de circulación de agua Jasco MCB-100. Los espectros de emisión de fluorescencia intrínseca de proteínas se midieron en el intervalo de 300-450 nm, cada 1 nm, con 1 s de tiempo de respuesta y 1 acumulación. La excitación de las muestras se realizó a 275 nm para obtener espectros de fluorescencia derivados de los residuos de Tyr/Trp y a 295 nm con el objetivo de lograr la señal exclusiva de los Trp. Se utilizó un ancho de banda de 5 y 10 nm para la excitación y emisión, respectivamente. La concentración de proteína usada fue de 0,15 mg/mL, usando cubetas de cuarzo de 1 cm de paso óptico. La línea base fue corregida en todos los experimentos usando solución de formulación sin proteínas propia del CIM.
Resultados y discusión
Espectroscopia de dicroísmo circular en el UV-lejano
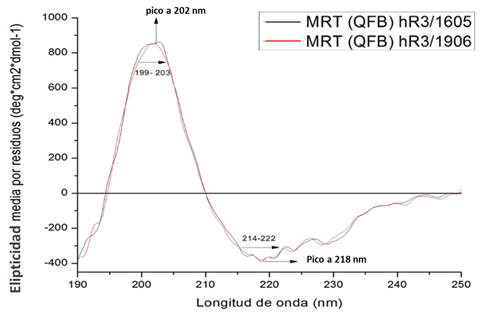
Una vez obtenidos los AcM en agua bidestilada, se procedió a la determinación de la estructura secundaria a partir del análisis de los espectros de CD UV lejano (190-250 nm). En la figura 1 se muestran los espectros de CD expresados en elipticidad media por residuo (deg.cm2.dmol-1) en función de la longitud de onda (nm) del nuevo candidato a MRT (QFB) hR3/1906 y del MRT (QFB) hR3/1605.
El comportamiento de los espectros en el UV-lejano de ambos MRT es muy similar. Se observó una banda positiva entre 199 y 203 nm, con un pico máximo a 202 nm y una banda negativa alrededor de los 214 y 222 nm, con un pico mínimo a 218 nm típico de proteínas estructuradas básicamente en hoja-β.11,12 La semejanza espectral observada entre ambos lotes del MRT, indica que existe una similitud en las composiciones de estructuras secundarias de ambas moléculas.
El contenido de estructura secundaria para ambas moléculas se determinado mediante el servidor Dichroweb, con el algoritmo CONTIN-LL. La tabla 2 muestra el porcentaje de estructuras de hélices α, hojas β y estructuras desordenadas para ambos lotes de MRT.
Tabla 2 Porcentajes de estructuras secundarias del nuevo candidato a MRT (QFB) hR3 1906 y del MRT (QFB) hR3 1605 analizados por Dicroweb.
| Estructuras secundarias (%) | MRT (QFB) hR3/1906 | MRT (QFB) hR3/1605 |
| Helices-α | 6,8 | 6,7 |
| Hojas-β | 42,1 | 42,2 |
| Estructuras desordenadas | 39,5 | 39,5 |
| Giros | 11,6 | 11,6 |
| Nrmsd | 0,09 | 0,17 |
Como se puede observar en la tabla 2 para ambos MRT, los valores de Nrmsd fueron menores que 0,20 y próximos a 0,1; lo cual confirma la calidad y validez del procedimiento de análisis según las indicaciones del servidor.13 El porcentaje de estructuras secundarias resultó similar en ambos lotes de MRT, predominando las hojas β (42 % aproximadamente) (tabla 2). Este valor está en correspondencia con los resultados de Paul y col.14, quienes monitorearon la estructura secundaria del AcMRituximab e identificaron un 49 % de hojas β. En la literatura se manifiesta que los AcM se caracterizan por la predominancia de hojas β.15,17
Espectroscopia de dicroísmo circular en el UV- cercano
La información de la estructura terciaria de los anticuerpos se analizó en el UV cercano, de 250-360 nm, figura 2.
El MRT (QFB) hR3 1906 y el MRT (QFB) hR3 1605 mostraron un plegamiento tridimensional similar, con la aparición de las señales de absorción correspondientes a los residuos aromáticos. Las bandas entre 255-272 nm se corresponden con la zona de absorción de Phe, de 275-282 nm con los residuos de Tyr y entre 290-305 nm se observa un máximo de absorción correspondiente a los Trp. Estas características reflejan la estructura nativa de la molécula de AcM y su plegamiento tridimensional.
La intensidad de la señal de absorción de la Tyr y Trp fue muy similar para ambos MRT, mientras que se observaron pequeñas diferencias en la intensidad de las bandas en la región del espectro correspondiente a los residuos de Phe (255-272 nm). Las posiciones e intensidades relativas de las bandas dependen fundamentalmente del número de residuos aromáticos y de las Cys, del grado de movilidad de esos residuos, de su proximidad (< 1nm) y de la naturaleza del microentorno de los mismos.
Esta diferencia observada en los espectros de ambos MRT puede ser el resultado del tiempo de uso y conservación a 4oC del MRT (QFB) hR3/1605, que pudo haber provocado un ligero cambio conformacional en la molécula de AcM y por ende en el microentorno de los aminoácidos aromáticos.18 Este ligero cambio conformacional no afectó la actividad ni las propiedades químico-físicas y biológicas de la molécula de AcM según estudios de estabilidad realizados a los 36 meses de producido el MR.19-20 Pérez y col. 21 evaluaron la estructura terciaria de un nuevo candidato a AcM anti-HER2 biosimilar del Trastuzumab por CD-UV cercano y obtuvieron resultados similares a los obtenidos en este caso.
Espectroscopia de emisión de fluorescencia
Las características conformacionales de ambos MRT se determinaron por emisión de fluorescencia en el intervalo de longitudes de onda de 300-450 nm, tras la excitación selectiva de los residuos de Trp a 295 nm y de Tyr a 275 nm. La figura 3 muestra los espectros de emisión de fluorescencia normalizados y expresados en intensidad de fluorescencia en unidades arbitrarias en función de la longitud de onda (nm) de ambos MRT a 275 y 295 nm respectivamente.
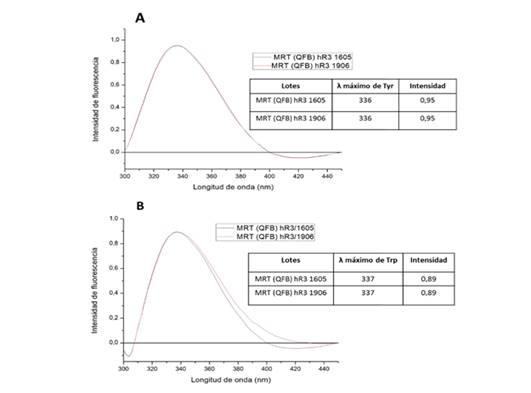
Fig. 3 Espectros de emisión de fluorescencia molecular del MRT (QFB) hR3 1605 y del nuevo candidato a MRT (QFB) hR3 1906. A) Excitación de los residuos de Tyr a 275 nm. B) Excitación de los residuos de Trp a 295 nm
En la figura 3A se observa que tras la excitación a 275 nm de los residuos de Tyr, el espectro de emisión está dominado por el del Trp. Esto se debe al hecho de que la sensibilidad del Trp es mayor, así como a la transferencia de energía desde las Tyr a los Trp debido al solapamiento que ocurre entre el espectro de emisión del primero y el de absorción del segundo. La longitud de onda de los máximos de emisión fue de 336 nm.
La figura 3B muestra casi exclusivamente el espectro de emisión fluorescente correspondiente a los residuos de Trp ya que se excitó a 295 nm que constituye una longitud de onda a la cual la Tyr absorbe muy poco. La longitud de onda de los máximos de emisión fue de 337 nm.
Ambos MRT tienen igual intensidad de emisión de fluorescencia tanto a 275 como a 295 nm. Los espectros mostraron similitud en cuanto a la longitud de onda de los máximos de emisión de los residuos de Tyr y Trp, con aproximadamente 336 y 337 nm respectivamente. Lo anterior demuestra que no existe una gran diferencia en el entorno conformacional de estos aminoácidos dentro de la conformación proteica de ambos MRT y que los residuos de Trp se encuentra en regiones de la molécula con entornos muy apolares, enterrados dentro de la estructura globular de la proteína. El medio de la solución donde se midió la fluorescencia es polar. Pérez y col. 21 evaluaron la estructura terciaria de un nuevo candidato a AcM anti-HER2 biosimilar del Trastuzumab por CD-UV cercano y obtuvieron resultados similares a los obtenidos en el presente trabajo.
Estudio de estabilidad termodinámica mediante CD-UV lejano
La estabilidad térmica de los anticuerpos ha sido ampliamente estudiada mediante CD-UV lejano y se ha comprobado que con determinados aumentos de temperatura se afecta su estructura secundaria 22, lo que se manifiesta en cambios de elipticidad en el rango de longitudes de onda de 202 a 222 nm. Por ello, seleccionado una longitud de onda comprendida en ese rango 23,24, es posible monitorear cambios específicos a nivel de la estructura secundaria de la proteína continuamente, a medida que la temperatura aumenta.
En este trabajo, la estabilidad térmica de ambos MRT se determinó a partir de los espectros de CD en la región del UV lejano a 208 nm para un rango de temperatura de 25-85 0C, con intervalos de 10C. Se calcularon los valores de Tm, monitoreando la desnaturalización térmica a esa misma longitud de onda. Las curvas de transición fueron normalizadas para la fracción de la proteína plegada por la ecuación 3. En la figura 4 se muestran las curvas de desnaturalización térmica de ambos lotes de MRT, donde se representa el porcentaje de desnaturalización en función de la temperatura (0C).

Fig. 4 Curva de desnaturalización térmica para el nuevo candidato a MRT (QFB) hR3/1906 y el MRT (QFB) hR3/1605 a 208 nm. La Tm y el coeficiente de regresión (R2) se muestran en la tabla insertada
Las curvas de desnaturalización térmica de ambos lotes de MRT analizados muestran el mismo comportamiento (figura 4). Los valores de Tm fueron análogos para ambos MRT, con una temperatura de desnaturalización de 70,90C y un R2 = 0,98 % para el MRT (QFB) hR3/1906 y de 70,7 0C y un R2 = 0,97 % para el MRT (QFB) hR3/1605, indicando un plegamiento muy parecido y similar estabilidad térmica, a pesar de que difieren en 4 años de elaboración.
Liu y col. 25 obtuvieron valores de Tm similares (aproximadamente 71 0C) para el biosimilar ABP 501 del Adalimumab y dos productos de referencia del mismo AcM, lo cual fue indicativo de propiedades termodinámicas análogas.
Conclusiones
La estructura secundaria predominante para ambos MRT fue principalmente hojas ?, con un contenido aproximado del 42 %. La estructura terciaria de ambos MRT (QFB) fue análoga, mostrando un plegamiento tridimensional asociado a la absorción de los residuos aromáticos presentes en la molécula. En cuanto a la intensidad y la emisión de fluorescencia ambos MRT mostraron comportamientos similares. Por otra parte, ambos MRT evidenciaron, una estabilidad térmica muy similar (~ 71 o C) de acuerdo a los resultados obtenidos mediante el CD-UV lejano, lo que demuestra un plegamiento análogo. Cabe destacar la excelente trazabilidad que muestra el nuevo MRT (QFB) hR3 1906, con respecto a su antecesor MRT (QFB) hR3 1605 en cuanto a las características estructurales de ambos, incluyendo la calidad del MRT (QFB) hR3 1605 que ha demostrado mantener sus propiedades conformacionales después de más de 3 años de vida útil