Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Vaccimonitor
versión impresa ISSN 1025-028X
Vaccimonitor vol.21 no.2 Ciudad de la Habana mayo-ago. 2012
ARTÍCULO ORIGINAL
Cromatografía de exclusión molecular como metodología para la purificación de bacteriófagos
Molecular exclusion chromatography as methodology for the purification of bacteriophages
Frank Camacho,1* Yaquelín Puchades, 2 Alicia Aguilar, 1 Nevis Amín, 1 Ariana García,2 Oscar Otero,1 Nelson Santiago Vispo2
1 Dirección de Investigaciones, Instituto Finlay. Centro de Investigación-Desarrollo-Producción de Vacunas. Ave. 27 No. 19805, La Lisa. AP. 16017 Cod. 11600. La Lisa, La Habana, Cuba
2 Division de Investigaciones Farmacéuticas, Centro de Ingeniería Genética y Biotecnología, Cuba. P.O. Box 6162, Cubanacán, Playa, Ciudad de La Habana, Cuba
email:fcamacho@finlay.edu.cu
* Licenciado en Bioquímica, Investigador Agregado
RESUMEN
La cromatografía de exclusión molecular puede ser usada para purificar fagos filamentosos, el virus bacteriano más usado en la tecnología de presentación de péptidos y proteínas en la superficie de los fagos. El bacteriófago, luego de ser precipitado del sobrenadante de cultivo con polietilenglicol, fue aplicado a una columna de Sepharose CL-4B de 100 cm de altura, usando como fase móvil solución tampón fosfato (PBS). Se obtuvo un 61,3% de recobrado del fago total aplicado y, mediante el análisis por SDS-PAGE, se verificó la pureza de estas preparaciones. La cromatografía de exclusión molecular es una metodología atractiva para la obtención de preparaciones de bacteriófagos con alta pureza.
Palabras clave: Cromatografía, bacteriófago, péptidos, proteínas.
ABSTRACT
Molecular exclusion chromatography can be used to purify filamentous phages which are the most commonly used virus in phage display technology of peptides and proteins. Bacteriophages were precipitated from culture supernatant using polyethylene glycol and they were loaded in a 100 cm high CL-4B Sepharose matrix using phosphate buffer as mobile phase. We recovered 61.3% of total phage loaded. SDS-PAGE analysis showed a high purity of these preparations. Molecular exclusion chromatography is an attractive alternative method for purifying filamentous phages.
Keywords : Cromatography, bacteriophages, peptides, proteins.
INTRODUCCIÓN
La tecnología de presentación de péptidos y proteínas en la superficie de los bacteriófagos (phage display technology) es una poderosa herramienta para el descubrimiento de ligandos con propiedades de unión específicas a una molécula blanco de interés (1, 2). Esta tecnología puede generar un número grande de ligandos con propiedades novedosas para uso analítico o farmacéutico (3-5).
Los bacteriófagos Ff (M13, fd, f1) son partículas virales de aspecto filamentoso con una masa molecular de 12 x106 Da. Estos virus presentan una cubierta proteica de alrededor de 6,5 nm de diámetro y 900 nm de largo, formada por, aproximadamente, 2 700 copias de las proteínas mayoritarias PVIII y cinco copias de cada una de las proteínas minoritarias que se agrupan PIII y PVI en un extremo y PVII y PIX en el otro. La partícula viral no contiene lípidos ni carbohidratos (6).
La técnica estándar para la purificación de bacteriófagos filamentosos es la doble precipitación con polietilenglicol (PEG), con una masa molecular de 8000 Da (7). Este método, debido a su poca resolución, provoca que las purificaciones estén contaminadas con proteínas del hospedero (8) y trazas de PEG, las que pueden interferir con la unión de los fagos a sus blancos (9).
Para obtener preparaciones de bacteriófagos altamente purificados se incluye un paso final de ultracentrifugación en gradiente de densidad CsCl. No obstante, este procedimiento es muy trabajoso, costoso, y tampoco logra eliminar todo el material contaminante (9, 10). Recientemente se han descrito métodos alternativos para la purificación de virus y bacteriófagos ë, que logran superar las principales desventajas asociadas con la ultracentrifugación (9, 10).
La cromatografía de exclusión molecular para la purificación de fagos, empleando una resina Sephacryl S-500, fue reportada por Zakharova y cols (10). En este trabajo se aplicó dicha estrategia utilizando una matriz de Sepharose CL-4B para purificar los fagos filamentosos, tipo M13, teniendo en cuenta la necesidad en nuestro laboratorio de obtener preparaciones libres de contaminantes para ser utilizados como inmunógeno.
MATERIALES Y MÉTODOS
Purificación de bacteriófagos por precipitacion con PEG 8000
El sobrenadante (300 mL) de cultivo de la cepa de Escherichia coli TG1 infectada con los fagos se precipitó con 1/4 de volumen de una solución de PEG 8000, 20%/ NaCl 2,5M, se incubó durante 1 h a 4ºC. A continuación se centrifugó a 10.000 rpm durante 30 min a 4 ºC en una centrífuga Beckman en el rotor JA-18. El precipitado se resuspendió en 20 mL de solución tampón fosfato y se le adicionó 5 mL de PEG 8000. Luego de incubar durante 1 h a 4ºC, se centrifugó a 10.000 rpm por 30 min a 4 ºC en una centrífuga Beckman en el rotor JA-18. El precipitado se resuspendió en 1 mL de PBS. Para determinar las unidades formadoras de colonias (u.f.c) se utilizó una alícuota de 20 µL de la suspensión final (11).
Purificación de bacteriófagos por cromatografía de exclusión molecular
Una preparación de 3 x 1013ufc/mL en 1 mL de PBS se aplicó a una columna XK16/100 (1,6 x 100 cm), empaquetada con 135 mL de Sepharose CL-4B, equilibrada con PBS, a un flujo de 0,4 mL/min, una sensibilidad de 0,5 unidades de absorbancia (UA) a 280 nm y con una velocidad del papel de 2,5 mm/min, utilizando un sistema Gradifrac (Amersham Pharmacia Biotech, Alemania). Los picos de elución se colectaron en fracciones de 2 mL. Todo el proceso cromatográfico se realizó a temperatura ambiente y fue repetido tres veces.
Titulación de fagos
A las fracciones se les realizó diluciones seriadas 1:10 en 100 µL de medio de cultivo Luria Bertani (LB). Posteriormente se añadió a cada dilución 90 µL de células de E. coli TG1 crecidas a 37°C hasta una absorbancia (A 600 ) de 0,5. Esta mezcla se incubó durante 30 min a 37°C. Luego las células se sembraron en medio LB sólido. El título de las preparaciones de fagos se expresó como u.f.c/mL.
Electroforesis en gel de poliacrilamida en presencia de dodecilsulfato de sodio (PAGE-SDS)
Una alícuota de 1010u.f.c de cada suspensión de fagos filamentosos fue tratada con solución muestra reductora y se empleó el patrón de bajo peso molecular de proteínas (Biorad). La separación electroforética se realizó en un gel al 12% de PAGE-SDS, como describe Laemmli (12). El gel fue revelado utilizando la tinción con azul de Coomassie específico para proteínas, durante 1 h y desteñido hasta eliminar totalmente la coloración de fondo.
Inmunodetección de fagos purificados
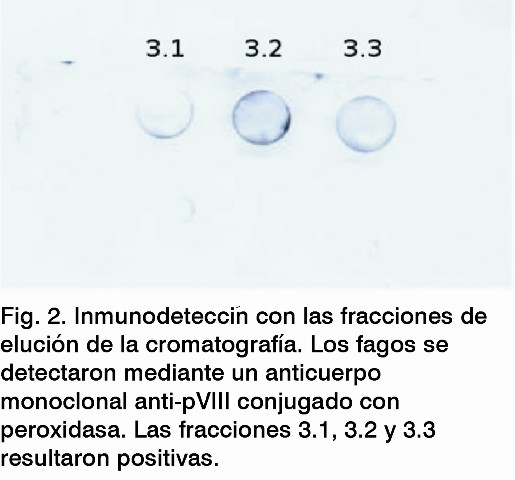
Una preparación de 0,1 mL de las diferentes fracciones de la cromatografía de exclusión molecular se aplicó mediante vacío en una membrana de nitrocelulosa. La membrana se bloqueó durante 1 h a temperatura ambiente con leche descremada al 5%, disuelta en PBS-Tween 0,1%. Seguidamente se añadió un anticuerpo monoclonal anti-pVIII (Amersham Pharmacia Biotech), conjugado con peroxidasa de rábano picante, y se incubó durante 1 h a temperatura ambiente. La señal se visualizó empleando el sistema amplificador de quimioluminicensia ECL (Amersham Pharmacia Biotech).
RESULTADOS Y DISCUSIÓN
Muchas de las nuevas aplicaciones de la tecnología de presentación de péptidos y proteínas en la superficie de fagos filamentosos, como la selección de ligandos internalizados en células eucariotas y la inmunización con ADN mediada por fagos filamentosos, necesitan una alta pureza de las preparaciones virales. El lipopolisacárido (LPS) de la bacteria hospedera y las trazas de PEG pueden ser citotóxicas, por lo que impiden la selección utilizando células vivas (9).
El límite de exclusión de la matriz de Sepharose CL-4B (60 kDa a 20000 kDa) es adecuado para separar las partículas virales del amplio rango de contaminantes potenciales que están presentes en la suspensión de los fagos, después de ser parcialmente purificados con PEG 8000. La precipitación con PEG 8000 produjo una preparación viral con un título de 3x10 13 u.f.c /mL (Tabla 1) y redujo el volumen inicial de 300 mL a 1 mL.
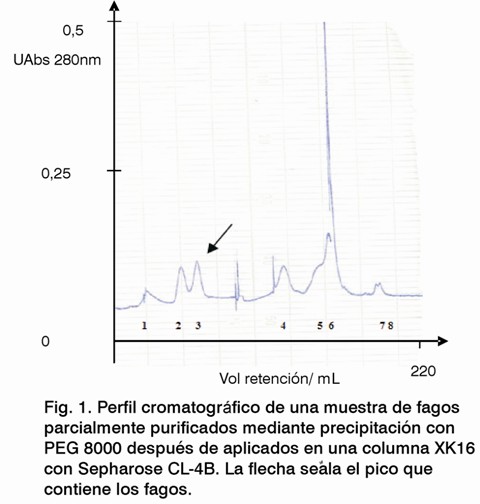
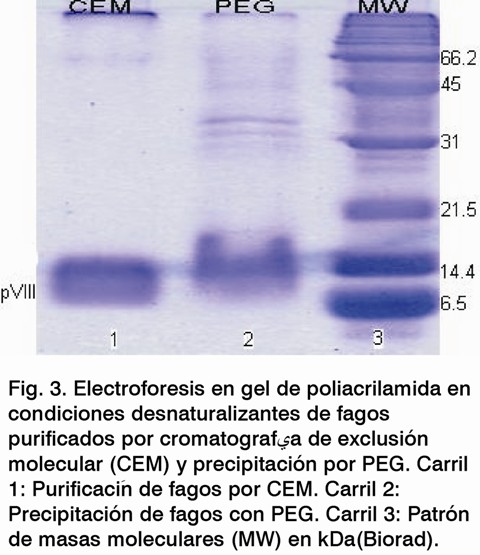
El perfil cromatográfico mostró ocho picos, donde la mayoría de las partículas virales se encuentran en el pico 3 (Fig.1). El ensayo de inmunodetección mostró que solo se detectaron fagos en las preparaciones correspondientes a este pico del perfil cromatográfico (Fig. 2), en un volumen total de 6 mL; las demás fracciones evaluadas fueron negativas. Las tres fracciones del pico 3 se titularon (Tabla 1), recuperándose el 61,3% de la muestra inicial del virus. La electroforesis en gel de poliacrilamida reveló que la mayoría de las proteínas contaminantes presentes después de la precipitación con PEG se eliminaron, al utilizar la cromatografía de exclusión molecular (Fig. 3), visualizándose solamente la proteína PVIII, componente mayoritario del fago M13.
En comparación con el perfil cromatográfico, obtenido por Zakharova y cols, 2005, que utilizaron una columna de 30 cm de altura empacada con Sephacryl S-500, la columna utilizada en nuestro estudio logró separar contaminantes de alta masa molar (Fig. 1). La máxima resolución en una cromatografía de exclusión molecular se obtiene con bajos flujos volumétricos en columnas largas. La altura de la columna afecta de forma significativa la resolución y el tiempo de retención de las moléculas en la cromatografía de exclusión molecular. La utilización de una columna de 100 cm de altura y la aplicación de bajos flujos volumétricos potencian la pureza de nuestra preparación. Además, el empleo de mayores volúmenes de la matriz permite aplicar mayores volúmenes de muestras a purificar. De esta manera se logra salvar limitaciones de esta técnica, tales como la baja capacidad y el tiempo de trabajo (9).
La purificación de fagos filamentosos mediante exclusión molecular, con la utilización de una matriz de Sepharose CL-4B, elimina la mayoría de los contaminantes del hospedero después de la precipitación con PEG (Fig 3). A pesar de ser un método de baja capacidad y que solo se puede purificar una preparación a la vez, puede ser una opción atractiva a la hora de obtener preparaciones de fagos con alto grado de pureza, además de que se acorta considerablemente el tiempo de purificación. Este método es de menor costo y fácil manipulación, al compararse con los largos tiempos de centrifugación en cloruro de cesio, el alto costo y el mantenimiento de las ultracentrífugas.
REFERENCIAS
1. Fagerlund A, Myrset AH, Kulseth MA. Construction and characterization of a 9-mer phage display pVIII-library with regulated peptide density. Appl Microbiol Biotechnol 2008;80:925-36.
2. Santiago N, Puchades Y. Bacteriófagos: de la terapia con fagos a la biología combinatoria. Biotecnología Aplicada 2001;18(3):135-47.
3. Uchiyama F, Tanaka Y, Minari Y, Tokui N. Designing scaffolds of peptides for phage display libraries. J Biosci Bioeng 2005;99:448-56.
4. Perea SE, Reyes O, Puchades Y, Mendoza O, Vispo NS, Torrens I, et al. Antitumor Effect of a Novel Proapoptotic Peptide that Impairs the Phosphorylation by the Protein Kinase 2 (Casein Kinase 2). Cancer Research 2004;64:7127-9.
5. Folgori A, Tafi R, Meola A, Felici F, Galfre G, Cortese R, et al. A general strategy to identify mimotopes of pathological antigens using only random peptide libraries and human sera. EMBO J 1994;13:2236-43.
6. Kehoe JW, Kay BK. Filamentous phage display in the new millennium. Chem Rev 2005;105:4056-72.
7. Kay BK, Winter J, MacCafferty J. Phage display of peptides and proteins. A laboratory manual. San Diego: Academic Press Inc; 1996.
8. Yamamoto RK, Alberts BM, Bezinger R, Lawhorne L, Treiber G. Rapid bacteriophage sedimentation in the presence of polyethilene glycol and its application to large scale virus purification. Virology 1970;40:734-44.
9. Smith GP, Gingrich TR. Hydroxyapatite chromatography of phage-display virions. Biotechnique 2005;39:879-83.
10. Zakharova MY, Kozyr AV, Ignatova AN, Vinnikov IA, Shemyakin IG, Kolesnikov AV. Purification of filamentous bacteriophage for phage display using size-exclusion chromatography. BioTechniques 2005;38:194-98.
11. Scott JK, Smith GP. Searching for peptide ligands with an epitope library. Science 1990;249:386-90.
12. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970;227:680-5.
Recibido: Septiembre de 2011
Aceptado: Enero de 2012