Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina General Integral
versión On-line ISSN 1561-3038
Rev Cubana Med Gen Integr v.25 n.2 Ciudad de La Habana jul.-sep. 2009
TRABAJOS DE REVISIÓN
Estatinas, uso racional en el tratamiento de la dislipoproteinemia
Statins related to a rational use in treatment of dyslipoproteinemia
José Illnait Ferrer
Doctor en Ciencias e Investigador Titular del Centro de Productos Naturales del Centro Nacional de Investigaciones Científicas. La Habana, Cuba.
La diferencia depende de que la indicación esté basada en la información correcta.
Cohen JS
RESUMEN
Las estatinas constituyen un grupo de medicamentos eficaces en el control de la hipercolesterolemia. La mayor parte de la información sobre las estatinas está dedicada a resaltar sus virtudes. El propósito del artículo es llamar la atención sobre aspectos no tan difundidos, o al menos, no suficientemente tomados en cuenta. A las estatinas se asocian algunos efectos indeseables que deben ser tomados en consideración para lograr un mejor tratmiento de los pacientes dislipoproteinémicos. Las interacciones medicamentosas, las altas dosis, la edad, el sexo, y otras enfermedades concomitantes como la diabetes, pueden condicionar efectos colaterales indeseables, como los trastornos del sistema nervioso central, la opacidad del cristalino o la elevación de las transaminasas, entre otros, que pueden afectar notablemente la calidad de vida de los pacientes. La rabdomiolisis es uno de los efectos colaterales adversos que más debe tomarse en consideración.
Palabras clave: Estatinas, dislipoproteinemias, efectos colaterales.
ABSTRACT
Statins are a group of effective drugs in control of hypercholesterolemia. Most of information on statins is devoted to emphasize its virtues. The aim of present paper is to attract the attention on features not so known or at least, non enough took account. Statins have some associated undesirable effects that must to be considered to achieve a better treatment of patients presenting with dyslipoproteinemia. Drug interactions, high doses, age, sex, and other concomitant diseases, e.g. diabetes, may cause undesirable collateral effects, e.g. central nervous system disorders, crystalline lens, or raise of transaminases, among others, that may to affect notably the patients' quality of life. The rabdomyolisis is one of the adverse collateral effects to take into account.
Key words: Statins, dyslipoproteinemia, collateral effects.
INTRODUCCIÓN
Las estatinas conquistaron el mercado de los medicamentos hipolipemiantes en un tiempo relativamente corto. Son medicamentos con alta eficacia para disminuir el colesterol asociado a las lipoproteínas de baja densidad (LDL-C). Se obtienen resultados apreciables apenas una semana después de iniciado el tratamiento, y de 4 a 6 semanas más tarde se logra alcanzar el máximo de su efecto sobre la disminución de la concentración de LDL-C en plasma.
Numerosos estudios avalan los efectos hipocolesterolemizantes de las estatinas en la disminución de las enfermedades cardiovasculares y sobre la muerte, por estas y otras causas.1-7
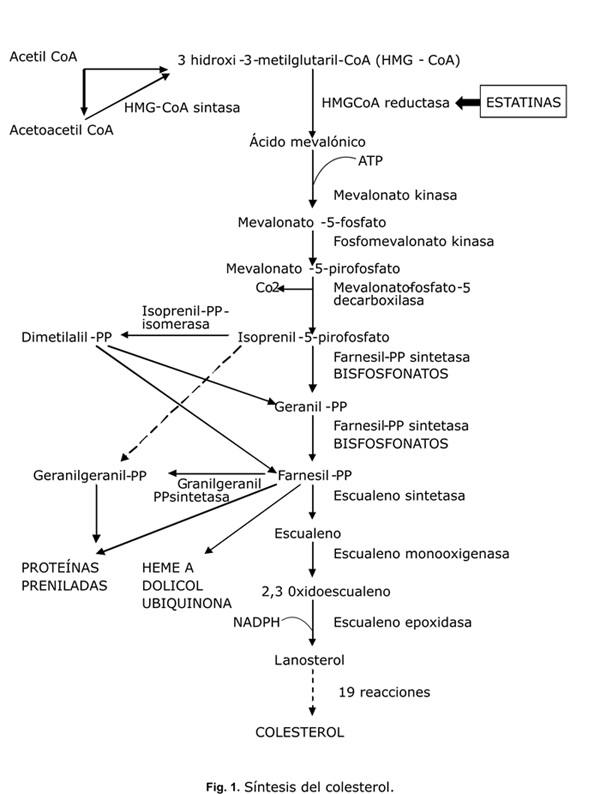
Las estatinas son un grupo de medicamentos inhibidores de la Hidroxi-Metil-Glutaril Coenzima A reductasa (HMG-CoA reductasa), la enzima que regula la síntesis del colesterol en el hígado (fig. 1). Las investigaciones sobre inhibidores de la HMG-CoA reductasa comenzaron al inicio de la década de los 70. Los investigadores japoneses Akira Endo y Masao Kuroda observaron que ciertos microorganismos podían producir inhibidores de esta enzima, letales para otros microorganismos, y utilizados como mecanismo de defensa. Así, lograron aislar la primera molécula que inhibe la enzima HMG-CoA reductasa a partir del Penicillium citrinum, a la que denominaron mevastatina.8
Tomando como base estos conocimientos, en 1976 se produjo la primera estatina comercial a partir del Aspergillius terreous. Desde entonces, ha aparecido un número importante de estatinas con distintas características, a partir de fuentes diversas y también obtenidas por síntesis. Tomando en cuenta que el colesterol, y en particular las LDL, se han considerado el factor de riesgo más importante en el desarrollo de la lesión aterosclerótica, las estatinas fueron acogidas como la solución "mágica" de los trastornos cardiovasculares. A esta percepción generalizada contribuyeron, sin duda, los resultados de los grandes ensayos clínicos que se desarrollaron a lo largo de este período.1-7 Esta situación quizás sea uno de los factores que ha contribuido a que, fascinados por el efecto hipocolesterolemizante de las estatinas y sin darle suficiente importancia al origen multifactorial de la aterosclerosis, los tratamientos con estas drogas hayan sido cada vez más agresivos.9,10 A ello también han contribuido las recomendaciones de grupos de expertos que enfatizan la necesidad de tratamientos agresivos para disminuir las LDL-C "cuanto más mejor."11,12
Sin embargo, la cuestión de los efectos adversos ha sido menos difundida. Quizás no se conozca lo suficiente que la cuarta causa de muerte en Estados Unidos son los efectos colaterales adversos de los medicamentos. La información especializada con relación a los efectos adversos fluye muy lentamente, pero las empresas farmacéuticas se encargan de suministrar información abundante y expedita a los médicos acerca de las propiedades beneficiosas de sus productos.13 En el caso de las estatinas, se conoce que del 60 al 75 % de los pacientes interrumpen el tratamiento con estas drogas antes de los 8 meses (como promedio), debido a efectos colaterales adversos (del 15 al 42 %), y también por efecto inadecuado o al costo, lo que afecta a entre 7 y 15 millones de estadounidenses.14,15
Por otro lado, algunos autores consideran que en la práctica médica las estatinas no cumplen las expectativas a que inducen los resultados de los ensayos clínicos,16 lo que puede haber contribuido a un aumento innecesario de las dosis, trayendo como consecuencia la aparición de efectos adversos.10 A pesar de que se ha generalizado el tratamiento hipocolesterolemizante con estatinas, y aun cuando la mortalidad cardiovascular haya disminuido durante las últimas décadas en algunos países, la aterosclerosis continúa siendo el principal problema de salud en todo el mundo desarrollado.
En este artículo se expresa una opinión acerca de la mejor utilización de las estatinas, sobre la base de los conocimientos relacionados con las interacciones medicamentosas de estas drogas y sus efectos adversos, a fin de hacer de ellas un uso más racional.
Interacciones
El citocromo P450 (CYT P450) es un sistema enzimático a través del cual se cataliza la oxidación de numerosos compuestos endógenos y exógenos. Así, en un número de medicamentos que se calcula alrededor del 90 %, entre ellos las estatinas, esta condición los hace susceptibles de provocar interacciones con otras drogas que también son metabolizadas por la misma vía (aspirina, antihistamínicos, antiácidos, diltiazen, ketoconazol, verapamilo, eritromicina, entre otros). Se han descrito también interacciones de las estatinas con la ciclosporina, con los fibratos y con el jugo de toronja.17,18
Es frecuente que este aspecto no se tenga en cuenta al indicar estatinas, ni aun en ensayos clínicos, donde se debería tener un mejor control. Así, entre unos 13 000 pacientes que formaron parte de los estudios CARE y LIPID, cerca del 50 % fueron tratados concomitantemente con drogas que son metabolizadas a través del CYT P450.19,20
Efectos adversos
Como grupo, las estatinas son por lo general bien toleradas, excepto por algunos eventos adversos que, aunque no son de alta frecuencia, en algunos casos sí pueden llegar a ser muy graves.
Efectos oculares. Se ha observado que la interrupción de la vía de síntesis de colesterol mediante diferentes agentes induce la aparición de opacidad del cristalino en animales y humanos, y en este sentido se ha investigado el efecto potencial de los inhibidores de la HMG-CoA reductasa en la aparición de cataratas en modelos animales y en vivo.21 El efecto de la HMG-CoA reductasa sobre el cristalino se ha atribuido al uso de altas dosis en los modelos experimentales. En los ensayos clínicos también se reportan efectos oculares, sin alcanzar niveles de significación estadística.22-24 No queda claro cómo, conociendo el efecto adversos sobre el cristalino que en sentido general tienen otros inhibidores de la síntesis de colesterol, en el caso particular de las estatinas estos efectos no tienen una relevancia clínica mayor.
Efectos sobre el sistema nervioso central. El sueño y la cognición pueden ser potencialmente afectados durante el tratamiento con algunas estatinas, ya que aquellas liposolubles atraviesan la barrera remato-encefálica.25 Estudios realizados en ratas revelan que las estatinas pueden producir cambios en la concentración de los lípidos de las membranas celulares, que pudieran estar relacionados con la génesis de los síntomas neurológicos y mentales que se reportan durante el tratamiento con estatinas.26 Otros experimentos realizados en ratas indican que el tratamiento a largo plazo de estatinas (10 mg/kg/d) afecta la memoria espacial de estos animales.27 En un estudio observacional, aproximadamente un 18 % de los pacientes reportan trastornos de la duración del sueño.28 Sin embargo, los ensayos controlados no han logrado demostrar el efecto sobre el sistema nervioso central.29 Las razones por las cuales estos efectos de las estatinas sobre el sistema nervioso central no han podido demostrarse en ensayos clínicos no han sido reportadas.
Hepatotoxicidad. El uso de las estatinas está asociado a elevaciones de las transaminasas de manera de dosis dependiente.19 El hecho de que con la suspensión de la medicación las transaminasas regresan a la normalidad, ha hecho suponer que la administración de estatinas no debe asociarse a una morbilidad hepática severa. Sin embargo, es bien conocido que un aumento mantenido de las transaminasas es un indicador de daño hepatocelular. No se han encontrado en la literatura disponible datos experimentales que expliquen el mecanismo de producción de este efecto adverso, y tampoco hay criterio del efecto de la droga sobre el hepatocito a largo plazo.
Efecto muscular. Las estatinas están asociadas a la aparición de rabdomiolisis. Esta condición es considerada rara, pero infelizmente puede tener una repercusión negativa tan notable que merece una atención particular.
La rabdomiolisis es un síndrome que puede ocurrir por diversas causas: tóxicas, metabólicas, inflamatorias, infecciosas, traumáticas o inducida por drogas. Es una destrucción del tejido muscular que puede llegar a ser severa, y se acompaña de mioglubulinemia y mioglobulinuria. La mioglobina causa un cambio del color en el suero y la orina, pudiendo ocasionar fallo renal y muerte. El fallo renal se produce por efecto tóxico de la mioglobina sobre la célula epitelial del túbulo renal o porque promueve depósitos intratubulares, produciendo hipovolemia y acidosis. Por otro lado, la mioglobina inhibe la producción de óxido nítrico y dispara la vasoconstricción y la isquemia del riñón.
Existen 4 síndromes relacionados con la integridad muscular descritos por el American Collage of Cardiology/American Heart Association:30
1. Miopatía: cualquier molestia muscular.
2. Mialgia: cuando hay franco dolor muscular sin elevación de creatina fosfoquinasa.
3. Miositis: cuando los síntomas musculares se acompañan de creatina fosfoquinasa (CPK) elevada.
4. Rabdomiolisis: cuando la CPK eleva 10 veces su valor normal, y se acompaña de aumento de creatinina sérica mioglobinuria e insuficiencia renal aguda.
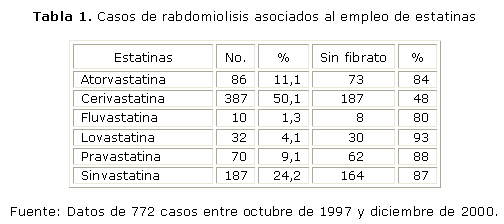
La rabdomiolisis severa se considera más rara (según Evans M entre el 1 y 7 % de los pacientes bajo el tratamiento con estatinas).31 Sin embargo, con relativa frecuencia se pueden detectar miopatía ligera y miositis, que no siempre se acompañan de incrementos de creatina quinasa.32 Aunque los problemas musculares prácticamente no se reportan en los ensayos clínicos, la Food and Drug Administration (FDA) Reporting System encontró 3 339 casos de rabdomiolisis asociados a estatinas entre el 1ro. de enero de 1990 y el 31 de marzo del 2002.33 La interacción droga-droga (con fibratos) se ha propuesto como causa de la rabdomiolisis, pero dicho reporte indica una alta proporción de rabdomiolisis asociada exclusivamente a estatinas (tablas 1 y 2).
La mayor frecuencia de aparición de afectación muscular se reporta antes de las 4 semanas, y la posibilidad de aparición es cada vez menor en la medida que pasa el tiempo, pudiendo presentarse hasta 35 semanas después de iniciado el tratamiento con estatinas.34
Un importante estudio cruzado y a doble ciegas en pacientes con dolor muscular sin elevación de creatina quinasa, demostró, por biopsia muscular, miopatía mitocondrial parcialmente reversible.35 La histopatología muestra pérdida del núcleo y de las estrías de miocito sin presencia de infiltrado de células inflamatorias.36 La microscopía electrónica revela que en los miocitos de pacientes tratados con estatinas hay un extenso daño mitocondrial.37
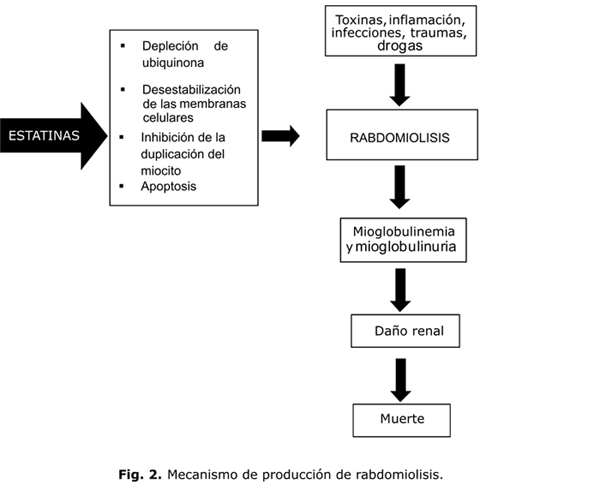
Aun en ausencia de rabdomiolisis o elevación de CPK se pueden producir notables afectaciones de la calidad de vida,38 todo lo cual hace que la miotoxicidad de las estatinas constituya una limitación terapéutica importante.39 El mecanismo por el cual las estatinas producen rabdomiolisis se considera insuficientemente esclarecido, pero se proponen diversas hipótesis bien fundamentadas. El daño muscular se produce, según algunos investigadores, por depleción de ciertos intermediarios que se producen en la vía de síntesis del colesterol, y también por desestabilización de las membranas celulares y la inhibición de la duplicación del miocito19 (fig. 2).
Se ha demostrado, que en los pacientes tratados con estatinas, la coenzima Q10 (ubiquinona) (fig. 1) disminuye en el plasma en forma dosis dependiente, y se ha postulado que este metabolito puede ser importante en relación con el efecto miotóxico por su participación en la función mitocondrial y su efecto antioxidante, no solo en el músculo esquelético sino también en el músculo cardiaco. Así, la relación lactato/piruvato en suero, tomada como indicadora de la función mitocondrial, se eleva en los pacientes tratados con inhibidores de la HMG-CoA reductasa.19
Según Dirks AJ y otros,40 las estatinas son capaces de inducir apoptosis de las células musculares, ya que la depleción de isoprenoides, que también se forman durante el proceso de síntesis de colesterol, disminuyen la geranilgeranilación o la farnesilación de las proteínas (fig. 1). A su vez, esto provoca elevación del calcio citosólico y la activación de la señal apoptótica mediada por la mitocondria.
Así, de las estatinas podría decirse que el origen de sus efectos adversos está en su propio mecanismo de acción. Según Dirks, el único remedio para prevenir la rabdomiolisis es suspender la medicación con estatina cuando aparecen los primeros síntomas. Según Caso G, la suplementación con Q10 puede prevenir las miopatías en un 40 % de los casos.41 Aunque algunos autores han encontrado similares beneficios suplementando otros antioxidantes naturales o sintéticos,42,43 otros no han encontrado igual efecto.41
Papel de la edad en la aparición de efectos adversos
Si bien es cierto que en los ancianos deben tomarse ciertas precauciones al aplicar cualquier farmacoterapia, debido a que la absorción, distribución y eliminación de los fármacos es diferente a los pacientes jóvenes, en el caso de las estatinas debe evitarse su aplicación o tomarse cuidados muy especiales. El anciano es frecuentemente tratado por otras enfermedades, de modo que la propia comorbilidad o la medicación concomitante, pudieran potenciar los efectos secundarios indeseables de las estatinas. Por otro lado, el anciano tiene reducida su masa muscular, y también tiene afectado el funcionamiento de otros órganos y tejidos a consecuencia del desgaste biológico propio del proceso de envejecimiento, o presenta enfermedades subclínicas incompatibles con este tipo de tratamiento hipolipemiante.44
En el anciano, el metabolismo de las lipoproteínas está afectado, porque en la medida en que avanza la edad la concentración de LDL tiende a incrementarse. Esto parece deberse a una incapacidad progresiva en la expresión de receptores hepáticos de apolipoproteína B100 (Apo B100), por lo que disminuye su catabolismo.45 Según algunos reportes, el tratamiento con estatinas en el anciano parece ser beneficioso en la prevención secundaria, pero no así en prevención primaria.46 Sin embargo, otros no observan tendencia beneficiosa en la sobrevivencia de los pacientes ancianos con alto riesgo tratados con estatinas.28 Un estudio observacional indica que en los ancianos, el riesgo de mortalidad ocasionado por la hipercolesterolemia disminuye,47 lo que hace menos necesario el uso de drogas agresivas en estos pacientes. Los problemas cognitivos que ocurren durante el tratamiento con estatinas tienen mayor impacto en los ancianos, y empeoran las deficiencias que se presentan en esta edad.48-51
Por otro lado, en los pacientes jóvenes, a menor riesgo, el uso de las estatinas tiene más incertidumbre, debido a que son pacientes que deben ser sometidos a un tratamiento crónico, y por tanto, las posibilidades de aparición de efectos adversos se hacen mayores al transcurrir del tiempo.52 En estos casos se debe conocer el nivel de riesgo de enfermedad coronaria, para así evaluar la relación riesgo-beneficio antes de indicar las estatinas, y en cualquier caso, realizar el seguimiento sistemático de los posibles eventos adversos.
Diferencias de género en relación con la tolerabilidad de las estatinas
Se plantea que las mujeres dislipoproteinémicas deben ser tratadas con la misma agresividad que el hombre. Sin embargo, algunos estudios revelan que los requerimientos de dosis de estatinas son menores para la mujer que para el hombre.53-55 Existen muchas razones para pensar que los requerimientos de la mujer son menores que para los hombres en relación con las dosis de estatinas.
En primer lugar, es habitual tomar al sexo masculino como norma para definir las dosis, sin tomarse en consideración que la mujer es, como promedio, más menuda que el hombre. Además, la proporción corporal de agua es mayor y la de grasa menor, por lo que cambia la distribución de medicamentos. La mujer tiene menor output cardiaco, por lo que la sangre fluye menos al hígado y los riñones, limitando la eliminación de medicamentos, como también hay diferencias en las enzimas intestinales y hepáticas que intervienen en el metabolismo de las drogas. Por otro lado, la gran mayoría de las mujeres comienzan a tratarse la hipercolesterolemia después de la menopausia, lo que las ubica dentro del grupo de adultos mayores, con los mismos riesgos de ese grupo etario.56
DISCUSIÓN
Tal como lo indican los estudios iniciales, la inhibición de la HMG-CoA reductasa tiene un efecto letal en algunos microorganismos. Sin embargo, eso no indica necesariamente que las estatinas pudieran tener igual efecto directo en el organismo humano como un todo, pero sí inducir muerte celular no programada en tejidos importantes, que a su vez puede conllevar situaciones adversas de carácter más general. Así, en un estudio presentado por Knap AC y otros en el 70 congreso de la Sociedad Europea de Aterosclerosis, en 1998, se demostró que las estatinas lipofílicas promueven el debilitamiento de la capa fibrosa de las lesiones ateroscleróticas por aumento de apoptosis de las células musculares lisas, lo que se traduce en un mayor riesgo de eventos clínicos vasculares.
Otra publicación más reciente señala la potencialidad de las estatinas para aumentar el proceso de calcificación de los ateromas, basándose en el efecto de estas sobre la proteína osteomorfogenética-2 (Bone Morphogenetic Protein-2) que existe en muchos tejidos, incluyendo las arterias.57
Por otro lado, tomando en consideración que el efecto letal de las estatinas pudiera estar relacionado con la disminución de un número de compuestos que se forman en la vía de síntesis del colesterol y no precisamente debido a su estructura molecular, es que resulta preocupante su uso indiscriminado, según la filosofía que aconseja disminuir la LDL-C, "cuanto más bajo mejor".
De acuerdo con los ensayos clínicos, la frecuencia de reacciones adversas severas bajo el tratamiento con estatinas se considera baja. Sin embargo, los estudios de vigilancia epidemiológica han detectado un número importante de eventos adversos, incluido los fatales, sobre todo, teniendo en cuenta que la afectación muscular puede ser inicialmente ligera o aparecer cuando los síntomas se disparan al realizarse una actividad física. La razón de la discrepancia pudiera ser, en el mejor de los casos, que siendo muy alta la incidencia de dislipoproteinemia en la población, el uso masivo e indiscriminado de estos medicamentos provoca la mayor frecuencia de efectos adversos.
No abundan las drogas que utilizadas a las dosis recomendadas sean capaces de causar la muerte del paciente. Aun cuando esto ocurriera de manera infrecuente, ello indica que resulta de sumo interés tomar en consideración las características del paciente antes de indicar estatinas, y observar precoz y sistemáticamente su tolerabilidad.
La rapidez y efectividad con que las estatinas disminuyen la colesterolemia se ha tomado como una de sus grandes ventajas. Sin embargo, esta característica suya contribuye más a la elevación de la confianza en el tratamiento que a los beneficios inmediatos reales, si se tiene en cuenta que más importante que disminuir la LDL-C en el plasma es preservar la estabilidad de las placas de ateroma. Si bien es cierto que la disminución de LDL-C contribuye a la estabilidad de la placa, este proceso requiere ineludiblemente de un tiempo mayor.
Es bien conocido que la lesión arterial puede iniciarse en la niñez o la adolescencia en forma de estría grasa con carácter reversible, o evolucionar hasta convertirse en placa fibrosa. En este estadio, que muchos consideran irreversible, la lesión puede eventualmente calcificarse y complicarse, o producir fisuras que provocan la formación de coágulos, los cuales pueden ocluir el vaso in situ o a distancia, dando lugar a las llamadas crisis ateroscleróticas (infarto cardíaco o cerebral, claudicación de miembros inferiores...).
La ruptura de la placa depende más de su vulnerabilidad (placa inestable), que del grado de estenosis (tamaño). La vulnerabilidad de la placa depende de:
1. De la consistencia de su núcleo lipídico, de manera que las placas blandas son más propensas a la ruptura.
2. Del grosor que haya alcanzado su capa fibrosa (mientras más gruesa será más estable).
3. De los procesos inflamatorios que se asocian a la lesión.
El colesterol que se ha ido acumulando durante décadas en la íntima arterial tiene una determinada influencia en la ruptura de una placa, pero no así el colesterol circulante, cuyo papel es el de promover y desarrollar la lesión. En este estadio influye, como detonante de la ruptura, el proceso inflamatorio que tiene lugar en el llamado "hombro" de la lesión, que no es más que el límite de la lesión con la parte sana del endotelio vascular. Así, mientras el desarrollo de la lesión es un proceso crónico que puede durar décadas y tiene una dependencia mayor de la hipercolesterolemia, la ruptura de la placa es un fenómeno agudo relativamente independiente de la hipercolesterolemia en el momento en que ocurre, y por tanto, independiente de cualquier reducción en suero sanguíneo de LDL-C por más rápida e intensa que esta sea. Por esta razón, el tratamiento hipocolesterolemizante debe tomarse siempre como preventivo de las crisis ateroscleróticas a más largo plazo.
Aunque según algunos la placa fibrosa es irreversible, su contenido de colesterol se puede reducir al pasar del tiempo, con lo que contribuye a su estabilidad en la medida en que se reduce la hipercolesterolemia, y se establece un gradiente del tejido vascular hacia el torrente sanguíneo, pero según se ha observado en estudios angiográficos,58,59 este proceso requiere entre 2 y 5 años, pues depende, no solamente de la disminución de la hipercolesterolemia, sino también del grado de cristalización del colesterol contenido en la lesión.
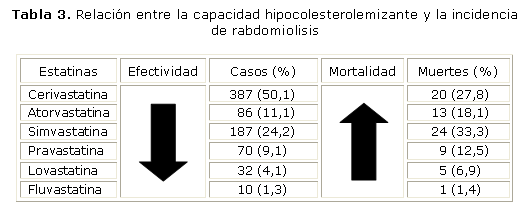
Si se observa el orden decreciente de la potencia hipocolesterolemizante de las distintas estatinas (cerivastatina > rosuvastatina > atorvastatina > simvastatina > lovastatina > pravastatina > fluvastatina),60 y se compara con el efecto rabdomiolítico reportado por el FDA, resulta evidente una cierta relación directa potencia/rabdomiolisis (tabla 3). La flecha de la izquierda indica el sentido descendente de la capacidad hipocolesterolemizante, y la de la derecha el incremento de la incidencia de muerte asociada a rabdomiolisis durante el tratamiento con estatinas. Se exceptúa la simvastatina que debería ocupar un lugar superior a la cerivastatina. La simvastatina es una excepción, ya que por su efecto rabdomiolítico debería ocupar un lugar superior. Esto se explica porque entre 6 estatinas evaluadas (incluida la cerivastatina), la sinvastatina es una de las que más afecta la actividad de la fosforilación oxidativa individual.61 Esta es una clara señal de que no resulta convincente la proposición de disminuir agresivamente la LDL "cuanto más bajo mejor".
Sheik A62 ha hecho una revisión de aquellos factores de riesgo que pueden favorecer la aparición de rabdomiolisis cuando las estatinas se combinan con fibratos. Tomando en consideración que la rabdomiolisis aparece aún durante la monoterapia con estatinas, estos factores deberían extenderse a los pacientes con monoterapia. Los factores de riesgo que predisponen a los pacientes bajo tratamiento con estatinas a la rabdomiolisis incluyen la edad avanzada, el género femenino, la enfermedad renal o hepática, la diabetes, el hipotiroidismo, el estado debilitado, la cirugía, el trauma, el consumo excesivo de alcohol y el ejercicio intenso.
Un análisis de los cambios que durante la vida tiene el colesterol indica que durante el desarrollo intrauterino el colesterol constituye un elemento de suma importancia en la formación de las membranas celulares de todos los tejidos. Así, durante el embarazo la madre aumenta el nivel de colesterol circulante para garantizar su adecuado suministro durante la vida embrionaria y fetal. Este suministro de colesterol madre-hijo continúa luego con la lactancia. Salvo en casos de trastornos genéticos, el niño se desarrolla con un nivel de colesterol bajo que puede incrementarse discretamente en los períodos de crecimiento lento. En la adolescencia, el crecimiento rápido y el aumento de la actividad física, así como los cambios hormonales, incrementan la utilización de colesterol por los diferentes tejidos, lo que limita el aumento de colesterol en plasma. En este período de la vida, habitualmente se incrementa la ingesta de alimentos para cubrir las necesidades del crecimiento y desarrollo. Sin embargo, las necesidades de una mayor cantidad de alimentos en la adolescencia, condiciona el establecimiento de hábitos de consumo que tienden a consolidarse y mantenerse hasta edades en que se detiene el crecimiento y disminuye la actividad física. El consumo innecesario de cantidades nutrientes que rebasan las necesidades, y la menor actividad física en el adulto de edad media y avanzada, condicionan la aparición de la mayoría de las dislipoproteinemias, según estudios epidemiológicos.63 Así, se considera que no es deseable el uso de las estatinas como compensación de un estilo de vida inadecuado.64
Teniendo en cuenta que en la medida que avanza la edad la concentración de LDL tiende a incrementarse, debido a la creciente incapacidad en la expresión de receptores hepáticos de Apo B100, por lo que disminuye su catabolismo y el mecanismo de acción de las estatinas requiere que se expresen los receptores Apo B100, se explica la menor eficiencia de estos medicamentos en el anciano.
Los efectos adversos de las estatinas sobre el sistema nervioso y la visión no están bien documentados. Estos aspectos no forman parte de la mayoría de los protocolos de ensayos clínicos, ya que requieren, por su naturaleza, de una indagación especializada, y por tanto, es necesario mantenerse alerta sobre estos.
Se concluye que las estatinas son medicamentos muy eficaces que pueden indicarse haciendo de ellos un uso racional. En este sentido debe atenderse a las condiciones individuales, tomando en consideración los factores de riesgo de rabdomiolisis en cada paciente, y hacer un seguimiento para indagar acerca de posibles efectos indeseables. Es recomendable, en cualquier caso, indicar dosis bajas. El incremento de la dosis para obtener mayores reducciones de la concentración de LDL-C debe someterse a un cuidadoso análisis de riesgo/beneficio. Cualquier aparición de algún evento adverso debe ser también motivo de análisis, y disminuir la dosis o suspender el medicamento según el caso.
Es conveniente advertir al paciente e indagar durante el seguimiento la aparición de cansancio físico inusual, dolores musculares, calambres y otros signos de afectación muscular, e indicar exámenes complementarios que alerten efectos adversos, principalmente relacionados con la integridad de las células hepáticas y musculares (transaminasas y creatina quinasa).
Las condiciones que en general tienen los ancianos en la medida que avanza la edad, hacen dudar de la necesidad del empleo de las estatinas como hipolipemiantes en estos pacientes, y se aconseja realizar un esfuerzo superior en la aplicación de los cambios terapéuticos del estilo de vida adecuados a la edad, así como el uso de farmacoterapias menos agresivas. En los casos en que se decida aplicar el tratamiento con estatinas, debe hacerse una evaluación de las condiciones del paciente.
REFERENCIAS BIBLIOGRÁFICAS
1. Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease. The Scandinavian. Lancet. 1994;344:1383-9.
2. Shepherd J. Cobbe SM, Ford I. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. N Engl J Med. 1995;333:1301.
3. Sacks FM, Pfeffer MA, Moye LA, Rouleau JL, Rutherford JD, Cole TG. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. N Engl J Med. 1996;335:1001-9.
4. The Lipid Study Group. Prevention of cardivascular events and death with pravastatin in patients with CHD and a broad range of initial cholesterol levels. N Engl J Med. 1998;339:1349-57.
5. Fuberg CD, Adams HP, Applegate WB. Effect of lovastatin on early carotid atherosclerosis and cardiovascular events. Circulation. 1994;90:1679.
6. Collaborative Group. MRC¤BHF Heart Protection Study of cholesterol lowering with simvastatin in 20536 high-risk individuals. The Lancet. 2002;360:7.
7. Shepherd J, Blawn GJ, Murphy MB, Bollen ELEM, Buckey BM, Cobbe SM, et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet. 2002;360(9346):1623-30.
8. Endo A. The discovery and development of HMG-CoA reductase inhibitors. J Lipid Res. 1992;33:1569-82.
9. Banegas JR, Rodriguez-Artalejo F. Dominguez-Rojas V, Del Rey Calero J. How much benefit could be obtained from cardiovascular disease intervention programs? Rev Epidemiol Sante Publique. 1992;40:313-22.
10. Abrokire SA. Misuse of statin drugs common Arch Intern Med. 2001;161:53-8.
11. Ravnskov U, Rosch P, Sutter M, Houston M. Should we lower cholesterol as much as possible? BMJ. 2006;332(7553):1330-2.
12. Teelin M, Bennett K, Feely J. The influence of guidelines on the use of statins: análisis of prescribing trenes 1998-2002. Br J Clin Pharmacol. 2005;59(2):227-32.
13. Cohen JS. What do you most know about statin drugs & their natural alternatives? SCUAREONE Publisher. New York: Ed. by Caratozzolo M and Weiser E; 2005.p.Xii.
14. Jakevicius LA, Mandami M, Tu JV. Adherence with statin therapy en elderly patients with and without acute coronary syndrome JAMA. 2002;288:462-7.
15. Benner JS, Glynn RJ, Mogun H, Neuman PJ, Weinstein MC, Avorn J. Long term persistence in use of statin therapy in elderly patients. JAMA. 2002;288:455-6.
16. Frolkis JP, Pearce GL, Nambi V, Minor S, Sprecher DL. Statins do not meet expectations fot lowering low-density lipoprotein colesterol levels when used in clinical practice. Amer J Med. 2002;113(8):685-6.
17. Bottorff M. Fire and forget? Pharmacological considerations in coronary care. Atherosclerosis. 147 Suppl 1(1999)S23-S30.
18. Neuvonen PJ, Kantola T, Kivisto KT. Simvastatin but not pravastatin is very susceptible to interaction with the CYPA4 inhibitor itraconazole. Clin Pharmacol & Ther. 1998;63(3):332-41.
19. Farmer JA, Torre-Amione G. Comparative tolerability of the HMG-CoA reductase inhibitors. Drug Safety. 2000;23(3):197-213.
20. Kane GC, Lipsky JJ. Drug-grape fruit juice interaction. Mayo Clin Proc. 2000;75:933-42.
21. Gerson. On the etiology of opacity in lens explanted from dogs receiving HMG CoA reductase inhibitors. Exp Eye Res. 1990;50(1):65-78.
22. Laties AM, Shear CL, Lippa EA, Gould AL, Taylor HR, Hurley DP, et al. Expanded clinical evaluation of lovastatin (EXCEL) study results. II Assessment of the human lens after 48 weeks of treatment with lovastatin therpy. Amer J Cardiol. 1991;67(6):447-53.
23. Schmidt J, Schmidt C, Hockwin O. No lens changes caused by simvastatin results from a prospective drug safety study. Lens Eye Toxic Res. 1990;7(3-4):447-53.
24. Harris ML, Bron AJ, Brown NA, Keech AC, Wallendszus KR, Armitage VM. Oxford Cholesterol Study Group. Absence of effect of sinvastatin on the progression of lens opacities in a randomized, placebo-controlled study. Br J Ophtalmol. 1995;79(11):996-1002.
25. Guillot F, Misslin P. Lemaire M. Comparison of fluvastatin and lovastatin blood-brain barrier transfer utilizing in vivo and in vitro methods. J Cardivasc Pharmacol. 1993;319:122.
26. Becka M, Tvrzická E, Stanková B, Novák F, Nováková O, Zák A Thoku. Hypolipidemic drugs can change the composition of rat brain lipids. J Exp Med. 2004;4:299-308.
27. Baytan SH, Alkanat M, Okuyn M, Fucine M, Gdikli E, Ozeran M, Akgun A. Simvastatin Impairs Memory in rats at a specific dose level. Tohoku J Exp Med. 2008;214:341-9.
28. Schaefer EJ. HMG CoA reductase inhibitors for hypercholesterolemia (letter). N Eng J Med. 1998;319:122.
29. Harrison RW, Ashton CH. Do cholesterol lowering agents affect brain activity? A comparison of simvastatin, pravastatin and placebo in healthy volunteers. Br J Pharmacol. 1994;37(3)231-6.
30. Pastermak RC, Smith SC, Bairey-Merz CN. ACC/AHA/NH LBI clinical advisory on the use and safety of statins. J Am Coll Cardiol. 2002;40:567-72.
31. Evans M, Rees A. The miotoxicity of statins. Curr Opin Lipidol. 2002;13(4):415-20.
32. Phillips PS, Haas RH. Statin associated myopathy with normal creatine kinase levels. Ann Intern Med. 2002;137(7):581-5.
33. Thompson PD, Clarkson P, Karas RH. Statin associated miopathy. JAMA. 2003;20(7):888-9.
34. Molokhia M, McKeigue P, Curcio V, Majeed A. Statin induced myalgia: time trend análisis and comparison of risk associated with statin class from 1991-2006. PLOS ONE. 2008;6(3):1-9.
35. Hino I, Afama H, Furuya T. Pravastatin-induced rabdomiolisis in patients with mixed connective tissue disease. Artritis Rheum. 1996;84:413-28.
36. Manoukian AA, Vagaban NV, Hayashi T, Nestor TA, Rios C, Scottolini AG. Rhabdomyolysis secundary to lovastatin therapy. Clin Chemistry. 1990;36:2145-47.
37. Golomb BA, Kena T, Dimsdale JA. Severe irritability associated with statin-cholesterol lowering drugs. QJM. 2004;97:229-35.
38. Tiwari A, Bansal B, Chugh A. Statins and yotoxicity: a therapeutic limitacion. Expert. Opin Drug Saf. 2006;5(6):651-66.
39. Evans M, Rees A. Effects of HMGCoA redutase inhibitors on skeletal muscle: are all statins the same? Drug Saf. 2002;25(1):649-63.
40. Dirks AJ, Jones KM. Statins-induced apoptosis and skeletal myopaty. Am J Physiol Cell Physil. 2006;291:1208-12.
41. Caso G, Kelly P, Mc Norlan MA, Lawson WE. Effect of coenzime Q10 on miopathic symptoms in patients with statins. Amer J Cardiol. 2007;15(10):1409-12.
42. Mortensen SA, Leth A, Agner E, Rolade M. Dose related decrease of serum coenzime Q during treatement with HMG CoA reductase inhibitors. Mol Aspect Med. 1997;18 Suppl:137-44.
43. Lankin VZ, Tikhase AK, Kukharchuk UV. Antioxidant decreases the intensification of low density lipoprotein peroxidation during therapy with statin. Mol Cell Biochem. 2003;249:129-40.
44. Illnait-Ferrer J. Farmacoterapia de la dislipidemia en el anciano. Rev Cubana Med Gen Integr. 1999;15(4):478-85.
45. Ericsson S, Ericsson M, Vitalob S, Einarsson K, Berglund L, Angelina B. Influence of age on the methabolism of plasma low density lipoproteins in healthy males. J Clin Invest. 1991;87(2):591-6.
46. Ali R, Alexander KP. Statin for the primary prevention of cardiovascular events in older adults: A review of evidence. Am J Geriatric Pharmcoter. 2007;5(1):52-63.
47. Weverling-Rijnsburger AW, Bluw GJ, Lagaay AM. Total cholesterol and risk of mortality in the oldest old. Lancet. 1997;350(9085):1119-23.
48. Muldoon MF, Barger SD, Ryan CM, Flory JD, Lehoczky JP, Mathews KA, et al. Effect of lovastatin on cognitive function and physiological well-being. Amer J Med. 2000;108(7):538-46.
49. King DS, Wilburn AJ, Wofford MR, Harrel TK, Lindney BJ, Jones DW. Cognitive impairment associated with atorvastatin and sinvastatin. Pharmacotherapy. 2003;23(12):233-7.
50. Orsi A, Sherman O, Woldeselassie Z. Simvastatin-associated memory loss. Pharmacotherapy. 2001;21(6):767-9.
51. Wagstaff LR, Mitton MW, Arvik BM, Doraiswamy PM. Statin associated memory loss: analysis of 60 case reports and review of the literature. Pharmacotherapy. 2003;23(7):871-80.
52. Ward S, Lloyd Jones M, Pandor A, Holmes M, Ara Rryan A, Yeo W, et al. Statins for prevention of coronary events a systematic review and economic evaluation. Health Technol Assess. 2007;11(14):1-78.
53. Wierzbicki AS, Lumb PJ Chik G, Crook MA. High-density lipoprotein cholesterol and triglycerides response with simvastatin versus atorvastatin in familial hypercholesterolemia. American J of Cardiol. 2000;86:547-9.
54. Cheng H, Roger J, Sweany AE, Dobrinska MR, Stein EA, Tate AL, et al. Influence of age and gender on the plasma profile of 3-hidroxi-3-metilglutaryl-coenzime A (HMG-CoA) reductase inhibitory activity following multiple doses of lovastatin and simvastatin. Pharmaceutical Research. 1992:9:1629-33.
55. Ose L, Luurila O, Eriksson J, Olsson A, Lithel H, Widgren B. Efficacy and safety of cerivastatin, 0.2 mg and 0.4 mg in patients with primary hypercholesterolemia: a multinational ramdomised double-blind study. Cerivastatin study group. Curr Med Res and Opinion. 1999;15:228-40.
56. Plym H, Spigset O, Kharassch ED, Dale O. Gender difference in drugs effects: implications for anesthesiologists Acta Anesthesiologica Scandinavica. 2003;47:241-59.
57. Zhang M, Li XP, Quiao Y, Nie SP, Ma. CS. Does treatment with statins have the potential of enhancing vascular calcification? Chinese Medical J. 2008;121(5):473-4.
58. Brown BG, Zhao XQ, Poulin D, Albers JJ. Atherosclerosis regression and plaque stabilization: a rationale for lipid-lowering in coronary artery disease Cardiol Rev. 1995;3(3):1.
59. Margitic SE, Bond G, Crouse JR, Furberg JL, Probsffield J. Progression and regression of carotid atherosclerosis in clinical trials. Arteriosclerosis and Thrombosis. 1991;11:443-51.
60. Shepherd J, Hunninghake DB, Barter P, McKenney JM, Hutchinson HG. Guidelines for lowering lipids to reduce coronary artery disease risk: a comparison of rosuvastatin with atorvastatin, prevastatin and sinvastatin for achieving lipids-lowering goals. Am J Cardiol. 2003;91(5ª):11C-17C.
61. Nadanaciva S, Dickens JA, Bernal A, Capaldi RA, Will Y. Mitocondrial impairement by PPAR agonists and statins identified via immunocaptured OXPHOS complex activity and respiration Toxicol Appl. Pharmacol. 2007;21:230-4.
62. Shek A, Ferril MJ. Statin-Fibrate combination therapy. The Annals of Pharmacotherapy. 2001;7:980-17.
63. Assmann G, Schulte H, Oberwittler W, Hauss WH. New aspects in the prediction of coronary heart disease: the prospective cardiovascular Munster Study. In: Fridge NJR, Nestel PJ (eds) Atherosclerosis VII. Excerta Medica; 1986.p.19-26.
64. Stalenhoef AF. Statins available from chemist shops will not positively affect health. Ned Tijdschr Geneeskd. 2007;151:1405-6.
Recibido: 7 de octubre de 2008.
Aprobado: 22 de noviembre de 2008.
José Illnait Ferrer. Centro Nacional de Investigaciones Científicas. Ave. 25, entre 158 y 190, No. 15 821, Cubanacán, municipio Playa, Ciudad de La Habana, Cuba. E mail: Jose.illnait@cnic.edu.cu