Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cuban Journal of Agricultural Science
versión On-line ISSN 2079-3480
Cuban J. Agric. Sci. vol.52 no.3 Mayabeque jul.-set. 2018 Epub 01-Sep-2018
Ciencia Animal
Composición química y digestibilidad in vitro de proteínas de semillas procesadas de Mucuna pruriens
1Instituto de Ciencia Animal, Km 47 ½ Carretera Central, San José de Las Lajas, Mayabeque, Cuba
2Facultad Medicina Veterinaria y Zootecnia, Universidad Autónoma de Yucatán, Apdo. 4-116, Itzimna, 97100. Km 15.5 Carretera Merida-Xmatkuil, Mérida, Yucatán, México.
Mucuna pruriens es una leguminosa tropical que tiene gran potencial para la alimentación animal, sin embargo, también contiene propiedades antinutricionales. Para determinar la composición química y la digestibilidad in vitro de proteínas de semillas procesadas de Mucuna pruriens, se desarrolló este experimento. El experimento se realizó en el laboratorio de Nutrición Animal de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad de Yucatán, Mérida, México. Cinco tratamientos consistieron en: remojo de las semillas en agua a las 24 y 48 horas o en bicarbonato de sodio al 0.1 % y 0.2 % y se utilizaron leguminosas crudas. Se utilizó la metodología pH-stat® para determinar el grado de hidrólisis de la proteína. Se analizaron MS, cenizas y energía bruta (EB), fraccionamiento fibroso, contenido de taninos y fenoles totales. Los datos se analizaron mediante ANOVA con cinco tratamientos y cuatro repeticiones cada uno. La materia seca fue menor y la fracción de proteína en tratamientos de agua después de 24 y 48 horas y 0.2 % de bicarbonato aumentaron en comparación con la leguminosa cruda. Se observó un incremento en el grado de hidrólisis de proteínas de todos los tratamientos en comparación con la leguminosa cruda (5.52 vs 8.17, 8.38, 8.99 y 8.62 %, respectivamente) (P <0.001). Los resultados muestran que las semillas de Mucuna pruriens sumergidas en agua y cocinadas, así como sumergidas en 0.1-0.2% de NaHCO3 y cocinadas a presión son métodos igualmente efectivos para mejorar la digestibilidad in vitro de la proteína.
Palabras-clave: pH-stat método; procesamiento de semillas; frijol terciopelo
Los trópicos son abundantes en recursos forrajeros factibles para usar en la alimentación animal. Tienen ventajas tanto desde el punto de vista agronómico como nutricional. En la literatura internacional se ha reportado una gran cantidad de recursos incluyendo las legumbres, las cuales representan fuentes de proteínas y ciertos minerales y vitaminas (Díaz et al. 2014). En este sentido, los granos de Mucuna pruriens, una leguminosa ampliamente estudiada en la literatura, se caracteriza por tener concentraciones entre 250-350 g de proteína cruda (PC)/kg de materia seca (MS) (Chikagwa et al. 2009), 31.2- 39.5 % de almidón (Vadivel y Pugalenthi 2010) y 2.74% a 3.41% de ceniza (Adebowale et al. 2005). Sin embargo, su inclusión en alimentos para no rumiantes es limitada debido al alto contenido de fibra (FDN: 21.3 %) (Pugalenthi et al. 2005) y la presencia de varios factores anti- nutricionales (FAN) (Safwat et al. 2014).
Para reducir algunas de estas limitaciones, se han utilizado diferentes métodos de procesamiento, como la germinación de las semillas, descascarillado, el tostado, el remojo en agua o en soluciones alcalinas y la cocción (Chaparro et al. 2009). Es necesario conocer tanto su composición química como su digestibilidad para ser recomendado como alimento para animales. Sin embargo, la determinación in vivo de la digestibilidad es un proceso laborioso y costoso que requiere el uso de grandes cantidades de alimento, por lo que se han propuesto varios métodos para la estimación in vitro (Lemos y Nunes 2008). Entre ellos, el método pH-stat se ha utilizado para analizar el grado de hidrólisis de diferentes sustratos con resultados satisfactorios (Rutherfurd 2010). Itzá (2012) estudió la digestibilidad de proteínas de cuatro leguminosas tratadas en autoclave y concluyó que el método era confiable para predecir la utilización digestiva de proteínas de leguminosas en comparación con un ensayo in vivo en ratones.
Teniendo en cuenta lo anterior, el objetivo de este estudio fue determinar la composición química y la digestibilidad in vitro de proteínas de semillas procesadas de Mucuna pruriens.
Materiales y Métodos
El experimento se realizó en el laboratorio de Nutrición Animal de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad de Yucatán, Mérida, México. Los tratamientos experimentales consistieron en 500 g de semillas Mucuna pruriens var. ceniza que fueron sometidos a diferentes métodos de procesamiento:
Semillas crudas de Mucuna pruriens (SMP).
SMP remojadas en agua durante 24 y 48 horas y cocinadas a 100°C por 1 hora.
SMP remojadas en NaHCO3 al 0,1 % (pH 8.5) y NaHCO3 al 0.2 % (pH 8,6) durante 4 horas y cocción a presión (autoclave) a 121°C durante 30 minutes (Chaparro et al. 2009 y Vadivel et al. 2011, respectivamente).
Se procesaron cuatro muestras por tratamiento, se secaron en estufa a 60 °C durante 48 horas, se molieron hasta tamaño de partícula de 1 mm en un molino de martillos y se almacenaron en bolsas de plástico hasta el análisis químico en el laboratorio.
Análisis químico. Cada análisis químico se realizó por duplicado. Para la muestra individual, se determinó el contenido de materia seca (MS) (AOAC 2005) y nitrógeno (N) en equipo Leco; con este último se calculó el contenido de proteína cruda (PC) (Nx6.25).
Se preparó un grupo de cuatro muestras que pesaban 75 g cada una, se homogeneizaron y luego se determinó la MS, la ceniza y la energía bruta (EB) de acuerdo con AOAC (2005). El fraccionamiento fibroso (fibra detergente neutra (FDN), fibra detergente ácida (FDA) y lignina se realizaron según Daenlon et al. (2013), los contenidos de taninos (Herald et al. 2014) y fenoles totales (Margraf et al. 2015) también fueron analizados.
Digestibilidad in vitro de proteínas. Se utilizó la técnica basada en el método pH-stat, la cual mide el grado de hidrólisis de la proteína (GHP) a partir de las semillas de leguminosas procesadas (Tibbetts et al. 2011). Se utilizó un dispositivo 736 Stat Titrino, (Metrohm, Herisau, Suiza), que automáticamente tituló y controló para mantener un pH estable.
Se utilizaron pancreatina y tripsina (SIGMA Tripsina T0303-1G, Pancreatina P-1750 de páncreas porcino) de acuerdo con la metodología descrita por Itza (2012). Se preparó una solución de las dos enzimas mencionadas anteriormente (0,8 mg / mL de tripsina y 20 mg/mL de pancreatina), que se ajustó a pH 8 y 37°C.
Se pesaron 200 miligramos de cada muestra de proteína de semillas de frijol terciopelo crudas y procesadas, se añadieron 25 mL de agua bidestilada para asegurar una suspensión acuosa de 8mg de proteína/mL. Se realizó un ajuste a pH 8,0 y 37°C bajo agitación constante. Luego, se añadieron 0,5 mL de la solución de enzima a la suspensión de proteína y se midió la actividad enzimática durante 900 segundos de incubación a pH-stat. Se añadió una solución alcalina de hidróxido sódico 0,1 N suficiente para mantener el pH a 8; el programa PC Control se usó para administrar el Titrant.
El GPH se determinó a partir del volumen de NaOH 0,1 N utilizado para mantener el pH 8 y se calculó a partir de la ecuación descrita por Meinlschmidt et al. (2016):
Where:
htot es el número total de enlaces peptídicos por proteína equivalente y depende de la composición de aminoácidos del sustrato de proteína. Se utilizó el valor de 7.8 para la soya reportado por Meinlschmidt et al. (2016) como valor estándar para la leguminosa estudiada y, h es el número de enlaces peptídicos hidrolizados que se calculó de acuerdo con:
where:
Vb es el consumo base en mL, Nb; normalidad del valorante, α; el grado de disociación del grupo α-NH2 que es de 1.3 a 37°C y pH 8.0 (Itza 2012), MP; masa proteica en la mezcla de reacción.
Diseño experimental y análisis estadístico. Los datos se analizaron mediante ANOVA con 5 tratamientos y 4 repeticiones para cada uno. Para el análisis de los resultados, se utilizó el paquete estadístico computarizado INFOSTAT (Balzarini et al. 2001) versión 5.1 en Windows XP. La comparación de las medias se realizó a través de la prueba de Duncan (1955), si es necesario.
Resultados y Discusión
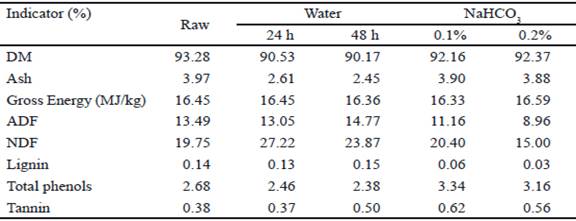
La tabla 1 muestra la composición química de las semillas de frijol terciopelo procesadas. Los valores están en el rango reportado por Ezeagu et al. (2003), Dahouda et al. (2009) y Nwaoguikpe et al. (2011).
Los valores más bajos de FDA, FDN y lignina en el tratamiento con 0.1 y 0.2 % de bicarbonato podrían explicarse por los resultados informados por Vadivel y Pugalenthi (2010) que usan una metodología similar para procesar semillas de mucuna. Estos autores argumentaron que podría deberse al remojo en la solución alcalina que mejora la permeabilidad de la semilla debido a la degradación de la cutícula y el posterior calor aplicado por cocción a presión (autoclave).
La concentración promedio de fenoles totales y taninos condensados en todos los tratamientos es inferior a los informados por Adebowale et al. (2005), sin embargo, están en el rango informado por Pugalenthi et al. (2005) y Chikagwa et al. (2009). Chaparro et al. (2009) explican que el contenido fenólico total varía dependiendo de varios factores, como el genotipo, las prácticas agronómicas, la madurez en la cosecha, el almacenamiento posterior a la cosecha, así como el clima y las condiciones de crecimiento.
La MS fue más baja en el tratamiento del agua después de 24 y 48 horas, lo que se esperaba debido al alto nivel de humedad al que fueron sometidos los frijoles terciopelo (tabla 2). La fracción de proteína en el tratamiento del agua después de 24 y 48 horas y 0.2 % de bicarbonato se incrementó en comparación con la leguminosa cruda (tabla 2). De acuerdo con Bergeson et al. (2016) el proceso de ebullición aumenta el contenido de proteína en las semillas tanto verdes como maduras. Además, la cocción con agua, con o sin presión, aumenta la calidad y la digestibilidad de las proteínas y los carbohidratos, y reduce los inhibidores de la proteasa, la amilasa y las lectinas (Savón y Scull 2006).
Table 2 Dry Matter (DM) and Crude Protein (CP) content of processed Mucuna pruriens seeds
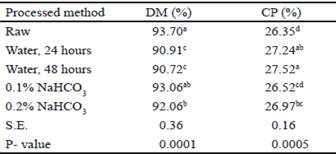
a,b,c,d Values with different letters within the same column differ significantly
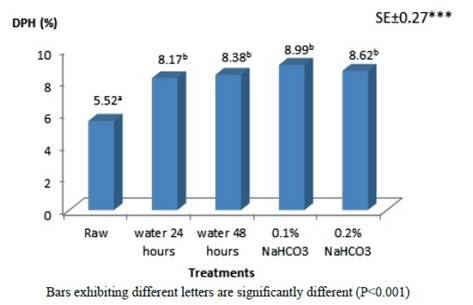
La figura 1 muestra el grado de hidrólisis de proteína en los diferentes métodos de procesamiento del frijol terciopelo. La digestibilidad de la proteína mejoró después de sumergirla en agua y solución alcalina, hervirla y cocinarla (autoclave). Estos valores son similares en comparación con los informados por Itza (2012) para el proceso de autoclave del frijol terciopelo a los 30 minutos y más altos que los reportados por Barać et al. (2011) en semillas de Pisum sativum (4.7 %) y harina de soya tratada a 121°C en autoclave durante 40 minutos (7.9 %) por Wang et al. (2009). Las diferencias entre los estudios indican que las especies de leguminosas y los diferentes métodos de procesamiento son responsables de la variación del indicador. Aparentemente los tratamientos utilizados modificaron las estructuras proteicas y eliminaron FAN en Mucuna pruriens, por lo que las enzimas utilizadas en el proceso de digestión pH- stat probablemente rompieron los enlaces peptídicos en la hidrólisis o digestión según Wang et al. (2009).
Torres et al. (2013) notificaron diferencias tanto en la composición nutricional como en la digestibilidad in vitro de los nutrientes de diferentes granos de legumbres tropicales y estos fueron correlacionados positivamente. Khattab et al. (2009) afirmaron que el tratamiento térmico ya sea por cocción o autoclave, proteínas desnaturalizadas de legumbres, su estructura se abrió y por lo tanto se volvió menos resistente a las proteasas digestivas. Además, estos métodos físicos reducen FAN (Pugalenthi y Vadivel 2010) como proteasas termolábiles y fitatos, entre otros, que interactúan con proteínas de leguminosas formando complejos insolubles que bloquean la acción de las enzimas digestivas, por lo que su reducción mejora la digestibilidad de la fracción proteica.
Los resultados muestran que las semillas de Mucuna pruriens sumergidas en agua y cocidas, así como sumergidas en 0.1-0.2 % de NaHCO3 y cocidas a presión son métodos igualmente efectivos para mejorar la digestibilidad in vitro de la proteína.
Agradecimientos
Este estudio fue apoyado por TWAS-CONACYT, México
REFERENCIAS
Adebowale, Y.A., Adeyemi, A. & Oshodi, A.A. 2005. Variability in the physicochemical, nutritional and antinutritional attributes of six Mucuna species. Food Chem. 89: 37-48. [ Links ]
AOAC. 2005. Official methods of analyses. 18 th ed. Association of Official Analytical Chemist. Arlington, VA, USA. [ Links ]
Balzarini, M., Casanoves, F., DiRienzo, J.A., González, L.A. & Robledo, C.W. 2001. Software estadístico: Infostat, versión 5.1. Manual de usuario. Universidad Nacional de Córdoba, Argentina. [ Links ]
Barać M., Čabrilo S., Pešić M., Stanojević S., Pavlićević M., Maćej O. & Ristić N. 2011. Functional Properties of Pea (Pisum sativum L.) Protein Isolates Modified with Chymosin. Int. J. Mol. Sci. 12:8372-8387. [ Links ]
Bergeson, T.L., Opio, C. & MacMillan, P.D. 2016. Crop ash filtrate influence on cooking time and sensory preferences for dried black beans (Phaseolus vulgaris L.). Afr. J. Food Sci. 10: 132. [ Links ]
Chaparro, S.P., Aristizabal, I.D. & Gil, J.H. 2009. Reducción de factores antinutricionales de la semilla de vitabosa (Mucuna deeringiana) mediante procesos físico-químicos. Rev. Fac. Nal. Agr. Medellín 62: 5157-5164. [ Links ]
Chikagwa-Malunga, S.K., Adesogan, A.T., Sollenberger, L.E., Badinga, L.K., Szabo, N.J. & Littell, R.C. 2009. Nutritional characterization of Mucuna pruriens 1. Effect of maturity on the nutritional quality of botanical fractions and the whole plant. Anim. Feed Sci. Tech. 148: 34-50. [ Links ]
Dahouda, M., Toléba, S.S., Youssao, A.K.I., Hambucker, A., Dangou-Sapoho, R., Martin, G.B., Fillet, M. & Hornick, J.L. 2009. Nutrient digestibility of Mucuna (Mucuna pruriens var. utilis) bean in guinea fowl (Numida meleagris, L): Effects of heat treatment and levels of incorporation in diets. Brit. Poultry Sci. 50: 564-572. [ Links ]
Danleon, J.L., Guaita, M.S., Fay, P., Chiffle, S., Wawrzkiewicz & M., Fernández, M. 2013. Technical Note: Comparison of three analytical procedures to estimate the acid detergent fiber concentration in feeds of widespread use in Argentina. Arch. Latinoam. Prod. Anim. 21: 131-134. [ Links ]
Díaz, M. F., Savón, L., Martínez, M., Torres, V., Coto, G., Martín-Cabrejas, M. A., Lon Wo, E. & Castro, M. 2014. Leguminosas temporales como alternativa para la alimentación animal en el trópico. In: Avances en Producción Sustentable de alimentos y Biotecnología Reproductiva. Editores: Juan Eulogio Guerra Liera, Jorge A. Saltijeral Oaxaca y Alejandro Córdova Izquierdo. Universidad Autónoma de Sinaloa. México 2014. Pág 147. [ Links ]
Ezeagu, I.E., Maziya-Dixon, B. & Tarawali, G. 2003. Seed characteristics and nutrient and antinutrient composition of 12 Mucuna accessions from Nigeria. Trop. Subtrop. Agroecosyst. 1: 129-139. [ Links ]
Herald, T.J., Gadgil, P., Perumal, R., Bean, S.R. & Wilson, J.D. 2014. High-throughput micro-plate HCI- vanillin assay for screening tannin content in sorghum grain. J. Sci. Food Agric. 94: 2133-2136. [ Links ]
Itzá, P.E. 2012. Determinación de la digestibilidad in vitro e in vivo de la proteína de cuatro leguminosas tratadas térmicamente en autoclave. Master Thesis. Universidad Autónoma de Yucatán, Mérida, Yucatán, México. 39 p. [ Links ]
Khattab, R.Y., Arntfield, S.D. & Nyachoti, C.M. 2009. Nutritional quality of legume seeds as affected by some physical treatments, Part 1: Protein quality evaluation. Food Sci. Tech. 42: 1107-1112. [ Links ]
Lemos, D. & Nunes, A.J.P. 2008. Prediction of culture performance of juvenile Litopenaeus vannamei by in vitro (pH-stat) degree of feed protein hydrolysis with species-specific enzymes. Aquacult. Nutr. 14: 181-191. [ Links ]
Margraf, T., Karnopp, A.R., Rosso, N.D. & Granat, D. 2015. Comparison between folin-ciocalteu and prussian blue assays to estimate the total phenolic content of juices and teas using 96-well microplates. J. Food Sci. 8: 2397-2403. [ Links ]
Meinlschmidt, P., Sussmann, D., Schweiggert-Weisz, U. & Eisner, P. 2016. Enzymatic treatment of soy protein isolates: effects on the potential allergenicity, technofunctionality, and sensory properties. Food Sci. Nutr. 4: 11-23. [ Links ]
Nwaoguikpe, R.N., Braide, W., Ujowundu, C.O. 2011. The effects of processing on the proximate and phytochemical compositions of Mucuna pruriens seeds (velvet beans). Pak. J. Nutr. 10: 947-951. [ Links ]
Pugalenthi, M., Vadivel, V. & Siddhuraju, P. 2005. Alternative food/feed perspectives of an underutilized legume Mucuna pruriens var. utilis. A review. Plant Food. Hum. Nutr. 60: 201-218. [ Links ]
Rutherfurd, S.M. 2010. Methodology for Determining Degree of Hydrolysis of Proteins in Hydrolysates: A Review. J. AOAC Int. 93: 1515-1522. [ Links ]
Safwat, A.M., Sarmiento-Franco, L. & Santos-Ricalde, R.H. 2014. Rabbit production using local resources as feedstuffs in the tropics. Trop. Subtrop. Agroecosyst . 17: 161-171. [ Links ]
Savón, L., Scull, I. 2006. Avances en los métodos para disminuir el efecto de factores antinutricionales en alimentos para especies monogástricas. Rev. Comp. Prod. Porcina 13: 25-29. [ Links ]
Tibbetts, S.M., Milley, J.E., Ross, N.W., Verreth, J.A.J. & Lallm, S.P. 2011. In vitro pH-Stat protein hydrolysis of feed ingredients for Atlantic cod, Gadusmorhua.1. Development of the method. Aquaculture 319: 398-406. [ Links ]
Torres, J., Muñoz, L.S., Peters, M. & Montoya, C.A. 2013. Characterization of the nutritive value of tropical legume grains as alternative ingredients for small-scale pork producers using in vitro enzymatic hydrolysis and fermentation. J. Anim. Physiol. An. N. 97: 1066-1074. [ Links ]
Vadivel, V. & Pugalenthi, M. 2010. Evaluation of growth performance of broiler birds fed with diet containing different levels of velvet bean meal as an alternative protein ingredient. Liv. Sci, 127: 76-86. [ Links ]
Wang, H., Faris, R., Wang, T., Spurlock, M. & Gabler, N. 2009. Increased in vitro and in vivo digestibility of soy proteins by chemical modification of disulfide bonds. J. Am. Oil Chem. Soc. 86: 1093-1099. [ Links ]
Recibido: 20 de Diciembre de 2017; Aprobado: 04 de Agosto de 2018











 texto en
texto en