Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cuban Journal of Agricultural Science
versión On-line ISSN 2079-3480
Cuban J. Agric. Sci. vol.52 no.3 Mayabeque jul.-set. 2018 Epub 01-Sep-2018
Ciencia Animal
Producción de xilanasas por Bacillus subtilis E44 en condiciones de fermentación sumergida
1Centro de Estudios Biotecnológicos, Universidad de Matanzas, Autopista a Varadero, km 3 ½, Matanzas, Cuba
2Instituto de Ciencia Animal, Apartado Postal 24, San José de las Lajas. Mayabeque, Cuba
3Universidad Tecnológica de La Habana. José Antonio EchevarríaCUJAE.Calle 114 #1901/ Ciclovia y Rotonda. Marianao. La Habana. Cuba. Código Postal 19390
4Centro Nacional de Biotecnología, CSIC, Darwin 3, Cantoblanco, Madrid, España
La producción de xilanasas a partir de microorganismos es de gran utilidad para la alimentación animal. El objetivo de esta investigación fue evaluar la capacidad de producción de xilanasas por la cepa Bacillus subtilis E44, en condiciones de fermentación sumergida. La bacteria se inoculó en placas Petri con xilano de haya (1 %). La producción de xilanasas se determinó durante 24, 48, 72 y 96 h. La formación de zonas claras alrededor de las colonias, después del revelado con rojo congo 0.5 %, confirmó la producción de la enzima por la cepa. El mayor halo de hidrólisis (24.7 mm ± 0.57) se obtuvo a las 72h. El índice de potencia mostró diferencias significativas para los tiempos evaluados, el mayor fue de 4.59 a las 72 h. En el transcurso de la fermentación sumergida, el crecimiento celular y la producción de enzimas xilanasas por B. subtilis E44 se evaluó durante 24 h, en medio mínimo de sales con xilano de haya y en caldo nutriente. La máxima actividad xilanasa fue de 0.326 U/mL al final de la fase exponencial del cultivo en medio mínimo de sales más xilano y 0.130 U/mL en caldo nutriente. La máxima producción de xilanasas se obtuvo a las 12 h durante la fermentación sumergida, y coincide con la disminución de la actividad proteolítica por Bacillus subtilis E44. Los resultados muestran la capacidad de Bacillus subtilis E44 para expresar enzimas xilanasas con la utilización de haya como fuente de carbono, en condiciones de cultivo sumergido. Estas enzimas podrían mejorar la calidad de las dietas empleadas en la alimentación de animales monogástricos.
Palabras-clave: enzimas; halo de hidrólisis; índice de potencia; actividad enzimática
Las xilanasas (β 1,4endoxilanasas; EC 3.2.1.8) son enzimas implicadas en la degradación del xilano. Hidrolizan los enlaces internos β (1→4) entre moléculas de xilosa y dan lugar a una mezcla de xilo oligosacáridos de diferente tamaño. La capacidad de degradar xilano está ampliamente distribuida entre los microorganismos que poseen diferentes enzimas con acción específica para la degradación completa de este sustrato (Chakdar et al. 2016).
Entre los grupos microbianos, las bacterias y hongos están dotados de poderosas maquinarias xilanolíticas (Chakdar et al. 2016). Las especies del género Bacillus son las más utilizadas para estos fines (Banka et al. 2014), ya que presentan altas tasas de crecimiento que permiten tiempos cortos de fermentación, poseen gran capacidad para la secreción extracelular de proteínas heterólogas y se incluyen entre los microorganismos considerados GRAS (Generaly Regarder As Safe) por la FAD (Gupta et al. 2015).
Las xilanasas son de gran interés desde la perspectiva biotecnológica. Se destaca su empleo comercial en la industria papelera, textil, en la producción de detergentes y en la mejora de la fermentación de cervezas y vinos (Chakdar et al. 2016) y, principalmente, en la industria alimentaria, en la bioconversión de materiales celulósicos en alimentos para aves de corral, con mejores tasas de digestión y absorción de nutrientes (Schoenlechner et al. 2013 y Hahn-didde y Purdum 2014).
El objetivo de esta investigación fue evaluar la capacidad de producción de xilanasas por la cepa Bacillus subtilis E44 en condiciones de fermentación sumergida.
Materiales y Métodos
Cultivo microbiano. Se utilizó la cepa Bacillus subtilis E44, conservada a -30 ºC en glicerol, procedente del Laboratorio de Microbiología de la Facultad de Ciencias Agropecuarias, de la Universidad de Matanzas.
Medio de cultivo mínimo de sales (MS). La solución mineral (%) estuvo compuesta por NaCl-0.1; KH2PO4-0.3; K2HPO4-0.6; MgSO4-0.12; peptona-0.5 y extracto de levadura-0.3. Se ajustó el pH 7.5 con KOH 1mol L-1.
El caldo y el agar nutriente se prepararon según indicaciones del fabricante (BioCen, Centro de Biopreparados).
Preparación del inóculo. A partir del cultivo, conservado en glicerol a -30ºC, la bacteria se cultivó en caldo nutriente y se incubó durante 16 h a 28 ºC en zaranda a 110 rpm. La suspensión celular se sembró en cuñas de agar nutriente y se conservó a 4 ºC. A partir de estas células, se preparó el preinóculo en 50 mL de caldo nutriente. Se incubaron a 28 ºC en zaranda, a 110 rpm, durante 16 h, hasta obtener densidad óptica (D.O 600nm = 0.8) equivalente a concentración de 1 x 108 ufc/mL.
Evaluación cualitativa de la producción de xilanasas. Se prepararon placas Petri, con medio de MS más 1 % de xilano de haya (Sigma-Aldrich). Las placas se inocularon por siembra a profundidad, a partir del cultivo de Bacillus subtilis E44. Se incubaron a 28 ºC durante 24, 48, 72 y 96 h. Para el revelado de los halos de hidrólisis, las placas se cubrieron con disolución de rojo congo a 0.5 %, durante 5 min. Posteriormente, se lavaron por tres veces con una disolución de NaCl 1molL -1. El índice de potencia (IP) se calculó por la relación entre el diámetro de la zona de hidrólisis y el diámetro de la colonia. Los diámetros se midieron con pie de rey Vernier (marca Suertek cap. Sensibilidad de ± 0,02 mm). El experimento se realizó por triplicado.
Fermentación sumergida. El experimento se realizó en matraces de 250 mL, que contenían 50 mL de los medios de cultivo: 1) caldo nutriente (CN) y 2) medio mínimo de sales más xilano de haya a 0.5 % como fuente de carbono (MS+X). El pH se ajustó a 7.5, antes de esterilizar a 121 ºC, durante 15 min. Los frascos se inocularon con suspensión celular de 1 x 108 ufc/mL (D.O 600nm= 0.8) de Bacillus subtilis E44, relación 1:10 (v/v). Posteriormente, se incubaron en zaranda a 110 rpm durante 24 h a 37 ºC.
Determinación de la cinética de crecimiento. Se tomaron 5 mL, a intervalos de dos horas, durante las primeras 12 h en ambos cultivos. Se midió la absorbancia (DO) a 600 nm y posteriormente, se centrifugaron a 10 000 rpm durante 15 min a 4 ºC. El sobrenadante se utilizó para evaluar la actividad de las enzimas xilanasas y proteasas.
Los valores de velocidad específica de crecimiento (μ) se determinaron como la pendiente de los polinomios, que correspondió a la fase exponencial de las curvas de dispersión, obtenidas de la cinética de crecimiento de B. subtilis E44 en los medios de cultivo evaluados, con el uso del método de ajuste en el programa Microsoft Excel. A partir de estos valores, se calculó el tiempo de duplicación (td): td=ln 2/μ Determinación de la actividad de enzimas xilanasas. La actividad de las enzimas xilanasas se determinó según método descrito por Bailey et al. 1992. Una unidad de actividad enzimática se define como la cantidad de enzima requerida para producir 1µmol de xilosa por minuto.
Determinación de la actividad de enzimas proteasas. La actividad de las enzimas proteasas se determinó mediante el método de Anson (1938). Una unidad de actividad enzimática se define como la cantidad de enzima requerida para producir 1µmol de tirosina por minuto.
Análisis estadístico. Los procedimientos estadísticos se realizaron con el uso del software InfoStat (Di Rienzo et al. 2012). Para el tratamiento de los índices de potencia (IP) se realizó un análisis de varianza, según diseño completamente aleatorizado y se aplicó la dócima de Duncan (1955), para P < 0.05. Los valores que se muestran en las tablas y figuras corresponden a la media de tres repeticiones.
Resultados y Discusión
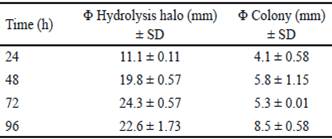
La producción de enzimas xilanasas por Bacillus subtilis E44 en presencia de xilano de haya (1%), como única fuente de carbono, se evidenció por la presencia de zonas claras alrededor de las colonias después del revelado con rojo congo. Este colorante muestra fuertes interacciones con polisacáridos unidos por enlaces β 1,4. Al producirse la hidrólisis de estos compuestos, las interacciones entre el colorante y los polisacáridos se pierden y a su vez, la coloración del halo correspondiente al área en la que la bacteria secretó las xilanasas.
Bacillus subtilis E44 mostró gran actividad xilanolítica a las 24, 48, 72 y 96 h. Los diámetros de los halos de hidrólisis mostraron valores entre 10 y 25 mm para los tiempos evaluados (tabla 1). El mayor valor se obtuvo a las 72 h de incubación con 24.7 mm. Estos resultados coinciden con los obtenidos por Akhavan et al. (2011), al evaluar 40 cepas de Bacillus mojavensis, que generaron halos con diámetros comprendidos entre 18-35 mm después de la tinción con rojo congo. Tork (2013) seleccionó 13 cepas productoras de xilanasas, aisladas de diferentes muestras, que exhibieron halos entre 13-22 mm de diámetro alrededor de las colonias.
Table 1 Qualitative evaluation of xylanase enzymes of Bacillus subtilis E44, in beech xylan as the only carbon source
Varios autores utilizan este método para evaluar, de una manera rápida, la producción de enzimas extracelulares por los microorganismos (Braga et al. 2014 y Chafla et al. 2016). Incluso, Cayetano-Cruz et al. (2016) evaluaron la expresión de genes recombinantes de xilanasa (xyn 11 A) en Pichia pastoris mediante la aplicación de la técnica en los clones obtenidos con agar xilano como sustrato.
La tabla 2 muestra el análisis de varianza de los índices de potencia (IP) calculados. El mayor IP se obtuvo a las 72 h, y coincide con el tiempo en el que se obtuvo el mayor halo de hidrólisis. A las 96 h, hubo disminución del IP. Sin embargo, el diámetro de la colonia obtenido en este tiempo fue superior respecto al valor del halo de hidrólisis (tabla 1). Esta disminución del IP podría estar asociada al aumento del diámetro de la colonia, debido a la esporulación de B. subtilis E44, período en el que no se observa incremento en el consumo de nutrientes (Milian 2009).
Los resultados indican que la producción de enzimas xilanasas por Bacillus subtilis E44 depende del tiempo en el ensayo cualitativo en placas. Chafla et al. (2016) también utilizaron este indicador en la selección de celulasas. Asimismo, Braga et al. ( 2014) lo emplearon en la selección de feruloil esterasa en hongos aislados de diferentes fuentes. Los valores obtenidos en este estudio superan los informados por los autores antes mencionados.
La cinética de crecimiento de Bacillus subtilis E44 en los medios de cultivo evaluados se muestra en la figura 1. En el medio de cultivo caldo nutriente (CN), la fase exponencial comienza muy temprano y se extiende hasta las 4 h. A partir de este tiempo, se inicia la fase de desaceleración del crecimiento. Sin embargo, en el medio MS+X, la fase exponencial comenzó a las 4 h y se extendió hasta las 12 h.
Table 2 Power index obtained for Bacillus subtilis E44, in beech xylan as the only carbon source
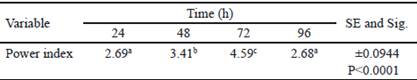
a, b, c Different letters indicate significant differences for P < 0.05

Figure 1 Growth kinetics of Bacillus subtilis E44 in nutrient broth and in a medium of salts plus beech xylan
Este comportamiento se podría asociar a las diferencias existentes en la composición de ambos medios. El CN contiene glucosa, que garantiza la disponibilidad de una fuente de carbono simple en el medio y de fácil utilización por la bacteria. En el medio MS+X, cuya única fuente de carbono es el xilano de haya, los polisacáridos presentan estructuras complejas, que precisan de enzimas sintetizadas por la bacteria para su degradación. Luego se emplean los productos de hidrólisis como fuente de carbono, lo que ocurre durante la fase logarítmica.
El comportamiento gráfico del crecimiento se corresponde con los valores de velocidad específica de crecimiento (tabla 3). Una vez que se inicia la fase exponencial en el medio MS+X, el tiempo de duplicación es superior al obtenido en el medio CN. Esto confirma la capacidad xilanolítica de la cepa.
Milián (2009) comparó dos medios de cultivo para la producción de B. subtilis E44, con valores de velocidad específica de crecimiento de 0.66 h-1, en un medio de cultivo tradicional y 1.00 h-1 en el medio optimizado, a partir de componentes nacionales.
Resultados similares informó Ho (2015), al evaluar diferentes residuos agroindustriales como fuente de carbono y xilano de haya como control para la producción de xilanasas por Bacillus subtilis ATCC 6633 durante la fermentación sumergida. El xilano de haya, que se utilizó como control positivo, mostró notable incremento en la actividad de las xilanasas, mientras que la cáscara de cebada se usó para evaluar el crecimiento de la bacteria y la actividad de dichas enzimas.
Al analizar la cinética de crecimiento (figura 1) y la actividad de las xilanasas durante el crecimiento (figura 2), se observó correspondencia entre ambos perfiles. La actividad de las xilanasas se incrementa desde las primeras horas. El máximo valor se encontró al final de la fase exponencial y se mantiene elevada durante la fase estacionaria. Abo-State et al. (2013) informaron una correlación directa entre el perfil del crecimiento microbiano y la producción de xilanasas y celulasas en especies de Bacillus. De la misma manera, Ho (2015) refirió correlación entre la biomasa microbiana y la expresión de xilanasas en Bacillus subtilis ATCC 6633.

Figure 2 Xylanase activity of the enzymatic preparation in broth and medium of minimum salts plus beech xylan
Una de las mayores limitaciones en la producción de enzimas extracelulares a partir de especies del género Bacillus, es la susceptibilidad de estas proteínas a la degradación por enzimas proteolíticas (Westers et al. 2006). La evaluación de la actividad proteolítica durante el crecimiento de B. subtilis E44 y su relación con las xilanasas en el medio MS+X se muestra en la figura 3.
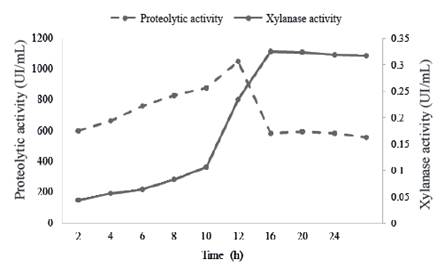
Figure 3 Relation between proteolytic activity (UI/mL) enzymes and xylanase activity of the enzymatic preparation in a MS+X medium
Durante la fase exponencial del crecimiento hubo incremento exponencial de la actividad proteasa, con aumento brusco al final de la fase exponencial, que comienza a disminuir drásticamente después de las 12 h. Esta disminución de las proteasas podría estar relacionada con procesos de inactivación de las mismas.
Estos resultados concuerdan con lo referido por Sevinc y Demirkan (2011), quienes informaron una cepa productora de proteasas. Según informan estos autores, el máximo de actividad ocurre al final de la fase de crecimiento exponencial.
Las proteasas desempeñan importantes funciones en el control de la calidad de proteínas desnaturalizadas o con defectos conformacionales, después de eventos post-traduccionales (Westers et al. 2008). Las peptidasas se expresan de forma constitutiva y tienen, temporalmente, diferentes afinidades por los sistemas secretores de pre-proteínas (Ling et al. 2007), lo que constituye uno de los principales problemas en la producción de proteínas heterólogas en Bacillus subtilis.
Estos resultados sugieren que la producción de proteasas está directamente relacionada con el crecimiento exponencial del cultivo, caracterizado por el incremento del metabolismo celular y la síntesis proteica. Cristina et al.(2004) informaron resultados similares en un cultivo de Bacillus sp SMIA-2, en el que la producción de proteasas alcanzó el máximo a las 9 h y comenzó a disminuir posteriormente.
A partir de obtenido en este estudio, se puede afirmar que Bacillus subtilis E44 produce enzimas xilanasas, capaces de degradar el xilano de haya, y utilizar los azúcares simples obtenidos durante su crecimiento y desarrollo. La diferencia en los tiempos de máxima expresión entre proteasas y xilanasas se podría utilizar para incrementar los rendimientos de las enzimas xilanasas durante la fermentación sumergida de Bacillus subtilis E44 en el medio MS+X.
Se concluye que Bacillus subtilis E44 produce enzimas xilanasas, al utilizar el xilano como fuente de carbono. Estas enzimas se podrían aplicar en dietas con elevado contenido de fibra en animales monogástricos.
Agradecimientos
El colectivo de autores agradece la colaboración del Departamento de Matemática del Instituto de Ciencia Animal por el análisis estadístico realizado.
REFERENCIAS
Abo-State, M., Ghaly, M. & Abdellah, E. 2013. Optimization of Cellulase(s) and Xylanase Production by Thermophilic and Alkaliphilic Bacillus Isolates. American-Eurasian J. Ari. & Environ. Sci., 13(4): 553-564. [ Links ]
Akhavan Sepahy, A., Ghazi, S., & Akhavan Sepahy, M. 2011. Cost-Effective Production and Optimization of Alkaline Xylanase by Indigenous Bacillus mojavensis AG137 Fermented on Agricultural Waste. Enzyme Research, Article ID 593624,ISSN: 2090-0414, DOI: 10.4061/2011/593624. [ Links ]
Anson, ML. 1938. The estimation of pepsin, trypsin, papain, and cathepsin with hemoglobin, Journal of Genetics & Physiology, 22: 79-89. [ Links ]
Bailey, M.J., Biely, P., Poutanen, K. 1992. Inter laboratory testing of methods for assay of xylanase activity. Journal of Biotechnology, 23: 257-270, ISSN: 0168-1656. [ Links ]
Banka, A.L., Guralp, S.A., & Gulari, E. 2014.Secretory expression and characterization of two hemicellulases, xylanase, and b-xylosidase, isolated from Bacillus subtilis M015. Applied Biochemistry and Biotechnology 174:2702-2710, ISSN: 0885-4513. [ Links ]
Braga, C. M. P., Delabona, P. da S., Lima, D. J. da S., Paixão, D. A. A., Pradella, J. G. da C. & Farinas, C. S. 2014. Addition of feruloyl esterase and xylanase produced on-site improves sugarcane bagasse hydrolysis. Bioresource Technology, 170, 316-324, ISSN: 1873-2976, DOI: 10.1016/j.biortech.2014.07.115. [ Links ]
Cayetano-Cruz, M., Itzel, A., Santos, P. D. L., García-huante, Y., Santiago-hernández, A., Pavón-orozco, P. & Hidalgo-lara, M. E. 2016. High level expression of a recombinant xylanase by Pichia pastoris cultured in a bioreactor with methanol as the sole carbon source: Purification and biochemical characterization of the enzyme. Biochemical Engineering Journal, 112: 161-169. http://doi.org/10.1016/j.bej.2016.04.014 [ Links ]
Chafla, A. L., Rodríguez, Z., Boucourt, R., Espín, J., & Silva, L. 2016. Isolation , selection and characterization of cellulolytic fungi from cocoa ( Theobroma cacao L. ) hull Aislamiento , selección y caracterización de hongos celulolíticos a partir de cáscara de cacao ( Theobroma cacao L.), Cuban Journal of Agricultural Science. 50(3): 411-420, ISSN: 2079-3480. [ Links ]
Chakdar, H., Kumar, M., Pandiyan, K., Singh, A., Nanjappan, K., Kashyap, P. L., & Srivastava, A. K. 2016. Bacterial xylanases : biology to biotechnology. Biotechnology, 6(2): 1-15,ISSN: 2190-5738, DOI: 10.1007/s13205-016-0457-z. [ Links ]
Cristina, W., Lelis, M., & Martins, L. 2004. Production and properties of an extracellular protease from thermophilic Bacillus sp. Brazilian Journal of Microbiology, 35, 91-96, ISSN: 1517-8382. [ Links ]
Di Rienzo, J.A., Casanoves, F., Balzarini, M.G., González, L., Tablada, M. & Robledo, C.W. 2012. INFOSTAT. Universidad Nacional de Córdoba, Argentina. Available: Available: http://www.infostat.com.ar . [Consulted: 08/10/2015] [ Links ]
Duncan, D. B. 1955. Multiple Range and Multiple F Tests. Biometrics. 11(1): 1-42, ISSN: 0006-341X, DOI: 10.2307/3001478. [ Links ]
Gupta, V., Garg, S., Capalash, N., Gupta, Nm & Sharma, P. 2015. Production of thermo-alkali-stable laccase and xylanases by co-culturing of Bacillus sp. and B. halodurans for biobleaching of kraft pulp and deinking of waste paper. Bioprocess and Biosystems Engineering, 38:947-956, ISSN: 1615-7605, DOI: 10.1007/ s00449-014-1340-0. [ Links ]
Hahn-didde, D. & Purdum, S. E. 2014. The effects of an enzyme complex in moderate and low nutrient- dense diets with dried distillers grains with solubles in laying hens. Journal of Applied Poultry Research. 23:23-33, http://dx.doi.org/10.3382/japr.2013-00764. [ Links ]
Ho, H. L. 2015. Xylanase Production by Bacillus subtilis Using Carbon Source of Inexpensive Agricultural Wastes in Two Different Approaches of Submerged Fermentation (SmF) and Solid State Fermentation (SsF). Journal of Food Processes & Technology, 6(4), ISSN: 2157-7110, DOI: 10.4172/2157-7110.1000437. [ Links ]
Ling, L.F., Zi, R.X., Wei, F.L., Jiang, B.S., Ping, L. & Chun, X.H. 2007. Protein secretion pathways in Bacillus subtilis: Implication for optimization of heterologous protein secretion. Biotechnology Advances. 25:1-12, ISSN: 0734-9750. [ Links ]
Milián, G. 2009. Obtención de cultivos de Bacillus spp. y sus endosporas. Evaluación de su actividad probiótica en pollos (Gallus gallus domesticus). PhD Thesis. Instituto de Ciencia Animal. La Habana. Cuba. [ Links ]
Schoenlechner, R., Szatmari, M., Bagdi, A. & Tömösközi, S. 2013. Optimization of bread quality produced from wheat and proso millet (Panicum miliaceum L.) by adding emulsifiers, transglutaminase and xylanase. Food Science and Technology 51: 361-366, ISSN: 1226-7708. [ Links ]
Tork, S., Aly, M. M., Alakilli, S. Y., & Al-Seeni, M. N. 2013. Production and characterization of thermostable xylanase from Bacillus subtilis XP10 isolated from marine water. African Journal of Biotechnology.12(8): 780-790, ISSN: 1684-5315, http://doi.org/10.5897/AJB11.4144. [ Links ]
Westers, H., Westers, L., Darmon, E., van Dijl, J.M., Quax, W.J., Zanen, G. 2006.The CssRS two-component regulatory system controls a general secretion stress response in Bacillus subtilis. FEBS J, 273: 3816-3827. [ Links ]
Westers L, Westers H, Zanen G, Antelmann H, Hecker M, Noone D, Devine KM, Maarten JD and Quax WJ. 2008. Genetic or chemical protease inhibition causes significant changes in the Bacillus subtilis exoproteome. Proteomics. 8:2704-2713. [ Links ]
Recibido: 02 de Mayo de 2018; Aprobado: 02 de Agosto de 2018











 texto en
texto en 



