Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cuban Journal of Agricultural Science
versión On-line ISSN 2079-3480
Cuban J. Agric. Sci. vol.52 no.4 Mayabeque oct.-dic. 2018 Epub 25-Oct-2018
Ciencia de los Pastos
Selección de rizobios por su efecto en la germinación y desarrollo incipiente de Moringa oleifera Lam. Fase I: condiciones controladas
1Instituto de Investigaciones de Pastos y Forrajes, Estación Experimental Sancti Spíritus, Apdo. 2255, ZP. 1, C. P. 62200, Sancti Spíritus, Cuba
Se efectuó un ensayo en condiciones controladas para evaluar el efecto de diferentes aislados nativos y cepas de referencia de rizobios en variables agrofisiológicas de Moringa oleifera Lam., así como seleccionar los mejores tratamientos para su evaluación en invernadero o vivero. Se aplicó un diseño completamente aleatorizado con doce tratamientos y 14 repeticiones, se realizó un análisis de ANOVA. Diferencias entre medias por LSD de Fisher. Los valores con conteo de dígitos se transformaron por √x, y los datos porcentuales, por arcosen√P. Se calculó coeficiente correlación entre variables. Se concluye que los aislados JK5, Ho9 y Ho5, ejercieron un efecto positivo superior en la germinación a los 10 y 15 días después de la siembra, así como en la mayoría de las variables. Sin embargo, las cepas de referencia mostraron un índice de eficiencia de la inoculación en el peso seco de la parte aérea, inferior al de los aislados nativos. El 50% de los tratamientos inoculados presentó valores superiores al control absoluto en peso seco de la parte aérea y en peso seco de la raíz, así como superiores al testigo fertilizado en ésta última variable. Por otra parte, la fertilización nitrogenada no mostró efecto positivo en ninguna de las variables que se evaluaron. Es de destacar que existió una correlación estadística moderadamente fuerte entre peso seco de la raíz y peso seco de la parte aérea, así como entre peso seco de la parte aérea e índice de velocidad de la germinación, lo que indica una alta interrelación fisiológica entre estas variables. Se recomienda efectuar ensayos de invernadero o en fase de vivero con los aislados Ho4, JK5 y Ho9.
Palabras-clave: Moringa oleifera; rizobios; variables agrofisiológicas
Introducción
Moringa oleifera Lam. es la especie más conocida de las 13 identificadas en el género Moringa (Font Quer 1975). Presenta bondades nutricionales y farmacéuticas, que la hacen altamente promisoria para su fomento y utilización. Entre las características de esta especie está su rápido crecimiento durante el primer año, donde puede alcanzar de 3 a 5 metros de altura. Por ello es una planta muy exigente a la nutrición mineral durante el primer año y sus deficiencias se observan rápidamente en la coloración del follaje (Pita-Hernández y García-Quiñones 2012).
El efecto de las bacterias rizosféricas benéficas en Moringa oleifera y otras especies arbóreas no pertenecientes a la familia de la Leguminosas se ha estudiado por varios autores (Zayed 2012 y Kannan y Rajendran 2015), pero poco se conoce sobre el efecto de los rizobios en la Moringa. No obstante, resultados que se obtuvieron al inocular rizobios en diferentes cultivos no pertenecientes a la familia de las Leguminosas (Bécquer et al. 2012, 2013, 2015), demuestran su utilidad para el desarrollo fenológico y productividad de diferentes cultivos, presumiblemente por su potencial de emisión de sustancias promotoras del crecimiento vegetal, (Machado et al. 2013), así como de solubilización de fosfatos (López et al. 2013), mecanismos que son responsables de inducir una respuesta favorable en la planta.
Aunque se recomienda el uso de abonos orgánicos en la siembra de Moringa (Oquendo 2014), los biofertilizantes pueden mejorar sustancialmente su efecto, por la producción de fitohormonas y por la alta actividad enzimática de las rizobacterias, las cuales inciden positivamente en la germinación y desarrollo fenológico de la planta, así como en su rendimiento (Singh et al. 2011).
Por estas razones, el objetivo general del trabajo fue evaluar el efecto de aislados nativos y cepas de referencia de rizobios en la germinación y desarrollo incipiente de plántulas de Moringa y seleccionar los más eficientes con vistas a una posterior evaluación en condiciones de invernadero o vivero.
Materiales y Métodos
Variedad vegetal. Moringa oleifera L., procedencia Supergenius, provista por la Estación Experimental de Pastos y Forrajes Sancti Spíritus.
Material bacteriano. Se utilizaron 2 cepas de referencia y 8 aislados nativos, los cuales se obtuvieron de nódulos radicales pertenecientes a leguminosas forrajeras procedentes de ecosistemas ganaderos de Cuba y que se caracterizaron previamente por Bécquer et al. (2016) (tabla 1).
Características del substrato. Se utilizó un sustrato no estéril, que contenía 40% de materia orgánica, 40% de suelo Pardo Mullido (Hernández et al. 2015), y 20% de arena de río. Sus características químicas se detallan en la tabla 2.
Procedimiento experimental. Todas las cepas de referencia y aislados nativos de rizobios crecieron en medio sólido levadura-manitol (Vincent 1970). Se resuspendieron en medio líquido levadura-manitol hasta lograr concentración de 107-108 UFC/mL. Previo a la inoculación, se disolvieron los inóculos en una solución isotónica estéril de NaCl (0.9 %), en proporción 1:10.
Siembra e inoculación. El experimento se realizó en bandejas de poliespuma, en casa de cristal, donde las plántulas crecieron en condiciones de luz natural en cámara de 2500 a 3500 lux, con temperaturas de ±27 ºC. La humedad relativa fue de 75/85 %. Se sembraron 2 semillas en cada pozuelo que contenían 120 g de sustrato. En el momento de la siembra se aplicaron 5 mL de inóculo por pozuelo. Al germinar, se raleó para dejar 1 plántula.
Variables que se evaluaron. % de germinación (10 d, 15 d y 20 d), según la fórmula (Ede et al. 2015):
% G: Número de semillas germinadas/número de semillas sembradas x 100
Índice de velocidad de germinación (IVG), según la fórmula (Terry et al. 2014):
Índice de Eficiencia de la Inoculación (IEI, %) (Santillana et al. 2012), según la fórmula: IEI: [(Tratamiento inoculado - Control absoluto)/ Control absoluto] x 100
Además, a los 20 días de siembra (DDS), se midió longitud del tallo (LT, cm) (con regla graduada desde el nivel del sustrato hasta el ápice de la rama apical), longitud de la raíz (LR, cm), número de hojas (NH), peso seco parte aérea (PSPA, g) y peso seco de la raíz (PSR, g).
Diseño experimental, tratamientos y análisis estadístico. En un diseño completamente aleatorizado, con doce tratamientos (tabla 3) y 14 repeticiones, se realizó un análisis de ANOVA. Hubo un control absoluto (C.A.), y el tratamiento fertilizado (T.F.) consistió en una aplicación de 23.84 mg de NH4NO3/ pozuelo, equivalente a 150 kgN/ha. Las diferencias entre medias se determinaron por LSD de Fisher. Los valores con conteo de dígitos se transformaron por √x, y los datos porcentuales, por arcosen√P. Se calculó el coeficiente de correlación entre variables (Sigarroa, 1985). Se utilizó el programa estadístico Stat Graphics Centurion (Stat Point Technologies 2010).
Resultados y Discusión
Al evaluar la germinación de las semillas, se observa que a los 10 DDS, los tratamientos inoculados con los aislados JK5 (64.3%), y Ho9 (57.1%) presentan los valores superiores (P<0.0001) en relación con el resto de los tratamientos, donde se incluyen el control absoluto (28.6 %) y el testigo fertilizado (35.7 %) (figura 1). Sin embargo, a los 15 DDS, JK5 muestra valores inferiores (85.7 %) con respecto a Ho5 (92.9 %) y Ho9 (92.9 %), los cuales a su vez fueron superiores (P<0,0001) al resto de los tratamientos inoculados, e igualan al testigo fertilizado (92.9 %).
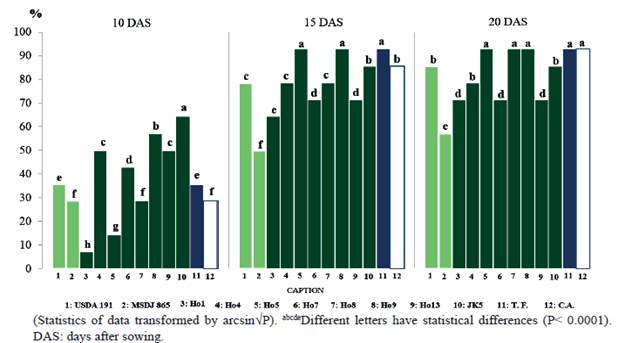
Figure 1 Percentage of germination of seeds of Moringa oleifera, at 10 DAS (SD: 0.0848, P<0.0001); 15 DAS (SD: 0.0699, P<0.0001) and 20 DAS (SD: 0.0661, P<0.0001)
Por otra parte, a los 20 DDS, JK5 muestra valores inferiores (85.7 %) a Ho5 (92.9 %), Ho9 (92.9 %) y Ho8 (92.9 %), los cuales fueron superiores (P<0.0001) al resto de los tratamientos inoculados, aunque con valores similares al testigo fertilizado (92.9 %) y al control absoluto (92.9 %).
Ninguna de las dos cepas de referencia influyó notablemente en la germinación en todo el período evaluativo y sí mostraron valores bajos en cada momento de evaluación, sobre todo MSDJ 865.
Estos resultados indican que el mayor impacto de la inoculación con rizobios se realizó a los 15 DDS. Nótese que el aislado JK5 ejerció mayor efecto a los 10 DDS, sin embargo, ese tratamiento resultó inferior a Ho5 y Ho8, así como al testigo fertilizado (15 y 20 DDS) y al control absoluto (20 DDS), sin embargo, el tratamiento inoculado con Ho9 mantuvo superioridad en sus valores desde los 10 DDS hasta los 20 DDS. El tratamiento inoculado con Ho8 fue superior sólo a los 20 DDS. Al parecer, las sustancias hormonales emitidas por diferentes cepas de estas bacterias tienen un efecto limitado en el desarrollo del embrión con respecto al tiempo de aplicación, lo que no necesariamente impide su efecto positivo en otras variables fisiológicas de la planta. También es posible que el efecto en algunas semillas se retardó debido a la impermeabilidad de la corteza seminal, lo cual provoca dormancia temporal y afecta de cierto modo la germinación (Kassa et al. 2010).
Santillana et al. (2005), observaron que el 47 % de las cepas de rizobios que evaluaron, presentaron efecto estimulante en las semillas de tomate, lo que resultó en una mejor germinación, posiblemente debido a la habilidad de los rizobios para producir hormonas como el ácido indolacético, ácido giberélico y citoquininas, sustancias reguladoras del crecimiento de las plantas. Cassán et al. (2009) encontraron que una cepa de Bradyrhizobium japonicum que estimuló la germinación y el desarrollo incipiente de la parte aérea de maíz, produjo abundante ácido indolacético, zeatina y ácido giberélico, lo que sustenta la posibilidad que estas propiedades de los rizobios hayan incidido positivamente en la germinación, con mejores resultados en los tratamientos inoculados con las cepas antes mencionadas.
En la figura 2 se observa que los mayores índices de velocidad de la germinación (IVG), correspondieron a los tratamientos inoculados con el aislado Ho9 (2.32), similar al testigo fertilizado (2.52), así como JK5 (2.30). Estos tratamientos fueron superiores (P<0.0001) al control absoluto y al resto de los tratamientos que se evaluaron.
El IVG es una variable importante que se relaciona con el vigor de las semillas, al tener en cuenta el número de éstas que germinan y el tiempo que requieren para lograrlo (Meot-Duros y Magné, 2008). Según Mia et al. (2012), el IVG determina el estado de salud de la plántula y finalmente el estado de productividad de la planta.
Evidentemente, los tratamientos inoculados con los aislados que se mencionan, influyeron significativamente en dicha variable. Es posible que estos presentaron mayor actividad de ácido giberélico, el cual puede romper la latencia de las semillas y que frecuentemente reemplaza la necesidad de estímulos ambientales, tales como luz y temperatura (Hernández, 2004).
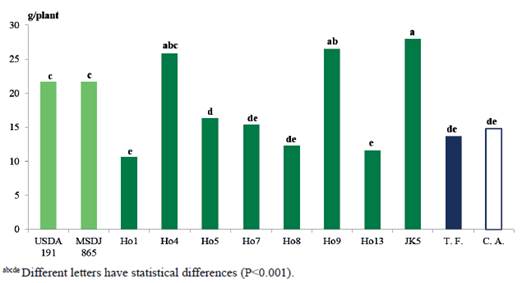
En la figura 3 se muestran los resultados en el peso seco de la parte aérea (PSPA), donde se evidencia la superioridad del tratamiento inoculado con el aislado nativo JK5 (162.5 g/planta) con respecto al resto de los tratamientos, seguido por Ho9 (137.5 g/planta), el cual fue superior (P<0.0001) al control absoluto (109.0 g/planta), testigo fertilizado (119.9 g/planta), Ho13 (109.5 g/planta), Ho5 (104.9 g/planta), así como las cepas de referencia USDA 191 (115.2 g/planta) y MSDJ 865 (103.1 g/planta).
Por otra parte, al calcular el Índice de Eficiencia de la Inoculación (IEI) (figura 4), sobre la base del PSPA, se confirmó que los tratamientos inoculados con los aislados JK5 (49.1%) y Ho9 (26.1%) presentaron los mayores incrementos con respecto al control no inoculado. En general, se constató en dicha variable una mayor eficiencia de los aislados nativos, en comparación con las cepas de referencia.
Estos resultados están en contradicción con lo que Mazher et al. (2014) observaron, que la inoculación con rizobios no ejerció efecto positivo en las variables de biomasa aérea en Moringa oleifera. No se descarta la posibilidad que, en el presente experimento, esta variable esté relacionada con el incremento de valores en el peso seco de la raíz debido a la fuerte actividad enzimática de los aislados anteriormente mencionados, y así pudieran incidir en la mayor absorción de nutrientes por la planta (McCully 2001).
En la figura 5 se constata, en el No. de hojas, que el tratamiento inoculado con el aislado Ho9 (29) fue superior (p<0,0001) al control absoluto (23), a los tratamientos inoculados con MSDJ 865 (21), Ho13 (21), Ho1 (22), Ho8 (22) y USDA 191 (23). Así mismo, presentó valores similares al testigo fertilizado (28), y a los tratamientos inoculados con JK5 (27), Ho7 (26), y Ho4 (26).
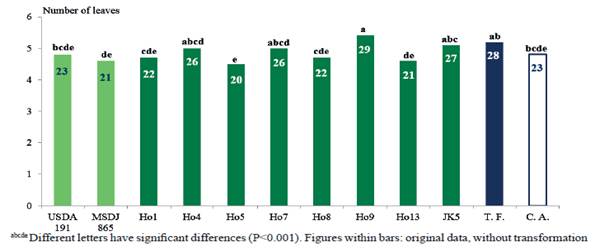
Figure 5 Number of leaves per planlet of Moringa oleifera (Data transformed by √x: S. D.: 0.5702, P<0.001).
En esta variable, se puede observar el efecto estimulador de una de los aislados (Ho9), que mostró resultados superiores en PSPA, y lo mostró también en la emisión de hojas.
Según Mia y Shamsudin (2010), la síntesis de auxinas por los rizobios se demuestra ampliamente, por lo que no se descarta que en el aislado Ho9 existiera una fuerte actividad de dichas enzimas, las cuales son responsables de la dominancia apical.
Aunque no se cuenta con literatura abundante sobre el efecto de los rizobios en esta variable en Moringa, Mazher et al. (2014) encontraron que la aplicación de varios biofertilizantes comerciales basados en rizobios y otras bacterias estimuladoras del crecimiento vegetal influyó favorablemente en el número de hojas/planta en Moringa, al compararlo con el control no inoculado.
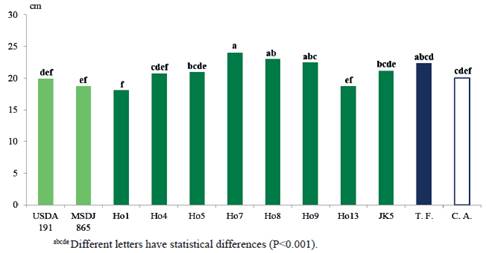
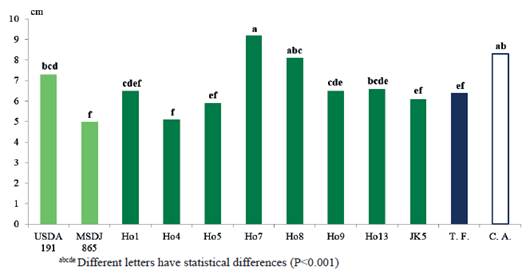
En la figura 6 se observa, en la longitud del tallo (LT), que el tratamiento inoculado con el aislado nativo Ho7 (24.0 cm) mostró resultados similares a Ho8 (23.0 cm) y Ho9 (22.5 cm), así como al testigo fertilizado (22.4 cm) y fue superior (P<0.0001) al resto de los tratamientos inoculados, y al control absoluto (20.0 cm).
Es de inferir, de acuerdo con estos resultados, que la producción de fitohormonas por parte de los aislados correspondientes, debió incidir no sólo en el sistema radical, sino que a través de éste pudiera influir positivamente en las variables de desarrollo de la parte aérea, como peso seco y longitud del tallo. También Yanni et al. (2001) y Rosenblueth y Martínez-Romero (2006), consideraron que rizobios y otros microorganismos pueden penetrar las raíces de las especies no leguminosas a través de las grietas o por los puntos de la aparición lateral de la raíz y establecerse en el xilema y en los espacios intercelulares de las plantas, por lo que el radio de acción de los metabolitos emitidos por las bacterias puede llegar lejos del sistema radical. De acuerdo a informes de Mia et al. (2012), la elongación del tallo en semillas de arroz, al ser inoculadas con diferentes cepas de rizobios y bacterias dinitrofijadoras de vida libre, se debe a la producción de giberelina por parte de las bacterias de ambos grupos, por lo que se infiere que Ho7, Ho8 y Ho9, presentan alta actividad de dicha fitohormona.
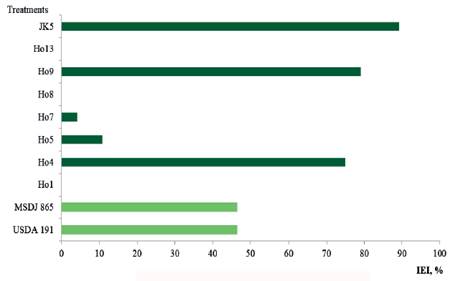
También en la variable peso seco de la raíz (PSR) (figura 7), el tratamiento inoculado con el aislado nativo JK5 presentó el mayor valor (28.0 g/planta) en comparación con la mayor parte de los tratamientos, aunque sus valores coinciden en mayor medida con Ho9 (26.5 g/planta) y con Ho4 (25.9 g/planta). Se observó que el 50 % de los tratamientos inoculados mostraron valores superiores (P<0.0001) a los del control absoluto (14.8 g/planta) y del testigo fertilizado (13.7 g/planta). Al calcular el IEI sobre la base de esta variable (figura 8), se comprobó la superioridad de los tratamientos inoculados con JK5, Ho9 y Ho4 con respecto al control absoluto, con índices de 89.2 % (JK5), 79.1% (Ho9). El tratamiento inoculado con Ho4 (75.0 %) también mostró incrementos superiores.
Zayed (2012) encontró un aumento significativo de la longitud y peso seco de la raíz de Moringa oleifera, al inocularla con Azotobacter chroococcum y Sacharomyces cerevisae; microorganismos los cuales, al igual que los rizobios, producen sustancias estimuladoras del crecimiento vegetal. En tal sentido, Perrine et al. (2004), así como Kumari et al. (2009), sostienen que las moléculas promotoras del crecimiento como el ácido indolacético, las giberelinas y las citoquininas producidas por los rizobios presentes, ya sea en la rizosfera o en tejidos de las plantas, estimulan el mayor desarrollo radical e incrementan la capacidad de absorción de nutrientes de la raíz en su beneficio.
En la longitud de la raíz principal (LRP) (figura 9), el tratamiento inoculado con Ho7 fue superior (P<0.0001) con valores de 9.2 cm al resto de los tratamientos, excepto al control absoluto (8.3 cm) y Ho8 (8.1 cm).
Estos resultados no concuerdan con autores como Mayak et al. (2004) quienes hacen mención sobre la habilidad de los rizobios para producir ACC (1-AminoCiclopropano, 1-Ácido Carboxílico) diaminasa, compuesto que reduce el nivel de etileno en las raíces de las plantas, por ser ACC su precursor, con el consiguiente incremento de la longitud y el crecimiento de las raíces al disminuir dicho compuesto. Se infiere que a pesar de que los tratamientos inoculados con Ho7 y Ho8, sobresalieron con respecto a los inoculados con el resto de las cepas y aislados nativos que se aplicaron, en general, la producción de sustancias estimuladoras del crecimiento vegetal por parte de los rizobios, no favoreció el desarrollo longitudinal de la radícula. Según Lynch (1983), las auxinas, las cuales son producidas por los rizobios y otras rizobacterias, inhiben la elongación de las raíces de las plantas, aunque favorecen su engrosamiento.
Al calcular la correlación entre PSPA y PSR, en los tratamientos inoculados, se determinó que el coeficiente fue de 0.57 (P<0.0001; E. E.: 24.09), También se calculó la correlación entre PSPA y el IVG, donde el coeficiente fue similar al anterior: 0,60 (p<0,05; E. E.: 15,22). Ambos coeficientes indican una relación entre variables moderadamente fuerte (Sigarroa, 1985).
Los datos que se muestran sugieren una estrecha relación fisiológica entre las variables analizadas en aquellos tratamientos donde se aplicaron las cepas de rizobios, donde llama la atención la correlación entre el PSPA y el IVG, lo que indica una posible dependencia del desarrollo de la biomasa aérea con respecto al vigor de las semillas. La correlación fuerte entre PSPA y PSR pudiera explicar los resultados que se obtuvieron en ambas variables, donde los tratamientos inoculados con Ho9 y JK5 presentaron valores superiores, indistintamente de la variable que se evaluó.
Se concluye que los aislados JK5, Ho9 y Ho5, ejercieron un efecto positivo superior en la germinación a los 10 y 15 DDS, así como en la mayoría de las variables. Sin embargo, las cepas de referencia mostraron un índice de eficiencia de la inoculación en PSPA, inferior al de los aislados nativos. El 50% de los tratamientos inoculados presentó valores superiores al control absoluto en PSPA y en PSR, así como superiores al testigo fertilizado en ésta última variable. Por otra parte, la fertilización nitrogenada no mostró efecto positivo en ninguna de las variables que se evaluaron. Es de destacar que existió una correlación estadística moderadamente fuerte entre PSR y PSPA, así como entre PSPA e IVG, lo que indica una alta interrelación fisiológica entre estas variables.
Se recomienda efectuar ensayos de invernadero o en fase de vivero con los aislados Ho4, JK5 y Ho9.
References
Bécquer, C. J., Galdo, Y., Ramos, Y., Peña, M. D., Almaguer, N., Peña, Y. F., Mirabal, A., Quintana, M. & Puentes, A. 2016. Rhizobia isolated from forage legumes of an arid cattle rearing ecosystem in Holguín, Cuba. Morpho-cultural evaluation and nodulation (Phase I). Cuban Journal of Agricultural Science, 50(4): 607-617, ISSN: 2079-3480. [ Links ]
Bécquer, C. J., Lazarovits, G., Nielsen, Laura, Quintana, Maribel, Adesina, Modupe, Quigley, Laura, Lalin, I. & Ibbotson, C. 2015. Efecto de la inoculación con bacterias rizosféricas y Trichoderma en trigo (Triticum aestivum L.) . Pastos y Forrajes. 38(1): 111-116. [ Links ]
Bécquer, C. J., Nápoles, J. A., Álvarez, O., Ramos, Y., Quintana, M. & Galdo, Y. 2012. Respuesta de diferentes variedades de cereales a la inoculación con Bradyrhizobium sp. Rev. Mexicana de Ciencias Agrícolas. 3(1): 187-200. [ Links ]
Bécquer, C. J., Salas, B., Slaski, J., Archambault, D. & Anya, A. 2013. Influence of rhizopheric bacteria on germination and initial growth of Sporobolus cryptandrus (Torr.) A. Gray. Cuban Journal of Agricultural Science , 47(4): 431-436. [ Links ]
Cassán, F., Perrig, D., Sgroy, V., Masciarelli, O., Penna, C. & Luna, V. 2009. Azospirillum brasilense Az39 and Bradyrhizobium japonicum E109, inoculated singly or in combination, promote seed germination and early seedling growth in corn (Zea mays L.) and soybean (Glycine max L.). European J. of Soil Biol. 45: 28-31. [ Links ]
Ede, A. E., Ndubuaku, U. M. & Baiyeri, K. P. 2015. Media Effects on Emergence and Growth of Moringa (Moringa oleifera Lam) Seedlings in the Nursery. American Journal of Experimental Agriculture, 7(3): 182-189, ISSN: 2231-0606. [ Links ]
Font Quer, P. 1975. Diccionario Botánico. Edit. Labor S.A. Barcelona. 1244 p. ISBN: 84-335-5804-8. [ Links ]
Hernández, S. V. 2004. Efecto de la luz, temperatura y ácido giberélico sobre la germinación de semillas de poblaciones de chiles silvestres. Facultad de Agronomía, Universidad Autónoma de Sinaloa. Primer Convenio Mundial del Chile, p. 441. [ Links ]
Hernández, A., Pérez, J. M., Bosch, D. & Castro, N. 2015. Clasificación de los Suelos de Cuba 2015. Ediciones INCA. Mayabeque, Cuba, 64 p. ISBN: 978-959-7023-77-7. [ Links ]
Kannan, M. & Rajendran, K. 2015. A sustainable agro-biotechnology for quality seedling production of Jatropha curcas L. in tropical nursery conditions. Int. Curr. Res. Aca. Rev. 3(2): 92-103. [ Links ]
Kassa A., Alia R., Tadesse W., Pando V. & Bravo F. 2010. Seed germination and viability in two African Acacia species growing under different water stress levels. African J. Pl. Sci. 4(9): 353-359. [ Links ]
Kumari, B.S., Ram, M. R. & Mallaiah, K. V. 2009. Studies on exopolysaccharide and indole acetic acid production by Rhizobium strains from Indigofera. African Journal of Microbiology Research. 3: 10 - 14. [ Links ]
López, M. del P., Criollo, P. J., Gómez, R. M., C., M., Estrada, G., Garrido, M. F. & Bonilla, R. 2013. Caracterización de bacterias diazotróficas solublizadoras de fosfato como promotoras de crecimiento en plantas de maíz. Rev. Colomb. Biotecnol. 15(2): 115-123. [ Links ]
Lynch, J. M. 1983. Soil biotechnology. Microbial factors in crop productivity. Blackwell Scientific Publications. 191 p. ISBN 0 632 00952 7. [ Links ]
Machado, R. G., de Sá, E. L. S., Bruxel, M., Giongo, A., Santos, N. da S. & Nunes, A. S. 2013. Indoleacetic Acid Producing Rhizobia Promote Growth of Tanzania grass (Panicum maximum) and Pensacola grass (Paspalum saurae). International Journal of Agriculture & Biology, 15(5): 827‒834, ISSN: 1560-8530, 1814-9596. [ Links ]
Mayak, S., Tirosh, T. & Glick, B. 2004. Plant growth promoting bacteria confer resistance in tomato plants to salt stress. Plant Physiology and Biochemistry. 42: 565-572. [ Links ]
Mazher, A., Abdel-Aziz, N., El-Dabh, R. S., El-Khateeb, M. A. & Abd El-Badaie, A. A. 2014. Effect of biofertilization on growth and constituents of Moringa oleifera Lam. Plants. Middle East Journal of Agriculture Research. 3(4): 793-798. [ Links ]
McCully M. E. 2001. Niches for bacterial endophytes in crop plants: a plant biologist´s view. Australian Journal of Plant Physiology. 28: 983 - 990. [ Links ]
Meot-Duros, L. & Magné, C. 2008. Effect of salinity and chemical factors on seed germination in the halophyte Crithmum maritimum. Plant and Soil. 313(1-2): 83-87. [ Links ]
Mia, M. A. B. & Shamsuddin, Z. H. 2010. Rhizobium as a crop enhancer and biofertilizer for increased cereal production¨. African Journal of Biotechnology. 9(37): 6001-6009. [ Links ]
Mia, M.A. B., Shamsuddin, Z. H. & Mahmood, M. 2012. Effects of rhizobia and plant growth promoting bacteria inoculation on germination and seedling vigor of lowland rice. African Journal of Biotechnology . 11: 3758-3765. [ Links ]
Oquendo, G. 2014. Descripción, establecimiento y uso de las principales arbóreas: Moringa oleifera. In: Uso de arbóreas como recurso sostenible para la crianza animal. Ed.: José M. Argenter, Holguín. Cuba. 112 p. [ Links ]
Perrine, F., Rolfe, B., Hynes, M. & Hocart, C. 2004. Gas chromatography-mass spectrometry analysis of indolacetic acid and tryptophan following aquerous chloroformate derivatisation of Rhizobium exudates. Plant Physiology and Biochemistry . 42: 723 - 729. [ Links ]
Pita-Hernández, A., García-Quiñones, E. 2012. Efectos del Glomus fasciculatum en la nutrición de Moringa oleifera Lam. Rev. Avances. 14(3): 241-250. [ Links ]
Rosenblueth, M., Martínez-Romero, E. 2006. Bacterial endophytes and their interactions with hosts. Molecular Plant-Microbe Interactions, 19(8): 827 - 837. [ Links ]
Santillana, N., Arellano, C. & Zúñiga, D. 2005. Capacidad del Rhizobium de promover el crecimiento en plantas de tomate (Lycopersicon esculentum Miller). Ecología Aplicada. 4(1,2): 47-51. [ Links ]
Santillana, N., Zúñiga, D., Arellano, C. 2012. Capacidad promotora del crecimiento en cebada (Hordeum vulgare) y potencial antagónico de Rhizobium leguminosarum y Rhizobium etli. Agrociencia Uruguay. 16(2):11-17. [ Links ]
Sigarroa, A. 1985. Biometría y diseño experimental. I Parte. Ed. Pueblo y Educación. 394 p. SNLC.CU 01.2665 1.9. [ Links ]
Singh, J., Pandey, C., Singh, D.P. 2011. Efficient soil microorganisms: A new dimension for sustainable agriculture and environmental development. Agriculture, Ecosystems and Environment. 140: 339-353. [ Links ]
Stat Point Technologies 2010. Statgraphics Centurion version XVI. Available: http://statgraphics-centuriónsoftware.informser.com/download/ [ Links ]
Terry, E., Ruiz, J., Tejeda, T. & Reynaldo, I. 2014. Efectividad agrobiológica del producto bioactivo Pectimorf® en el cultivo del Rábano (Raphanus sativus L.) . Cultivos Tropicales. 35(2): 105-11. [ Links ]
Vincent, J. M. 1970. A manual for the practical study of root nodules bacteria. Blackwell Sci. Publications. Oxford and Edinburgh. 164 p. [ Links ]
Yanni, Y., Rizk, R., Fattah, F. K. & Squartine, A. 2001. The beneficial plant growth promoting association of Rhizobium leguminosarum bv. trifolii with rice root. Australian Journal of Plant Physiology . 28: 845 - 870. [ Links ]
Zayed, M. S. 2012. Improvement of growth and nutritional quality of Moringa oleifera using different biofertilizers. Annals of Agricultural Sciences. 57(1): 53-62. [ Links ]
Recibido: 13 de Febrero de 2018; Aprobado: 25 de Octubre de 2018











 texto en
texto en