Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.37 no.1 Santiago de Cuba ene.-abr. 2017
ARTICULO ORIGINAL
Adsorción de NI(II) en carbón activado de conchas de coco modificado con soluciones de Ácido Nítrico
Adsorption of NI (II) on activated Carbon of Coconut shell Chemicaly Modifieded with Acid Nitric Solutions
Ing. Mónica Hernández-RodríguezI, Ing. Alexis Otero-CalvisI, Dr. José Falcón-HernándezII, Dr. Yan YpermanIII
I: Instituto Superior Minero Metalúrgico Antonio Núñez Jiménez. mhernandezr@ismm.edu.cu
II: Universidad de Oriente, Santiago de Cuba
III: Universidad de Hasselt
Resumen
En la investigación se estudió el efecto de la modificación del carbón activado granular de conchas de coco con soluciones diluidas de ácido nítrico, en sus características químicas y capacidad de remoción de los iones de níquel (II) presentes en soluciones modeladas de sulfatos, con características semejantes al licor ácido residual de la industria del níquel. La caracterización de los materiales adsorbentes evidenció que el proceso de modificación incrementa los grupos superficiales ácidos conforme con el aumento de la concentración de ácido nítrico empleada en el tratamiento, mientras que las pruebas de equilibrio de adsorción realizadas con soluciones de concentraciones entre 0,5 y 3,5 g/L de la especie metálica reflejaron que el proceso es descrito por el modelo de Freundlich. El efecto de la modificación química del material adsorbente en la capacidad de adsorción de los iones de níquel (II) se evaluó mediante la aplicación de un diseño experimental tradicional a pH de 1,2 y 6,9 unidades, obteniéndose que el acrecentamiento de los grupos ácidos en la superficie del carbón provoca un aumento de la capacidad de adsorción y porcentajes de remoción del níquel (II), debido a las interacciones específicas de estos grupos con los cationes del metal.
Palabras clave: procesos de adsorción, química superficial, carbón activado de cascarón de coco, remoción de níquel (II).
Abstract
In the research the effect of modification of coconut shell activated carbon with diluted solutions of nitric acid, in its chemical characteristics and removal capacity of the nickel (II) ions present in modeling solutions of sulfates with similar characteristics to the acid liquor waste of the nickel industry, was studied. The characterization of the adsorbent material evidenced that the modification process increases the superficial acids groups according with the increase of acid nitric concentration employee in the treatment. The adsorption equilibrium tests, carried out with metallic species solutions at concentrations between 0,5 and 3,5 g/L evidenced that the process is described by Freundlich model. The effect of chemical modification of the adsorbent material in adsorption capacity of nickel (II) ions was evaluated using a traditional experimental design at pH of 1,2 and 6,9 units, obtaining that the increase of acid groups in the carbon surface causes an increase of adsorption capacity and removal percentages of nickel (II), due to specific interactions of these groups with the metal cations.
Keywords: adsorption process, superficial chemistry, coconut shell activated carbon, removal of nickel (II).
INTRODUCCION
Los procesos metalúrgicos constituyen uno de los procesos industriales más agresivos para el medioambiente y la sociedad, por los volúmenes de desechos generados anualmente durante el procesamiento de los minerales y los reactivos altamente contaminantes que se manejan en el proceso.
La empresa metalúrgica "Comandante Pedro Sotto Alba", durante la producción de sulfuros mixtos de níquel y cobalto genera diversos residuales, entre los que se encuentra el licor ácido, conocido como WL (siglas en inglés), que es vertido al río Cabañas sin tratamiento. Debido a su carga contaminante, por la presencia de iones metálicos pesados y bajo pH la necesidad del tratamiento del WL ha generado numerosas investigaciones para minimizar el impacto ambiental negativo en la región y recuperar especies metálicas valiosas, principalmente níquel (II) [2, 7, 16].
Estudios recientes motivados por la versatilidad de los carbones activos en el tratamiento de aguas, adsorción de gases contaminantes y recuperación de especies químicas de efluentes residuales, utilizan carbón activado granular de conchas de coco (CAG) para remover iones de níquel (II) presentes en soluciones acuosas [9].
La capacidad de remoción del CAG está influenciada por la gran superficie activa debido a su elevado y variado grado de porosidad, sin embargo, un aspecto influyente en el proceso de adsorción lo constituye la química superficial del material adsorbente. Varios investigadores [1, 5, 12-14] establecen que la capacidad de remoción de los adsorbentes no está determinada solamente por sus características texturales, sino que los grupos químicos existentes en la superficie ejercen un papel distintivo, producto a las interacciones específicas con el adsorbato.
Por ello el presente estudio evalúa cómo influye la modificación del carbón activado de conchas de coco con soluciones diluidas de ácido nítrico en sus características químicas y en la capacidad para remover iones de níquel (II) presentes en soluciones acuosas con características similares al licor ácido (WL), sin considerar el efecto de otros cationes metálicos presentes en el residual.
FUNDAMENTACION TEORICA
El término adsorción se emplea para describir la existencia de una elevada concentración de cualquier sustancia en la superficie de un líquido o sólido [10].
Esta concentración superficial suele ser bastante mayor que la concentración promedio en el sólido o en el líquido, debido al estado de desbalance de fuerzas moleculares o al estado de insaturación. Como resultado las superficies sólidas y líquidas tienden a completar sus fuerzas atrayendo y reteniendo en sus superficies gases o sustancias disueltas con las cuales estén en contacto. La sustancia así adsorbida en la superficie se denomina fase adsorbida o adsorbato, mientras que la sustancia en la cual está fijada se conoce como adsorbente [10]. El carbón activado es un adsorbente muy versátil, porque el tamaño y distribución de sus poros en la estructura carbonosa le confieren posibilidades de utilización en la purificación en fase gaseosa y líquida. Su superficie interna y variados grupos químicos superficiales, son las principales características responsables de sus propiedades adsorbentes [6, 15].
La superficie de los carbones puede encontrarse combinada en mayor o menor proporción con otros átomos o grupos de átomos distintos al carbono (heteroátomos), entre los que figuran los grupos carboxílicos, lactonas, fenólicos y carbonilos como principales grupos de carácter ácido y los grupos básicos algunos autores lo atribuyen a los grupos pirona, cromeno y electrones π deslocalizados en las capas del grafeno [11, 15].
Todos los carbones presentan en principio un carácter hidrófobo, que puede ser disminuido por la adición de ciertos grupos superficiales, lo que puede conseguirse por oxidación con algún tipo de agente oxidante que crea grupos oxigenados, dando lugar a la adsorción de moléculas de agua, que a su vez adsorberán nuevas moléculas por formación de puentes de hidrógeno, de esta forma se incrementa el carácter hidrófilo, que resulta beneficioso para la adsorción de compuestos inorgánicos en fase acuosa [15].
MATERIALES Y METODOS
Materiales
Soluciones de sulfato de níquel (II)
Las soluciones de sulfato de Níquel (II) utilizadas en los ensayos de adsorción fueron preparadas con las siguientes concentraciones 0,5 g/L, 1 g/L, 2 g/L, 2,5 g/L, 3 g/L y 3,5 g/L a pH de 1,2 y 6,9 unidades, para evaluar el efecto de esta variable (entre la zona ácida y neutral de la solución) durante el proceso de adsorción. El valor mínimo de pH se escogió teniendo en cuenta las características del licor residual y el máximo para garantizar que la especie de interés se encuentre en forma iónica o hidrocomplejos, pues a un valor ligeramente superior (7,7 unidades) comienza la precipitación de hidróxido poco soluble según el siguiente equilibrio a 298 K [3]:
Ni(OH)2(s) = Ni2+(ac) + 2OH-(ac) Kps= 1,6·10-16
Carbón activado granular de conchas de coco
Las características del adsorbente (carbón activado granular de conchas de coco) suministrado por la Planta de Carbón Activado de Baracoa, provincia Guantánamo se relacionan en la tabla 1 que se presenta a continuación. Los ensayos fueron realizados de acuerdo a las normas ASTM.
Tabla 1
Características del carbón activado granular de conchas de coco
| Cenizas (%) | Humedad (%) | Carbono fijo (%) |
| 19,24 | 13,49 | 80,75 |
Métodos
Modificación química del carbón activado de conchas de coco
Entre la amplia variedad de reactivos químicos utilizados para potenciar la formación de grupos superficiales ácidos (H2SO4, H3PO4, H2O2, HNO3, O3, CH3COOH), fue escogido el ácido nítrico por su mejor desempeño en la formación de grupos oxigenados en comparación con los otros agentes oxidantes comúnmente empleados [4, 13]. Se decidió evaluar su actuación utilizando concentraciones diluidas, en el rango de 0,1 - 1 mol/L y para el punto medio de 0,55 mol/L, pues los procedimientos de oxidación con ácido nítrico provocan una disminución del área superficial del carbón, producto a la erosión de las paredes de los microporos, pudiendo esto afectar su capacidad de adsorción [13].
Los tratamientos se desarrollaron durante 2 h a 200 °C, temperatura donde se considera que las fuerzas convectivas ayudaran a la agitación y mezclado entre el material adsorbente y la solución de HNO3. Luego los carbones fueron lavados con abundante agua destilada para remover cualquier exceso de ácido existente en el mismo y posteriormente secados a 110 oC durante 6 h en una estufa de calefacción eléctrica. Las codificaciones de los adsorbentes obtenidos según la concentración de la solución empleada se relacionan en la tabla 2.
Tabla 2
Codificación de los carbones activados
| Tratamiento | Codificación |
| Carbón activado granular (CAG) sin modificar | CAG0 |
| CAG tratado con soluciones de HNO3 de 0,1 mol/L | CAG1 |
| CAG tratado con soluciones de HNO3 de 0,55 mol/L | CAG2 |
| CAG tratado con soluciones de HNO3 de 1 mol/L | CAG3 |
Determinación del contenido de grupos ácidos superficiales (Titulación de Boehm)
Los grupos funcionales ácidos existentes en la superficie del carbón fueron determinados según la titulación de Boehm mediante la adición de 0,5 g de carbón en diferentes beakers conteniendo 50 mL de soluciones de hidrógeno carbonato de sodio (NaHCO3), carbonato de sodio (Na2CO3) e hidróxido de sodio (NaOH) de 0,05 mol/L. Luego de 24 h en agitación se filtra y se valoran 10 mL de filtrado de las soluciones con ácido clorhídrico (HCl) de 0,05 mol/L. Se asume que el NaOH neutraliza los grupos carboxílicos, lactonas y fenólicos, el Na2CO3 los carboxílicos y las lactonas, el NaHCO3 solamente los carboxílicos.
Los grupos superficiales ácidos por gramo de adsorbente se determinaron empleando la siguiente expresión:

Pruebas de equilibrio de adsorción
Las pruebas de equilibrio de adsorción en soluciones modeladas de sulfato de níquel (II) se desarrollaron a valores de pH de 1,2 y 6,9 unidades. La temperatura del sistema se mantuvo a condiciones ambiente, la velocidad de agitación en 200 rpm y se empleó 1 g de adsorbente. Para el desarrollo de las pruebas experimentales se siguió el siguiente procedimiento:
Pesar 1 g de adsorbente y colocarlo en un beaker.
Añadir 50 mL de la solución de sulfato de níquel (II).
Colocar el beaker en el agitador magnético y dejar en agitación durante 6 h (tiempo suficiente para alcanzar el equilibrio).
Filtrar y recolectar el filtrado para determinar la concentración final de la especie metálica.
La concentración final de la especie metálica se determinó mediante espectrofotometría por plasma acoplado inductivamente.
Los porcentajes de adsorción en cada caso fueron estimados a partir de la siguiente expresión:

Isoterma de adsorción de Freundlich
La isoterma de Freundlich de carácter empírico, comenzó a utilizarse extensamente a partir de 1910. Esta ecuación se utiliza tanto en la adsorción de gases sobre sólidos como en la adsorción de sustancias en disolución [7]. Una de las expresiones linealizadas y más utilizadas es la siguiente:

RESULTADOS
Resultados del contenido de grupos ácidos superficiales
En la tabla 3 se relaciona el contenido de grupos ácidos conformados por grupos carboxílicos, lactonas y fenólicos, determinados mediante la titulación de Bohem. Como se observa, los grupos superficiales de carácter ácido se incrementan en correspondencia con el aumento de la concentración de la solución oxidante desde un valor inicial de 0,05 mmol/g alcanzado para el material adsorbente sin modificar hasta valores entre 1,150 y 1,575 mmol/g.
En todos los casos estos grupos se incrementan entre 23 y 32 veces sobre el valor inicial. También es notable un mayor incremento de los grupos carboxílicos, seguidos de los fenólicos y las lactonas excepto para el CAG3, en el cual el orden es el siguiente: carboxílicos, lactonas y fenólicos.
Para el carbón activado sin modificar (CAG0) fue imposible por esta vía determinar el contenido de cada grupo independiente, debido a que los consumos de la solución ácida del agente valorante en cada uno de los casos fueron muy similares a los de la solución básica empleada.
Tabla 3
Contenido de grupos ácidos superficiales
| Carbón | Carboxílicos (mmol/g) | Lactonas (mmol/g) | Fenólicos (mmol/g) | Totales (mmol/g) |
| CAG0 | - | - | - | 0,050 |
| CAG1 | 0,850 | 0,043 | 0,257 | 1,150 |
| CAG2 | 1,250 | 0,019 | 0,281 | 1,550 |
| CAG3 | 0,900 | 0,381 | 0,294 | 1,575 |
Resultados de las pruebas de equilibrio de adsorción
Los resultados de las pruebas de equilibrio de adsorción desarrolladas en soluciones modeladas de sulfato de níquel (II) a pH de 1,2 y 6,9 unidades para los diferentes tipos de carbones se muestran en las tablas 4, 5, 6 y 7.
Tabla 4
Resultados de las pruebas de equilibrio de adsorción a pH de 1,2 unidades para el CAG0 y el CAG1
| Muestra | Concentración de Ni(II)inicial (g/L) | pH final de la solución | Concentración en el equilibrio (g/L) | Porcentaje de adsorción de Ni (II) (%) | ||
| Ni (II) | Na (I) | K (I) | ||||
| CAG0 | 0,5 | 0,59 | 0,145 | 0,000 6 | 0,001 | 71,00 |
| CAG0 | 1,0 | 0,58 | 0,230 | 0,000 6 | 0,001 | 77,00 |
| CAG0 | 2,0 | 0,57 | 0,379 | 0,001 1 | 0,001 | 81,05 |
| CAG0 | 2,5 | 0,63 | 0,489 | 0,000 6 | 0,002 | 80,44 |
| CAG0 | 3,0 | 0,70 | 0,601 | 0,000 7 | 0,001 | 79,97 |
| CAG0 | 3,5 | 0,69 | 0,740 | 0,000 6 | 0,001 | 78,86 |
| Valor promedio del porcentaje de adsorción de Ni (II) (%) | 78,05 | |||||
| CAG1 | 0,5 | 0,57 | 0,162 | 0,038 3 | 0,013 | 67,60 |
| CAG1 | 1,0 | 0,56 | 0,210 | 0,028 0 | 0,014 | 79,00 |
| CAG1 | 2,0 | 0,56 | 0,362 | 0,019 0 | 0,012 | 81,90 |
| CAG1 | 2,5 | 0,64 | 0,437 | 0,009 7 | 0,006 | 82,52 |
| CAG1 | 3,0 | 0,71 | 0,573 | 0,007 9 | 0,004 | 80,90 |
| CAG1 | 3,5 | 0,71 | 0,712 | 0,007 2 | 0,006 | 79,66 |
| Valor promedio del porcentaje de adsorción de Ni (II) (%) | 78,60 | |||||
Los porcentajes promedios de remoción de níquel (II) a pH de la solución de 1,2 unidades varían entre 78,5 % y 78,84 %. Siendo los valores mínimo y máximo puntuales de 67,60 % y 82,52 %, alcanzados con el CAG1 cuando la concentración inicial de níquel (II) es de 0,5 y 2,5 mol/L respectivamente.
Con el CAG3 no se obtiene el mayor porcentaje de remoción, sin embargo, luego de incrementarse la concentración inicial de níquel (II) por encima de 2 g/L, los valores no descienden del 80 %, obteniéndose el mayor promedio (82,52 %).
En todos los casos, los promedios de remoción de níquel (II) no alcanzan el 80 %, pero se observa un ligero incremento con los carbones activados tratados con soluciones de ácido nítrico que presentan mayor contenido de grupos superficiales ácidos, evidenciándose la existencia de interacciones específicas entre estos grupos y los cationes de níquel (II) presentes en la solución.
Tabla 5
Resultados de las pruebas de equilibrio de adsorción a pH de 1,2 unidades para el CAG2 y el CAG3
| Muestra | Concentración de Ni(II)inicial (g/L) | pH final de la solución | Concentración en el equilibrio (g/L) | Porcentaje de adsorción de Ni (II) (%) | ||
| Ni (II) | Na (I) | K (I) | ||||
| CAG2 | 0,5 | 0,57 | 0,136 | 0,001 7 | 0,001 | 72,80 |
| CAG2 | 1,0 | 0,56 | 0,185 | 0,002 0 | 0,001 | 81,50 |
| CAG2 | 2,0 | 0,57 | 0,355 | 0,018 2 | 0,002 | 82,25 |
| CAG2 | 2,5 | 0,65 | 0,455 | 0,011 2 | 0,001 | 80,80 |
| CAG2 | 3,0 | 0,70 | 0,595 | 0,007 9 | 0,000 5 | 80,17 |
| CAG2 | 3,5 | 0,72 | 0,704 | 0,009 2 | 0,000 4 | 79,89 |
| Valor promedio del porcentaje de adsorción de Ni (II) (%) | 78,73 | |||||
| CAG3 | 0,5 | 0,57 | 0,143 | 0,012 6 | 0,053 | 71,40 |
| CAG3 | 1,0 | 0,56 | 0,220 | 0,009 5 | 0,055 | 78,00 |
| CAG3 | 2,0 | 0,56 | 0,379 | 0,008 7 | 0,058 | 81,05 |
| CAG3 | 2,5 | 0,64 | 0,476 | 0,007 1 | 0,055 | 80,96 |
| CAG3 | 3,0 | 0,71 | 0,570 | 0,006 2 | 0,058 | 81,00 |
| CAG3 | 3,5 | 0,71 | 0,677 | 0,007 4 | 0,055 | 80,66 |
| Valor promedio del porcentaje de adsorción de Ni (II) (%) | 78,84 | |||||
A pH de la solución de 6,9 unidades se obtiene el mayor porcentaje de adsorción, 86,10 %) para el carbón con más contenido de grupos superficiales ácidos (CAG3), coincidiendo con la máxima media alcanzada (84,23 %). Los valores promedios de remoción son superiores a los obtenidos cuando el pH inicial de la solución es de 1,2 unidades (ver tablas 4 y 5), variando entre 77,81 y 84,23 %. Es necesario considerar que en este caso la concentración de iones hidronio que compiten por los sitios activos de la superficie del material adsorbente es menor.
Tabla 6
Resultados de las pruebas de equilibrio de adsorción a pH de 6,9 unidades para el CAG0 y el CAG1
| Muestra | Concentración de Ni(II)inicial (g/L) | pH final de la solución | Concentración en el equilibrio (g/L) | Porcentaje de adsorción de Ni (II) (%) | ||
| Ni (II) | Na (I) | K (I) | ||||
| CAG0 | 0,5 | 7,30 | 0,179 | 0,004 5 | 0,001 0 | 64,20 |
| CAG0 | 1,0 | 7,75 | 0,284 | 0,004 5 | 0,000 7 | 71,60 |
| CAG0 | 2,0 | 7,26 | 0,336 | 0,004 6 | 0,000 7 | 83,20 |
| CAG0 | 2,5 | 7,63 | 0,425 | 0,004 5 | 0,000 6 | 83,00 |
| CAG0 | 3,0 | 7,67 | 0,518 | 0,002 0 | 0,000 6 | 82,73 |
| CAG0 | 3,5 | 7,69 | 0,626 | 0,001 6 | 0,003 5 | 82,11 |
| Valor promedio del porcentaje de adsorción de Ni (II) (%) | 77,81 | |||||
| CAG1 | 0,5 | 5,09 | 0,114 | 0,006 6 | 0,001 | 77,20 |
| CAG1 | 1,0 | 5,81 | 0,181 | 0,005 6 | 0,001 | 81,90 |
| CAG1 | 2,0 | 5,10 | 0,350 | 0,005 5 | 0,001 | 82,50 |
| CAG1 | 2,5 | 6,11 | 0,454 | 0,005 3 | 0,001 | 81,84 |
| CAG1 | 3,0 | 5,09 | 0,552 | 0,003 2 | 0,001 | 81,60 |
| CAG1 | 3,5 | 6,04 | 0,690 | 0,003 2 | 0,002 | 80,29 |
| Valor promedio del porcentaje de adsorción de Ni (II) (%) | 80,89 | |||||
El aumento de la concentración de iones potasio (I) y sodio (I) en la solución luego del proceso de adsorción, paralelamente a la disminución del pH (excepto para el CAG0 a pH de 6,9 unidades), indica la existencia de un mecanismo de intercambio iónico de los elementos contenidos en la matriz del carbón por los iones de níquel (II) (ecuaciones 1.1 y 1.2). La reducción del pH de la solución está asociada a la ionización de los grupos ácidos débiles que en soluciones acuosas originan iones hidronio, quedan cargados negativamente y ejercen atracción sobre los cationes de níquel (II) (ecuaciones 1.3 y 1.4). En el caso del CAG0 a pH de 6,9 unidades el ligero incremento en el pH de la solución está originado por la ionización de grupos básicos débiles y adsorción de protones hidronio durante el proceso (ecuaciones 1.5 y 1.6), pues este material adsorbente es el que presenta menor contenidos de grupos ácidos y por consiguiente mayor basicidad.

Tabla 7
Resultados de las pruebas de equilibrio de adsorción a pH de 1,2 unidades para el CAG2 y el CAG3
| Muestra | Concentración de Ni(II)inicial (g/L) | pH final de la solución | Concentración en el equilibrio (g/L) | Porcentaje de adsorción de Ni (II) (%) | ||
| Ni (II) | Na (I) | K (I) | ||||
| CAG2 | 0,5 | 4,00 | 0,127 | 0,003 4 | 0,001 | 74,60 |
| CAG2 | 1,0 | 4,52 | 0,187 | 0,003 5 | 0,001 | 81,30 |
| CAG2 | 2,0 | 4,49 | 0,363 | 0,003 6 | 0,001 | 81,85 |
| CAG2 | 2,5 | 4,41 | 0,515 | 0,003 5 | 0,001 | 79,40 |
| CAG2 | 3,0 | 4,47 | 0,625 | 0,001 8 | 0,001 | 79,17 |
| CAG2 | 3,5 | 4,34 | 0,738 | 0,001 9 | 0,002 | 78,91 |
| Valor promedio del porcentaje de adsorción de Ni (II) (%) | 79,21 | |||||
| CAG3 | 0,5 | 4,09 | 0,093 | 0,004 9 | 0,028 | 81,40 |
| CAG3 | 1,0 | 4,30 | 0,171 | 0,005 0 | 0,030 | 82,90 |
| CAG3 | 2,0 | 4,24 | 0,278 | 0,005 1 | 0,031 | 86,10 |
| CAG3 | 2,5 | 4,20 | 0,351 | 0,003 1 | 0,034 | 85,96 |
| CAG3 | 3,0 | 4,15 | 0,476 | 0,003 1 | 0,034 | 84,13 |
| CAG3 | 3,5 | 4,17 | 0,530 | 0,002 9 | 0,032 | 84,86 |
| Valor promedio del porcentaje de adsorción de Ni (II), (%) | 84,23 | |||||
A ambos valores de pH de la solución se observa una tendencia al acrecentamiento en la remoción, hasta que la concentración inicial de níquel (II) es 2,0 g/L, excepto para el CAG1 a pH de 1,2 unidades que se eleva hasta que la concentración inicial es 2,5 g/L, luego el porcentaje de adsorción desciende ligeramente, indicando que el proceso se favorece con el aumento del gradiente de concentración que origina la difusión de los iones desde el seno de la solución a la superficie del sólido, hasta un valor en el cual el aumento de la fuerza iónica de la solución provoca una disminución en la capacidad de adsorción.
Ajuste al modelo de adsorción de Freundlich
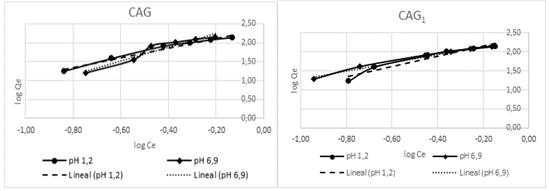
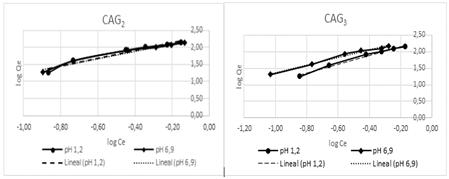
En la tabla 8 se relacionan los parámetros del modelo de Freundlich [8] para cada tipo de carbón activado a pH de la solución de 1,2 y 6,9 unidades. Se lograron coeficientes de regresión superior al 92 % en todos los casos.
A partir del ajuste de los datos experimentales al modelo de Freundlich, se establece que la adsorción del níquel (II) sobre la superficie de los carbones activados puede ocurrir formando multicapas. En todos los casos los valores de 1/n es menor que la unidad, lo que indica un proceso de adsorción favorable y un elevada intensidad de adsorción.
En las figuras 1 y 2 se muestra el ajuste de los datos experimentales al modelo de Freundlich para ambos valores de pH de la solución.
Tabla 8
Parámetros para el modelo de adsorción de Freundlich
| pH 1,2 unidades | pH 6,9 unidades | |||||
| Muestra | A (mg/g) | 1/n | R2 | A (mg/g) | 1/n | R2 |
| CAG0 | 234,10 | 0,79 | 0,9760 | 420,82 | 0,55 | 0,9298 |
| CAG1 | 271,58 | 0,73 | 0,9297 | 235,13 | 0,92 | 0,9817 |
| CAG2 | 236,59 | 0,86 | 0,9513 | 206,21 | 0,93 | 0,9654 |
| CAG3 | 261,10 | 0,76 | 0,9852 | 325,84 | 0,87 | 0,9851 |
Fig. 1 Ajuste al modelo de Freundlich para el CAG0 y CAG1.
Fig. 2 Ajuste al modelo de Freundlich para el CAG2 y CAG3.
CONCLUSIONES
1. La modificación química del carbón activado de conchas de coco con soluciones de ácido nítrico origina un incremento de los grupos ácidos (carboxílicos, lactonas y fenoles) existentes en la superficie del material adsorbente.
2. El incremento de los grupos superficiales ácidos en la superficie del carbón activado provoca un aumento de la capacidad de adsorción y por cientos de remoción del níquel (II) producto a la creación de interacciones específicas con el material adsorbente.
3. El posible mecanismo de adsorción de los iones de níquel (II) está influenciado por las interacciones con los grupos superficiales ácidos y el intercambio iónico con las especies de sodio y potasio.
4. El proceso de adsorción del níquel (II) a partir de soluciones modeladas es descrito por el modelo de Freundlich, formándose múltiples capas del adsorbato sobre la superficie del adsorbente.
NOMENCLATURA
A: es un indicador aproximado de la capacidad de adsorción, mg/g.
CAG0: carbón activado granular sin modificar.
CAG1: carbón activado granular tratado con una solución de 0,1 mol/L de HNO3
CAG2: carbón activado granular tratado con una solución de 0,55 mol/L de HNO3
CAG3: carbón activado granular tratado con una solución de 1 mol/L de HNO3
Ce: concentración en equilibrio de adsorbato, mg/L
Ci: concentración inicial de adsorbato, mg/L
m: masa de carbón, g
nGim: contenido de grupos superficiales, mmol/g
niB: cantidad de sustancia inicial de la base, mmol
nrB: cantidad de sustancial residual de la base, mmol
PA: porcentaje o eficiencia de adsorción, %
Qe: incremento en la concentración por unidad de masa de adsorbente, mg/g
V: volumen de la solución, L
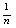 : factor relacionado con la intensidad de adsorción
: factor relacionado con la intensidad de adsorción
BIBLIOGRAFIA
1. AHMADPOUR, A. et. al., "Rapid removal of cobalt ion from aqueous solutions by almond green hull". Journal of Hazardous Materials, Vol. 166, Nº 2-3, 2009, p. 925-930.
2. BARRABIA, E., SOSA. M., BASSAS, R., Estudio preliminar de una variante de recuperación de valores metálicos a partir del licor ácido de la ECPSA. Informe Técnico. ISMM, Moa, 1997.
3. COHEN, R., LORIMER, J. W., IUPAC Solubility Data Series 47. Oxford University Press, 1991.
4. HUANG, C. C., LI, H. S., CHEN, C. H.,"Effect of surface acidic oxides of activated carbon on adsorption of ammonia." Journal of Hazardous Materials, Vol. 159, 2008, p. 523-527.
5. LU, C. LIU, C., "Removal of nickel (II) from aqueous solution by carbon nanotubes." Journal of Chemical Technology and Biotechnology, Vol. 81, Nº. 12, 2006, p. 1932-1940.
6. MORENO, J. C., GIRALDO L., "Determinación de la entalpía de inmersión de carbones activados en disoluciones acuosas de fenol y 4-nitrofenol." Revista Afinidad LXVII, Vol. 545, 2010, p. 45-50.
7. MORRELL, A., Desarrollo de una metodología para la descontaminación del WL y recuperación de algunos valores metálicos. Universidad de Oriente, Santiago de Cuba, 1990.
8. MYERS, D. Surfaces, Interfaces, and Colloids: Principles and Applications. 2 Edition, 1999.
9. PENEDO, M. M., et. al., "Adsorción de níquel y cobalto sobre carbón activado de cascarón de coco." Tecnología Química, Vol. 35, No.1, 2015, p. 110-124.
10. PETER, A., PAULA, J., Elements of Physical Chemistry. 1 Edition, 2009.
11. RODRÍGUEZ, E. P., GIRALDO, L., MORENO-PIRAJÁN, J. C., "Modificación de la química superficial de carbones activados. Efecto de la oxidación con soluciones de HNO3 y H2O2 sobre la remoción de cadmio (II) en solución acuosa." Revista Afinidad LXXI, Vol. 565, 2014, p. 49-56.
12. RODRÍGUEZ, E. P., Modificación y Caracterización Calorimétrica de Carbón Activado Granular, para la Remoción de Cd (II) y Ni (II) en Adsorción Simple y Competitiva. Universidad Nacional de Colombia, Bogotá, 2011.
13. RODRÍGUEZ, E. P., GIRALDO, L., MORENO, J., "Oxidación de la superficie de carbón activado mediante HNO3 y H2O2: efecto sobre la remoción de níquel (II) en solución acuosa." Colombiana de Química, Vol. 40, No. 3, 2011, p. 349-364.
14. SHIM, J. W., PARK, S. J., RYU, S. K., "Effect of modification with HNO3 and NaOH on metal adsorption by pitch-based activated carbon fibers."Carbon, Vol. 39, No. 11, 2001, p.1635-1642.
15. SMISEK, M., CERNY S. Activated Carbon Manufacture, Properties and Applications. New York, 1970.
16. SOSA, M. M., Regularidades físico químicas en la recuperación de las principales especies metálicas del licor residual de la empresa Comandante Pedro Sotto Alba, Moa Nickel. S.A. ISMM, Moa, 2006.
Recibido: Septiembre 2016
Aprobado: Diciembre 2016
Ing. Mónica Hernández-RodríguezI. Instituto Superior Minero Metalúrgico Antonio Núñez Jiménez. mhernandezr@ismm.edu.cu