Introducción
La infección del pie diabético, sobre todo si se asocia a is quemia, es la causa más frecuente de amputación de extremi dad inferior en la población general, de ingreso hospitalario y disminución de la calidad de vida en los diabéticos. El 15 % de las personas con diabetes mellitus (DM) va a sufrir a lo largo de su vida una infección del pie, con una incidencia anual del 1 %-4 %, precedida en más del 80 % de los casos por una úlcera en el pie. Las infecciones deben clasificarse, en función de su gravedad, como leves, moderadas-leves, moderadas-graves y graves. Su tratamiento es complejo y debe ser multidisciplinario.1
La recogida de una muestra adecuada es determinante para que el diagnóstico microbiológico sea útil. El cultivo de muestras no representativas proporciona resultados sin valor que pueden conducir a tratamientos inadecuados.2
Los microorganismos implicados en la etiología de la infección del pie diabético varían según el tipo de infección y determinadas situaciones del paciente (tratamiento antibiótico, manipulación u hospitalización previas).1
Al Benwan y otros,3 en un estudio sobre la microbiología del pie diabético infectado en un hospital general de Kuwait, reportaron que la mayoría de las infecciones leves eran monomicrobianas, causadas por cocos grampositivos aerobios tales como Staphylococcus aureus y Streptococcuss pp.; y que la mayoría de las infecciones graves resultaban polimicrobianas, causadas por bacterias aerobias cocos Gram positivos y bacilos Gram negativos como Pseudomonas Spp., Escherichia coli, Klebsiella Spp., Proteus Spp. y anaerobios.
La identificación temprana de la infección tiene importancia para el éxito de los resultados clínicos, porque muchas úlceras del pie diabético representan verdaderas emergencias y la antibioticoterapía debe comenzarse inmediatamente para mejorar las posibilidades de recuperación de la extremidad.3,4
Las características microbiológicas de las úlceras del pie diabético pueden depender de condiciones territoriales y hasta locales, por lo cual se necesita identificar las características de cada lugar concreto.
El objetivo de este estudio fue identificar los microorganismos aislados para estimar tanto la sensibilidad a los antibióticos como la coincidencia entre el tratamiento empírico y los resultados microbiológicos en pacientes con úlceras del pie diabético.
Métodos
Se desarrolló un estudio descriptivo y retrospectivo en todos los pacientes ingresados en el Servicio de Angiología y Cirugía Vascular del Hospital Universitario Clínico Quirúrgico “Comandante Faustino Pérez Hernández” de Matanzas, en el período comprendido desde enero de 2017 hasta diciembre de 2020 con el diagnóstico de úlcera del pie diabético infectado.
El universo del estudio estuvo conformado por los 221 pacientes que ingresaron en el período del estudio.
La muestra estuvo formada por 210 pacientes debido a que los 11 restantes no cumplían con los criterios de inclusión y exclusión del estudio. Los datos primarios se obtuvieron de los expedientes clínicos de todos los pacientes ingresados con diagnóstico de úlcera del pie diabético en cualquiera de sus variantes etiopatogénicas.
La variable principal de salida fue la frecuencia de gérmenes para cada úlcera.
Las variables secundarias de salida resultaron el tipo de germen para cada úlcera, la cantidad de gérmenes por úlcera, la frecuencia de tipo de infección en el conjunto de úlceras, la sensibilidad de cada tipo de germen para cada tipo de antibiótico y el porcentaje de coincidencia entre el tratamiento empírico y el resultado microbiológico.
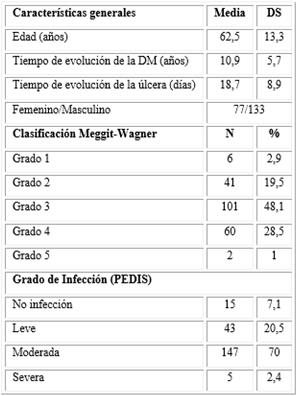
Como variables de explicación o confusión se mostraron: la edad, el sexo, el tipo de diabetes mellitus (DM), el tiempo de evolución de la diabetes mellitus, la clasificación de la úlcera según Meggit-Wagner, el tiempo de evolución de la úlcera y la severidad o grado de la infección, según la clasificación PEDIS.5,6
Se incluyeron en el estudio todos los pacientes mayores de 18 años con úlceras del pie diabético infectadas que fueron ingresados en el período de la investigación. Se excluyeron aquellos con insuficiencia renal crónica, que requerían de diálisis regularmente; con antecedentes de enfermedad maligna; y que hubieran recibido tratamiento con oxigenación hiperbárica o con ozono localmente.
Procesamiento de las muestras microbiológicas
Las muestras de tejidos desvitalizados -piel, partes blandas y hueso- se tomaron a través de biopsia -con bisturí para el caso de piel y tejidos blandos y con Ronger para el caso de hueso-. En los abscesos, la toma de muestra se realizó por aspiración con aguja y jeringuilla. La muestra se introdujo en tubo de cristal con medio de cultivo previamente preparado, se sembró en agar sangre de carnero 0,5 %, en agar Mc. Conkey y medio de tioglicolato (anaerobio facultativo) y el procesamiento se realizó en las primeras 24 horas mediante el manual de normas y procedimientos para tales fines aprobado por el laboratorio que procesó la muestra.7
Con la información recogida se creó una base de datos, la cual fue procesada en una computadora con ambiente Windows XP. Los resultados se llevaron a tablas. Las variables cuantitativas fueron expresadas en forma de media y desviación típica; y las cualitativas, en porcentaje. Para expresar la frecuencia de cada germen en las úlceras se empleó el intervalo de confianza de 95 %.
El estudio siguió las recomendaciones detalladas en la actualización de la Declaración de Helsinki8 para la investigación biomédica del Consejo de Organizaciones Internacionales de Ciencias Médicas y fue aprobado por el comité de ética institucional.
Resultados
La tabla 1 permite apreciar las características generales de los 210 pacientes incluidos en el estudio.
En lo relacionado con la presencia de gérmenes, se observaron 259 gérmenes en total, para una proporción de 1,23 (259/210) gérmenes por úlcera en los 195 pacientes (92,9 %), en los cuales se comprobó una infección.
La tabla 2 muestra la distribución de las úlceras según el número de gérmenes presentes en ellas.
Tabla 2 Distribución de las úlceras según el número de gérmenes
| Cantidad de gérmenes por úlcera | n | % |
|---|---|---|
| No crecimiento bacteriano | 15 | 7,1 |
| Monomicrobiana | 136 | 64,8 |
| Úlceras con dos gérmenes | 54 | 25,7 |
| Úlceras con tres gérmenes | 5 | 2,4 |
| Total | 210 | 100 |
Fuente: Historia clínica.
En la tabla 3 se presentan la distribución porcentual y el intervalo de confianza del 95 % de los gérmenes aislados en los cultivos microbiológicos. Los gérmenes Gram negativos se presentaron 1,67 (162/97) veces más frecuentes que los gérmenes Gram positivos.
Tabla 3 Gérmenes aislados en los cultivos microbiológicos
| 80 | 30,9 (25-37) | |
|
|
33 | 12,7 (9-17) |
|
|
47 | 18,1 (13-239 |
| Enterococos | 11 | 4,2 (2-7) |
| Estreptococos | 4 | 1,5 (0-3) |
| Estreptococo beta hemolítico | 1 | 0,4 (0-1) |
| Estreptococo epidermis | 1 | 0,4 (0-1) |
| 50 | 19,3 (14-24) | |
| 37 | 14,3 (10-19) | |
| 23 | 8,9 (5-12) | |
| 15 | 5,8 (3-9) | |
| 9 | 3,5 (1-6) | |
| 5 | 1,9 (0-4) | |
| 6 | 2,3 (0-4) | |
| Bacilo no fermentador | 6 | 2,3 (0-4) |
| Pseudomonas | 5 | 1,9 (0-4) |
| Citrobacter | 4 | 1,5 (0-3) |
| 2 | 0,8 (0-2) | |
| 259 |
Fuente: Historia clínica.
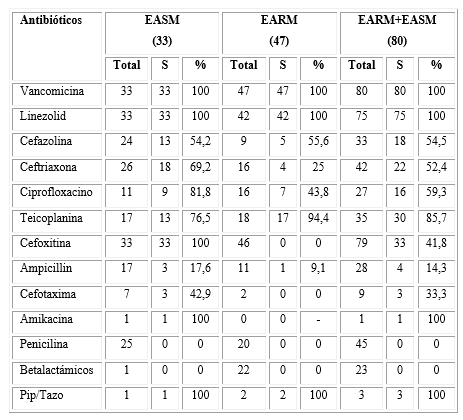
La tabla 4 muestra la sensibilidad de las diferentes cepas de Staphylococcus aureus frente a los antibióticos empleados. No se muestra de forma detallada la sensibilidad entre los diferentes gérmenes Gram positivos debido a que su frecuencia de presentación no fue importante. El 58,8 % de las especies de Staphylococcus aureus resultaron resistentes a la meticilina.
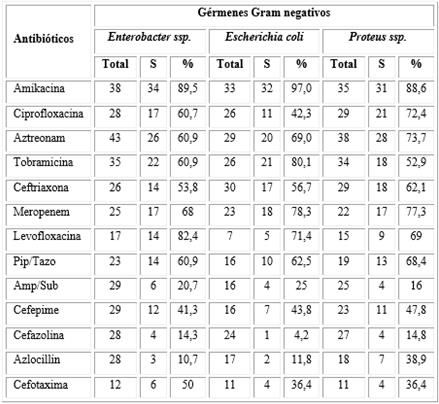
La tabla 5 muestra la sensibilidad de los Enterobacter ssp., la Escherichia coli y la familia de Proteus ssp., que fueron los gérmenes Gram negativos más frecuentes en el estudio.
La tabla 6 presenta la asociación entre el tipo y la cantidad de gérmenes en cada úlcera. El 53,3 % de todas las úlceras estuvieron infectadas solo por gérmenes Gram negativos, mientras que en el resto de las úlceras siempre se presentó, al menos, un germen Gram positivo.
Tabla 6 Distribución de los tipos de gérmenes en las úlceras
| Gram positivos | 48 | 4 | 0 | 52 |
| Gram negativos | 88 | 21 | 3 | 112 |
| Gram positivos y Gram negativos | 0 | 29 | 2 | 31 |
| Total | 136 | 54 | 5 | 210 |
Fuente: Historia clínica.
Los antibióticos empíricos más utilizados fueron la cefazolina, la cefotaxima y la ceftriaxona en un 44,3 %, 27,7 % y 17,1 %, respectivamente. La combinación de cefazolina o cefotaxima unida al metronidazol se empleó solamente en un 6,7 % y 4,2 %, respectivamente.
La coincidencia entre el antibiótico utilizado de forma empírica y la sensibilidad demostrada por el antibiograma solo alcanzó el 27,6 %.
Discusión
La diabetes mellitus es un importante problema de salud en Cuba, con una tasa de 66,7 por 1000 habitantes, según el informe del Anuario Estadístico de Salud de 2019.9
La incidencia de infecciones en el pie de los pacientes diabéticos varía entre un 4 % del riesgo total de por vida, en la atención primaria, y un 7 % anualmente en los centros especializados en el tratamiento de pie diabético.10
La exploración de la naturaleza microbiana y de la resistencia ante los antibióticos constituyen aspectos importantes del manejo de la úlcera infectada del pie diabético. Las heridas del pie en los diabéticos carecen de muchas de las barreras y mecanismos protectores asociados con la piel intacta, lo que proporciona un portal para los microorganismos invasores.11
En este estudio se observó un 92,9 % de úlceras infectadas, lo cual se corresponde con lo reportado en pacientes hospitalizados, que incluyen elevados porcentajes de estas úlceras y niveles menores de úlceras colonizadas.12,13,14,15,16,17,18
Los organismos que de forma predominante colonizan e infectan las úlceras son los Gram positivos, con el Staphylococcus aureus como principal exponente.4) La proporción entre los gérmenes Gram negativos y Gram positivos observados en este estudio fue de 1,67, lo cual no se corresponde con la afirmación anterior y sí con lo reportado por algunos autores de estudios que provienen del África, Medio Oriente y Asia, quienes muestran valores para esta variable entre 1,43 y 3,71.15,18,19,20,21,22,23 Sin embargo, Seung y otros24 en 2017 en Corea, informaron una mayor proporción de gérmenes Gram positivos, aunque la distribución de los gérmenes específicos difería de la observada en los países occidentales, por lo cual concluyeron que, probablemente, la distribución de gérmenes en Corea era diferente a la observada en estos países y sugirieron la confección de guías específicas para cada región.
Un elemento cardinal en la valoración de la carga bacteriana de la úlcera del pie diabético lo constituye la cantidad de gérmenes por úlcera. En el estudio que se presenta se reportan 1,23 gérmenes por úlcera, lo cual se corresponde con la mayoría de las revisiones realizadas,14,15,18,19,21,24,25,26,27 aunque resulta pertinente señalar la existencia de investigaciones con valores alrededor de 1,9 o más de dos gérmenes por úlcera.17,20,22,28 Esta discrepancia pudiera estar relacionada con el uso previo de antibióticos, el tiempo de hospitalización y la cronicidad de la úlcera.
Directamente vinculado con la cantidad de gérmenes por úlcera, se destacan la cantidad de úlceras infectadas por un solo germen e infectadas por números variables de gérmenes que pudieran llegar hasta 4 o 5 por úlcera. En este estudio se encontró un 64,8 % de úlceras monomicrobianas, lo cual se corresponde con lo reportado por un número considerable de autores14,15,16,17,18 y pudiera ser una expresión de la baja complejidad de las úlceras incluidas. Numerosos autores reportan frecuencias de úlceras infectadas por más de un germen por encima del 50 % y se corresponden, por lo general, con la inclusión de úlceras de larga duración, alta complejidad y un elevado uso histórico de antibióticos.20,21,22,23,25,28,29
Resulta interesante que, a pesar de la existencia de una mayor frecuencia de gérmenes Gram negativos, el más frecuentemente encontrado, de forma casi abrumadora por la mayoría de los autores, es el Staphylococcus aureus, lo cual se corresponde con los resultados de este estudio.4,11,13,24,30 El grupo Enterobacter ssp., el Proteus spp. y la Escherichia coli representaron, en orden decreciente, los gérmenes que secundaron al Staphylococcus aureus en este estudio. Hay que resaltar que, bajo determinadas condiciones, se puede observar una preponderancia de gérmenes del tipo Gram negativos como reportan Hefni y otros15 en la población egipcia, Sánchez-Sánchez y otros26 en la mexicana, Flores y otros31 en la hondureña, y Yovera-Aldana y otros32) en la peruana. Tanto las úlceras crónicas o severamente infectadas, como los ambientes cálidos y húmedos pueden constituir condiciones para la proliferación de los gérmenes Gram negativos.11,27
La mayor sensibilidad de los Staphylococcus aureus de este estudio se observó a la vancomicina, el linezolid y la teicoplanina, lo cual se corresponde con lo reportado anteriormente por otros autores.13,23,30,33 La ciprofloxacina mostró una buena efectividad, especialmente frente a los estafilococos sensibles a la meticilina; al igual que la cefotaxima, la cual tuvo una efectividad del 100 % frente a los sensibles a la meticilina y una resistencia total frente a los estafilococos resistentes a la meticilina.
Se destaca en este estudio la presencia de un 57,7 % de Staphylococcus aureus resistentes a la meticilina, lo cual se corresponde con estudios de un número importante de autores.14,15,18,20,22,24,44 En contraposición con lo anterior, Miyan y otros21 y Citron y otros23 reportan un 26,7 % y un 23,4 %, respectivamente. Es menester destacar el reporte de Katherine y otros,17 quienes en un hospital del tercer nivel en Escocia, después de estudiar 65 especies de Staphylococcus aureus, informan la ausencia de cepas resistentes a la meticilina.
La existencia de Staphylococcus aureus resistentes a la meticilina se ha convertido en un enorme problema a nivel global, debido a que estos gérmenes no solo resultan resistentes a la meticilina, sino, por lo general, a los aminoglucósidos, los macrólidos, la tetraciclina, el cloranfenicol y las lincosamidas.34
Los antibióticos más efectivos encontrados en este estudio para los gérmenes Gram negativos fueron la amikacina, la levofloxacina y el meropenem, lo cual se corresponde, de forma general, con lo reportado por otros autores en diferentes localizaciones geográficas.14,15,16,21,23,43
La aparición de gérmenes Gram negativos resistentes a múltiples drogas se ha ido convirtiendo en un serio problema en el tratamiento de las infecciones. La presencia de Pseudomona aeuriginosa y de Acinetobacter baumanii resistentes a casi todas las drogas se ha convertido en un gran reto para la práctica médica.34 En este estudio se observó que solo el 1,9 % de los gérmenes encontrados se correspondió con Pseudomona aeuriginosa y no se detectó la existencia de Acinetobacter baumanii, por lo cual se consideraron estos gérmenes de poca importancia y no se profundizó en las características que los acompañaron. Sí se reporta la existencia de cepas de enterobacterias resistentes al aztreonam y a los carbapenem, lo cual pudiera ser una señal de la existencia de cierta proporción de gérmenes Gram negativos con multirresistencia.
La propuesta efectuada por el grupo internacional de expertos reunidos en Canadá en 2011 para discutir las definiciones sobre la resistencia adquirida, propuso la existencia de organismos multirresistentes, organismos con multirresistencia extendida y gérmenes pan-resistentes.35 En este estudio solamente se pudo identificar la presencia de gérmenes multirresistentes, debido a que el sitio en el cual se realizó no contaba con los elementos de diagnóstico requeridos para la identificación de gérmenes con multi-resistencia extendida o gérmenes pan-resistentes. Se necesita señalar que en todos los gérmenes identificados en este estudio siempre se logró identificar susceptibilidad a alguno de los antibióticos evaluados, por lo cual se puede afirmar que no se hallaron gérmenes con pan-resistencia, aunque no es posible descartar la existencia de algún germen con multi-resistencia extendida.
En la serie que se presenta resulta interesante que el 53,3 % de todas las úlceras estuvieron infectadas solamente por gérmenes Gram-negativos, mientras que en el resto siempre se presentó un germen Gram-positivo. Hefni y otros15 también reportan en la India en una serie mucho más pequeña que la del presente estudio, con un 53 % de úlceras polimicrobianas infectadas solo por gérmenes Gram negativos.
La existencia de un número elevado de úlceras solamente con gérmenes Gram negativos es un hallazgo importante y pudiera condicionar la elección del tratamiento empírico de la úlcera del pie diabético infectada. En los países occidentales se prefiere la utilización de un tratamiento empírico dirigido de forma intencionada contra los gérmenes Gram positivos, que con mayor frecuencia se encuentran en las úlceras infectadas en esa parte del mundo.
Uno de los hallazgos más preocupantes de este estudio lo constituyó la muy baja frecuencia de coincidencia entre el antibiótico empírico utilizado y la suceptibilidad observada en el cultivo, la cual fue de solo un 27,6 %, aunque se ubica en el entorno de la reportada por Susanti y otros36 en 2016.
El tratamiento empírico debe fundamentarse en la forma clínica de presentación, la severidad de la úlcera, la disponibilidad de antibióticos específicos y el patrón local de suceptibilidad/resistencia microbiana,37,38 y solo debe utilizarse cuando existen evidencias clínicas de infección. En general, se sugiere iniciar el tratamiento con el antibiótico más seguro y barato existente, que cubra los gérmenes más frecuentemente encontrados en las úlceras del pie diabético.39
La guía más reciente sobre el diagnóstico y tratamiento de las infecciones en el pie del paciente con diabetes mellitus expresa que en la úlcera del pie diabético con una infección moderada de pacientes residentes en zonas templadas y que no hayan recibido tratamiento con antibióticos recientemente, deben emplearse, de forma empírica, antibióticos dirigidos hacia los gérmenes aerobios Gram positivos, especialmente Staphylococcus aureus y Estreptococo beta hemolítico. Para aquellos pacientes residentes en zonas tropicales o subtropicales o que hayan sido tratados con antibióticos en fecha reciente, se sugiere el empleo de un régimen de antibióticos que cubra a los gérmenes Gram positivos y gérmenes Gram negativos que hayan sido identificados en cultivos de forma habitual.40,41,42
En la serie que se presenta, la cefazolina y la cefotaxima se utilizaron de forma frecuente como antibióticos empíricos. La cefazolina mostró una resistencia alrededor del 45 % y la cefotaxima mostró una resistencia por encima del 60 % para los gérmenes Gram positivos. La ceftriaxona, usada en un menor grado como antibiótico empírico, mostró una susceptibilidad similar a la de la cefazolina para los gérmenes Gram positivos. Un análisis de los resultados del laboratorio permite sugerir el empleo del ciprofloxacino como un posible antibiótico empírico, siempre que no se considere la existencia de un Staphylococcus aureus resistente a la meticilina, debido a que mostró una resistencia frente a los gérmenes Gram positivos ligeramente inferior a la observada para la cefazolina y la ceftriaxona.
Este estudio es el más abarcador realizado en los últimos veinte años en Cuba -hasta donde los autores conocen-, relacionado con la bacteriología de la úlcera del pie diabético y, sin lugar a dudas, contribuye a mejorar el entendimiento de la microbiología del pie diabético infectado en Cuba, al ofrecer datos acerca de la resistencia microbiana en un hospital general. La principal limitación de este estudio radicó en su naturaleza retrospectiva, lo cual obligó a los autores a obtener toda la información de los expedientes clínicos de los pacientes incluidos. Esto puede conllevar el riesgo de omisión de algunos datos que no siempre se han recogido de forma adecuada.
La principal fortaleza se encontró en el número de pacientes incluidos y en haber contado con un laboratorio de microbiología con una elevada experiencia en el manejo de pacientes con úlceras del pie diabético.
Resulta necesario un apropiado diagnóstico microbiológico de las úlceras del pie diabético para identificar los gérmenes presentes en las lesiones y diseñar algoritmos de terapia antimicrobiana adecuados.