Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina
versión On-line ISSN 1561-302X
Rev cubana med vol.55 no.1 Ciudad de la Habana ene.-mar. 2016
Rev Cubana Med. 2016;55(1)
TRABAJO ORIGINAL
Experiencia en el tratamiento de la infección bacteriana en receptores de trasplante renal
Experience in the treatment of bacterial infection in renal transplant recipients
Rafael Enrique Cruz Abascal, Sergio Ignacio Camacho Romero, Osmany Antonio Hernández Pérez, Milagro Estrella Hernández Fernández, Raunel Batista Hernández
Hospital Universitario “Arnaldo Milián Castro”. Santa Clara, Cuba.
RESUMEN
Introducción: el trasplante renal constituye la terapéutica de elección en el tratamiento de la enfermedad renal crónica, pero las complicaciones infecciosas, específicamente bacterianas, mantienen elevadas tasas de morbilidad y mortalidad y constituyen un problema de difícil solución. En el Hospital Universitario “Arnaldo Milián Castro” contamos con 8 años de experiencia en el tratamiento de la infección bacteriana en receptores de trasplante renal.
Objetivo: caracterizar el comportamiento de la infección bacteriana en receptores de trasplante renal.
Métodos: se efectuó un estudio descriptivo, longitudinal y prospectivo que incluyó a 102 pacientes receptores de TR con diagnóstico de infecciones bacterianas, entre junio de 2001 y diciembre de 2009, y 192 infecciones bacterianas confirmadas por estudios microbiológicos.
Resultados: se localizaron 9 procesos infecciosos en el parénquima pulmonar con clínica, radiografía y respuesta antimicrobiana sin positividad en los especímenes recolectados y procesados en el laboratorio. El grupo etario más afectado fue el de 31 a 40 años con 32 procesos infecciosos. No hubo diferencias en cuanto al sexo ni a la relación sexo-edad. Predominó la piel blanca (74,5 %) (x² BA= 0,064 p= 0,936). Los que exhibieron una sola infección fueron los más representados (50 %) y el urocultivo fue el espécimen con más positividad, 94 para un índice de 0,92. Los grupos de pacientes con uno y dos episodios infecciosos tuvieron 2 fallecidos cada uno al egreso (p= 0,278). La infección del tracto urinario y la herida quirúrgica predominaron en el posoperatorio inmediato, con 16 casos, respectivamente, aunque la primera se presentó más frecuentemente en los diferentes períodos evolutivos. El microorganismo más resistente fue el Acinetobacter spp. en el cultivo de orina en 3 pacientes (10,34 %) y el antimicrobiano menos efectivo, la combinación de amoxicilina-sulbactán, en 8 (21,05 %).
Conclusiones: el conocimiento de las características de la infección bacteriana en receptores de trasplante renal y la selección oportuna y específica del antimicrobiano a la dosis recomendada han sido las herramientas principales en nuestra experiencia.
Palabras clave: trasplante renal; infección bacteriana; antimicrobianoterapia.
ABSTRACT
Introduction: renal transplantation is the therapy of choice in the treatment of chronic kidney disease, but specifically bacterial infectious complications maintain high rates of morbidity and mortality and it is a problem difficult to solve. At "Arnaldo Milian Castro" University, eight year-experience has been gained in the treatment of bacterial infection in renal transplant recipients.
Objective: characterize the bacterial infection behavior in renal transplant recipients.
Methods: a descriptive, longitudinal and prospective study was conducted from June 2001 to December 2009, in 102 patients receiving renal transplantation and who were diagnosed with bacterial infections; and 192 bacterial infections confirmed by microbiological education.
Results: nine infectious processes were located in the pulmonary parenchyma with clinic, X-ray images and antimicrobial answer with no positiveness in the specimens gathered and processed in the laboratory. The most affected age group was 31 to 40 years with 32 infectious processes. There were no differences in gender or sex-age relationship. White skin subjects prevailed (74.5 %) (x² BA = 0.064 p = 0.936). Those who exhibited a single infection were overrepresented (50 %) and urine culture was more positive specimen, 94 for an index of 0.92. Patient groups one and two infectious episodes had 2 deaths each at discharge (p = 0.278). The wound and urinary tract infections prevailed in the immediate postoperative period, with 16 cases, respectively, although the latter was more likely at different evolutive periods. Acinetobacter spp was the most resistant microorganism in urine culture in 3 patients (10.34 %) and the less effective antimicrobial was amoxicillin-sulbactam, in 8 (21.05 %).
Conclusions: the timely and specific selection of the antimicrobial drug at the recommended dose for each patient has been the main tool in our experience.
Keywords: renal transplantation; bacterial infection; antimicrobial therapy.
INTRODUCCIÓN
El trasplante renal (TR) constituye la terapéutica de elección en el tratamiento integrado de la enfermedad renal crónica (ERC), de manera que su puesta en práctica ha rebasado ampliamente las limitaciones que imponen otras variantes sustitutivas temporales de la función renal: diálisis peritoneal o hemodiálisis y, por otra parte, propicia un incremento sostenido en la mejoría de la calidad de vida de los pacientes.
Entre los métodos de suplencia, el TR es consustancial a la ERC en la etapa avanzada o la terminal, que resulta de un complejo multifactorial de interacciones que tienen su punto culminante en una disfunción celular generalizada y afectación progresiva, y no siempre reversible, de los mecanismos biológicos efectores y adaptativos del organismo que en su conjunto confluyen en un síndrome multisistémico con susceptibilidad aumentada al impacto de las interrelaciones del medio interno y de los nexos del individuo con el entorno que le circunda.1-3
Connotación especial merecen las complicaciones infecciosas, específicamente las bacterianas, que aún mantienen elevadas tasas de morbilidad y mortalidad y constituyen un problema de difícil solución. Suelen aparecer en cualquier momento de la evolución y están entrelazadas con la génesis y el desencadenamiento de las crisis inmunológicas de rechazo atribuibles a un cúmulo de factores que ejercen disímiles influencias sobre la biología del receptor lo que, en muchos casos, determina la pérdida del injerto y en otros, una amenaza para la vida. La continua evolución de las características de la pareja donante-receptor deviene un factor que también altera el escenario de la infección en este peculiar grupo de pacientes que, al compararlo con los inmunocompetentes, representan un desafío para su atención y seguimiento.4-6
La inmunosupresión crónica presente en la enfermedad renal desde la etapa predialítica, a diferencia de los no trasplantados, expresa un fracaso en los mecanismos inmunológicos frente a agentes biológicos de naturaleza diversa, su empeoramiento y perpetuación durante su estancia en los métodos sustitutivos temporales, así como la acción de la medicación dirigida a la prevención del rechazo, determinan un grado de respuesta inefectivo y desproporcionado para contrarrestar infecciones, si tomamos en cuenta que el individuo se somete a tratamientos invasivos, anestesia general con intubación endotraqueal, cirugía vascular de alto riesgo, drenajes, cateterismo venoso central, ureteral y vesical, así como a múltiples punturas arteriales y venosas que, en su conjunto, proveen condiciones favorables para la adquisición, multiplicación y desarrollo de microorganismos, como el Staphylococcus aureus, con la consecuente aparición de sepsis grave y resistencia a los antimicrobianos.7,8
En el presente trabajo nos proponemos caracterizar el comportamiento de la infección bacteriana en receptores de trasplante renal, del Hospital Universitario "Arnaldo Milián Castro", al contar los primeros 8 años de experiencia.
MÉTODOS
Se efectuó un estudio descriptivo, longitudinal y prospectivo que incluyó a los pacientes receptores de TR con diagnóstico de infecciones bacterianas en diferentes niveles de localización y en cualquier momento de la evolución posinjerto.
Se revisaron los expedientes clínicos, las pancartas de seguimiento y el registro de entrada del Laboratorio de Microbiología de los 228 pacientes en el período de estudio. La muestra del presente estudio estuvo conformada por 102 pacientes.
Los grupos etarios se constituyeron, por años, como sigue: hasta 20, de 21 a 30, de 31 a 40, de 41 a 50, de 51 a 60 y mayores de 60.
Criterios de inclusión
- Pacientes con trasplantes renales y evidencias clínicas de infección, por un mismo microorganismo, demostrada mediante dos o más cultivos, independientemente de la ubicación.
- Pacientes que iniciaron la función del órgano injertado y contrajeron infección bacteriana en su evolución posoperatoria o el proceso infeccioso fue la causa de pérdida del riñón trasplantado o la muerte.
Se tomó en cuenta convenientemente, el momento del postrasplante en el que apareció la infección bacteriana y la repercusión sobre la evolución del paciente, se clasificó como:
- Inmediato: hasta 15 días posteriores al TR.
- Mediato: entre los 16 y 30 días posinjerto.
- Tardío: entre los 31 y 90 días posinjerto.
- A largo plazo: a partir del día 91 posinjerto.
La respuesta terapéutica se estimó en efectiva y no efectiva.
La conducta terapéutica de la infección se concibió con el empleo de antimicrobianos de amplio espectro sin efectos secundarios sobre la función renal a las dosis habituales y las pautas antimicrobianas seguidas en cada paciente para la elección de la droga, así como para su dosis, se individualizaron tomando en cuenta: la edad, el estado clínico, la función del injerto estimada por el índice de filtración glomerular (IFG), calculada según la fórmula de Cockroft-Gault,9 la prescripción previa de otros antimicrobianos y la susceptibilidad in vitro en concordancia con el antibiograma.
Se utilizaron las pruebas estadísticas de chi cuadrado (x2) de independencia para determinar independencia entre factores y la de bondad de ajuste (x2 BA) para contrastar distribuciones. Para la comparación de estratos de interés se empleó el método de Log-Rank. En todas las pruebas que implicaron uso de inferencia se utilizaron los siguientes criterios para la definición estadística; p < 0,05 diferencias significativas, p ˃ 0,05 no existen diferencias y p < 0,01 diferencias altamente significativas. Se establecieron medidas de probabilidad para contraer infecciones y la valoración de intervalos de confianza para el estudio de estos factores vinculados a la morbilidad y a la mortalidad.
RESULTADOS
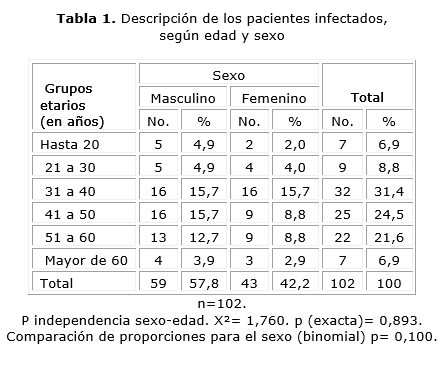
La tabla 1 muestra la descripción de los pacientes infectados según edad y sexo. La mayor proporción de pacientes se ubica en el grupo de 31 a 40 años, aunque la mediana está en la clase 41 a 50 según el valor de la media aritmética, que es de 42 años, con un recorrido de 16 a 64 años. Sin embargo, no existe asociación sexo-edad en estos pacientes (p= 0,893). Se distribuyen independientemente una y otra variable. El color de la piel blanca predomina 76 (74,5 %) sobre mestizos y negros.
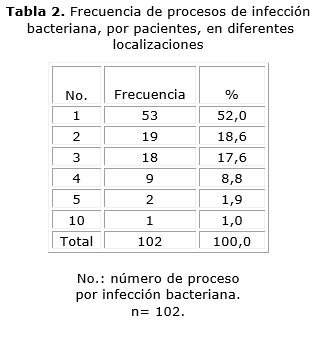
En la tabla 2 se hace referencia a los eventos de infección bacteriana en diferentes localizaciones. Se percibe que los pacientes que mostraron mayor frecuencia de infecciones a cualquier nivel: 53 (52 %), fueron los que presentaron un solo evento, incluidos los 9 pacientes con diagnóstico de neumopatía inflamatoria sin precisarse microbiológicamente el agente causal, no obstante presentar manifestaciones clínicas y radiográficas sugestivas, así como respuesta terapéutica adecuada.
La tabla 3 reseña la relación entre el número de procesos infecciosos y el estado del paciente al egreso. Ambas distribuciones no están relacionadas, pues la prueba de independencia no muestra significación (p= 0,278). Sí descriptivamente observamos los episodios confirmados de infección en relación con el estado al egreso, se percibe que 2 (28,6 %) fallecidos solo presentaron un proceso de infección, otros 2 no sobrevivieron de los que adquirieron infecciones en 2 ocasiones de 17 egresos vivos y con 3, 4 y 5 reinfecciones se ubicaron, respectivamente, 3 fallecidos. El paciente que presentó 10 eventos sobrevivió a los mismos, todo lo cual avala la independencia del número de infecciones respecto al riesgo de fallecer por esta causa.
El índice de infección según el sitio de ubicación, se expone en la tabla 4. Se constata que el urocultivo en la ITU, es el que en más alta frecuencia se encontró; 94, seguido por el hemocultivo y, en tercer lugar, por la herida quirúrgica, aunque esta no siempre relacionada con el acto quirúrgico del injerto, sino con reintervenciones a ese nivel u otros tipos de cirugía.
En la tabla 5 se describe la relación entre el sitio de localización de la infección y el momento de su aparición. Se aprecia que los procesos que afectaron el tracto urinario y la herida quirúrgica fueron los que se encontraron con preponderancia en el período inmediato a la cirugía de implante del injerto. En los períodos mediato, tardío y a largo plazo, a la infección del tracto urinario también le correspondió la mayoría. La infección localizada en el catéter venocentral estuvo representada por el Acinetobacter spp. (n= 37). En la pielonefritis aguda (n= 21), los microorganismos causales fueron, en igual proporción, el Citrobacter spp. y la Klebsiella pneumoniae: 4 (19,04 %), respectivamente. En cuanto a la ITU, la Escherichia coli y el Citrobacter spp. se constataron en 30 urocultivos en similar distribución, que representó el 31,91 % para cada uno de ellos. Cinco especímenes positivos a Staphylococcus aureus (26,31 %) predominaron en la herida quirúrgica del TR (n= 19) e igual patógeno; 3 (42,85 %) se detectaron en mayor número al nivel de otras heridas quirúrgicas no relacionadas con el implante (n= 7). Las secreciones respiratorias con cultivos positivos a Pseudomonas aeruginosa; 2 (33,3 %) fueron los más frecuentemente constatados en las neumopatías inflamatorias (n= 7).
La tabla 6 refleja la resistencia a los antimicrobianos empleados, condición que determinó la inadecuada respuesta terapéutica. El Acinetobacter spp., fue el agente que mayor resistencia ofreció: 7 (24,13 %); el antimicrobiano menos efectivo fue la combinación de amoxicilina-sulbactán y la localización de ese patógeno, el tracto urinario: 3 (10,34 %). Precisamente, este sitio fue el más frecuentemente observado en 12 urocultivos que mostraron resistencia, para 41,37 %. La respuesta a las pautas terapéuticas utilizadas por nuestro grupo no fue lo suficientemente efectiva a la primera prescripción en 28 procesos infecciosos a distintas localizaciones, que representa el 14,58 %, mientras que una sola infección requirió de un tercer antimicrobiano en la segunda pauta empleada: 3,44 %. Los antimicrobianos que mostraron acción terapéutica inadecuada fueron: ceftriaxone 13 (14,6 %), amoxicilina-sulbactán 8 (21,05 %), ciprofloxacino 6 (13,63 %), ceftazidima 1 (5,26 %) y aztreonam 1 (100 %), a diferencia de la vancomicina, que se utilizó en dos ocasiones sin precisarse resistencia.
En nuestra casuística, el Acinetobacter, frente a diferentes agentes prescritos ha mostrado, por la multirresistencia, requerimientos de pautas terapéuticas prolongadas, fundamentalmente carbapenémicos, lo que se traduce en una amenaza para la vida del paciente y en un alto coste económico.
En sentido general, merece la pena comentar que la resistencia antimicrobiana en este estudio representa el 15,1 %, con muy buena respuesta a la acción de un segundo fármaco. Esta respuesta no se obtuvo, únicamente, en el contexto de una sepsis a Staphylococcus aureus de evolución fatal tratada con aztreonam luego de ciprofloxacino.
DISCUSIÓN
En cuanto al sexo, la comparación de proporciones revela que, a pesar de que existe preponderancia en hombres (57,8 %), no llega a ser significativamente superior, por ser estos los mayormente representados en la población estudiada (p= 0,100). La edad superior a los 40 años y el sexo femenino predominaron en los resultados de Kamath y otros, en la India.10 Sin embargo, los resultados de nuestros estudios coinciden con los de Ingsathit y otros11 y los de Lee y otros.12
En cuanto al color de piel, aunque descriptivamente se observa predominio de la blanca cuando se contrasta, mediante bondad de ajuste, esta distribución con la de la provincia (datos del Comité Estatal de Estadísticas), no existen diferencias significativas al respecto (p= 0,936). O sea, que cada color de la piel se presenta en proporción similar a la que posee la población general. De igual manera se comporta en el reporte de Borroto13 y otros, no obstante, ello depende de la ubicación geográfica donde se efectúe la investigación.
Al tomar en consideración las diferentes localizaciones de los procesos de infección bacteriana se corrobora que concuerdan con el crecimiento de la población que ha recibido trasplante a lo largo del tiempo de estudio y, por tanto, de la elevada probabilidad de infectar independientemente del sitio de localización del proceso infeccioso, cuestión esta que nos permite inferir que la influencia de los procesos infecciosos sobre la mortalidad no traduce una connotación relevante, lo que coincide con diferentes reportes.13-15
Un hecho a destacar es lo referente a la baja mortalidad (3,07 % del total de injertos efectuados en el período de estudio), si se considera que tal comportamiento no es usual en reportes de diferentes autores y se explica por el establecimiento del proceso infeccioso sin una enmarcación temporal establecida en la evolución, atribuible a un cúmulo de factores, dependientes del huésped, del agente causal, del lapso entre el diagnóstico y el inicio del tratamiento, así como de la virulencia y el desarrollo o no de resistencia al antimicrobiano. Dos reportes muestran resultados equiparables a los del presente trabajo.16,17 En una serie comparativa de la morbilidad y la mortalidad entre receptores de trasplantes de donador vivo y cadavérico, presentada por Lee y otros12 en Seul, Korea, la infección bacteriana representó el 21,8 % y la supervivencia a los 5 años fue similar.
En cuanto al índice de infección según el sitio de ubicación, evidencia que la ITU demostrada en urocultivos predominó en el presente estudio, guarda relación con lo reportado por otros autores.11 Igualmente lo sostienen Valera16 y Veroux.19 En cuanto a la infección nosocomial, la más común y amenazante es la urinaria, imputable a la inserción de catéter urinario a partir del segundo día del acto quirúrgico. Los microorganismos que más colonizan la vía urinaria son: Escherichia coli, Pseudomonas aeruginosa, Klebsiella spp., Enterobacter spp. y Acinetobacter spp. La Escherichia coli uropatógena coloniza tales estructuras a través de una serie de mecanismos que incluyen adhesinas especializadas, fimbrias, biofilm, así como aversión a la respuesta del huésped, según lo sostienen Pelegy Hooper.20 En los primeros 15 días posteriores al acto operatorio del TR para ambas localizaciones y atendiendo a las complejidades de la cirugía, la manipulación de estructuras vasculares y de la vía urinaria, la presencia de drenajes internos y externos, que permanecen insertados durante un tiempo variable, unido al estado de inmunosupresión, contribuyen a vulnerar las barreras biológicas naturales y facilitan el crecimiento y desarrollo de patógenos latentes presentes en el propio individuo o de origen nosocomial. Asimismo, el establecimiento de ITU sin distinguir momento de la evolución postrasplante es un fenómeno común asistido por la inmensa mayoría de los grupos de TR, donde se destacan situaciones inherentes a la cirugía de implante y/o proceso como la aperistalsis ureteral, los trastornos vesicales previos y posteriores al acto operatorio, la presencia de litiasis o quistes, la influencia de los riñones nativos, el sexo femenino, los hábitos higiénicos y miccionales, las relaciones sexuales, etc. Así lo reportan diferentes series publicadas.4,5,10,13,20-28 En el análisis retrospectivo de Khanna y otros29 en la India, sobre la incidencia y los factores de riesgo predisponentes a la ITU usando diferentes regímenes inmunosupresores, el 46,71 % de los pacientes presentaron infección a ese nivel y la Escherichia coli fue el patógeno predominante, la terapia antimicrobiana se instauró según la sensibilidad y falleció el 2,8 % de los pacientes por esta causa. La edad inferior a 45 años, el sexo femenino, la diabetes y la terapia con prednisona, azatioprina y ciclosporina en microemulsión se asociaron más a ITU, sin relación estadísticamente significativa. Rivera y otros,30 en México, aportan a la evidencia, que el 37 % de una primera ITU se presentó entre los 3 y 75 días posimplante con una media de 19,5. La Escherichia coli y el Enterococcus spp. fueron los patógenos más frecuentes, tanto en la primera infección como en las recurrencias (13,4 %) y emergieron entre los 17 y 65 días posoperatorios. Las mujeres fueron las más susceptibles y la resistencia antimicrobiana se presentó en el 22 % al ciprofloxacino. Lyerová31 informó 12 % de infección de la herida quirúrgica del TR, mientras que nuestro reporte lo hace en el 9,89 %. Lopau yotros,32 en Alemania, revelan un comportamiento equivalente al nuestro, donde los pacientes tratados con azatioprina presentaron proceso infecciosos de la herida quirúrgica y linfoceles, comparados con los que recibían micofenolato mofetil.
El presente estudio, igual que lo reflejan Hoyo y otros,33, coincide en la pertinencia de establecer oportunamente el diagnóstico etiológico de las infecciones del tracto respiratorio y obtener la muestra del material a analizar en cantidad suficiente y no contaminado. No siempre este proceder es susceptible de realizarlo con efectividad, por lo cual se impone, instaurar una terapéutica adecuada y urgente a la espera de la sensibilidad del antibiograma, así como de su posible extensión al torrente circulatorio, una amenaza temida para los equipos trasplantadores. Nosotros no pudimos demostrar microorganismos en nueve episodios de neumonía clínica y radiográficamente sugestivos, sin embargo, se logró respuesta a los antimicrobianos empleados en el tiempo pautado, razón que nos llevó a inferir que se trataba de procesos de naturaleza bacteriana. Sin embargo, asistimos a una paciente de evolución fatal tres horas después de su admisión, con un cuadro de gravedad extrema en el contexto de una neumonía a Pseudomonas aeruginosa.
Respecto a la resistencia antimicrobiana, el juicio valorativo del presente estudio concuerda con diferentes series publicadas.34-38 Para Reddy y otros,39 en Illinois, la infección por Acinetobacter spp. representó una amenaza para el receptor de TR, en particular las cepas Baumannii productoras de β-lactamasas de amplio espectro resistentes a aminoglucósidos, fluoroquinolonas y carbapenémicos, cuestión esta que no tiene una explicación convincente para la comunidad científica y constituye una preocupación fundada en la prolongación del tiempo de hospitalización, coexistencia de infecciones con otros microorganismos multirresistentes, disfunción y pérdida del injerto, así como altas tasas de mortalidad.40-45
En conclusión, en nuestro estudio se precisaron los patógenos más frecuentemente detectados; se evidenció el predominio de las infecciones del tracto urinario, las especies de enterobacterias en cualquier momento de la evolución postrasplante, el comportamiento de la resistencia a la antimicrobianoterapia en el rango de lo reportado en la literatura y pobre incidencia sobre la mortalidad. No obstante, la selección oportuna y específica del antimicrobiano a la dosis recomendada en cada paciente, ha estado presente y ha sido la herramienta principal en nuestra experiencia.
REFERENCIAS BIBLIOGRÁFICAS
1. Levey A, Eckardt KU, Tsukamoto Y. Definition and classification of chronic kidney disease. A position statement from Kidney Disease Improving Global Outcomes (KDIGO). Kidney Int. 2005;67:1098-2100.
2. Helanterä I, Saha H, Koskinen P. The follow-up of kidney transplant patients. Duodecim. 2010;126(22):2601-8.
3. Wavamunno MD, Harris DCH. The need for early nephrology referral. Kidney Int. 2005;67(Suppl 94):S128-32.
4. Parasuraman R, Samarapungavan D, Venkat KK. Updated principles and clinical caveats in the management of infection in renal transplant recipients. Transplant Rev (Orlando). 2010;24(2):43-51.
5. Dalinkevičienė E, Kuzminskis V, Petrulienė K, Skarupskienė I, Bagdonavičiūtė G, Bumblytė IA. Ten-year experience of kidney transplantation at the Hospital of Kaunas University of Medicine: demography, complications, graft and patient survival. Medicina (Kaunas). 2010;46(8):538-43.
6. Remuzzi G, Remuzzi A. Is regression of chronic nephropathies a therapeutic target? J Am Soc Nephrol. 2005;16:840-2.
7. Mainis MF, Mahorter SD, Jain A, Shrestha NK, Avery RK, van Duin D. Staphylococcus aureus bacteremia in solid organ transplant recipients: evidence for improved survival when compared with nontransplant patients. Transplantation. 2012;93(10):1045-50.
8. Florescu DF, Qiu F, West SB, Richards S, Florescu MC, Stevens B, et al. Staphylococcus aureus infections in kidney transplantation: a matched case controlled study. Scand J Infect Dis. 2012;44(6):427-32.
9. Cockroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephrol. 1976;16:31-41.
10. Kamath NS, John GT, Neelakantan N, Kirubakaran MG, Jacob CK. Acute graft pyelonephritis following renal transplantation. Transpl Infect Dis. 2006;8(3):140-7.
11. Ingsathit A, Avihingsanonc Y, Rattanasirib S, Premasathiand N, Pongskule C, Jittikanontf S, et al. Different etiologies of graft loss and death in Asian kidney transplant recipients: A report from Thai Transplant Registry. Transplant Proc. 2010;42(10);4014-6.
12. Lee S, Kim J, Shin M, Kim E, Moon J, Jung G, et al. Comparison of outcomes of living and deceased donor kidney grafts surviving longer than 5 years in Korea. Transplant Proc. 2010;42(3):775-7.
13. Borroto G, Barceló M, Guerrero C, Ponce P. Infecciones en el trasplante renal. Rev Cubana Med. (online) 2002;41(3):162-6.
14. Linares L, Cofán F, Cervera C, Ricart MJ, Oppenheimer F, Campistol JM, et al. Infection-related mortality in a large cohort of renal transplant recipients. Transpl Proc. 2007;39(7):2225-7.
15. Splendiania G, Cipriani S, Tisone G, Iorio B, Condo S, Vega A, et al. Infectious complications in renal transplant recipients. Transplant Proc. 2005;37(6):2497-9.
16. Valera B, Gentil MA, Cabello V, Fijo J, Cordero E, Cisneros JM. Epidemiology of urinary infections in renal transplant recipients. Transpl Proc. 2006;38(8):2414-5.
17. Gupta G, Unruh ML, Nolin TD, Hasley PB. Primary care of the renal transplant patient. J Gen Intern Med. 2010;25(7):731-40.
18. Lopes JA, Fernandes P, Jorge S, Resina C, Santos C, Pereira A, et al. Long-term risk of mortality after acute kidney injury in patients with sepsis: A contemporary analysis. BMC Nephrol. 2010;11:9.
19. Veroux M, Giuffrida G, Corona D, Gagliano M, Scriffignano V, Vizcarra D, et al. Infective complications in renal allograft recipients: Epidemiology and outcome. Transplant Proc. 2008;40(6):1873-6.
20. Peleg AY, Hooper DC. Hospital-acquired infections due to gram-negative bacteria. N Engl J Med. 2010;362:1804-13.
21. Linares L, Cervera C, Hoyo I, Sanclemente G, Marco F, Cofán F, et al. Klebsiella pneumoniae infection in solid organ transplant recipients: epidemiology and antibiotic resistance. Transplant Proc. 2010;42(8):2941-3.
22. Gołębiewska J, Dębska-Ślizień A, Komarnicka J, Samet A, Rutkowski B. Urinary tract infections in renal transplant recipients. Transplant Proc. 2011;43(8):2985-90.23. Barbouch S, Cherif M, Ounissi M, Karoui C, Mzoughi S, Hamida FB, et al. Urinary tract infections following renal transplantation: a single-center experience. Saudi J Kidney Dis Transpl. 2012;23(6):1311-4.
24. Linares L, García-Goez JF, Cervera C, Almela M, Sanclemente G, Cofán F, et al. Early bacteremia after solid organ transplantation. Transplant Proc. 2009;41(6):2262-4.
25. Fishman JA. Infection in solid-organ transplant recipients. N Engl J Med. 2007;357:2601-14.
26. Bromberg JS, Fairchild RL, Feng S, Kaplan B, Bar ML, Grady JO, et al. Acute graft pyelonephritis following renal transplantation. Urinary tract infection. Am J Transpl. 2009;9(Suppl 3):S59-S62.
27. Fortun J, Martin-Davila P, Pascual J, Cervera C, Moreno A, Gavalda J, et al. Immunosuppressive therapy and infection after kidney transplantation. Transpl Infect Dis. 2010;12(5):397-405.
28. Vidal E, Torre-Cisneros J, Blanes M, Montejo M, Cervera C, Aguado JM, et al. Bacterial urinary tract infection after solid organ transplantation in the RESITRA cohort. Transpl Infect Dis. 2012;14(6):595-603.
29. Khanna P, Abraham G, Mohamed Ali AA, Miriam PE, Mathew M, Lalitha MK, et al. Urinary tract infections in the era of newer immunosuppressant agents: a tertiary care center study. Saudi J Kidney Dis Transpl. 2010;21(5):876-80.
30. Rivera R, Delgado D, Flores RR, García EE, Espinosa R, Bazan AA, et al. Prospective study of urinary tract infection surveillance after kidney transplantation. BMC Infect Dis. 2010;10:245.
31. Lyerová L, Viklický O, Nemcová D, Teplan V. The incidence of infectious diseases after renal transplantation: a single-centre experience. Int J Antimicrob Agents. 2008;31(Suppl1):S58-62.
32. Lopau K, Syamken K, Rubenwolf P, Riedmiller H, Wanner C. Impact of mycophenolate mofetil on wound complications and lymphoceles after kidney transplantation. Kidney Blood Press Res. 2010;33(1):52-9.
33. Hoyo I, Linares L, Cervera C, Almela M, Marcos MA, Sanclemente G, et al. Epidemiology of pneumonia in kidney transplantation. Transplant Proc. 2010;42(8):2938-40.
34. Johnson JR, Johnston B, Clabots C, Kuskowski MA, Pendyala S, Debroy C, et al. Escherichia coli sequence type ST131 as an emerging fluoroquinolone-resistant uropathogen among renal transplant recipients. Antimicrob Agents Chemother. 2010;54(1):546-50.
35. Diomedi A. Infecciones por Acinetobacter baumannii pan-resistente. Consideraciones epidemiológicas y de manejo antimicrobiano actualizado. Rev Chil Infect. 2005;22(4):298-320.
36. Rodríguez CH, Bombicino K, Granados G, Vay C, Famiglietty A. Evaluación microbiológica y epidemiológica de los clones de Acinetobacter baumannii resistentes a los carbapenemes aislados en la unidad de cuidados intensivos de un Hospital Universitario de la ciudad de Buenos Aires. Rev Argent Microbiol. 2009;41(3):151-5.
37. Barreto S, Zambrano M, Araque M. Variaciones fenotípicas de susceptibilidad en cepas de Klebsiella pneumoniae de origen nosocomial y su asociación con la formación de biopelículas. Invest Clin. 2009;50(2):221-9.
38. van Hal SJ, Jensen SO, Vaska VL, Espedido BA, Paterson DL, Gosbell IB. Predictors of mortality in Staphylococcus aureus Bacteremia. Clin Microbiol Rev. 2012;25(2):362-86.
39. Reddy P, Zembower TR, Ison MG, Baker TA, Stosor V. Carbapenem-resistant Acinetobacter baumannii infections after organ transplantation. Transpl Infect Dis. 2010;12(1):87-93.
40. Johnson JR, Johnston B, Clabots C, Kuskowski MA, Pendyala S, Debroy C, et al. Escherichia coli sequence type ST131 as an emerging fluoroquinolone-resistant uropathogen among renal transplant recipients. Antimicrob Agents Chemother. 2010;54(1):546-50.
41. Jung JY, Park MS, Kim SE, Park BH, Son JY, Kim EY, et al. Risk factors for multi-drug resistant Acinetobacter baumannii bacteremia in patients with colonization in the intensive care unit. BMC Infect Dis. 2010;10:228.
42. Tacconelli E, Cataldo MA, De Pascale G, Manno D, Spanu T, Cambieri A, et al. Prediction models to identify hospitalized patients at risk of being colonized or infected with multidrug-resistant Acinetobacter baumannii calcoaceticus complex. J Antimicrob Chemother. 2008;62(5):1130-7.
43. Rodríguez CH, Bombicino K, Granados G, Vay C, Famiglietty A. Evaluación microbiológica y epidemiológica de los clones de Acinetobacter baumannii resistentes a los carbapenemes aislados en la unidad de cuidados intensivos de un Hospital Universitario de la ciudad de Buenos Aires. Rev Argent Microbiol. 2009;41(3):151-5.
44. Linares L, Cervera C, Hoyo I, Sanclemente G, Marco F, Cofán F, et al. Klebsiella pneumoniae infection in solid organ transplant recipients: epidemiology and antibiotic resistance. Transplant Proc. 2010;42(8):2941-3.
45. Winters HA, Parbhoo RK, Schafer JJ, Goff DA. Extended-spectrum beta-lactamase-producing bacterial infections in adult solid organ transplant recipients. Ann Pharmacother. 2011;45(3):309-16.
Recibido: 24 de noviembre de 2014.
Aceptado: 7 de julio de 2015.
Rafael Enrique Cruz Abascal. Hospital Universitario “Arnaldo Milián Castro”. Ave Nuevo Hospital entre Ave. 26 de Julio y Circunvalación, Santa Clara, Villa Clara. Cuba. CP 60100. recruzab61@gmail.com