Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión On-line ISSN 1561-3119
Rev Cubana Pediatr v.71 n.1 Ciudad de la Habana ene.-mar. 1999
Artículos originales
Hospital General "Dr. Ernesto Guevara de la Serna"Potenciales evocados visuales en recién nacidos a término
Dr. Julio Montes Brown1Resumen
Se realizaron 446 potenciales evocados visuales (PEV) en 69 recién nacidos (RN) a término, los cuales fueron estudiados en estado de vigilia y sueño espontáneo, mediante el uso de estimulación monocular tipo LED y 2 variantes de tiempo de análisis y frecuencia de estimulación (400 min y 2 Hz vs 1s y 1 Hz). Se realizaron correlaciones de los parámetros latencias y amplitud con las distintas variables perinatales. Apareció mayor número de respuestas con la utilización de un tiempo de análisis de 1s y 1 Hz de frecuencia de estimulación. Los componentes P2 y N2 aparecieron en el 100 % de las respuestas identificadas. Se produjo una prolongación de las latencias y caídas de la amplitud de los principales componentes al pasar del estado de vigilia a sueño. No se encontró correlación entre las variables peso, circunferencia cefálica y sexo con P2, pero sí con las horas de vida del RN. Se presentan las tablas de valores normativos de latencias y amplitud de los PEV para las condiciones estudiadas, cuyos resultados guardan similitud con los descritos en la literatura médica.Descriptores DeCS: POTENCIALES VISUALES EVOCADOS; RECIEN NACIDO/ fisiología; VIGILIA; SUEÑO.
Con la introducción de los Light Emitting Diodes (LED) en 1974 por Evans,1 se dio un salto cualitativo en la práctica para la estimulación visual en el recién nacido (RN) aun dentro de la incubadora, al contar con una unidad estimuladora más manuable y compacta. A pesar de esto y de la replicabilidad que han mantenido las respuestas visuales evocadas con los LED (goggles),2-4 pocos estudios se han reportado en RN con este tipo de estimulador.
Los potenciales evocados visuales (PEV) obtenidos con luz difusa son muy susceptibles a variaciones, no sólo entre los sujetos normales, sino también en un mismo sujeto estudiado en diferentes momentos.2 Estas características se acentúan en los estudios con RN, donde a los factores inherentes a estos niños se suman otros de carácter técnico. Así, por ejemplo, el estado de conciencia (sueño-vigilia) ha sido señalado como fuente de variabilidad.5 Por otra parte, el sexo, el peso del RN, la edad posconcepcional y su circunferencia cefálica (CC) han sido correlacionados con la latencia del componente P2.6
Se conoce que estas señales también varían cuando cambian las características físicas del estímulo visual, por lo que parámetros como iluminación, distancia del estimulador al globo ocular y tipo, frecuencia e intensidad del estímulo deben ser controlados.2
En un intento por completar la batería diagnóstica que garantice la exploración de l vía visual, nos dimos a la tarea de estandarizar y caracterizar los PEV en el RN a término como complemento de los métodos tradicionales de estudio de la visión.
Métodos
Características generales de la muestra
Se estudiaron 69 RN sanos (29 hembras y 40 varones), nacidos entre las 37 y 42,2 semanas de edad gestacional (EG), en las primeras 48 horas de vida, con un peso promedio de 3 268 g y un perímetro cefálico promedio de 34,5 cm, seleccionados del Servicio de Neonatología del Hospital Ginecoobstétrico "Ramón González Coro". Se consideró para la selección de éstos una revisión minuciosa de la historia clínica del RN, y se hizo énfasis en la ausencia de antecedentes de morbilidad pre, peri y posnatales; así como un examen físico normal con inclusión del estudio del fondo de ojo por un oftalmólogo.Condiciones generales de registro
Los niños se estudiaron en un local oscuro, a una temperatura ambiente entre 25 y 29 °C, abrigados, alimentados (en los casos en que las horas de vida lo permitieron) y con sus ropas secas, en estado de vigilia y sueño espontáneo, teniendo en cuenta las características conductuales que para ambos estados de conciencia describen Anders y colaboradores,7 en el RN. Se utilizó una cuna estándar donde se colocaron en decúbito supino o lateral, según mostraran mayor comodidad.Sistema de recolección y análisis de los datos electrofisiológicos
En la obtención de los PEV se utilizaron electrodos de superficie de Ag++/AgCl2 colocados en la región de Fpz (referencia) y en Oz (activo); la región mastoidea se conectó a tierra. Los electrodos se fijaron mediante pasta conductora. La impedancia se mantuvo por debajo de 10 kohms.Los registros se obtuvieron con el equipo NEURONICA-02 de fabricación cubana.
Se utilizó un esquema experimental que utilizaba ganancia de amplificación igual a 100 x 103, ancho de banda de 5 a 100 Hz, tiempo de análisis de 400 min y frecuencia de estimulación de 2 Hz; y otro con igual ancho de banda y ganancia que el esquema anterior, pero con tiempo de análisis de 1 000 min y una frecuencia de estimulación de 1 Hz.
En todos los casos se aplicó un estímulo monocular con LED rojos (goggles), de 4 min de duración, el que fue sostenido manualmente frente al globo ocular correspondiente a una distancia de 3 a 5 cm de éste.
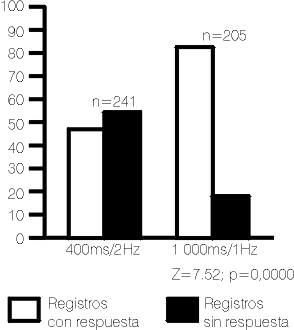
Dos jueces expertos en la identificación de PEV en RN clasificaron los registros obtenidos, en registros con respuesta y sin ésta, para las 2 condiciones experimentales (fig. 1). Aquellos que ofrecieron duda en la clasificación, al menos por 1 de los jueces, se excluyeron del estudio. Para decidir la mejor clasificación se realizó una prueba Z para diferencias entre proporciones.
Se obtuvieron mediciones de las latencias absolutas y amplitudes relativas de los componentes P1, N1, P2, N2 y P3.
Se determinó la frecuencia de aparición de cada componente y se correlacionaron variables como edad gestacional, horas transcurridas desde el nacimiento hasta el momento del estudio, peso, circunferencia cefálica, y sexo con las latencias y amplitudes de los componentes de aparición más frecuente. Para la variable sexo se aplicó la prueba no paramétrica rho de Spearman.
Al estudiar la variabilidad de las respuestas dentro de cada condición (OA/OC,vigilia/sueño),se consideraron al menos 2 repeticiones por ojo. Garantizar el mismo número de observaciones para las latencias y amplitudes de los componentes principales, entre la primera y segunda repetición, obligó a excluir del estudio 43 PEV, con el objetivo de poder aplicar una prueba t pareada.
Finalmente se calcularon los valores de diferencia interocular en aquellos casos donde fue posible estudiar ambos ojos en un mismo estado.
El procesamiento estadístico se realizó utilizando el paquete comercial NCSS (versión 5.1, 1987). El nivel de significación utilizado fue £ 0,05.
Resultados
Se obtuvieron 446 registros corticales, 205 utilizando 1 000 min de tiempo de análisis y 1 flash/s y 241 utilizando sólo 400 min de tiempo de análisis y 2 flash/s de frecuencia de estimulación. Mejor tanto por ciento de identificación se obtuvo con el primer esquema, aun cuando no se hubiera realizado una prueba Z para diferencias entre proporciones. No obstante el 18,4 % de los registros no presentó respuestas (fig.1).Diversas estructuras de onda se observaron al revisar los registros, incluso en un mismo individuo y explorando un mismo ojo. Los componentes P2 y N2 se inscribieron de forma bífida en el 15,6 y 32 % de los registros respectivamente; en tanto, la P3 se mostró desdoblada en el 29,9 %.
Con la variable horas de nacido, se obtuvieron los mejores coeficientes de correlación, siempre negativos en el caso de las latencias y amplitudes. También hubo significación con la variable edad gestacional cuando se correlacionó con las amplitudes de P2. Correlaciones muy bajas se hallaron con el resto de las variables estudiadas.
La ecuación de regresión, latencia de P2 versus horas de nacidos se expresa así:
Lat.(min) P2= 0,78(h) + 227,04 ± 16,09.
Los resultados del análisis de varianza (ANOVA) para decidir si la condición vigilia/sueño en el caso de los PEV, influía en las latencias y amplitudes de los componentes P2 y N2, se muestra en la tabla 1. Las diferencias fueron muy significativas para el componente P2 tanto en latencia como en amplitud, mientras que N2 sólo varió significativamente su amplitud.
| Componente | Variables | | F | Probabilidad | |
| P2 | Latencia | 208,5 | 219,4 | 14,2 | 0,0002* |
| Amplitud | 4,6 | 3,3 | 11,7 | 0,0008* | |
| N2 | Latencia | 297,1 | 301,7 | 1,9 | 0,16 ns |
| Amplitud | 10,4 | 7,5 | 11,8 | 0,0008* | |
No se observó variabilidad de las respuestas dentro de cada condición, y se verificó una alta correlación entre ambas repeticiones (tabla 2).
| | | | | | ||
| | | | | | | |
| | | | | | | |
| | | | | | | |
| | | | | | ||
| | | | | | ||
| | | | | | | |
| | | | | | | |
| | | | | | | |
| | | | | | ||
Considerar la simetría interocular en la exploración de la vía visual, tiene un indudable valor clínico (P2= 5,8 ± 6,2 y N2= 9,5 ± 8,3). Si bien las diferencias medias para P2 y N2 no superan los 10 min, sí se observan grandes dispersiones. No se encontró en la literatura médica consultada reportes que cuantifiquen estas variables a edades tan tempranas.
Discusión
Es evidente que en nuestro intento de utilizar un tiempo de análisis de 400 min para registrar un ERG y PEV al unísono y disminuir el tiempo de estudio, se pierde información de la estructura de onda del PEV y de sus componentes más tardíos (tablas 3 y 4) (donde el componente P3 se inscribe alrededor de los 400 min). Por otra parte, si utilizamos 1 s de tiempo de análisis para ambas técnicas, se pierde información del ERG. Esto justifica el mayor número de fallos en identificar respuestas corticales cuando se utilizaron 400 min de tiempo de análisis (fig 1).| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
Otro factor tecnológico que parece estar gravitando en el mayor número de fallos que se distinguen en el primer caso es la frecuencia de estimulación. Hrbek y Mares8 hallaron peores respuestas corticales en la medida que aumentaba la frecuencia del estímulo visual. Parece ser, que el grado de inmadurez del SNC del RN sugiere pobre mielinización y escasas conexiones sinápticas, que resultarían en una lenta respuesta ante los estímulos externos; y un incremento en la frecuencia de estimulación pudiera fatigar las poco desarrolladas sinapsis axodendríticas y las mejores establecidas conexiones axosomáticas, a tal punto, que estos autores llegaron a obtener hasta el 62,5 % de fallos cuando aumentaron la frecuencia de estimulación por encima de 1 Hz..8
A pesar de resultar mejor el segundo esquema experimental, una ausencia de la respuesta cortical a la luz se encontró en 38 registros: 23 de ellos aislados, en sujetos que en otras repeticiones sí tuvieron respuestas y donde el fallo en la identificación del PEV estuvo relacionado con el alto nivel de ruido residual (NRR) que al parecer enmascaró una respuesta de baja amplitud. En 3 sujetos (8 registros) no se obtuvo respuesta en un ojo, en el cual se manifestaron movimientos oculares rápidos en el momento de obtener el PEV, y sólo en 1 RN (7 registros) no se obtuvo respuesta bilateral. Este RN se siguió posteriormente y desarrolló una visión normal. Los registros iniciales tuvieron un NRR > 1,8 µV y correlaciones muy bajas entre los hemipromedios del potencial, que explican el fallo en acertar.
Las respuestas corticales obtenidas presentaron gran similitud en cuanto a estructura con las descritas en el adulto, aunque de mayor latencia y menor amplitud, lo que sugiere que el producto de la gestación, para el momento del parto, ya presenta una vía visual funcional aunque inmadura.9,10
Nuestros resultados con respecto a la latencia de los componentes más replicables concuerdan con lo reportado en la literatura médica.11-13
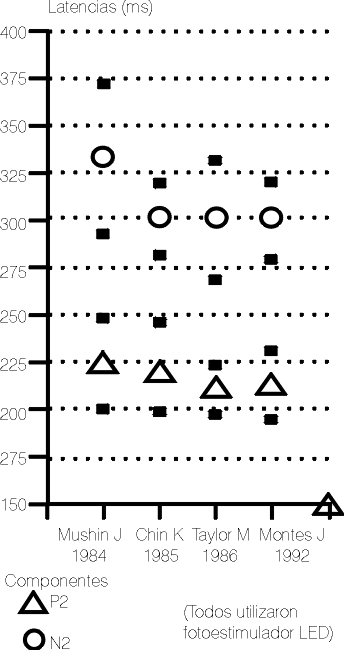
La fig.2 presenta los valores medios de las latencias absolutas de los componentes P2 y N2 encontrados por diferentes autores,11-13 incluidos los del actual estudio. Todos utilizaron el mismo montaje e igual tipo de fotoestimulador (LED), aunque con pequeñas diferencias en otros parámetros técnicos.
La aparición de componentes bífidos en la estructura de los PEV ha sido tratada por diversos autores,13,14 quienes la atribuyen al uso de la luz estroboscópica. Otros consideran que el uso de montajes bipolares unido a una amplia dispersión del flash, podría contribuir a formas de ondas más complejas.11,15 Teniendo en cuenta las distintas variantes estructurales que se pueden producir, incluso dentro de una misma sesión de trabajo, consideramos que se podría atribuir a la llegada a la corteza estriada de una "señal" desfasada que viaja a diferentes velocidades, por una vía que está en un acelerado proceso de maduración no uniforme.
En este estudio no se consideró la etapa particular del sueño en que se encontraba el RN, sino que interesó el efecto global del estado de conciencia sobre el PEV, pues si se consideraba el probable origen cortical de los componentes, se podrían esperar variaciones en sus características, incluso en su estructura con el paso del estado de vigilia al estado de sueño. La gran variabilidad descrita en estas respuestas por otros autores14,15 pudiera estar dada por el no control del estado de conciencia.
Una prolongación de las latencias y una caída de la amplitud se produce cuando el RN se duerme durante el examen, aunque para el caso de la N2 esto no pudo ser demostrado estadísticamente, tabla 1. El apantallamiento al paso de la luz que produce el descenso del párpado superior y el cambio azaroso de la actividad electroencefalográfica que caracteriza el sueño de estos RN, pudieran explicar, además de lo referido por otros autores,5 las diferencias encontradas.
En general hubo una gran variabilidad de las amplitudes de los componentes en los RN, hallazgo que se corresponde con los publicados en la literatura médica, cuyos valores experimentan mayor dispersión que las mediciones de latencia.11-13 Por otra parte el modo de establecer el nivel de referencia de medición de diferentes componentes, así como la variabilidad de la relación señal/ruido contribuyen a la mayor dispersión de la amplitud. En nuestros datos la dispersión logró reducirse con una transformación logarítmica sólo para el componente N2.
Por último, debemos aclarar que considerar nuestras normas para propósitos clínicos, ayudaría a implementar esquemas de trabajos similares al del presente estudio, con inclusión de los LED goggles que demostraron ser útiles y prácticos en la obtención de PEV en el RN.
En conclusión podemos decir que:
- En la obtención de los PEV en RN, la uti-lización de un tiempo de análisis de 1 s y 1 Hz de frecuencia de estimulación, resultaron ser adecuados en la identificación de los registros.
- Existe una relación negativa entre la latencia del componente P2 del PEV y las horas de vida del RN.
- No se encontró relación entre las variables perinatales peso, circunfe-rencia cefálica y sexo con las latencias y amplitud de los PEV en el RN a término.
- El estado de función cerebral modifica las características de los PEV, y se produce una prolongación de las latencias y una caída de las amplitudes de sus principales componentes, cuando el RN pasa de vigilia al sueño.
- Los valores normativos de los PEV obtenidos en una muestra de RN cubanos, con la utilización de un equipo de fabricación nacional y LED goggles como fotoestimulador, se corresponden con los publicados internacionalmente para similares rangos de edades.
Summary
446 visual evoked potentials (VEP) were performed in 69 full-term newborns who were studied in state of wakefulness and spontaneous sleep by using LED monocular stimulation and 2 variants of time of analysis and frequency of stimulation (400 min and 2 Hz vs ls and 1 Hz). The correlations of the latency and width parameters with the different perinatal variables were stablished. A higher number of responses was obtained with the utilization of a time of analysis of 1s and 1 Hz of stimulation frequency. P2 and N2 components appeared in 100 % of the identified responses. There was a prolongation of latency and falls of width of the main components on passing from the state of wakefulness to sleep. No correlation was found between the weight, head circumference and sex variables with P2, but it was observed with the hours of life of the newborn. The tables of normative values of latencies and width of the VEP for the studied conditions are shown. The results are similar to those described in medical literature.Subject headings: EVOKED POTENTIALS, VISUAL; INFANT, NEWBORN/physiology; WAKEFULNESS; SLEEP.
Referencias Bibliográficas
- Evans BT, Binnie CD, Lloyd DS. A simple visual pattern stimulator. Electroenceph Clin Neurophysiol 1974;37:403-6.
- Mushin J, Hogg CR, Dubowitz LMS, Skouteli H, Arden GB. Visual evoked responses to ligh emitting diode (LED) photostimulation in newborn infants. Electroenceph Clin Neurophysiol 1984;58:317-20.
- Chin KC, Taylor MJ, Whyte HE. Development of visual evoked potentials in neonates. A study using light emitting diode goggles. Arch Dis Child 1985;60:1166-8.
- Taylor MJ, Menzies R, MacMillan LJ, Whyte HE. VEP in normal full-term and premature neonates: longitudinal versus cross data. Electroenceph Clin Neurophysiol 1987;68:20-7.
- Whyte HE, Pearce JM, Taylor MJ. Changes in the VEP in preterm neonates with arousal states, as assessed by EEG monitoring. Electroenceph Clin Neurophysiol 1987;68:223-5.
- Stanley OH, Fleming PJ, Morgan MH. Developmental wave form analysis of the neonatal flash evoked potential. Electroenceph Clin Neurophysiol 1987;86:149-52.
- Anders T, Emde R, Parmelee A. A Manual of Standardized Terminology, Techniques and Criteria for Scoring of States of Sleep and Wakefullness in Newborn Infants. Los Angeles: UCLA Brain Information Service/BRI. Publications Office; 1971.
- Hrbek A, Mares P. Cortical evoked responses to visual stimulation in full-term and premature newborn. Electroencephal Clin Neurophysiol 1994;16:575-81.
- Barnet AB, Lodge A, Armintong JC. Electroretinogram in newborn human infants. Science 1995;148(3670):651-4.
- Abramov I, Gordon J, Hendrickson A, Hainline L, Dobson V, LaBossiere E. The retina of the newborn human infant. Science 1992;217(4556):265-7.
- Mushin J, Hogg CR, Dubowitz LMS, Skouteli H, Arden GB. Visual evoked responses to light emitting diode (LED) photostimulation in newborn infants. Electroenceph Clin Neurophysiol 1984;58:317-20.
- Chin KC, Taylor MJ, Whyte HE. Development of visual evoked potentials in neonates. A study using light emitting diode goggles. Arch Dis Child 1985;60:1166-8.
- Taylor MJ, Menzies R, MacMillan LJ, Whyte HE. VEP in normal full-term and premature neonates: longitudinal versus cross data. Electroenceph Clin Neurophysiol 1987;68:20-7.
- Umezaki H, Morrell F. Developmental study of photic evoked responses in premature infants. Electroenceph Clin Neurophysiol 1990;28:55-63.
- Ellingson RJ. Variability of visual evoked responses in the human newborn. Electroenceph Clin Neurophysiol 1970;29:10-9.
Dr. Julio Montes Brown. Hospital General Dr. "Ernesto Guevara de la Serna", avenida 2 de Diciembre, número 2, Las Tunas, CP 75500, Cuba.














