Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Pediatría
versión impresa ISSN 0034-7531
Rev Cubana Pediatr vol.85 no.3 Ciudad de la Habana jul.-set. 2013
ARTÍCULO DE REVISIÓN
Urolitiasis en el niño
Urolithiasis in the child
Dr. Sandalio Durán Álvarez
Hospital Pediátrico Universitario "William Soler". La Habana, Cuba.
RESUMEN
La litiasis del tracto urinario es una condición que, por lo general, se asocia a alteraciones metabólicas como hipercalciuria, hipocitraturia, hiperfosfaturia, hiperuricosuria, hiperoxaluria, cistinuria y defecto de acidificación urinaria, pero su etiología es multifactorial, e intervienen en su formación la predisposición genética y los factores ambientales, entre los que la dieta y la baja ingestión de líquidos contribuyen a la formación de los cálculos. En niños y adolescentes las causas genéticas y anatómicas son las principales. La hipercalciuria idiopática es la causa más frecuente en estos grupos etarios, aunque, como en el adulto, los factores ambientales (ingestión dietética de sal, proteínas, calcio y otros nutrientes) pueden ganar importancia para su incremento. Entre los factores locales de la orina que favorecen la formación del cálculo se encuentran, la disminución del volumen urinario, el pH urinario bajo, la tendencia al estancamiento y las infecciones. En esta revisión se analizan brevemente las distintas causas que pueden producir litiasis, valorando la importancia de la ingestión adecuada de líquidos en general, las modificaciones dietéticas que deben realizarse en cada tipo de enfermedad litiásica, las diferentes medidas terapéuticas que deben utilizarse en el cólico nefrítico producido por litiasis, en los casos asintomáticos con litiasis demostrada y en los casos en que la litiasis pueda provocar obstrucción al flujo urinario.
Palabras clave: urolitiasis, hipercalciuria idiopática, cólico nefrítico, tipos de litiasis.
ABSTRACT
Urinary tract litiasis is a condition that is generally associated to metabolic impairments such as hypercalciuria, hypocitraturia, hyperphosphaturia, hyperuricosuria, hyperoxaluria, cystinuria and urinary acidification defect. However the true etiology of the disease is multifactoral and its formation involves genetic predisposition and environmental factors among which diet and low fluid intake contribute to the formation of calculi. The genetic and anatomic causes are the main factors in children and adolescents. Idiopathic hypercalciuria is the most frequent cause in these age groups, although as it occurs in the adult, the environmental factors (diet salt, protein, calcium and other nutrient intake) may be important for the disease. Among the local factors of the urine that may favor the formation of calculi are low urinary volume, low urinary pH, urinary retention and infections. This review briefly analyzed the various causes of lithiasis and assessed the importance of adequate fluid intake, the changes in diet that can be made according to the type of lithiasis, the different therapeutic actions that should be taken in case of lithiasis-caused renal colic, asymptomatic cases with proven lithiasis and in those cases in which lithiasis may obstruct urinary flow.
Keywords: urolithiasis, idiopathic hypercalciuria, nephric colic, lithiasis types.
INTRODUCCIÓN
El término urolitiasis significa cálculos que son formados dentro del riñón, y menos frecuentemente, en la vejiga, pero pueden estar en el riñón, la pelvis, los uréteres o la vejiga.
Cálculo es la estructura sólida en el tracto urinario formada a partir de precipitaciones de componentes de la orina, que pueden llegar a obstruir la vía urinaria y comprometer la función renal.
Nefrocalcinosis es el término utilizado para describir los depósitos de calcio dentro del parénquima renal (túbulos, epitelio e intersticio). La nefrocalcinosis es altamente sugestiva de trastornos metabólicos, como, la acidosis tubular renal y la oxaluria primaria. Puede presentarse sola o en asociación con cálculos.1
DESARROLLO
Estudios arqueológicos muestran evidencia de que los humanos han tenido cálculos renales y vesicales desde hace siglos. La litiasis renal en el niño se presenta en todo el mundo, en ricos y pobres, tiende a recurrir, su prevención y terapéutica siguen siendo controvertidas, y es una condición clínica en aumento.1
La urolitiasis es una condición que afecta aproximadamente entre el 3 y 5 % de la población mundial,2 y por lo general se asocia con alteraciones metabólicas, como, hipercalciuria, hiperfosfaturia, hiperoxaluria, hipocitraturia, hiperuricosuria, cistinuria, un bajo volumen urinario por poca ingestión hídrica, y defecto en la acidificación urinaria.3 Si no se corrigen, estas alteraciones pueden provocar la formación recurrente de cálculos en proporción tan alta como el 50 % a los 5 años.4,5
La etiología de la litiasis renal es multifactorial, e intervienen interacciones ambientales y predisposición genética.6-9 Los cálculos y la nefrocalcinosis en niños son los síntomas de una enfermedad, pero no la enfermedad.1 La nefrolitiasis o urolitiasis es la manifestación final de un amplio rango de etiologías y patogénesis. Las malformaciones congénitas aportan entre 10 y 30 % de las causas de litiasis en el niño,10 las causas metabólicas el 40, las asociadas a infecciones el 10 y el 25 % son idiopáticas (se desconoce la causa).1
Entre los factores ambientales se incluyen la ingestión dietética de sal, proteínas, calcio y otros nutrientes, la poca ingestión de líquidos, las infecciones del tracto urinario, el estado socioeconómico del individuo, su estilo de vida y el clima.9-12
Mientras el incremento de la litiasis en el adulto está relacionado principalmente con factores ambientales, como hábitos dietéticos, ingestión de líquidos y obesidad, y aunque estos factores pueden ganar importancia en Pediatría, las causas genéticas y anatómicas son las principales determinantes a esta edad.13,14
La hipercalciuria idiopática es la causa más frecuente de litiasis en el niño.14 Las familias con hipercalciuria idiopática y recurrencia de litiasis de oxalato de calcio, por lo general, revelan una forma de herencia autosómico dominante.15 Los estudios en estas familias han establecido ligazón entre la litiasis hipercalciúrica y un locus en el cromosoma 1q23.3-q24, el cual contiene el gen adenil-ciclasa soluble (SAC);9,16 otro, en el cromosoma 12q12-q14, el gen receptor de la vitamina D (VDR); y otro, en el cromosona 9q23.2-q34.2, para el cual no se ha encontrado un gen candidato apropiado.9 Los mecanismos patogénicos responsables de la hipercalciuria idiopática incluyen aumento de la absorción gastrointestinal, aumento de la resorción ósea y descenso de la reabsorción renal de calcio.14,17
La composición de los cálculos ha cambiado con el paso del tiempo con aumento de los de oxalato y fosfato de calcio, haciéndolos más frecuentes que los cálculos de ácido úrico y por infecciones. Estudios epidemiológicos recientes, citados por Restrepo y otros,1 en distintos países y continentes, reportan que el oxalato de calcio es responsable del 60 al 90 % de los cálculos en niños, seguido por el fosfato de calcio con el 10 a 20 %, estruvita 1 a 14 %, ácido úrico 5 a 10 %, cistina 1 a 9 % y misceláneos 4 %. En un estudio de 99 niños cubanos, en la composición de los cálculos predominó el oxalato de calcio (64,5 %), seguido de los fosfáticos (28,9 %), mixtos (5,5 %) y cistina (1,1 %).10 En un estudio italiano en adultos con litiasis cálcicas, el 34 % de los casos tenían una hipercalciuria idiopática.18
PATOFISIOLOGÍA DE LOS CÁLCULOS
Los mecanismos multifactoriales ya señalados, contribuyen a la formación de cálculos que pasan por la génesis de un núcleo, que, permaneciendo en la vía urinaria, puede crecer mediante la agregación de cristales o partículas cristalinas.
La orina es una solución en la que las sales pueden estar en distintas concentraciones. Cuando ocurre incremento de las concentraciones de solutos en la orina que excede el umbral de saturación, la solución se comporta de forma inestable y ocurre la precipitación de cristales; se forma un núcleo al que se agregan otros cristales por medio de mucoproteínas, y esto es favorecido por cualquier mecanismo que altere el flujo normal de orina para aumentar la sobresaturación. Entre los factores locales de la orina que favorecen este proceso se encuentran: la disminución del volumen urinario, el pH urinario bajo, la tendencia al estancamiento y las infecciones. Estos mecanismos son los que favorecen la formación de cálculos.1
SÍNTOMATOLOGÍA
Los pacientes con litiasis pueden permanecer asintomáticos durante largo tiempo, y en los niños pequeños la sintomatología suele ser inespecífica.1 El síntoma más común es el cólico nefrítico, sobre todo, en mayores de 10 años, que puede ser superior al 50 % como síntoma de presentación.1,10 El dolor abdominal recurrente en los más pequeños es una manifestación relativamente frecuente. Entre el 33 y el 90 % de los casos presentarán hematuria macroscópica no glomerular, y la bacteriuria asintomática y las infecciones urinarias recurrentes en el niño mayor. Sobre todo, si se aísla proteus sp., hace pensar en una litiasis.1
En un estudio cubano que incluyó 227 pacientes de entre 2 y 18 años, el 59,9 % con edades entre los 11 y 18 años, Labrada y otros reportan: cólico nefrítico en el 53,7 %, dolor abdominal recurrente en 11,5 %, trastornos digestivos en 10,1 %, trastornos miccionales sin infección en 10,1 %, infección urinaria en 8,4 %, hematuria monosintomática en 4,8 %, residual de cirugía (operaciones anteriores por litiasis) en 2,6 % y expulsión de cálculo en 0,9 %.10
La sintomatología variará de acuerdo con la edad y la localización del cálculo. Los cálculos renales en el niño, por lo general, son asintomáticos durante mucho tiempo, y se descubren al realizar ultrasonografía abdominal por causa no relacionada o durante el estudio de una tubulopatía.1 En nuestra experiencia los niños mayores de 10 años en la mayoría de las ocasiones se presentan con el cólico nefrítico típico al igual que en el adulto. En ocasiones los cálculos pueden salir en forma de fragmentos (matriz suave) o "arenilla" a través de la uretra. Señala Restrepo1 que la presencia de este raro material y pintas de sangre en el pañal de un lactante puede ser interpretado incorrectamente; por ejemplo, atribuirlos a una balanitis.
DIAGNÓSTICO
El diagnóstico de una litiasis del tracto urinario puede ser casual al realizar una ultrasonografía renal o abdominal en un niño asintomático, o puede realizarse en un paciente con síntomas clínicos en el que ya se sospecha la enfermedad litiásica. Las imágenes son los estudios indicados para confirmar la litiasis y su localización. El ultrasonido abdominal puede diagnosticar y localizar un cálculo, pero no encontrarlo no descarta el diagnóstico; cuando el cálculo está en el riñón, se visualiza con mayor frecuencia que cuando se encuentra en el uréter o vejiga. La radiografía de tracto urinario simple (TUS) permite localizar los cálculos radiopacos, no así los radiotransparentes; en este último tipo de cálculo es frecuente la necesidad de utilizar el urograma excretor (UE). La escanografía del tracto urinario no contrastado (UROTAC) y la uroresonancia magnética (RM) con gadolinio, pueden utilizarse, pero por lo general no es necesario su indicación en la práctica médica diaria.
Una vez que se establece la presencia de litiasis, lo importante es precisar la alteración metabólica que condiciona la formación de cálculos. Teniendo en cuenta que los cálculos más frecuentes son los que contienen calcio, en un niño con antecedentes familiares de enfermedad litiásica o sin estos antecedentes, la primera prueba encaminada a diagnosticar esta anomalía debe ser la determinación de calcio en orina de 24 horas. Los valores de calcio en orina de 24 horas en el niño mayor de 2 años de edad se consideran normales hasta 4 mg/kg de peso (0,1 mmol/kg), pero cifras superiores a estas se considera hipercalciuria. En el menor de 2 años sin entrenamiento vesical es muy difícil, prácticamente imposible, la recolección de orina de 24 horas, por lo que es necesario recurrir a la determinación de la relación calcio/creatinina en una muestra de orina en ayunas.18,19
La relación normal de calcio/creatinina en orina en ayunas varía con la edad: 0 a 6 meses (< 0,8 mg/mg), 7 a 12 meses (< 0,6 mg/mg) y más de 2 años (< 0,2 mg/mg). Después de los 15 años puede aplicarse lo establecido en el adulto: 250 mg (6,25 mmol en la mujer) y 300 mg (7,5 mmol en el hombre).20,21 Para la interpretación de las pruebas metabólicas en orina debemos guiarnos por la propuesta de Restrepo,1 citando a Kher y otros,22 y que se expone en la tabla 1. Cuando el estudio se hace en una muestra de orina, podemos guiarnos por las cifras de referencia que aparecen en la tabla 2, propuestas por los mismos autores.1,22
Tabla 1. Valores normales de excreción en orina de 24 horas en niños estudiados por urolitiasis
| Volumen | Tiempo/o relación con la creatinina urinaria |
| 20-25 mL/kg | 24 horas |
| | 90 mL/min/1,73 m2 |
| Excreción de calcio | < 4 mg/24 horas |
| Excreción de sodio | < 3 mEq/kg/24 horas |
| Excreción de potasio | > 3 mEq/kg/24 horas |
| Excreción de magnesio | > 88 mg/1,73 m2/24 horas |
| | < 52 mg/1,73 m2/24 horas |
| | > 180 mg/g de creatinina en niños |
| Excreción de proteínas | < 4 mg/m2/hora |
| Excreción de cistina | < 60 mg/1,73 m2/24 horas |
| Excreción de xantinas | 20-60 umol/24 horas |
| Excreción de hipoxantinas | 20-100 umol/24 horas |
TRATAMIENTO
El tratamiento de la litiasis urinaria hay que dividirlo en tres períodos o etapas diferentes: el cólico nefrítico agudo, la litiasis asintomática y su prevención, y la litiasis que crea obstrucción de las vías excretoras.
Cólico nefrítico: durante el cólico, nefrítico además de las medidas farmacológicas, son imprescindibles la hidratación y los analgésicos. El incremento de la ingestión de líquidos, o su administración intravenosa, es la primera medida terapéutica en todos los tipos de cálculos, con lo que se busca obtener un volumen urinario diario mayor de 750 mL en los niños pequeños, 1 000 mL en mayores de 5 años, 1 500 en mayores de 10, y más de 2 000 en preadolescentes y adolescentes.1
Dos factores importantes para predecir el paso de un cálculo hacia el exterior son su tamaño y su localización. Estudios observacionales señalan una tasa de expulsión de 12, 22 y 45 %, cuando el cálculo se encuentra en la porción proximal media y distal del uréter; y 55, 35 y 8 % para cálculos de < 4, 4-6 y > 6 mm.23 Sin embargo, cálculos que pueden pasar, en muchas ocasiones, hacen impredecible el tiempo de expulsión, y estos pacientes necesitan tratamiento para reducir los síntomas asociados con el descenso del cálculo.24 Como tratamiento en este sentido se han evaluado corticosteroides, hormonas, antinflamatorios no esteroideos, bloqueadores de los canales de calcio y bloqueadores alfa-adrenérgicos. Los bloqueadores de canales de calcio y alfa-adrenérgicos emergen como los agentes más prometedores como terapéutica médica expulsiva.24 La adición de corticosteroides a estas drogas ha mostrado modestos resultados solamente,25 y su utilidad es aún incierta.26
Litiasis asintomática: en estos casos lo más importante es tratar de precisar el trastorno metabólico que condiciona la formación de los cálculos, ya que cada alteración debe llevar medidas terapéuticas diferentes, pero la ingestión abundante de líquidos es primordial en todos los casos.
El tratamiento universal, y probablemente el más importante en todos los tipos de cálculos renales, es el aumento del volumen urinario, para disminuir la concentración de solutos, y consecuentemente, la sobresaturación.27 Hay estudios que demuestran que el niño con litiasis del tracto urinario tiende a tener un volumen urinario diario menor que el de los niños sanos sin litiasis,28 como también se ha demostrado que el niño litiásico que tiene un volumen urinario mayor de 1 mL/kg/hora, casi elimina el riesgo de sobresaturación de oxalato y fosfato de calcio, así como de ácido úrico, que lo protege de la formación de este tipo de cálculos.28
En los niños con cistinuria el flujo urinario debe ser aún mayor, y en otros casos como la xantinuria, la alta ingestión de líquidos es el único tratamiento disponible, pero lamentablemente, se ha visto que en los niños la recomendación de ingesta abundante de líquido tiene poco éxito, por lo que estamos obligados a mayores esfuerzos educativos en este sentido.26
La otra intervención no farmacológica es la alimentación, pero no se ha logrado disminuir el exceso de sodio, pues, por lo general, se ingiere dos o tres veces más de lo que es recomendado. La óptima ingestión de sodio entre los 4 y 8 años de edad es 1,2 g, y entre 9 y 18 años de 1,5 g diarios, y el límite superior máximo para evitar riesgo es 1,9 y 2,3 g, respectivamente.26
Debido a la falta de estudios prospectivos randomizados controlados que enfoquen el problema dietético, no existe amplia evidencia para recomendar los cambios dietéticos. Pero, a pesar de esto, existen experiencias que apoyan la modificación de la dieta como prevención de la nefrolitiasis. En particular se recomienda limitar la ingestión de proteína animal, consumir leche y sus derivados que se corresponda con una ingestión diaria de calcio no mayor de 1 200 mg, consumir diariamente frutas y vegetales y evitar los alimentos con alto contenido de oxalato (cuadro 1),1 no exceder de 1 500 mg de vitamina C por día, evitar la deficiencia de vitamina B6, así como abstenerse, si es posible, de los suplementos de vitamina D. La leche aporta 120 mg de calcio por cada 100 mL, al igual que el yogur, y el queso aporta un promedio de 700 mg por cada 100 g. Con el queso hay que tener en cuenta la ingestión de sodio.29,30
Cuadro 1. Alimentos ricos en oxalato
| Remolacha |
| Apio |
| Frambuesa |
| Chocolate |
| Cocoa |
| Jugo de arándano |
| Higos secos |
| Frijoles verdes |
| Cebolla verde |
| Espinaca |
| Mostaza verde |
| Col |
| Puerro |
| Pimienta |
| Calabaza |
| Té |
La restricción de alimentos que contengan oxalato, en pacientes con cálculos de oxalato de calcio, aún se discute. Mientras algunos autores proponen este tratamiento, otros no encuentran asociación entre la dieta y el riesgo de litiasis, señala Alon.26 También destaca este autor, que los hábitos nutricionales no se cambian de un día para otro, y que un cambio gradual puede ser más tolerable y efectivo, por lo que se necesita de un nutricionista para asesorar a la familia y lograr los cambios necesarios.26 Estas medidas generales son las indicaciones para el paciente con litiasis asintomática, como para el paciente que ya ha expulsado cálculos.
Se ha indicado que los cálculos de < 10 mm en el uréter distal deben medicarse, y hay buena evidencia para apoyar esta conducta.25 Cuando se logra diagnosticar el trastorno metabólico que condiciona la formación de cálculos, cada alteración tiene su terapéutica específica.
Cálculos de calcio: en los niños y adolescentes con cálculos cálcicos recurrentes o hipercalciuria persistente después de 3 a 6 meses de tratamiento dietético adecuado, fundamentalmente la reducción de la ingesta de sodio, si persiste la hipercalciuria debe utilizarse la terapia con diuréticos tiazídicos (hidroclorotiazida: 1-2 mg/kg/día en una sola dosis), lo que reduce la excreción de calcio por la orina, y aumenta la reabsorción de calcio y sodio en el túbulo distal, y suele normalizar la calciuria independientemente de su etiología.1 En los pacientes con hipercalciuria e hipocitraturia, el tratamiento con citrato de potasio tiene la doble ventaja de disminuir el calcio, y aumentar el citrato en la orina, y además, mejora la mineralización ósea en estos pacientes. El citrato de potasio es la droga de elección en los pacientes con hipocitraturia y las tiazidas en las hipercalciurias.26
Como las tiazidas pueden producir hipopotasemia, es conveniente utilizar la combinación de tiazidas y diuréticos ahorradores de potasio, como el amiloride, con lo cual se puede lograr una reducción de la hipercalciuria.26 También se puede utilizar la espironolactona (aldactone: 1,5-3 mg/kg/día). Otra opción para aumentar los efectos hipocalciúricos de las tiazidas, es evitar la hipopotasemia y aumentar la citraturia; o sea, utilizar las tiazidas en combinación con citrato de potasio.31 La eficacia de las tiazidas en la prevención y tratamiento de los cálculos cálcicos recurrentes ha sido bien demostrada, y hasta el presente es el único medicamento que actúa directamente para reducir la calciuria.25
Hiperoxaluria primaria: debido a que la mayor carga de oxalato en estos pacientes es debido a un defecto enzimático hepático, existen pocos razonamientos para recomendar restricción dietética extrema de oxalato, pero parece sensato recomendar a pacientes y familiares la reducción o eliminación de los alimentos muy ricos en oxalato.26 El tratamiento tradicional ha sido la ingestión de abundante líquido, magnesio, citrato y pirofosfatos. Se ha demostrado que entre el 30 y 50 % de los pacientes con oxaluria tipo I disminuyen la oxaluria después de la administración de piridoxina (vitamina B6). En los pacientes con hiperoxaluria primaria, que desarrollan insuficiencia renal crónica terminal, es necesario un tratamiento enérgico con métodos dialíticos, seguido de trasplante renal y hepático.26
Hiperoxaluria absortiva: la hiperoxaluria absortiva puede ser idiopática, o ser secundaria a anomalías gastrointestinales, principalmente asociadas a malabsorción, y en esta última situación es necesaria la corrección de la alteración gastrointestinal, restringir el oxalato, e incrementar la ingestión de calcio. El suplemento de calcio es necesario para compensar el calcio que se une a las grasas no absorbibles. Aunque aún discutidos sus efectos, puede ser beneficiosa la colonización intestinal con Oxalobacter formigenes, que no solo degrada el oxalato intestinal, sino que también mejora la secreción colónica de oxalato, y produce un descenso de su concentración en sangre y orina.26 Oxalobacter formigenes es una bacteria gram negativa anaeróbica, cuya principal vía energética es el oxalato. Según Jiang y otros,31 se ha demostrado que esta bacteria disminuye el riesgo de formación de cálculos recurrentes de oxalato de calcio en el riñón. Señalan que el estudio realizado por ellos tiene ciertas limitaciones por el escaso número de individuos estudiados (11 pacientes y 11 controles), pero sugiere que la colonización intestinal por esta bacteria disminuye la excreción de oxalato durante períodos de baja ingestión de calcio y oxalato.
Kaufman y otros32 estudiaron 247 adultos con cálculos recurrentes de oxalato de calcio, y 259 controles de igual edad y sexo; aislaron la bacteria en las heces del 17 % de los casos con litiasis y 38 % de los controles, y al final de su análisis señalan que sus resultados sugieren que la colonización con Oxalobacter formigenes está asociada con un 70 % de reducción de riesgo para tener recurrencias de cálculos de oxalato.
Cistinuria: según Alon26 un individuo sano excreta menos de 30 mg (0,13 mmol) de cistina por día, mientras los pacientes homozigotos excretan entre 400 y 3 000 mg (1,7 y 13,0 mmol) por día. La meta de este tratamiento es mantener la cistina soluble a una concentración menor de 250 mg (1 mmol/L). Esto significa, explica el autor, que un paciente que excrete 750 mg (3 mmol) de cistina por día, necesita tener un volumen urinario diario de 3 L para mantener la cistina urinaria soluble. Señala, además, que la ingestión de líquido hay que distribuirla durante el día y la noche, por lo que el paciente debe tomar una buena cantidad de líquido antes de acostarse y, al menos, una toma adicional durante las horas de sueño. Como la solubilidad de la cistina aumenta dramáticamente en orina alcalina, el pH urinario debe mantenerse entre 7,0 y 7,5. Los agentes óptimos para alcalinizar la orina son el citrato de potasio y el bicarbonato de potasio.26
La cistinuria es un trastorno del transporte tubular de cistina, ornitina, lisina y arginina. Es un trastorno hereditario producido por defectos en SLC3A1 (tipo A) o SLC7A9 (tipo B). La cistinuria tipo AB, producida por mutación de ambos genes, es encontrada solamente en el 2 % de los pacientes con cistinuria.33 Si se considera el uso de acetazolamida, se debe tener en cuenta que los inhibidores de anhidrasa carbónica siempre tienen el riesgo de producir orina demasiado alcalina asociada a hipocitraturia, que pueden conducir a la producción de cálculos de fosfato de calcio. La excreción urinaria de cistina se correlaciona con la ingesta dietética de sodio, por lo que se recomienda una dieta baja en sodio, así como evitar las preparaciones alcalinizantes con base sódica.27,34
En algunos pacientes estas medidas son suficientes para evitar la formación de nuevos cálculos; otros necesitan terapéutica específica.25 Si con estas medidas no se obtiene la respuesta deseada se utiliza la D-penicilamina o la mercaptopropionilglicina. Como estos agentes quelantes tienen efectos adversos importantes, deben reservarse para los pacientes que no responden al tratamiento más conservador.35 La dosis recomendada de D-penicilimina es de 20 a 40 mg/kg/día.34 Se ha visto que esta droga produce dermatopatía en el 20 a 33 % de los pacientes, incluyendo la elastosis serpiginosa perforante.36
Otros tipos de litiasis: existen otros tipos de nefrolitiasis, mucho menos frecuentes en el niño, secundarias a alteraciones que condicionan su aparición: inmovilización prolongada, hiperparatiroidismo y sarcoidosis, que producen hipercalciuria. La acidosis tubular distal y los procesos mieloproliferativos son más frecuentes en la edad pediátrica; la acidosis tubular distal puede producir nefrocalcinosis, y los procesos mieloproliferativos son causa frecuente de hiperuricosuria.26
Existen situaciones en las que interviene la iatrogenia y las condiciones particulares del paciente. En los recién nacidos pretérmino de muy bajo peso (< 32 semanas de gestación y < 1 500 g de peso), se ha reportado un 16 % de nefrocalcinosis. Se plantea que en estos casos la nefrocalcinosis es multifactorial, donde intervienen la prematuridad extrema, la severidad de enfermedad respiratoria, así como la frecuencia y duración del tratamiento con gentamicina.37 También se ha reportado en la asociación de prematuridad, muy bajo peso al nacer y la administración de furosemida.38,39 La nutrición parenteral en el prematuro puede producir hiperoxaluria.26 En resumen, hay varios medicamentos que pueden provocar nefrolitiasis, entre ellos, el exceso de corticoides, la furosemida, los inhibidores de anhidrasa carbónica, la vitamina D, las metilxantinas, el indinavir, las sulfonamidas, el triamtereno, la guaifenesina, las enzimas pancreáticas y la ceftriaxona.1
La ceftriaxona, una cefalosporina de tercera generación, antibiótico de amplio espectro con vida media larga en plasma, es utilizado ampliamente para el tratamiento de las infecciones en el niño, se elimina principalmente por el riñón (33 a 67 %) con la eliminación restante por el sistema biliar.40 La ceftriaxona puede unirse al calcio y formar un precipitado (ceftriaxonato de calcio) insoluble, que conduce a la seudolitiasis biliar y a la nefrolitiasis.41,42 La ceftriaxona es un anión, y cuando la concentración de la droga en sangre es alta, puede unirse a los iones de calcio para formar estos complejos insolubles que precipitan en el sistema biliar, y al parecer, pueden formarse de la misma manera en el sistema colector renal.42,43
Los cálculos descritos son de unos pocos milímetros, aunque se recoge el reporte de un caso en un niño de 3 años con cálculo de 15,5 mm en el riñón izquierdo.40 En la mayoría de los reportes la nefrolitiasis inducida por ceftriaxona ocurrió durante los 8 y 10 días de tratamiento con dosis de 50-100 mg/kg/día. Entre los 5 y 21 días después de la suspensión de ceftriaxona, el cálculo es eliminado de la vesícula y de las vías urinarias.
Otros tipos de cálculos, cada día menos frecuentes, pero que pueden presentase, son los asociados a infección, sobre todo, en casos con anomalías congénitas del tracto urinario que pueden predisponer a infección y la formación de estos. Los cálculos ocasionados por infección están formados principalmente por fosfato amónico magnesiano (también conocido como estruvita) y carbonato-apatita. Los cálculos de estruvita se desarrollan rápidamente, y en ocasiones, forman una masa en el sistema pielocalicial. Estos cálculos se forman en presencia de bacterias que producen ureasa, que desdobla la urea en amonio y bicarbonato, tales como, proteus sp., estafilococos aureus y klebsiella sp., cuyo resultado final en orina alcalina, es la producción del cálculo. En estos casos, la medida principal es esterilizar la orina, que en ocasiones requiere la exéresis del cálculo para evitar la recurrencia, corregir el defecto anatómico, y proteger contra la infección.26
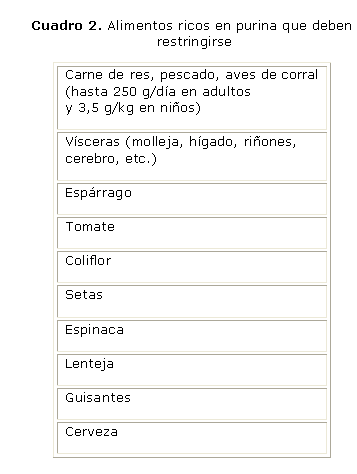
Cálculos de ácido úrico: se producen por una elevada excreción de uratos o pH urinario bajo persistente, o combinación de ambas. En estos casos la primera medida es alcalinizar la orina con citrato de potasio. Si son producidos por elevada excreción de uratos, debe indicarse restricción dietética de purinas, y puede ser necesaria la administración de alopurinol. Si el cálculo está formado por ácido úrico y calcio, debe utilizarse además, citrato de potasio, y se pueden asociar alopurinol y tiazidas.26 Los principales alimentos ricos en purina son mostrados en el cuadro 2.1
OBSTRUCCIÓN DE VÍAS EXCRETORAS
Deben ser enviados a urología pediátrica aquellos pacientes con urolitiasis y obstrucción urinaria, hidronefrosis secundaria -independientemente del tamaño del cálculo-, presencia de malformación urológica, compromiso renal debido a la presencia de grandes cálculos en la pelvis renal por alto riesgo de obstrucción, y presencia de cálculos asociados a infección.1
Los métodos de tratamiento en los casos de obstrucción de vías excretoras pueden ser la litotricia extracorpórea por ondas de choque, nefrolitotomía percutánea, extracción endoscópica, cirugía retrógrada intrarrenal, cirugía abierta o combinación de estas, pero para definir conducta hay que tener en cuenta el tamaño del cálculo, su localización y composición.1
La litotricia extracorpórea por ondas de choque es cada día más utilizada en el tratamiento de estos pacientes. Labrada y otros trataron con litotricia extracorpórea por ondas de choque 227 niños, 59,9 % de ellos entre 11 y 18 años, 38,3 % entre 5 y 10 años, e incluso 1,8 % menores de 5 años, con localización piélica en el 27,4 %, calicial en 16,0 %, incluso 7 coraliformes, y el resto ureterales, con resultados satisfactorios y escasas complicaciones (pielonefritis aguda en 3 % y hematoma renal en 0,88 %).10 Los otros métodos de tratamiento dependen de las técnicas que decida el urólogo, de acuerdo con las características y sitios de la obstrucción.
ENFERMEDAD DE DENT
Mención especial merece esta rara enfermedad. La enfermedad de Dent, también denominada nefrolitiasis recesiva ligada al cromosoma X, raquitismo hipofosfatémico hipercalciúrico recesivo, nefrocalcinosis con hipercalciuria y proteinuria de bajo peso molecular, es una alteración tubular que se caracteriza por manifestaciones de disfunción tubular, tales como, proteinuria de bajo peso molecular, hipercalciuria, nefrolitiasis, nefrocalcinosis e insuficiencia renal progresiva. Esta enfermedad se produce en varones por mutaciones en los genes CLCN5 u OCRL1 (enfermedad de Dent tipos 1 y 2), que están localizados en el cromosoma Xp11.22 y Xq25, respectivamente, pero es muy probable que otras mutaciones genéticas puedan producirla. El pronóstico vital es relativamente bueno, aunque entre el 30 y 80 % de los hombres afectados pueden progresar a la insuficiencia renal entre la tercera y quinta décadas de la vida.44 Cuando aparecen hombres en una familia con estas manifestaciones, sin afectaciones en el sexo femenino, debe sospecharse esta enfermedad.
CONSIDERACIONES FINALES
En esta revisión se ha tratado de llevar a los lectores, las principales causas de litiasis del tracto urinario en el niño, las medidas preventivas para tratar de evitar la formación de los cálculos, y la conducta que debemos adoptar de acuerdo con el tipo de trastorno metabólico del paciente. Por ser la causa más frecuente, se insiste en el diagnóstico y tratamiento de la litiasis producida por hipercalciuria idiopática, sobre todo, asociada a la hipocitraturia, pero sin olvidar que existen otros tipos de litiasis que también se pueden presentar en el niño.
REFERENCIAS BIBLIOGRÁFICAS
1. Restrepo de Rovetto C, de Castaño I, Carvajal Duque D. Urolitiasis en niños, una patología en aumento. Programa de Educación Continua en Pediatría. Sociedad Colombiana de Pediatría. Volumen 8. Número 5. Bogotá: Editorial Legis; 2009. p. 46-63.
2. Stamatelou ME, Francis ME, Jones CA, Nyberg LM, Curhan GC. Time trends in reported prevalence of kidney stones in the United States: 1976-1994. Kidney Int. 2003;63:1817-23.
3. Frick KK, Bushinsky DA. Molecular mechanisms of primary hipercalciuria. J Am Soc Nephrol. 2003;14:1082-95.
4. Cohen TD, Ehreth J, King LR, Preminger GM. Pediatric urolithiasis: medical and surgical management. Urology. 1996;47:292-303.
5. Kroovand RL. Pediatric urolithiasis. Urol Clin North Am. 1997;24:173-84.
6. Robertson WG, Peacock M, Marshall RW, Speed R, Nordin BE. Seasonal variations in the composition of urine in relation to calcium-stone formation. Clin Sci Mol Med. 1975;49:597-602.
7. Parry ES, Lister IS. Sunlight and hipercalciuria. Lancet. 1975;1:1063-5.
8. Moe EW, Bonny O. Genetic hipercalciuria. J Am Soc Nephrol. 2005;16:729-45.
9. Stechman MJ, Nellie Y, Loh NY, Rajesh V. Genetic causes of hypercalciuric nephrolithiasis. Pediatr Nephrol. 2009;24:2321-32.
10. Labrada Rodríguez MV, Larrea Masvidal E, Castillo Rodríguez M, Borrero Barriento LL, Valdés Gómez AC. Tratamiento de la litiasis renoureteral con litotricia extracorpórea por ondas de choque: experiencia en Cuba. Rev Cubana Pediatr [serie en Internet]. 2012 [citado 2 de septiembre de 2012];84(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312012000200002&lng=es&nrm=iso&tlng=es
11. Curhan GC, Willet WC, Rimn EB, Stampfer MJ. A prospective study of dietary calcium and others nutrients and the risk of symptomatic kidney stones. N Engl J Med. 1993;328: 833-8.
12. Serio A, Fraioli A. Epidemiology of nephrolithiasis. Nephron. 1999; 81(suppl 1):26-30.
13. Habbig S, Beck BB, Hoppe B. Nephrocalcinosis and urolithiasis in children. Kidney Int. 2011;80:1278-91.
14. Bastug F, Düsünsel R. Pediatric urolithiasis: causating factors, diagnosis and medical management. Nat Rev Urol. 2012;9:138-46.
15. Coe FL, Parks JH, Moore ES. Familial idiopathic hypercalciuria. N Engl Med. 1979;300:337-40.
16. Reed BY, Heller HJ, Gotimer WL, Pak CY. Mapping a gene defect in absortive hypercalciuria to chromosome 1q23.3-q24. J Clin Endocrinol Metab. 1999;84:3907-13.
17. Aladjem M, Baar J, Lahat E, Bistritzer T. Renal and absortive hypercalciuria: a metabolic disturbance with varying and interchanging modes of expression. Pediatrics. 1996;97:216-9.
18. Croppi F, Taddei L, Brandi ML, Croppi E. Idiopathic hypercalciuria and calcium renal stone disease: our cases. Clin Cases Miner Bone Metab. 2009;6:251-3.
19. Stapleton FB, Smith J. Hypercalciuria. En: Zelikovic I, Eisenstein I (eds). Practical Algorithms in Pediatric Nephrology. Basel: Karger; 2008. p. 102-3.
20. Worcester EM, Coe FC. New insights into pathogenesis of idiopathic hypercalciuria. Sem Nephrol. 2008;28:120-32.
21. Srivastava T, Schwaderer A. Diagnosis and management of hypercalciuria in children. Curr Opin Pediatr. 2009;21:214-9.
22. Kher KK, Schnaper HW, Makker SP. Clinic pediatric nephrology. 2nd ed. Abingdon: Informa, UK Ltd; 2007. p. 539-51.
23. Hubner WA, Irby P, Stoller ML. Natural history and current concepts for the treatment of small ureteral calcul. Eur Urol. 1993;24:172-6.
24. Moe OW, Pearle MS, Sakhaee K. Pharmacotherapy for urolithiasis: evidence for clinical trials. Kidney Int. 2011;79:385-92.
25. Dellabella M, Milanese G, Muzzonigro G. Medical-expulsive therapy for distal ureterolithiasis: randomized prospective study on role of corticosteroids used in combination with tamsulosin-simplified treatment regimen and health-related quality of life. Urology. 2005;66:712-5.
26. Alon US. Medical treatment of pediatric urolithiasis. Pediatr Nephrol. 2009;24:2129-35.
27. Miller LA, Stapleton FB. Urinary volume in children with urolithiasis. J Urol. 1989;141:918-20.
28. Lande MB, Varade W, Erkan E, Niederbracht Y, Schwartz GJ. Role of urinary supersaturation in the evaluation of children with urolithiasis. Pediatr Nephrol. 2005;20:491-4.
29. Nouvenne A, Meschi T, Guerra A, Allegri F, Prati B, Borghi C. Dietary treatment of nephrolithiasis. Clin Cases Miner Bone Metab. 2008;5:135-41.
30. Frassetto LA, Nash E, Morris RC, Sebastian A. Comparative effects of potassium chloride and bicarbonate on thiazide-induced reduction in urinary calcium excretion. Kidney Int. 2000;58:748-52.
31. Jiang J, Knight J. Easter LH, Neiberg R, Holmes RP, Assimos DG. Impact of dietary calcium and oxalate, and Oxalobacter formigenes colonization on urinary oxalate excretion. J Urol. 2011;186:135-9.
32. Kaufman DW, Kelly JP, Curhan GC, Anderson T, Dretter SP, Preminger GM, et al. Oxalobacter formigenes may reduce the risk of calcium oxalate kidney stones. J Am Soc Nephrol. 2008;19:1197-203.
33. Goodyer P, Saadi I, Ong P, Elkas G, Rozen R. Cystinuria subtype and risk of nephrolithiasis. Kidney Int. 1998;54:56-61.
34. Alon US, Srivastava T. Urolithiasis. En: Kher KK, Schnaper WH, Makker SP, (eds). Clinical Practice Nephrology. 2nd. edition. London: Informa; 2007. p. 539-52.
35. Milliner DS. Cystinuria. Endocrinol Metabol Clin North Am. 1990;19:889-907.
36. De Berardinis RJ, Coughlin CR, Kaplan P. Penicillamine therapy in pediatric cystinuria. Experience from a cohort of American children. J Urol. 2008;180:2620-3.
37. Pavitra S, Rao S, Vishal G, Pai GS. D-penicillamine induced elastosis perforans serpiginosa mimicking acne keloidalis nuchae. Indian J Dermatol. 2011;56:449-50.
38. Narendra A, White M, Rolton H, Allou BZ, Wilkinson G, McColl J, et L. Nephrocalcinosis in preterm babies. Arch Dis Child Fetal Neonatol Ed. 2001;85:F207-F213.
39. Wolfiel N. Haslam R, Le Quesle G, Chambers HM, Hogg R, Jureidini K. Ultrasound diagnosis of Nephrocalcinosis in preterm infants. Arch Dis Child. 1988;63:86-8.
40. Stojanovic V, Vijatov GD. Nephrolithiasis caused by ceftriaxone in a 3-year-old child with ureteropelvic junction obstruction. Case Report Med. 2009; Online may 26, doi: 10,1155/2009/365962 (PubMed).
41. Schaad UB, Wedgwood-Krucko J, Tschaepeller H. Reversible ceftriaxone-associated biliary pseudolithiasis in children. The Lancet. 1988;332:1411-13.
42. de Moor RA, Egberts ACG, Schroder CH. Ceftriaxone-associated nephrolithiasis and biliary pseudolithiasis. Eur J Pediatr. 1999;158:975-7.
43. Dulac Y, Bouissou F, Azema C, Baunin C, Normand-Gottis N. Anuria caused by urinary lithiasis induced by ceftriaxone in a 6-year-old child. Press Medicalle. 1995;24:916.
44. Devuyst O, Thakker RV. Dent's disease. Orphant J Rare Dis. 2010;5:28.
Recibido: 29 de junio de 2012.
Aprobado: 18 de octubre de 2012.
Sandalio Durán Álvarez. Hospital Pediátrico Universitario "William Soler". San Francisco # 10 112, Reparto Altahabana, municipio Boyeros. La Habana, Cuba. Correo electrónico: sduran@infomed.sld.cu