Introducción
El derrame pleural paraneumónico constituye un importante problema de salud en los niños, resulta la complicación más frecuente de la neumonía adquirida en la comunidad; su incidencia se incrementó en el mundo durante los últimos años.1 Se define como la colección de líquido que aparece en el espacio pleural en relación con una neumonía.
Transita por tres estadios: I: fase exudativa, II: fase fibrinopurulenta, III: fase organizada. Puede presentarse precedido de una fase de pleuritis seca, que se produce cuando el proceso inflamatorio del parénquima pulmonar se extiende a la pleura adyacente y produce una reacción pleurítica local, sin derrame pleural.2,3
El empiema, es una inflamación pleural en la que el líquido presenta un aspecto macroscópico opalescente o francamente purulento, y cuyo examen citológico muestra abundantes polinucleares, piocitos y, frecuentemente, bacterias. Entre los gérmenes etiológicos más repetidos se destacan el Streptococcus pneumoniae y el Staphylococcus aureus y, en menor frecuencia, el Haemophilus. influenzae tipo b y otros gramnegativos, como Pseudomona. aeruginosa y Klebsiella pneumoniae.1,2) Los empiemas del lactante y niño pequeño pueden ocasionar la muerte, lo que acontece entre el 5 y el 10 % de los pacientes.2)
El objetivo de este artículo es mostrar la importancia de la correlación fisiopatológica y diagnóstica con los pilares fundamentales de actuación terapéutica en el derrame pleural paraneumónico.
Métodos
Se realizó una revisión en Pubmed y Google Scholar de artículos publicados hasta abril de 2021, que abordaran el derrame pleural paraneumónico, su fisiopatología, elementos diagnósticos, tanto clínicos como los resultados del estudio del líquido pleural, pruebas de imágenes y estrategias terapéuticas. Se examinaron 72 trabajos y según su relevancia para el tema se incluyeron 37 artículos en la revisión.
Análisis y síntesis de la información
Derrame pleural paraneumónico. Generalidades morfológicas y funcionales de la pleura
La pleura ofrece una estructura mesotelial que en cada hemitórax recubre el pulmón, el mediastino, el diafragma y la porción correspondiente de la caja torácica. Está integrada por dos hojas en contacto íntimo: la pleura visceral, que recubre las superficies externa e interlobar de los pulmones, y la pleura parietal, que recubre la superficie interna de la caja torácica (pleura costal), el mediastino (pleura mediastínica) y la superficie superior del diafragma (pleura diafragmática). Entre ambas hojas existe un espacio virtual, el espacio pleural, separado por el mediastino de su homónimo heterolateral. Este espacio contiene habitualmente unos 0,1 y 0,3 mL/kg (en el adulto entre 5 y15 mL) de líquido, cuya función es lubricar el desplazamiento pleural durante la excursión respiratoria, resulta indetectable clínica y radiológicamente.1,2,3,4
La vascularización arterial de la pleura parietal procede de las arterias intercostales y mamaria interna; la de la visceral, principalmente de las arterias bronquiales y en menor proporción, de la circulación pulmonar. El retorno venoso de los capilares de la pleura visceral drena en las venas pulmonares mientras que los de la parietal lo hacen en la vena cava. El líquido pleural proveniente de ambas hojas fluye a la cavidad pleural a un ritmo de unos 0,5 mL/h. El drenaje venoso se efectúa en la circulación sistémica, asume 90 % del líquido pleural y el restante 10 % lo absorben los vasos linfáticos. Estos vasos de la pleura parietal, sus lagunas y los estomas, se consideran el principal mecanismo de eliminación de las partículas del espacio pleural (proteínas, bacterias, hematíes, células y otras), que es más intenso en las zonas más declives del tórax, y aumenta considerablemente cuando existe un derrame pleural. La pleura visceral drena en los ganglios linfáticos mediastínicos, bien por la superficie del pulmón o a su través, y se une a los vasos linfáticos bronquiales; la pleura visceral carece de estomas y los vasos linfáticos discurren separados del mesotelio por una capa de tejido conjuntivo, lo que explica el nulo papel de esta hoja en la extracción de partículas del interior del espacio pleural.2,3
La pleura costal y la diafragmática poseen receptores del dolor. Los estímulos procedentes de la pleura costal y de la zona periférica de la diafragmática se transportan por los nervios intercostales y el dolor se expresa en el área torácica adyacente; los estímulos procedentes de la zona central de la pleura diafragmática resultan vehiculados por el nervio frénico y el dolor se expresa en el hombro del mismo lado. La pleura visceral carece de receptores del dolor; por lo tanto, el dolor pleural tiene su origen exclusivamente en la hoja parietal.
En condiciones fisiológicas el espacio pleural mantiene una presión hidrostática negativa media de unos −5 cm H2O (−6 cm H2O en la inspiración y −2 cm H2O en la espiración).
El líquido pleural normal constituye un trasudado resultante de un proceso de filtración y reabsorción a nivel de las hojas pleurales. La filtración acontece en la zona arterial de los capilares. Este líquido pleural fisiológico es claro y transparente; contiene una escasa cantidad de proteínas, alrededor de 1,5 g/dL, principalmente albúmina; su pH es alcalino en relación con la sangre, debido a un aumento de la concentración de bicarbonato; su contenido en células resulta escaso con predominio de las mononucleadas, las mesoteliales, los linfocitos y los macrófagos, con concentraciones de glucosa iguales a los del plasma y lactato deshidrogenasa (LDH) menor que 50 % de la plasmática.2,5
La cantidad de líquido pleural constituye el resultado de un equilibrio entre su formación y su reabsorción, funciones que resultan de la precisa relación entre las presiones hidrostáticas y oncóticas, intravasculares e intrapleurales. Por lo común, las presiones hidrostáticas y oncóticas intravasculares superan ampliamente las intrapleurales pero la reabsorción de líquido pleural es mayor que su filtración. El líquido pasa al espacio pleural y se reabsorbe en la pleura visceral, este sentido circulatorio se debe a la mayor presión hidrostática en la pleura parietal, cuyos capilares resultan tributarios de la circulación mayor. La baja presión hidrostática de los capilares de la pleura visceral asegura, en condiciones normales, una rápida evacuación del líquido, lo cual mantiene el espacio pleural virtualmente exento de él. Por su parte, la capacidad del sistema linfático de la pleura parietal para drenar el líquido pleural supera en varias veces el volumen fisiológicamente filtrado.
La operación de drenar el líquido pleural se potencia por la actividad de los movimientos respiratorios de la pared torácica y del diafragma. Solo cuando se supere la capacidad de reabsorción de estos eficientes mecanismos se asiste al desarrollo de un derrame pleural (DP).2,5,6,7,8
Concepto y clasificación
El derrame pleural paraneumónico (DPP) se asocia con neumonía bacteriana, abscesos pulmonares o bronquiectasias.
El empiema es un derrame macroscópicamente purulento que se produce por una infección pulmonar (lo más frecuente) o de zonas adyacentes como espacio retroperitoneal, retrofaríngeo, vertebral o abdominal, por aumento en la permeabilidad capilar a nivel de la pleura.2,3
La infección pleural (derrame paraneumónico) puede dividirse en tres fases:
Exudativa. Acúmulo de líquido claro en el espacio pleural, con escaso contenido de leucocitos, asociado a neumonía.
Fibrinopurulenta. Existe depósito de fibrina en el espacio pleural que produce septos. Se acumulan leucocitos, el líquido es espeso y, en ocasiones, se convierte en pus.
Organizada. El infiltrado de fibroblastos hace que la pleura, que es muy fina, se engrose, se vuelva rígida e impida la reexpansión pulmonar, empeora la función pulmonar y se crea un espacio pleural persistente.2,3,6,9,10
Fisiopatología
Cuando se produce una infección pulmonar o de zonas adyacentes, se activa la respuesta inmune con inflamación pleural. La reacción inflamatoria desencadenada por bacterias aumenta la permeabilidad vascular y ocurre vasodilatación, con pérdida de proteínas (por lo que el DPP muestra característica de exudado), migran al espacio pleural células inflamatorias (leucocitos, linfocitos, eosinófilos). Este proceso resulta mediado por citocinas, liberadas por las células mesoteliales que revisten el espacio pleural, entre ellas interleucina 8 para reclutar neutrófilos, células mononucleares y linfocitos; se liberan también factor de crecimiento plaquetario, factor de crecimiento transformante beta y factor de crecimiento para los fibroblastos con actividad angiogénica y mitogénica. Posteriormente, tras la fagocitosis de los microrganismos se producen interleucina 12 y factor de necrosis tumoral alfa, que perpetúan la respuesta inflamatoria.
La fase exudativa generalmente es estéril y con pocos leucocitos, posteriormente puede progresar a una fase fibrinopurulenta por el paso de bacterias por el endotelio dañado (invasión de gérmenes), con la activación de los componentes proinflamatorios y profibróticos, con migración de neutrófilos y fagocitosis, con la consiguiente disminución de pH por la utilización anaeróbica de la glucosa por las bacterias, liberación de CO2 y ácido láctico, aumento de las concentraciones de LDH por lisis de neutrófilos. Se produce activación de la cascada de la coagulación, que induce la actividad procoagulante y disminución de la fibrinólisis (disminución de los niveles de activador del plasminógeno e incremento de los inhibidores del activador del plasminógeno), con el consiguiente depósito de fibrina, producción de septos y loculaciones, con acúmulo de fluido.
En las últimas etapas de esta fase resulta posible observar un líquido pleural purulento, debido a la presencia de productos de degradación celular y restos bacterianos(empiema). Este proceso puede progresar a la última fase (organizada), en la que el daño de las células mesoteliales varía desde una transición cuboidal inicial a la total descamación, en la que se forma una capa de fibrosis sobre ambas superficies pleurales debido al aumento de la infiltración fibroblástica.3,9,10,11
Los cambios fisiopatológicos que tienen lugar en el espacio pleural, expresan que desde un punto de vista clínico, se hable de DPP simple o no complicado, que se resolverá con tratamiento antibiótico,9,11,12) de DPP complicado (DPPC), que necesitará un drenaje de tórax o cirugía para su resolución y empiema, presencia de pus en el espacio pleural, que siempre deberá drenarse.9,11
Diagnóstico clínico, por imágenes y estudio del líquido pleural
Las manifestaciones clínicas del DPP resultan similares a las que se presentan en un paciente con neumonía, dadas por fiebre elevada, tos y taquipnea con tiraje, guardan relación con la localización y volumen del líquido.1,2,7,11) La fiebre sostenida y el dolor intenso a la inspiración profunda resultan característicos del compromiso pleural. Se puede hallar roce pleural en las etapas iniciales (pleuritis seca) pero suele desaparecer pronto, menor movilidad del hemitórax afectado, abombamiento del hemitórax principalmente en niños pequeños, escoliosis ipsilateral; se puede observar trepopnea, matidez a la percusión y disminución o ausencia de las vibraciones vocales y del murmullo vesicular. En los lactantes, los signos físicos son menos evidentes, y se puede auscultar respiración bronquial en lugar de disminución de los ruidos respiratorios. Si el líquido no está loculado, estos signos pueden cambiar con los cambios de postura del paciente.1,3,6,12
Pruebas de imagen
Radiografía de tórax
Cuando el derrame es pequeño, en la radiografía de tórax (Rx) anteroposterior, se visualiza la obliteración del seno costofrénico (CF), cuando es mayor asciende por la parte lateral de tórax produciendo el signo del menisco. Si se practica en supino puede aparecer de forma homogénea una mayor opacidad de ese hemitórax, en ocasiones, es difícil diferenciar si lo que existe es una gran condensación o un colapso pulmonar grave, también puede aparecer una línea pleural en la parte lateral del hemitórax. La Rx lateral no suele añadir mayor información, por lo que no debe practicarse de forma rutinaria. Los derrames pleurales pequeños pueden detectarse en una radiografía en posición decúbito lateral sobre el lado afectado.6,8,9,12,13,14
Ecografía torácica
Es un método útil en el estudio del DP (puede realizarse en la cabecera del paciente). Sus indicaciones son:
Identificar DP pequeños (10 mL). Estima la localización y el tamaño del derrame.
Identificación de la localización apropiada para efectuar toracocentesis y colocación de sonda pleural. Ayuda a evitar el riesgo de complicaciones secundarias a estos procedimientos.
Identificación de loculaciones o tabicaciones pleurales.
Diferenciación entre derrame y engrosamiento pleural.
Puede ayudar al diagnóstico de tuberculosis si se visualizan pequeños nódulos difusos en la superficie pleural.
Control evolutivo del derrame.
La ecografía detecta líquido pleural septado con mayor sensibilidad que la tomografía computarizada.3,6,8,9,13,14,15
Tomografía axial computarizada torácica
LA TAC es útil para distinguir entre lesiones parenquimatosas y pleurales (cuando se pretende distinguir un empiema encapsulado de un absceso pulmonar en contacto con la pleura). Está indicada ante la sospecha de abscesos pulmonares o masas en el mediastino, en los casos complicados, cuando no se logra la evacuación del líquido pleural o fracasa el tratamiento médico y en los pacientes inmunocomprometidos, ya que puede revelar otras alteraciones. De existir indicación de cirugía debe practicarse una TAC previa para evidenciar la anatomía y descartar un absceso pulmonar. Es poco sensible para visualizar septos en la cavidad pleural.2,8,9,10,13,14
Estudio del líquido pleural
Se debe realizar toracocentesis en pacientes adultos o pediátricos con DPP, con radiografía de tórax con DP> 10mm11,12,13,16) Bonina y otros,16) añadieron que también debe realizarse ante opacidad pulmonar, sin límites pleurales precisos, con semiología de derrame.
La toracocentesis diagnóstica, se indica con el fin de intentar detectar el agente etiológico y distinguir los derrames no complicados de los complicados (por las características citoquímicas del líquido pleural), pues la clínica y el estudio radiológico no siempre permiten esta diferenciación.6,12,14,16
Para el estudio y diagnóstico diferencial de un DPP se aconseja: pH, glucosa, LDH, proteínas, recuento y fórmula celular (tabla 1).
Además, de forma opcional (dependiendo de la clínica): adenosindesaminasa (ADA), amilasa, colesterol y triglicéridos.
Para el estudio microbiológico: tinciones de Gram y Ziehl, cultivos aerobios, anaerobios, cultivo Lowenstein y hongos. La utilización previa de antibióticos afecta al análisis bacteriológico del líquido pleural, pero no interfiere con los parámetros bioquímicos del líquido pleural (pH y glucosa). La muestra de líquido pleural se debe obtener en condiciones de anaerobiosis. El análisis del pH se realiza en una máquina de gases sanguíneos con la muestra en una jeringa heparinizada y tiene que ejecutarse de inmediato o bien hay que guardar la muestra en hielo.2,3,6,9,13,14,16
Tabla 1 - Correlación fisiopatológica de los valores citoquímicos y microbiológicos del líquido pleural en el derrame pleural paraneumónico complicado y empiema
|
|
||
|---|---|---|
| pH | < 7,2 | Utilización anaeróbica de la glucosa por las bacterias, liberación de CO2 y ácido láctico |
| Glucosa | ˂3,3 mmol/L (60mg/dL) | Utilización de la glucosa por las bacterias |
| LDH | ˃ 1000 U/L | Lisis de neutrófilos |
| Proteínas | ˃ 3g/dL | Aumento de la permeabilidad vascular |
| Recuento celular | Elevado con predominio de PMN | Migración al espacio pleural de células inflamatorias |
| Gram y cultivo de LP | Pueden ser positivos | Invasión de bacterias al espacio pleural |
Leyenda: PMN: polimorfonucleares; LP: líquido pleural.
El empiema suele presentar un pH inferior a 7,10.3 El pH puede resultar diferente en distintas cámaras del derrame pleural loculado y el Proteus sp. provoca la alcalinización del líquido pleural.10,17
Las muestras de pus deben analizarse en los laboratorios de microbiología. El estudio bioquímico, a menudo impracticable por la viscosidad del espécimen, y en todo caso sus resultados son intrascendentes clínicamente, ya que el paciente requerirá en cualquier caso un drenaje pleural.15
Tratamiento
La mayoría de los autores concuerdan que el tratamiento antibiótico y el drenaje torácico, con la administración de fibrinolíticos intrapleurales, cuando se indica, resulta la mejor práctica clínica en los DPPC, su aplicación se asocia a un buen pronóstico a medio plazo en pediatría y aunque no existen suficientes estudios en la población infantil, proporciona un marco razonable de actuación que se sigue por muchos especialistas. El fármaco y las dosis óptimas no se presentan con nitidez, sino que se establecen de forma empírica. Si no se produce mejoría, está indicada la cirugía video-toracoscópica (CVT). Si la fibrinólisis y la CVT no son eficaces, la toracotomía abierta con decorticación pleural resulta la indicación establecida.3,6,10,11,13,18
Antibioticoterapia
El tratamiento antibiótico inicial es fundamentalmente empírico. La elección del antibiótico se basa en la posible etiología según la edad del paciente, la gravedad de los síntomas, las características de la imagen radiológica, el resultado de estudios de laboratorio clínico, comorbilidad, datos de prevalencia y resistencia antimicrobiana, según estudios locales. Se necesita también considerar el estado de inmunización del niño, es decir, cumplimiento del esquema de vacunación según edad. Debe tratarse con antibióticos intravenosos, que se administrarán a dosis adecuadas para que penetren en el espacio pleural. Según las posibilidades, el antibiótico se indica por los resultados microbiológicos. Si el cultivo del líquido pleural resulta positivo, el tratamiento antibiótico se guiará por la sensibilidad del germen, si los cultivos ofrecen datos negativos se continuará con el tratamiento antibiótico inicial, si la evolución resulta satisfactoria. Existen diferentes criterios relacionados con la duración adecuada del tratamiento antibiótico, se recomienda la vía intravenosa hasta que el niño se mantenga afebril entre 48 h hasta 5 días. o, al menos, hasta que se retire el drenaje pleural. Se continúa con tratamiento oral entre una y tres semanas más, o durante más tiempo si persiste enfermedad residual. En el empiema la respuesta clínica resulta lenta, y puede necesitarse tratamiento con antibióticos sistémicos durante hasta 4 semanas.1,3,6,12
Los DP deben tratarse con antibióticos intravenosos. Se cubrirán los gérmenes más frecuentes de neumonía adquirida en la comunidad, especialmente el E. pneumoniae. La primera línea de tratamiento: ceftriaxona (80 a 100mg/kg/día) o cefotaxima (150 a 200 mg/kg/día). Cuando se trata una neumonía a focos múltiples, rápidamente progresiva, necrotizante, con empiema, neumotoceles o asociada a infección de piel y partes blandas se añadirá, a las cefalosporinas de tercera generación, la vancomicina (40 a 60 mg/kg/día) o la clindamicina (40 mg/kg/día), debido a la sospecha de estafilococos aureus meticilin resistente (MRSA) a cualquier edad.
Las oxazolidinonas, específicamente el linezolid, resulta otra opción terapéutica a tener en cuenta si existe evolución desfavorable aún con vancomicina y tratamiento quirúrgico adecuado, o se demuestra una cepa de estafilococo resistente a vancomicina. El DP también puede asociarse a infección por mycoplasmas aunque es infrecuente el empiema. Si el paciente se presenta inmunodeprimido, deben considerarse otras causas, como infección por micobacterias, macrólidos asociados a los β-lactámicos en los que se sospeche probable neumonía por Mycoplasma pneumoniae o Clamidia pneumoniae, por vía oral o parenteral.1,3,6,10,11,16,18
Drenaje pleural
Es importante colocar el tubo de drenaje pleural de forma precoz, tan pronto como se establezca el diagnóstico de DPPC, porque si se retrasa puede ser muy difícil realizar un buen drenaje del líquido, ya que un derrame con líquido libre se puede transformar en pocas horas en un derrame con tabicaciones.14
Criterios para colocar drenaje pleural en el DPP:
Se recomienda retiro de sonda pleural cuando se documente drenaje menor a 1,5 mL/kg/día en población infantil o menos de 200 mL/día en población adulta. El retiro del drenaje torácico resulta apropiado después de la real mejoría clínica, disminución de los marcadores de inflamación y expansión pulmonar plasmada en radiografía de tórax.13,16
Fibrinolíticos
La fisiología para la formación de los coágulos de fibrina se encuentra bien descrita. Un trombo o coágulo se forma cuando células de la sangre quedan encerradas en una matriz de la proteína fibrina. Posteriormente. una enzima, la plasmina, que es una proteasa sérica similar a la tripsina, puede actuar en la disolución de los coágulos. Este proceso se conoce como trombólisis o fibrinólisis.19,20
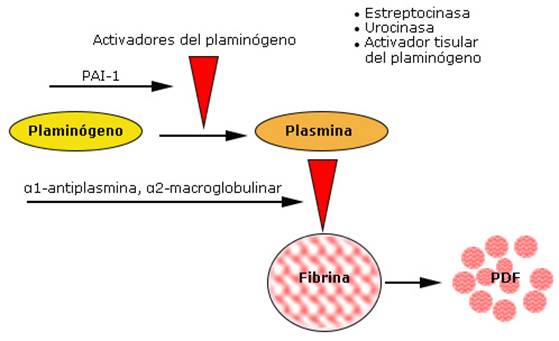
La plasmina es la forma fibrinolíticamente activa que se produce a partir del zimógeno inactivo, denominado plasminógeno, el cual existe presente en la sangre. La conversión del plasminógeno en plasmina está mediado por un corte proteolítico del enlace R561-V562, el cual se produce por varios activadores del plasminógeno.22 Los activadores del plasminógeno presentes en la sangre son el activador tisular del plasminógeno (t-PA, del inglés tissue plasminogen activator) y el activador del plasminógeno tipo uroquinasa (uPA, del inglés urokinase-typeplasminogen activator). La actividad fibrinolítica en la circulación se modula por los inhibidores de los activadores del plasminógeno, entre ellos, el inhibidor 1 del activador del plasminógeno (PAI-1) y de la plasmina (α1-antiplasmina, α2-macroglobulina).21 La plasmina actúa sobre la red de fibrina y la convierte en productos de degradación del fibrinógeno (PDF) (fig.).
En el tratamiento clínico aparecen las formas recombinantes de los activadores humanos del plasminógeno (t-PA y uPA) y también la estreptoquinasa (SK), una proteína aislada de la bacteria estreptococo, que no se encuentra de forma natural en la circulación humana. La SK, a diferencia del t-PA y la uPA que son proteasas, no presenta actividad enzimática propia.20 Esta proteína adquiere su capacidad activadora por medio de la formación de un complejo con el plasminógeno o la plasmina presentes en la circulación sanguínea. Este complejo asume una función de proteasa sumamente específica, al activar otras moléculas de plasminógeno en su conversión a plasmina.20,22
Estreptoquinasa recombinante (Heberkinasa®)
En el Centro de Ingeniería Genética y Biotecnología (CIGB) de La Habana se obtuvo en 1990 la estreptoquinasa recombinante (SKr; Heberkinasa®), primera molécula de estreptoquinasa obtenida por las técnicas de ADN recombinante, está compuesta por una proteína con cadena de 415 aminoácidos, con pureza de 99 % y peso molecular de 47 kiloDalton (kDa) que difiere de la SK natural en cinco aminoácidos. Se demostró que la proteína obtenida se puede utilizar en clínica para el tratamiento de diferentes tipos de trombosis. La Heberkinasa® resultó eficaz y seguro por el bajo grado de severidad de las reacciones adversas y por la tolerancia del medicamento.23
Fibrinólisis intrapleural
La instilación de agentes fibrinolíticos a través de la sonda pleural para licuar las loculaciones y los septos en etapas tempranas demostraron eficacia para resolver el empiema en múltiples estudios, ayudaron a equilibrar la homeostasis fibrinolítica, además de lisar los tractos fibrosos, disminuir la viscosidad del líquido pleural y restablecer su filtración y reabsorción, lo cual facilita el drenaje y evita procederes quirúrgicos.6,13,14,16,24,25,26
Las guías actuales de tratamiento del DPP recomiendan utilizar los fibrinolíticos de forma precoz cuando se presentan loculaciones en la cavidad pleural y ante un empiema.1,6,10,11,13,14,27)
Se muestran algunos ensayos clínicos controlados en adultos que demostraron la heterogeneidad en los resultados, sugirieron que el tratamiento con fibrinolíticos redujo las tasas de necesidad de cirugía, aunque no la de mortalidad,11) en coincidencia con una revisión sistemática Cochrane,28 (Tabla 2).
Tabla 2 - Tratamiento fibrinolítico intrapleural. Características de los ensayos controlados con placebo en adultos
|
|
|
|||||||
|---|---|---|---|---|---|---|---|---|
| Tto | Pbo | Tto | Pbo | |||||
|
Maskell 2005 |
Reino Unido | 454 |
DPPC y E |
Estreptoquinasa 250 000 UI; 1 dosis/12 h/3 días |
15,5 NS | 14,0 | 15,5 | 14,5 |
| Rahman 2011 | Reino Unido | 210 |
DPPC y E |
t-PA y DNasa 10 mg+5 mg; 1 dosis/12 h/3 días |
8 NS |
4,0 | 4 p = 0,03 | 16,0 |
|
Davies 1997 |
Reino Unido | 24 |
DPPC y E |
Estreptoquinasa 25 .000 UI; 1 dosis/24 h/3 días |
0 NS |
0,0 | 0 No ap. | 25,0 |
|
Bouros 1999 |
Grecia | 31 |
DPPC |
Uroquinasa 100000 UI; 1 dosis/24 h/3 días |
0 NS |
0,0 |
13 p ˂ 0,05 |
38,0 |
| Tuncozgur 2001 | Turquía | 49 |
E estadio II |
Uroquinasa 100 000 UI; 1 dosis/24 h/3 días |
0 NS |
0,0 |
29 p ˂ 0,001 |
60,0 |
| Diacon 2005 |
Sudáfri- ca |
53 | DPPC y E |
Estreptoquinasa 250}000 UI; 1 dosis/24 h/7 días |
4,5 NS |
4,5 |
14 p ˂ 0,02 |
45,5 |
| Misthos 2005 | Grecia | 127 | E | Estreptoquinasa 250.000 UI; 1 dosis/24 h/3 días |
1,7 P ˂ 0,001 |
4,2 |
12,3 p ˂ 0,05 |
32,9 |
Leyenda: E: empiema; NS: no significativo; Pbo: grupo placebo; Tto: grupo tratamiento; No ap.: No aportado.
Se utilizan varios protocolos de tratamiento con SK, uroquinasa y t-PA en el tratamiento de niños con DPPC y empiema.29,30,31) La dosis diaria de estreptoquinasa consiste en 100 000-250 000 UI/ día (o 10 000-20 000 UI/kg/día), mientras que la de uroquinasa utilizada en los diferentes estudios osciló entre 10 000-50 000 UI/ 12-24 h, alteplasa 4 mg/día (o 0,1mg/kg/día); la mayoría de los autores recomendaron realizar tratamientos de tres a seis días.1,2,3,6,13,14,16,31) En Cuba existen reportes aislados de casos con DPPC tratados con fibrinólisis intrapleural en niños,32 y un caso de una embarazada en la que se utilizó SKr intrapleural de manera eficaz y segura.33
Tratamiento quirúrgico
La CVT es el procedimiento quirúrgico de elección para romper las adherencias, se establece como el estándar de oro del manejo quirúrgico del DPPC, en fase fibrinopurulenta u organizada, cuando el manejo con fibrinólisis fracasó.2,6,9,10,13,18)
Algunos autores,34) acerca de un ensayo clínico controlado y aleatorizado, que incluyó 32 pacientes, concluyeron que la CVT temprana en el DPPC y empiema, resultó segura y puede acortar la estadía hospitalaria comparado con la terapia fibrinolítica intrapleural. No encontraron diferencias relacionados con fallos de tratamiento, mortalidad, eventos adversos ni complicaciones, entre ambos grupos de tratamiento.
El hallazgo de un líquido pleural purulento o de loculaciones no es predictivo de la necesidad de cirugía, varios estudios compararon el tratamiento conservador (antibióticos y drenaje de tórax con/sin fibrinolíticos) con la CVT como tratamiento de primera línea, tanto en niños como en adultos, el enfoque quirúrgico precoz no demostró ventajas en la mortalidad ni en la morbilidad grave en ningún ensayo, además la cirugía no resulta exenta de complicaciones (11
El consenso nacional para el diagnóstico y tratamiento de la de la neumonía adquirida en la comunidad en pediatría sugieren que se debe considerar la cirugía toracoscópica como primera opción de tratamiento quirúrgico en cualquiera de las fases del empiema pleural para actuar sobre sus consecuencias en el espacio pleural.12)
La CVT demostró su eficacia en el tratamiento de niños con DPPC sin asociarse con la mortalidad, el 21,4 % presentó al menos una complicación intra- o posoperatoria, la fístula broncopleural resultó la más frecuente.35 La CVT es un método con el que se lograron excelentes resultados, y permitió disminuir la estadía hospitalaria, las complicaciones pulmonares y extrapulmonares, así como la necesidad de reintervenciones quirúrgicas.36
En la etapa organizada se forma una corteza fibrosa que restringe la movilidad y expansión pulmonares, la toracotomía abierta con decorticación pleural tiene como propósito remover el tejido fibroso, realizar un adecuado drenaje y limpieza de la cavidad pleural y asegurar la adecuada expansión del parénquima pulmonar, se utiliza cuando no se logran los objetivos del tratamiento con la opción mínimamente invasiva, o cuando existe fuga aérea persistente, generalmente debido a paquipleuritis o neumonía necrotizante.1,12,13
Los cambios fisiopatológicos que se producen en las tres fases del DPP se correlacionaron con los diferentes elementos diagnósticos y guiaran la aplicación oportuna de los pilares de tratamiento (anexo).
Conclusiones
El líquido pleural fisiológico es claro y transparente, su pH es alcalino, respecto a la sangre, las concentraciones de glucosa son iguales a los del plasma y la LDH menor que de la plasmática en 50 %. Los resultados citoquímicos: pH˂ 7.20, glucosa˂ 3,3 mmol/L, LDH˃ 1000 U/I; y microbiológicos del líquido pleural: Gram o cultivo positivo, corresponden con la fase fibrinopurulenta del DPP en el que, como consecuencia del endotelio vascular dañado y la invasión de gérmenes, existe estimulación de los componentes proinflamatorios y profibróticos con activación de la cascada de la coagulación, que induce la actividad procoagulante y disminución de la fibrinólisis. La obtención de estos resultados citoquímicos y microbiológicos en el estudio del líquido pleural conlleva de forma indispensable, la colocación del drenaje pleural para evitar el acúmulo de fluido, que se volverá cada vez más viscoso, con depósito progresivo de fibrina que llevará a la formación de tabiques y la presencia de pus. Ante DPPC, con septos, tabiques o partículas en suspensión en la ecografía de tórax, hallazgo de fibrina, líquido turbio o pus en el proceder de colocación del drenaje de tórax o aparición de tabiques, septos o fibrina en los 10 días siguientes a la colocación del drenaje, se debe iniciar fibrinólisis intrapleural. Cuando el tratamiento con fibrinolíticos intrapleurales falla, la CVT es el procedimiento quirúrgico de elección.
En Cuba, en la Unidad de Terapia Intensiva del Hospital Pediátrico Provincial de Camagüey "Dr. Eduardo Agramonte Piña”, se ejecuta el estudio DENIS, ensayo clínico publicado en el Registro Público Cubano de Ensayos Clínicos (registro primario de la OMS; http://registroclinico.sld.cu/; RPCEC00000292). Loret de Mola Bueno y otros,37) proponen un algoritmo terapéutico en la atención del DPP apoyado en las bases fisiopatológicas y diagnósticas antes expuestas. Los resultados parciales de dicho ensayo demostraron que la utilización de la Heberkinasa® intrapleural en el derrame pleural paraneumónico complicado complejo en niños resultó un método eficaz y seguro.