Introducción
El derrame pleural paraneumónico (DPP) se produce por una infección pulmonar, como la neumonía bacteriana (lo más frecuente), el absceso pulmonar y la bronquiectasia o de zonas adyacentes, como el espacio retroperitoneal, retrofaríngeo, vertebral o abdominal.1,2) Citados en el libro de Light y otros3) se encuentra que Hipócrates (460-377 a. C.) fue el primero en describir la pleuresía y su progresión al empiema si no se trataba. El manejo proactivo y el drenaje de pus con instrumentos progresaron en el siglo xvi, dirigido por Ambrosie Paré. Siglos más tarde, la infección pleural resultaba un problema mundial, con una significativa morbilidad y mortalidad en adultos y en niños.
El DPP se desarrolla entre el 2 y el 12 % de los niños con neumonía y hasta el 28 al 40 % de los que requieren hospitalización.4,5Light6 en 1995 clasificó el DPP en siete clases; la presencia de derrame con tabiques en la ecografía de tórax definió el derrame pleural paraneumónico complicado complejo (DPPCC) y el pus en cavidad pleural definió el empiema.
El tratamiento tiene como fin esterilizar el espacio pleural y restaurar la función pulmonar normal. Hay varias opciones para el tratamiento: los antibióticos sistémicos, el drenaje torácico, la instilación de agentes fibrinolíticos, la cirugía video-toracoscópica (CVT) y la toracotomía con desbridamiento quirúrgico.2,7
La instilación de agentes fibrinolíticos, a través de la sonda pleural, para licuar los septos, presenta demostrada eficacia para resolver el empiema en múltiples estudios en niños. Lisan los tabiques, acortan la estadía hospitalaria y disminuyen la necesidad de cirugía. Los utilizados son estreptoquinasa (SK), uroquinasa (Uk) o activador tisular del plasminógeno (t-PA).8,9,10
La Heberkinasa® fue la primera molécula de SK obtenida por las técnicas de ácido desoxirribonucleico recombinante, en el Centro de Ingeniería Genética y Biotecnología (CIGB) de La Habana hace tres décadas. Se demostró que esta proteína podía utilizarse para el tratamiento de diferentes tipos de trombosis, con resultados clínicos satisfactorios, bajo grado de severidad de las reacciones adversas y tolerancia del medicamento.11,12,13) Se realizaron estudios con diferentes protocolos de tratamiento fibrinolítico en niños y adultos con DPPCC y empiema.14,15 En Cuba solo existen publicaciones aislados.16,17) El objetivo de este estudio fue evaluar la eficacia y la seguridad de la Heberkinasa® en el tratamiento del DPPCC y el empiema en niños.
Métodos
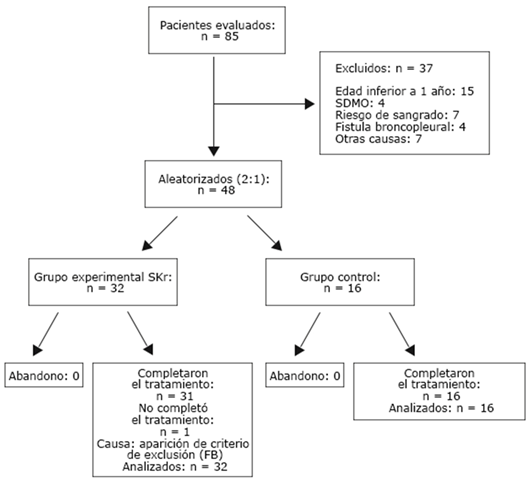
Se ejecutó un ensayo clínico confirmatorio fase III, abierto, aleatorizado, en grupos paralelos y controlado. Se completó la inclusión prevista de 48 niños que ingresaron en la unidad de terapia intensiva pediátrica (UTIP) del Hospital Pediátrico Provincial de Camagüey “Dr. Eduardo Agramonte Piña”, desde septiembre de 2018 hasta diciembre de 2021, con el diagnóstico de neumonía complicada con DPPCC y empiema.
Se incluyeron los pacientes que cumplían con los siguientes criterios:
Pacientes de cualquier sexo, con edades comprendidas entre 1 y 18 años.
Cumplimiento de los criterios diagnósticos de DPPCC y empiema, y alguno de estos criterios: derrame pleural complejo, con septos, tabiques o partículas en suspensión en la ecografía de tórax con criterios de colocación del drenaje; hallazgo de fibrina o pus en el procedimiento de colocación del drenaje de tórax; y aparición de tabiques, septos o fibrina en los 10 días siguientes a la colocación del drenaje.
Voluntariedad de los padres o tutores del paciente mediante la firma del consentimiento informado.
Se excluyeron:
Postoperatorio de cirugía mayor reciente (48 horas).
Presencia de fístula broncopleural (FBP).
Sangrado activo, discrasias sanguíneas, malformaciones arteriovenosas o aneurismáticas.
Paciente con tumor intracraneal o con accidente cerebrovascular.
Pacientes con endocarditis o con antecedentes de cardiopatías.
Shock séptico inestable o resistente a catecolaminas, síndrome de disfunción múltiple de órganos (SDMO).
Tratamiento con Heberkinasa® en los últimos seis meses.
Pacientes con alguna condición de riesgo de sangrado mayor (contraindicaciones establecidas para la Heberkinasa® por vía intravenosa).
Enfermedad crónica descompensada.
Antecedentes de alergia a la Heberkinasa® o a cualquier ingrediente de la formulación en estudio.
Pacientes embarazadas o en período de lactancia al momento de la inclusión en el estudio.
El protocolo del estudio siguió la Declaración de Helsinki y las normas éticas establecidas en los códigos nacionales e internacionales y en las regulaciones vigentes en Cuba (Directrices de Buenas Prácticas Clínicas, CECMED 2000, Cuba; Guía de Buenas Prácticas Clínicas de la Conferencia Internacional de Armonización-ICH E-6). Se aprobó por el Comité de Ética y Revisión del Hospital Pediátrico Provincial “Dr. Eduardo Agramonte Piña”, y por el Ministerio de Salud Pública. El Grupo Nacional y la Sociedad Cubana de Pediatría avalaron el estudio. Este ensayo se encuentra en el Registro Público Cubano de Ensayos Clínicos (registro primario de la OMS; http://registroclinico.sld.cu/; RPCEC00000292). Se notificó a la Autoridad Reguladora cubana, Centro para el Control Estatal de Medicamentos y Dispositivos Médicos (CECMED). En todos los casos se solicitó el consentimiento informado por escrito a los padres o tutores legales del paciente para participar en el estudio
Aleatorización
La aleatorización se centralizó en el CIGB. Se confeccionó una lista aleatoria en bloques de seis individuos (razón 2:1), a través de una herramienta informática desarrollada en la Universidad de Arkansas para Ciencias Médicas. La investigadora responsable en el sitio clínico del estudio, después de verificados los criterios de selección y obtenido el consentimiento informado por parte de los padres/tutores legales del paciente, localizó al responsable clínico del proyecto en el CIGB, a través de una línea de telefonía celular disponible las 24 h quien; después de registrar las iniciales de los pacientes asignó el código de identificación correspondiente, así como el grupo de tratamiento. En las visitas de monitoreo se verificó este proceso, así como el completamiento de la información primaria, el cumplimiento del tratamiento y de las Buenas Prácticas Clínicas.
Esquema de tratamiento
Todos los pacientes recibieron los cuidados y el tratamiento estándar establecido para el manejo de la neumonía con DPPCC y empiema, protocolizado en la UTIP y se distribuyeron de manera aleatoria (2:1) en dos grupos de estudio: I (experimental-Heberkinasa®): terapia fibrinolítica con Heberkinasa®, una administración intrapleural diaria de 200 000 UI durante 3-5 días + antibioticoterapia intravenosa según protocolo de la unidad, punción pleural, colocación de drenaje de tórax bajo anestesia local y sedación, y CVT en los casos que lo requirieron; II (control-terapia estándar): recibió todo lo indicado para el grupo experimental, excepto la fibrinólisis.
En el grupo experimental se cumplimentó el algoritmo terapéutico propuesto para el manejo pediátrico del DPP.18) Previo a la administración de Heberkinasa®, se aplicó hidrocortisona (10 mg/kg intravenoso, 30 min antes del procedimiento) y bupivacaína 0,5 % (1 mg/kg, completar hasta 20 mL con cloruro de sodio 0,9 % y administrar por vía intrapleural antes de la fibrinólisis).
Para la reconstitución del liofilizado de Heberkinasa® se adicionó 7,5 mL de agua para inyección, dirigiéndose el líquido hacia las paredes del bulbo, con giros cuidadosos para evitar la formación de espuma y suave rotación para facilitar la disolución. Del liofilizado se extrajeron 2 mL (200 000 UI) con una jeringa de 50-60 mL (cargada con 48 ml de cloruro de sodio al 0,9 %). Previa administración de bupivacaína, se administró lentamente el contenido de la jeringa (50 mL) dentro de la cavidad pleural a través de la sonda pleural en 1 min ± 10 seg.
La sonda pleural permaneció pinzada durante cuatro horas, con cambios de posición del paciente cada 20-30 min. Posterior, se conectó el drenaje al sistema cerrado con aspiración controlada. Se retiró la pinza, se midió el gasto y las características del líquido pleural y se registraron en la historia clínica.
El ensayo duró el tiempo que cada paciente permaneció ingresado en el hospital. Las evaluaciones clínicas se realizaron diarias durante la estadía en la UTIP. Se realizó seguimiento hasta el egreso hospitalario por el equipo de investigación.
Las variables principales fueron: necesidad de tratamiento quirúrgico (CVT) por fracaso de la terapia estándar o experimental, y estadía hospitalaria. Como variables secundarias se consideraron: resolución del derrame pleural, tiempo para extraer el drenaje pleural, estadía en terapia intensiva, complicaciones y mortalidad.
Se registraron los eventos adversos durante la ejecución del ensayo (tipo, duración, intensidad, resultado y relación de causalidad). La intensidad de los eventos adversos se clasificó en tres niveles: a) leve, si no requirió tratamiento; b) moderado, si fue necesario un tratamiento específico; y c) grave, cuando se requirió hospitalización, esta se prolongó, si el evento ocasionó incapacidad, puso en riesgo la vida del paciente o contribuyó a su muerte.19 Se empleó un análisis cualitativo para clasificar la relación causal como definitiva, probable, posible o dudosa.20
Se consideraron las siguientes variables de base: edad (años), sexo (masculino, femenino), color de la piel (blanco, negro, mestizo), talla (cm), peso (kg) y relación edad/peso (en percentiles).
La hipótesis del estudio fue la ausencia de eventos adversos graves con causalidad demostrada atribuible a la Heberkinasa®, con reducción ˃ 20 % de la necesidad de tratamiento quirúrgico y de más de tres días de la estadía hospitalaria con respecto al tratamiento estándar (grupo control). Se fijaron errores de tipo I y II, α = 0,05 y β = 0,2, en un modelo de superioridad y aleatorización 2:1, y se estimó un tamaño de muestra de 42 sujetos (28 en el grupo experimental y 14 en el grupo control). Se supuso, además, un 14 % de pérdidas para cubrir los abandonos o interrupciones del tratamiento y la cantidad de individuos ascendió a 48 (32 en el grupo de Heberkinasa [SKr] y 16 en el control). Para el cálculo del tamaño muestral se usó el software PASS (https://www.ncss.com).
Se empleó una aleatorización desbalanceada por dos elementos de racionalidad: 1) exponer un mínimo de pacientes al tratamiento estándar exclusivo, pues aunque no está aprobado en Cuba el uso de la Heberkinasa® para el DPPCC y el empiema; la fibrinolisis intrapleural resulta una recomendación del consenso nacional para el tratamiento de la neumonía complicada con empiema y existen reportes en el mundo con resultados favorables para esta afección con otros fibrinolíticos; y 2) obtener más datos de seguridad en el tratamiento experimental con un número mayor de pacientes expuestos. Este desbalance se consideró en el cálculo del tamaño muestral, así como en la metodología estadística.
Análisis estadístico
La información primaria se entró por duplicado en bases de datos creadas con el software OpenClinica (https://www.openclinica.com). Se utilizó el software R versión 3.6.2 para los análisis estadísticos. Se calcularon medidas de tendencia central y dispersión de las variables cuantitativas. Se realizaron pruebas t de Student para la diferencia entre las medias de los grupos de estudio. Se calcularon las distribuciones de frecuencias absolutas y relativas de las variables cualitativas. Se utilizó prueba exacta de Fisher o Chi-cuadrado, en dependencia de las distribuciones de frecuencia. Se estimaron las distribuciones de frecuencia para cada evento adverso registrado. El nivel de significancia elegido fue = 0,05. Todos los análisis se realizaron por “intención de tratar”.
Con el objetivo de computar un índice beneficio/riesgo, se calculó la razón entre las probabilidades medias de beneficio y de riesgo, que se correspondieron con el factor de Bayes (FB). Se calcularon, como índices de impacto, la reducción de riesgo absoluto (RRA) de necesidad de CVT, la reducción de riesgo relativo (RRR) y el número necesario a tratar (NNT) para evitar una CVT. Estos cálculos se hicieron con el software CATmaker versión 1.1 del Centro de Medicina Basada en la Evidencia (https://www.cebm.net).
Resultados
Se incluyeron 48 pacientes, de 85 evaluados por neumonía con DPPCC y empiema. Los 37 no incluidos presentaban causas previstas en el protocolo (< 1 año, SDMO, riesgo de sangrado, FBP, derrame pleural en fase organizada, DPPC simple, adolescente en lactancia materna y cetoacidosis diabética). Ningún paciente abandonó el ensayo, todos cumplieron el tratamiento de base previsto. De los pacientes tratados con Heberkinasa®, 31 (96,8 %) completaron el esquema terapéutico previsto (fig.).
Los grupos estudiados resultaron homogéneos con predominio del sexo masculino y color de la piel blanca en 62,5 %. Los menores de cuatro años constituyeron el grupo más afectado. La mayoría (60,4 %) presentó una relación peso/edad correspondiente a sujetos eutróficos, seguido del sobrepeso con 31,2 % y dos niños con más del 97 percentil para su edad (4,2 %). Dos pacientes se encontraban entre el tres y el 10 percentil (tabla 1).
Tabla 1 Distribución de pacientes según características demográficas
| Variables | Grupo experimental | Grupo control | Total | |
|---|---|---|---|---|
| N = 32 | N = 16 | N = 48 | ||
| Sexo N (%) | Masculino | 20 (62,5) | 10 (62,5) | 30 (62,5) |
| Femenino | 12 (37,5 | 6 (37,5) | 18 (37,5) | |
| Color de la piel N (%) | Blanca | 18 (56,3) | 12 (75,0) | 30 (62,5) |
| Negra | 9 (28,1) | 2 (12,5) | 11 (22,9) | |
| Mestiza | 5 (15,6) | 2 (12,5) | 7 (14,6) | |
| Edad (años) | Media ± DE | 3,4 ± 2,4 | 2,6 ± 1,7 | 3,0 ± 2,2 |
| Mediana (RI) | 2,0 (3,5) | 2,0 (2,3) | 2,0 (3,6) | |
| (Mín; Máx) | (1; 9) | (1; 7) | (1; 9) | |
| Peso (kg) | Media ± DE | 17,0 ± 7,8 | 16,7 ± 9,2 | 16,9 ± 8,2 |
| Mediana (RI) | 14,0 (8,0) | 13,5 (8,8) | 14,0 (8,8) | |
| (Mín; Máx) | (9,5; 37) | (10; 43) | (9,5; 43) | |
| Talla (cm) | Media ± DE | 100,0 ± 21,8 | 94,5 ± 17,6 | 98,2 ± 20,5 |
| Mediana (RI) | 91,0 (38,8) | 86,0 (25,0) | 86,5 (34,8) | |
| (Mín; Máx) | (72; 137) | (79; 143) | (72; 143) | |
| Relación peso/ edad (percentil) N (%) | 3 < 10 | 2 (6,2) | 0 | 2 (4,2) |
| 10 < 25 | 2 (6,2) | 0 | 2 (4,2) | |
| 25 < 50 | 5 (15,6) | 4 (25) | 9 (18,7) | |
| 50 < 75 | 7 (21,9) | 3 (18,8) | 10 (20,8) | |
| 75-90 | 4 (12,5) | 4 (25,0) | 8 (16,7) | |
| > 90-97 | 11 (34,5 | 4 (25,0) | 15 (31,2) | |
| > 97 | 1 (3,1 | 1 (6,2) | 2 (4,2) | |
Leyenda: DE: desviación estándar; RI: rango intercuartílico; Mín: mínimo; Máx: máximo.
La mayoría de los pacientes del grupo experimental requirió tres dosis de Heberkinasa®; la media fue de 3,1 ± 0,6 dosis. Cuatro niños requirieron cuatro dosis (12,5 %) y uno (3,1 %) cinco dosis; solo un paciente utilizó una dosis, por la aparición de una FBP. Ningún paciente del grupo experimental requirió tratamiento quirúrgico, mientras que en seis niños (37,5 %) del grupo control, resultó necesario realizar CVT para evacuar el derrame pleural, con una diferencia altamente significativa favorable al grupo experimental (tabla 2).
En 27 de 48 pacientes (56,3 %) aparecieron complicaciones durante el estudio, con mayor frecuencia en el grupo control (12/16; 75 %) en comparación con el grupo tratado con Heberkinasa® (15/32; 46,9 %). Estas constituyeron eventos adversos sin relación de causalidad con la administración de Heberkinasa® y se incluyeron en los análisis de seguridad. Al considerar la aleatorización 2:1, era de esperar un mayor número de complicaciones en el grupo experimental; sin embargo, el número de reportes resultó similar entre ambos grupos, lo que traduce que el número de complicaciones se duplicó en el grupo control (terapia estándar) respecto al tratado con Heberkinasa® (tabla 2).
Se encontró predominio de complicaciones intratorácicas (62,8 %), todas con mayor incidencia en el grupo control; las más frecuentes: el neumatocele, el neumotórax, el enfisema subcutáneo y la FBP. Entre las complicaciones extratorácicas, la infección asociada a la asistencia sanitaria (IAAS) resultó la más frecuente (27,1 %), con mayor reporte en el grupo que recibió la terapia estándar (31,3 %) contra 25,0 % en el grupo experimental. No ocurrieron fallecimientos en los pacientes incluidos en el estudio; sin embargo, entre los no incluidos, dos niños fallecieron por SDMO (2,3 % del total evaluado).
La estadía en la UTIP resultó similar en ambos grupos, con una media de 8,0 días. La reducción de cuatro días de la estadía hospitalaria global observada en el grupo experimental respecto al control (19,2 ± 6,4 vs. 23,3 ± 9,3 días) aunque no significativa, si tuvo relevancia clínica y cumplió con la hipótesis del estudio. La media de duración del drenaje pleural global fue de 7,4 días, con resultado similar entre los grupos de estudio. Una vez finalizada la terapia fibrinolítica con Heberkinasa®, la media de duración del drenaje pleural fue de 3,3 días, mientras que en aquellos pacientes del grupo control sujetos a CVT el drenaje pleural se retiró a los 5,5 días (tabla 2).
Tabla 2 Variables primarias y secundarias según grupo de tratamiento
| Variables | Grupo experimental | Grupo control | Total | |
|---|---|---|---|---|
| N = 32 | N = 16 | N = 48 | ||
| Dosis requeridas de Heberkinasa (SKr 200 000 UI) | ||||
| Media± DE | 3,1 ± 0,6 | - | - | - |
| Mediana (RI) | 3,0 (0,0) | - | - | |
| (Mín; Máx) | (1; 5) | - | - | - |
| Necesidad de cirugía videotoracoscópica | ||||
| 0/32 | 6/16 (37,5 %) | 6/48 (12,5 %) | 0,0028* | |
| Pacientes con complicaciones | ||||
| 15/32 (46,9) | 12/16 (75,0) | 27/48 (56,3) | 0,48** | |
| Total de complicaciones | ||||
| 26 (51,0 %) | 25 (49,0 %) | 51 (100 %) | - | |
| Estadía en UTIP (días) | ||||
| Media± DE | 8,0 ± 2,3 | 8,0 ± 2,9 | 8,0 ± 2,5 | 0,9701*** |
| Estadía hospitalaria global (días) | ||||
| Media ± DE | 19,2 ± 6,4 | 23,3 ± 9,3 | 20,6 ± 7,6 | 0,1319*** |
| Drenaje pleural posfibrinolisis (días) | ||||
| Media± DE | 3,3 ± 1,8 | - | - | 0,1102*** |
| Drenaje pleural posCVT (días) | ||||
| Media± DE | - | 5,5 ± 2,7 | - | |
Leyenda: DE: desviación estándar; RI: rango intercuartílico; Mín: mínimo; Máx: máximo; *Prueba exacta de Fisher; **prueba Chi-cuadrado; ***prueba t de Student para la diferencia de medias.
Se localizaron 170 reportes de eventos adversos de 55 tipos diferentes en 40 niños (83,3 %). Los más afectados fueron los del grupo control (15/16 pacientes; 93,8 %) con respecto al experimental (25/32 niños; 78,1 %). En el grupo control se duplicó el registro de eventos adversos según el número de pacientes incluidos comparado con el experimental (88/16 vs. 82/32). Del total de eventos adversos, la mayoría tuvieron intensidad leve (78/170; 45,9 %) o moderada (86/170; 50,6 %). Se reportaron seis eventos adversos graves en tres pacientes: 1/82 (1,2 %) en un paciente del grupo experimental, que consistió en una IAAS, sin relación de causalidad con la Heberkinasa® y 5/88 (5,7 %) en dos pacientes del grupo control. La mayoría de los eventos adversos informados en el grupo experimental (81/82; 98,8 %) no se relacionaron con la administración de Heberkinasa®; solo un dolor torácico en un niño, con la segunda dosis de Heberkinasa® en la cavidad pleural, se consideró con dudosa relación de causalidad. Este no reapareció con la tercera dosis del medicamento en ese mismo paciente. Los eventos adversos se resolvieron antes del alta hospitalaria, con la excepción de un niño (2,1 %) del grupo control el cual egresó con un neumotórax residual pequeño y una fibrosis pulmonar; ambos se solucionaron en los dos meses posteriores al alta hospitalaria.
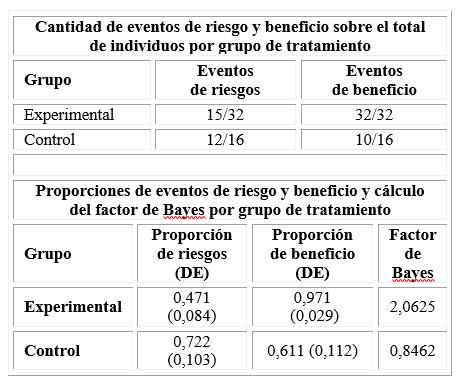
Como medida de balance beneficio/riesgo se estimaron los FB en cada grupo de tratamiento, se consideró:
Beneficio: cantidad de pacientes que no requirió CVT.
Riesgo: cantidad de pacientes con complicaciones posinclusión.
El FB fue mayor que uno en el grupo experimental lo cual indica evidencias a favor del beneficio; a diferencia del grupo control, donde el FB fue menor que uno, lo que traduce que, con el tratamiento estándar se incrementaron las complicaciones asociadas, así como la necesidad de tratamiento quirúrgico (tabla 3).
La estimación del impacto del tratamiento en términos de la Medicina Basada en la Evidencia mostró resultados muy favorables. La RRR para la CVT fueron del 100 %, con un intervalo de confianza (IC) del 95 %, que no se estimó pues ningún paciente tratado con Heberkinasa® requirió tratamiento quirúrgico, lo que indicó que eliminaba de modo significativo el riesgo de la necesidad de este procedimiento invasivo. El valor de NNT para evitar una CVT resultó tan bajo como 3 con un IC del 95 %: 2-7, medida de elevado impacto (tabla 4).
Tabla 4 Estimación de impacto del uso de Heberkinasa®
| Criterios de evaluación | HeberkinasaSKr: 200 000 UI | RRA | RRR | NNT | ||
|---|---|---|---|---|---|---|
| Sí | No. (%) | (IC 95 %) | (IC 95 %) | (IC 95 %) | ||
| Necesidad de CVT | Sí | 0 | 6 (37,5) | 38,0 % | 100 % | 3 |
| No | 32 (100 %) | 10 (62,5) | (14,0-61,0 %) | (*) | 2-7 | |
Leyenda: CVT: cirugía video-toracoscópica; SKr: dosis requerida de Heberquinasa; RRA: reducción del riesgo absoluto; RRR: reducción del riesgo relativo; NNT: número necesario a tratar; *IC 95 % no estimable.
Discusión
Se cumplió el cronograma de inclusión de pacientes previsto en el ensayo en aproximadamente tres años. En publicaciones nacionales que abordan las neumonías complicadas, predominó el sexo masculino,5,16) con lo que coincide el presente estudio. Con respecto a la edad, la OMS21 y la UNICEF22 informaron que los menores de cinco años resultan los más afectados, al igual que en este ensayo. La desnutrición es un factor de riesgo para la adquisición de neumonía grave y de mortalidad por esta causa.21 La mayoría de los incluidos en el presente trabajo correspondió a niños eutróficos, similar a otros estudios en Cuba.16,23
La Asociación Americana de Cirugía del Tórax24 considera la CVT como primera línea de tratamiento en los pacientes con empiema agudo y al igual que la Sociedad Británica del Tórax25 desaconsejaron la administración de fibrinolíticos intrapleurales en adultos, apoyados en los resultados del ensayo MIST1,26 en el que el uso de SK no resultó superior al placebo, en cuanto a necesidad de tratamiento quirúrgico. El ensayo MIST227 demostró que el t-PA con Dornasa intrapleural, redujo la cirugía.
Varios estudios pediátricos28,29,30,31 demostraron disminución de la necesidad de cirugía en los pacientes tratados con fibrinolisis intrapleural, con diferentes agentes y esquemas terapéuticos; al igual que en una revisión Cochrane32 y un ensayo controlado y aleatorizado33) en adultos, publicados en años recientes. En el presente estudio los pacientes que utilizaron Heberkinasa® intrapleural resolvieron el DPPCC y el empiema sin necesidad de tratamiento quirúrgico.
El requerimiento de anestesia general de la CVT, añade un riesgo no despreciable, al tratarse de niños con riesgo anestésico incrementado (ASA II o III).Sin olvidar las complicaciones que pueden derivarse de la ventilación mecánica durante la anestesia, como barotrauma, volutrauma, atelectrauma y biotrauma,34,35 o inconvenientes como la hipoventilación o la hiperventilación36en pacientes con lesión inflamatoria del parénquima pulmonar secundaria a la neumonía, en ocasiones necrotizante y en muchos casos agravada por complicaciones sistémicas asociadas, como la sepsis.
Estudios de empiema pleural en niños detectaron que el mayor número de complicaciones estuvo representado por FBP, neumotórax, y enfisema subcutáneo.37,38 Un estudio en Sudáfrica, que evaluó a 52 niños con empiema tratados con t-PA documetaron un caso de sangrado intrapleural.39) Múltiples trabajos no informaron complicaciones mayores (muerte, anafilaxia, hemorragia intrapleural o a distancia) relacionadas con los fibrinolíticos intrapleurales en niños,38,40,41),similar a la presente investigación.
Las IAAS constituyen un importante problema de salud a nivel mundial, los factores de riesgo más importantes los constituyen: la menor edad, la gravedad de la enfermedad y los procedimientos invasivos.42 Estudios de infección nosocomial en varias UTIP en Cuba encontraron que los más afectados resultaron los niños menores de un año, seguido de los de uno a cuatro años.43,44Salcedo y otros43 documentaron que el diagnóstico principal al ingreso fue la infección respiratoria y la sepsis.
La neumonía constituye una de las principales causas de morbilidad y mortalidad en la población pediátrica globalmente.45,46 Se registra un 15 % de muertes de niños menores de cinco años por neumonía en el mundo,21 principalmente en países poco desarrollados.47) Estudios en Cuba muestran que la mortalidad por neumonía es comparable con la de países desarrollados,5,48 al igual que en este trabajo.
En el grupo experimental se redujo la estadía hospitalaria en cuatro días respecto al grupo control. Los agentes fibrinolíticos lisan los tractos fibrosos, restablecen la capacidad de filtración y la reabsorción del líquido a nivel pleural,25,49 lo que favorece la mejoría clínica y el aclaramiento radiológico,50,51 ventajas del desbridamiento enzimático, que van más allá del drenaje a través del tubo pleural, y se relaciona con el resultado favorable de esta variable en los niños que utilizaron Heberkinasa®intrapleural.
Las complicaciones por fuga aérea como la FBP y el neumotórax, prolongan la necesidad de drenaje pleural, aún lograda la resolución del derrame, lo que puede influir en el mayor tiempo de necesidad de sonda pleural posCVT.
No se produjeron eventos hemorrágicos en relación con la terapia fibrinolítica, lo que demostró que el uso intrapleural de la Heberkinasa® no afectó la función de la coagulación sanguínea en los pacientes estudiados. La menor frecuencia de pacientes afectados por los eventos adversos y de menos del 50 % de estos en el grupo experimental, así como la ausencia de relación de causalidad con el producto de estudio, indican que la fibrinolisis intrapleural con Heberkinasa® resultó segura y bien tolerada.
A pesar de estar disponible este fibrinolítico en Cubas hace cerca de tres décadas, no se había logrado documentar, hasta ahora, su empleo para fibrinolisis intrapleural en edades pediátricas, a través de ensayos clínicos controlados y demostrar su eficacia y seguridad con rigor y credibilidad científica.
Como todo ensayo clínico presenta limitaciones, dadas por los criterios restrictivos para la selección de los pacientes como los lactantes y pacientes con enfermedades crónicas descompensadas, por cuestiones de seguridad en una población vulnerable puesto que se trata de la primera exposición documentada de la Heberkinasa® en una urgencia médica pediátrica
Se concluye que la administración intrapleural de Heberkinasa® en el DPPCC y el empiema en niños aplicada según el algoritmo terapéutico propuesto, resultó eficaz para la evacuación del foco séptico, con reducción de la estadía hospitalaria, las complicaciones intratorácicas, así como las infecciones asociadas a la asistencia sanitaria, con reducción significativa de la necesidad de tratamiento quirúrgico; y segura, sin eventos adversos relacionados con su administración, lo que garantiza su futuro uso en la práctica médica habitual.
Se recomienda evaluar la eficacia de la Heberkinasa® en el tratamiento pediátrico del DPPCC y el empiema, con el algoritmo terapéutico propuesto, en ensayos multicéntricos que involucren un mayor número de pacientes, incluidos los lactantes, como parte del proceso de generalización de los resultados.