Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Militar
versión On-line ISSN 1561-3046
Rev Cub Med Mil vol.44 no.1 Ciudad de la Habana ene.-mar. 2015
Rev Cubana Med Mil. 2015;44(1)
ARTÍCULO ORIGINAL
Identificación fenotípica de cepas de Acinetobacter circulantes
Phenotypic identification of Acinetobacter circulating strains
DrC. Rafael Nodarse Hernández, Lic. María Elena Fuerte Calvo
Hospital Militar Central “Dr. Luis Díaz Soto”. La Habana, Cuba.
RESUMEN
Introducción: en la actualidad, a nivel mundial, las infecciones hospitalarias más graves incluyen a cepas de Acinetobacter resistentes a múltiples antibióticos.
Objetivo: identificar desde el punto de vista fenotípico cepas de Acinetobacter spp y caracterizar su resistencia a los antibióticos.
Métodos: estudio observacional analítico en una muestra de 60 cepas de Acinetobacter spp, de origen hospitalario, aisladas en el Hospital Militar Central “Dr. Luis Díaz Soto” en el primer trimestre de 2014, las cuales se clasificaron en un primer momento según esquema de Bouvet y Grimont (modificado por Gemer-Smidt y otros). Posteriormente se les realizó prueba de sensibilidad a antimicrobianos con discos: piperacilina, piperacilina/tazobactam, cefoperazona, ceftriaxona, ceftazidima, cefepime, imipenem, meropenem, aztreonam, gentamicina, amikacina y ciprofloxacina; e-test: colimicina y por último, producción de biopelícula in vitro por técnica de slime-test.
Resultados: la aplicación del esquema solo permitió identificar fenotípicamente a las cepas pertenecientes a la especie Acinetobacter baumannii (88,3 %); en los casos restantes la identificación no fue conclusiva. El 51,6 % de las cepas de Acinetobacter baumannii fue aislado en la Unidad de Cuidados Intensivos de adultos y el 46,6 % a partir de secreciones bronquiales. La resistencia de las cepas de Acinetobacter baumannii fue mayor de 80 %, lo que contrastó con la baja resistencia de las cepas “no baumannii”. Con la aplicación del E-test para colimicina en cepas de Acinetobacter baumannii se constató que el 90 % de ellas fue inhibida a concentraciones inhibitorias mínimas ≤ 0,5 µg/mL. La totalidad de las cepas de Acinetobacter baumannii fueron productoras de biofilm.
Conclusiones: la cepa de Acinetobacter baumannii constituye uno de los microorganismos más aislados en el hospital en pacientes graves, con una resistencia bacteriana importante, excepto para colimicina.
Palabras clave: Acinetobacter, Acinetobacter baumannii, resistencia bacteriana.
ABSTRACT
Introduction: currently, worldwide, the most serious hospital infections include Acinetobacter strains resistant to multiple antibiotics.
Objective: phenotypically identify Acinetobacter spp and characterize their resistance to antibiotics.
Methods: an observational study was conducted in a sample of 60 Acinetobacter spp strains of hospital waste origin, which were isolated in Dr. Luis Díaz Soto central military hospital in 2014 first quarter. These strains were initially classified according to Bouvet and Grimont scheme (modified by Gemer-Smidt and others). Subsequently these strains underwent antimicrobial susceptibility testing with disks: piperacillin, piperacillin/tazobactam, cefoperazone, ceftriaxone, ceftazidime, cefepime, imipenem, meropenem, aztreonam, gentamicin, amikacin and ciprofloxacin; E-test: colimycin and finally, in vitro biofilm production by slime-test technique.
Results: the implementation of this scheme only allowed to phenotypically identify Acinetobacter baumannii strains (88.3 %); in other cases the identification was not conclusive. 51.6 % of Acinetobacter baumannii strains was isolated in the adult intensive care unit and 46.6 % from bronchial secretions. Acinetobacter baumannii resistance was 80 % higher, which contrasted with the no-baumannii strains low resistance. The e-test implementation for colimycin in Acinetobacter baumannii strains found 90 % inhibited at minimum inhibitory concentrations ≤ 0.5 µg/mL. All Acinetobacter baumannii strains were biofilm producing.
Conclusions: Acinetobacter baumannii strain is one of the most isolated microorganisms in critical patients in hospital, with significant bacterial resistance, except for colimycin.
Keywords: Acinetobacter, Acinetobacter baumannii, bacterial resistance.
INTRODUCCIÓN
En la actualidad las infecciones hospitalarias más graves incluyen a cepas de Acinetobacter resistentes a múltiples antibióticos.
Dentro de esta especie se considera al Acinetobacter baumannii como uno de los más problemáticos patógenos en instituciones de salud a nivel mundial.1
Este germen ataca fundamentalmente a los pacientes ingresados más vulnerables, o sea, pacientes graves, que presentan brechas en la integridad de su piel o reciben ventilación asistida. Tal y como se informa desde la década del 70 del siglo XX, la neumonía hospitalaria es todavía la infección más común producida por esta bacteria.2
La taxonomía del género Acinetobacter es larga, compleja y cambiante. En 1911, Beijerinck, microbiólogo holandés, propone el nombre de Micrococcus calcoaceticus. En 1954, Brisou y Prévost designan a la especie como Acinetobacter, del griego akineto, que significa inmóvil. En la edición de 1974 del Manual Bergey aparece el término Acinetobacter calcoaceticus. Posteriormente esta especie fue subdividida en dos subespecies o biovares: anitratus e iwoffii. En 1986, Bouvet y Grimont plantean 12 genoespecies: A. baumannii, A. iwoffii, A. calcoaceticus, A. johnsonii, A. junii, A. haemolyticus, entre otras.
Las especies de A. calcoaceticus, A. baumannii, Acinetobacter genoespecie 3 y A. genoespecie 13TU están muy relacionadas y es difícil diferenciarlas por sus propiedades fenotípicas, por lo que se creó el llamado “complejo A. calcoaceticus-A. baumannii”.3
Al ser el A. calcoaceticus un germen ambiental y que nunca ha sido implicado en enfermedades, la designación “complejo A. calcoaceticus-A. baumannii” resulta engañosa y no es apropiada en el contexto clínico. Es por esto que en 2011, Nemec propone el nombre de Grupo baumannii, que incluye: A. baumannii, A. pittii (antes genoespecie 3) y A. nosocomialis (antes genoespecie 13 TU).4
En la actualidad se considera de importancia la diferenciación dentro del llamado “complejo A. baumannii-calcoaceticus” debido a que A. baumannii y A. pittii producen infecciones graves; A. nosocomialis es un habitante del medio hospitalario, pero de baja patogenicidad y A. calcoaceticus predomina en el suelo y no es patógeno sino excepcionalmente.
Para lograr la diferenciación se creó un esquema de identificación de especies de Acinetobacter, diseñado por Bouvet y Grimont,5 el cual fue modificado por Gemer-Smidt y otros,6 basado en el uso de diferentes temperaturas de incubación y reacciones bioquímicas, que tiene la ventaja de poder ser aplicado sin grandes recursos materiales.
La importancia clínica de Acinetobacter baumannii se ha incrementado, sobre todo en los últimos 15 años, por su significativa habilidad para adquirir resistencia a los antibióticos.
Dentro de los mecanismos de resistencia a antimicrobianos que posee Acinetobacter baumannii,7 destacan los dirigidos contra los betalactámicos, que incluyen la producción de enzimas betalactamasas, ya sea de espectro extendido o carbapenemasas; alteraciones en las proteínas de la membrana externa, las bombas de expulsión y las alteraciones en la afinidad o expresión de las proteínas fijadoras de penicilina. De igual forma los aminoglucósidos, las quinolonas y las tetraciclinas (incluida tigeciclina) se ven afectadas en su acción debido a diferentes mecanismos de resistencia creados por esta bacteria.8 Otro mecanismo es la producción de biopelícula o biofilm, como posible explicación a la resistencia a la desecación y los desinfectantes.9
Este trabajo tiene como objetivo realizar la identificación fenotípica de cepas de Acinetobacter spp y caracterizar su resistencia a los antibióticos.
MÉTODOS
Se realizó un estudio observacional analítico, en una muestra de 60 cepas identificadas presuntivamente como Acinetobacter spp (Kligler: no fermentador, oxidasa: negativa, motilidad: negativa, OF: oxidante), de origen hospitalario y aisladas en el Hospital Militar Central “Dr. Luis Díaz Soto” durante el primer trimestre de 2014. A todas se les realizó:
1. Clasificación según esquema de Bouvet y Grimont (modificado por Gemer-Smidt y otros).6
2. Pruebas de sensibilidad: difusión con discos frente a 12 antimicrobianos; de ellos nueve betalactámicos que incluyeron dos penicilinas (piperacilina y piperacilina/tazobactam), tres cefalosporinas de tercera generación (cefoperazona, ceftriaxona y ceftazidima), una cefalosporina de cuarta generación (cefepime), dos carbapenemos (imipenem y meropenem) y un monobactámico (aztreonam). Se incluyeron también dos aminoglucósidos (gentamicina y amikacina) y una fluoroquinolona (ciprofloxacina). Se utilizó un lipopéptido, colimicina, el cual fue probado por el método de e-test. En todos los casos se siguieron los criterios del Instituto de Estándares Clínicos y de Laboratorios (CLSI, en inglés), para pruebas de sensibilidad in vitro.10
3. Producción de biopelícula in vitro: por técnica de slime-test.9
RESULTADOS
La identificación fenotípica de las cepas de Acinetobacter spp mostró que la inmensa mayoría de ellas (88,3 %) pertenecían a la especie A. baumannii.
Más de la mitad de las cepas (51,6 %) fueron aisladas en pacientes ingresados en la Unidad de Cuidados Intensivos de adultos y el 25 % correspondió a las salas de Quemados y a la Unidad de Cuidados Intermedios Quirúrgicos. En la Unidad de Cuidados Intermedios de Medicina y la sala de Ortopedia, el porcentaje en ambas fue de 8,3 %, seguido por las salas de Medicina (3,3 %) y la de Ginecología y Cirugía (1,6 % cada una) (tabla 1).
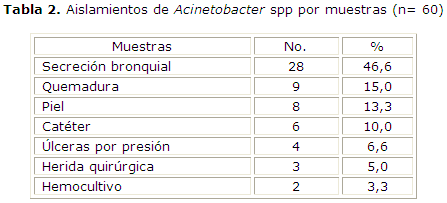
En los aislamientos por muestras sobresalió la secreción bronquial (46,6 %), seguida por la quemadura (15 %), lesiones en piel (13 %), catéter (10 %) y úlceras por presión, heridas quirúrgicas y hemocultivos (14,3 % de conjunto) (tabla 2).
Con relación a la resistencia a los antimicrobianos utilizados en el estudio según las especies identificadas se obtuvieron altos valores por A. baumannii (más de 80 %) en comparación con las cepas “no baumannii” (tabla 3). Sin embargo, se pudo constatar mediante el método e-test, que el 90 % de las cepas de A. baumannii fue inhibido a concentraciones inhibitorias mínimas menores o iguales a 0,5 µg/mL (punto de corte para “sensibilidad”, ≤ 2 µg/mL), por lo que el porcentaje de resistencia fue de 10 %.
Otro resultado del estudio, que no está comprendido en las tablas, es el análisis de las resistencias según la lectura interpretada del antibiograma. En relación con la posibilidad de detección de enzimas betalactamasas de espectro extendido en las cepas estudiadas (utiliza discos de cefalosporinas de tercera generación, C3G, enfrentados a disco con inhibidor), se observa que estas no fueron detectadas. No hubo posibilidad de detección de enzimas carbapenemasas. En cuanto a la aparición de resistencias inducidas (con discos de C3G y aztreonam enfrentados a discos con imipenem y meropenem con halos cortados) se encontraron en cuatro aislamientos, mayormente de cepas “no baumannii”.
Por otra parte, en cuanto a la producción de biopelícula por parte de las cepas se constató que el 100 % de A. baumannii fue positivo a esta reacción, a diferencia de las “no baumannii” cuyo valor fue de 42,8 %.
DISCUSIÓN
La identificación fenotípica de los aislamientos de Acinetobacter spp mostró que dentro de este género sigue siendo A. baumannii la especie más aislada en el ambiente hospitalario, tal y como se plantea en otros estudios.7,11,12
A pesar de que otros autores reportan la utilidad del esquema de Bouvet y Grimont (modificado por Gemer-Smidt) para la identificación fenotípica de cepas patógenas del género Acinetobacter,5,6,11 en este estudio solo fue pertinente la identificación de A. baumannii, ya que para otras especies esta prueba no fue conclusiva debido a que los resultados no se adaptaban adecuadamente a lo planteado en dicho esquema. De igual forma, el origen de las cepas según la sala de procedencia, así como el tipo de muestra, están acordes con los informes actuales, se debe tener en cuenta que este microorganismo afecta preferentemente a los pacientes graves, que son sometidos a ventilación mecánica (como es el caso de los pacientes ingresados en unidades de cuidados intensivos) o que presentan brechas en la integridad de su piel (quemados, heridas).1,2
Los resultados del estudio de la sensibilidad in vitro de las cepas concuerdan con el planteamiento de que A. baumannii es uno de los microorganismos que más resistencia crean frente a los antibióticos más comúnmente utilizados en la práctica médica, ya que la mayoría de los valores de resistencia son extremadamente altos, a excepción de los que corresponden a colimicina, muy similares a los informados por autores nacionales y extranjeros.7,11,13-15
En el caso de colimicina (o colistina) hay que aclarar que el método de e-test es el establecido, en lugar del uso del disco, ya que es necesario comprobar el valor de las concentraciones inhibitorias mínimas como única forma de establecer la sensibilidad del germen a este fármaco. Los valores de este estudio indican la extrema sensibilidad de la mayoría de las cepas probadas a este antibiótico, aunque el porcentaje de resistencia de 10 % difiere de lo notificado por otros autores (0-5 %),7,11,15 sin embargo, está muy cercano a lo planteado por Vakili (11,6 %).14
En conclusión, el Acinetobacter baumannii constituye uno de los microorganismos más aislados en el hospital, fundamentalmente en pacientes graves, y muestra una resistencia bacteriana importante, excepto para colimicina; este hecho se debe tomar en cuenta en la atención y manejo de esos pacientes, sobre todo en los casos de neumonía asociada a la ventilación.
REFERENCIAS BIBLIOGRÁFICAS
1. Hernández A, García E. Acinetobacter baumanii multirresistente: situación clínica actual y nuevas perspectivas. Rev Esp Quimioter. 2010;23(1):12-9.
2. Munoz-Price S, Weinstein R. Infección por Acinetobacter. N Engl J Med. 2008;358:1271-81.
3. Djkshroorn L, Nemec A. The diversity of the genes Acinetobacter. En: Gerischer A (ed). Acinetobacter molecular microbiology. Nueva York: Academic Press; 2008. p. 1-34.
4. Nemec A. Genotypic and phenotypic characterization of the Acinetobacter calcoaceticus-Acinetobacter baumannii complex. Res Microbiol. 2010;162:393-404.
5. Bouvert PJ, Grimont PA. Taxonomy of the genes Acinetobacter. Int J Syst Bact. 1986;361:228-40.
6. Gener-Smidt P. Reliability of phenotype tests for identification of Acinetobacter species. J Clin Microbiol. 1991;29(2):277-82.
7. Daoud Z. Acinetobacter baumannii epidemiology and resistance in North Lebanon. The APUA Newslatter. 2013;31(2):20.
8. Peleg A, Seifert H, Paterson DL. Acinetobacter baumannii: Emergence of a Successful Pathogen. Clin Microbiol Rev. 2008;21(3):538-82.
9. Longo F, Vuotto C, Donelli G. Biofilm formation in Acinetobacter baumannii. New Microbiol. 2014 Apr;37(2):119-27.
10. CLSI. Performance Standards for Antimicrobial Disk Susceptibility Tests. Approved Standard. 2012;32(1):15.
11. Wisplinghoff H. Nosocomial bloodstream infections due to Acinetobacter baumannii, Acinetobacter pittii and Acinetobacter nosocomialis in the United States. J Infect. 2012 Mar;64(3):282-90.
12. Prado A, Arias NL, Chávez M, Cabrera CE, Gómez RF. Phenotypic characterization of Acinetobacter baumannii isolates in a high-complexity healthcare institution in the city of Cali. Biomedica. 2014 Apr;34(Suppl 1):101-7.
13. Larrondo H, Figueiras A, Hidalgo T, Espinosa F. Caracterización de pacientes con bacteriemia por Acinetobacter spp. ingresados en una Terapia Intensiva. Intramed. 2013;2(2):20-2.
14.Vakili B, Fazeli H, Shoaei P, Yaran M, Ataei B, Khorvash F, et al. Detection of colistin sensitivity in clinical isolates of Acinetobacter baumannii in Iran. J Res Med Sci. 2014 Mar;19(Suppl 1):S67-70.
15.Spiliopoulou A, Jelastopulu E, Vamvakopoulou S, Bartzavali C, Kolonitsiou F, Anastassiou ED, et al. In vitro activity of tigecycline and colistin against A. baumannii clinical bloodstream isolates during an 8-year period. J Chemother. 2014;5(14):23-4.
Recibido: 12 de agosto de 2014.
Aprobado: 9 de septiembre de 2014.
Rafael Nodarse Hernández. Hospital Militar Central “Dr. Luis Díaz Soto”. Ave. Monumental y Carretera del Asilo, CP 11700, La Habana, Cuba.