Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Militar
versión On-line ISSN 1561-3046
Rev Cub Med Mil vol.45 no.4 Ciudad de la Habana set.-dic. 2016
ARTÍCULO ORIGINAL
Presencia del gen cagA y de la citotoxina vacA del Helicobacter pylori en pacientes dispépticos
Presence of Caga Gene and Vaca Cytotoxin of Helicobacter Pylori in Dyspeptic Patients
Ludmila Martínez Leyva,I Yanelys Márquez Aleaga, I Boris Luis Rodríguez González,II Orlando Reyes Zamora,III Salvador Roberto Mora GonzálezI
I Hospital Militar Central "Carlos J. Finlay". La Habana, Cuba.
II Facultad de Biología, Universidad de La Habana., Cuba.
III Centro Nacional de Investigaciones Científicas (CNIC). La Habana, Cuba.
RESUMEN
Introducción: existen evidencias de la participación de ciertos genotipos del Helicobacter pylori con patologías más severas.
Objetivo: determinar la frecuencia del gen cagA y las variantes alélicas de la citotoxina vacA del Helicobacter pylori en un grupo de pacientes dispépticos, así como el daño causado en la mucosa gástrica por esta bacteria.
Métodos: se realizó un estudio descriptivo en el Hospital "Dr. Carlos J. Finlay", desde el 2011-2012. La muestra estuvo conformada por 71 pacientes con cultivo positivo para Helicobacter, a los que se les realizó endoscopía con toma de biopsias. Se realizó determinación del gen cagA y de los alelos de la citotoxina vacA y se determinó mediante estudio histológico el daño causado en la mucosa gástrica por la bacteria. Se utilizó el método estadístico Chi cuadrado con una significación estadística de alfa < 0,05 para determinar la significación de los genotipos.
Resultados: el 69 % de los pacientes fue cagA+ y el 56,3 % vacA s1m1. En los individuos cagA+ predominaron los alelos s1m1 (52,1 %) y en los cagA- las variantes s2m2 (22,5 %). La gastritis crónica moderada fue el diagnóstico histológico más frecuente relacionado con el genotipo cagAvacAs1m1.
Conclusiones: los pacientes dispépticos estudiados presentaron con mayor frecuencia una cepa muy virulenta (cagA+/vacAs1m1), aunque el daño histológico sobre la mucosa gástrica fue menor del esperado.
Palabras clave: Helicobacter pylori; pacientes dispépticos; genotipos.
ABSTRACT
Introduction: There is evidence of the involvement of certain genotypes del Helicobacter pylori in more several pathologies.
Objective: Determine the frequency of gen cagA and the citotoxinavacA of Helicobacter pylori in dyspeptic patients and the damage of gastric mucosa.
Methods: A descriptive study was conducted at the Hospital Dr. Carlos J. Finlay, from 2011-2012 in 71 patients with positive culture for Helicobacter . The study included determination of the gen cagA and the citotoxinavacA. The analysis of results was performed using the Chi square statistic method with statistical significance alpha <0.05.
Results: 69 % of patients wascagA+ and 56.3 % vacAs1m1. In individuals cagA+ predominateds1m1 (52.1 %) and in the cagA- predominate s2m2 (22.5 %). The moderate chronic gastritis was the most frequent histological diagnosis related to the cagAvacAs1m1 genotype.
Conclusions: A highly virulent strain (cagA + / vacAs1m1) predominate in dyspeptic patients of this study.
Keywords: Helicobacter pylori; dyspeptic patients; genotypes.
INTRODUCCIÓN
El Helicobacter pylori (H. pylori) es un bacilo Gram negativo espiralado y microaerofílico1 capaz de colonizar la mucosa gástrica humana y causar gastritis crónica, úlceras gástricas, duodenales, cáncer gástrico y linfoma del tejido linfoide asociado a mucosa (MALT).2
La prevalencia de la infección varía con respecto al área geográfica. En los países industrializados es de 20-50 % y en los países subdesarrollados alcanza un 80 %.2
La infección por H. pylori origina casi siempre gastritis crónica. Sin embargo, las complicaciones principales (úlcera péptica, adenocarcinoma y linfoma gástrico) se desarrollan solo en una minoría de personas infectadas (por lo general en hospedadores adultos). Esto se debe a que el desarrollo de la enfermedad está influenciado por varios elementos: la susceptibilidad genética del huésped, el ambiente y los factores de virulencia de la cepa infectante.
Los factores de virulencia son características presentes en los microorganismos que los hacen capaces de causar enfermedad. En el H. pylori los factores de virulencia más importantes son: la ureasa, el flagelo, el gen cagA, la citotoxinavacA y la proteína babA. 3 Aunque se han asociado con un mayor riesgo de enfermedad ulcerosa péptica, adenocarcinoma gástrico o linfoma tipo MALT, ninguno de ellos implica por sí mismo el desarrollo de una enfermedad en concreto.
Las cepas cagA positivas (cagA+) inducen la reorganización de la actina en la célula huésped y en las proteínas de las células adyacentes al sitio de adherencia, mientras que las cepas cagA negativas (cagA-) inducen cambios mínimos en la actina en el sitio de adherencia. La citotoxinavacuolizante bacteriana (vacA), es responsable de la formación de vacuolas intracelulares que conducen a la célula a cambios en su metabolismo y eventualmente a la muerte celular.4
El gen vacA posee una estructura en la cual se han identificado cuatro alelos en la secuencia señal responsable del grado de inflamación de la mucosa gástrica (s1a, s1b, s1c y 2s). Existe una asociación significativa entre la presencia de s1 y el grado de infiltración celular. En la región media de vacA se ha demostrado la presencia de dos alelos (m1 y m2), de los cuales m1 se asocia con un mayor daño al tejido gástrico.4
De acuerdo a la presencia del gen cagA, las cepas de H. pylori se han denominado como cagA+ o cagA-. La importancia de cepas cagA+ radica en que son más agresivas porque son capaces de causar inflamación severa, úlceras y tumores.
La proteína vacA es codificada por el gen vacA, el cual se encuentra en todas las cepas del H.pylori. Sin embargo, estas presentan variaciones en su actividad vacuolizante debido a la heterogenicidad dentro del gen vacA.4 Los tipos de combinaciones alélicas entre estas regiones s y m determinan la producción y el tipo de actividad de la citotoxina, ya que por ejemplo cepas con la combinación vacAs1/m1 producen grandes cantidades de toxina por lo que tienen una alta actividad vacuolizante, las cepas vacAs1/m2 producen cantidades moderadas de toxina y su actividad vacuolizante también es moderada, mientras que las cepas vacAs2/m2 producen muy poca toxina o no producen. En cuanto a los subtipos de s1 se ha reportado que las cepas que expresan el subtipo s1a parecen ser más patógenas que las cepas s1b o s2.2 Las cepas con el tipo m1 se encuentran más asociadas con daño epitelial gástrico que las cepas vacAm2 4.
Con el objetivo de determinar la frecuencia del gen cag A y las variantes alélicas de la citotoxina vacA del H. pylori en un grupo de pacientes dispépticos se realizó este trabajo.
MÉTODOS
Se realizó un estudio descriptivo en el Hospital "Dr. Carlos J. Finlay", desde el 2011-2012. El universo fueron todos los pacientes con síntomas dispépticos que acudieron a la consulta externa del servicio de Gastroenterología del Hospital Militar Central Dr. Carlos J. Finlay, en el período de mayo del 2011 a mayo del 2012.
Se realizó un muestreo no probabilístico por designación. La muestra quedó conformada por 71 pacientes, que cumplieron con los criterios de selección (inclusión y exclusión)
Criterios de inclusión: pacientes con edades comprendidas entre 18 y 80 años, con serología positiva para H. pylori , con cultivo positivo y aislamiento de la cepa.
Criterios de exclusión: pacientes tratados con cualquier antibiótico o con inhibidores de bomba de protones en las últimas 4 semanas.
A los pacientes incluidos se les realizó determinación de anticuerpos IgG contra H. pylori realizado por el método de ELISA® mediante la toma de una muestra de suero sanguíneo en el laboratorio de microbiología del Centro Nacional de Investigaciones Científicas (CNIC). A los que resultaron positivos en el examen serológico se les practicó endoscopia digestiva superior Se les tomaron cuatro muestras de biopsia para cultivo (2 en antro caras anterior y posterior y 2 en cuerpo caras anterior y posterior). En los pacientes con cultivo positivo se determinó la presencia del gen cagA y de la citotoxina vacA. Las muestras para cultivo fueron analizadas en el CNIC. Para el estudio histológico se tomó una muestra de biopsia de la curvatura menor del antro y se utilizó la tinción de hematoxilina y eosina. Las muestras fueron procesadas en el servicio de Anatomía Patológica del hospital.
La descripción de los hallazgos endoscópicos y los diagnósticos correspondientes se realizó mediante el sistema Sidney de clasificación de gastritis vigente desde 1990,5 así como la terminología endoscópica aceptada internacionalmente.6
Para determinar la significación de los genotipos se aplicó el método estadístico Chi cuadrado con una significación estadística de alfa < 0,05.
Para la realización de este trabajo se respetaron las bases éticas de las investigaciones en seres humanos. A todos los pacientes incluidos se les explicaron las características y objetivos del estudio. La aprobación del paciente para participar fue plasmada en la planilla de consentimiento informado. El proyecto fue aprobado por el Comité de Ética de la Institución. Para la realización de la investigación se solicitó la autorización del Comité Científico del Hospital y se garantizó la confidencialidad de la información.
RESULTADOS
Se estudiaron 71 pacientes, 34 (47,8 %) del sexo femenino y 37 (52,1 %) masculinos. La edad promedio fue de 42,5 años, con un límite inferior de 18 y un límite superior de 82 años, la desviación estándar fue de 16,3.
De los 71 pacientes estudiados 49 (69 %) tuvo el gen cagA (p= 0,00001) y 22 (31 %) no lo presentaron.
Con respecto a la distribución de los alelos de la citotoxina vacA predominó la variante vacA s1m1 la cual fue diagnosticada en 40 (56,3 %) de los 71 individuos incluidos. Le siguieron en orden de frecuencia las variantes alélicas s2m2 con 23 (32,3 %) y s1m2 con 8 (11,4 %) pacientes.
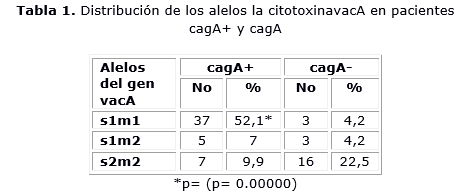
La tabla 1 muestra la distribución de las variantes alélicas de la citotoxina vacA según la presencia o no de la proteína cagA. En los pacientes cagA+ predominó el genotipo s1m1con 37 (52,1 %) pacientes (p= 0,00000). El alelo s1m2 fue el menos frecuente con 5 (7 %) individuos. La variante alélica de la citotoxinavacAs2m2 se encontró en 7 (9,9 %) personas. En los individuos cagA- la variante alélica s2m2 fue la más frecuente con 16 (22,5 %) personas. Los alelos s1m1 y s1m2 tuvieron igual distribución en este grupo con 3 (4,2 %) pacientes cada uno.
En relación con el estudio histológico, en la tabla 2 se observa la distribución según los alelos de la citotoxina vacA en los pacientes con el gen cagA. La gastritis crónica moderada prevaleció con 28 individuos de los 37 pacientes diagnosticados en total. De ellos 22 (78,6 %) tenían la variante alélica de la citotoxina vacA s1m1; 4 (14,3 %) individuos tenían los alelos s2m2 y las variantes alélicas s1m2 solo se observaron en 2 (7,1%) pacientes.
Le sigue en orden de frecuencia la gastritis crónica severa con 12 pacientes, de los cuales 8 (66,7%) tenían los alelos s1m1 y los alelos s2m2 y s1m2 se encontraron en 2 (16,7 %) personas.
Aunque no aparece reflejado en tablas ni gráficos llama la atención que solo en 1 paciente con la proteína cagA se diagnosticó metaplasia (tenía los alelos de la citotoxina vacA s1m1). No hubo pacientes con displasia.
En todos los casos predominó la variante de la citotoxinavacAs1m1. No hubo pacientes con estudio histológico normal.
DISCUSIÓN
De manera similar a investigaciones de otros países, el gen cagA se encontró en el 69 % de los aislamientos. En un estudio realizado en México, Martínez y cols. reportan la presencia de cagA en el 69, 7 % de los aislamientos.7
Mediante la determinación de la citotoxina vacA se observó la presencia de tres combinaciones de los subtipos de los alelos s1 y s2 con alelos m (s1m1, s1m2, s2m2). La combinación alélica más frecuente fue vacA s1m1 en el 56 % de los casos. Torres y cols., en el año 2009, en pacientes cubanos con dispepsia funcional, encontraron una frecuencia del 54,9 % para el genotipo vacA s1m1 y del 70,6 % para el genotipo cagA+.8
En esta investigación no se observó vacA s2m1. Esta combinación es poco frecuente y algunos autores consideran que no es viable y puede conferir desventajas para el microorganismo. No obstante, otros estudios la reportan y plantean que puede indicar no necesariamente una desventaja de selección al microorganismo, sino una forma silenciosa de evadir la terapia antibiótica.9
En los pacientes con el genotipo cagA predominaron los alelos s1m1 de la citotoxina vacA, lo cual confiere mayor patogenicidad al microorganismo. Sin embargo en aquellos cagA- los alelos más frecuentes de la citoxina vacA fueron s2m2, que son menos patógenos.
Se reporta que las cepas más virulentas son aquellas que presentan las combinaciones cagA+/vacAs1m1, cagA+/vacAs1m1/babA2+, cagA+/vacAs1m1/iceA1, 4 ya que la presencia de estos genes puede estar relacionada con altos grados de colonización antral y corporal. La coexistencia de uno o más de estos genes resulta en un incremento de la severidad en cambios histopatológicos. Este hallazgo es importante puesto que pone en evidencia la presencia de cepas virulentas del H. pylori en la población de estudio.
Es probable que sea la combinación de estos dos genes (cagA y vacA) la mejor forma de expresar el poder patógeno de un aislamiento de H. pylori.7 La combinación alélica de la citotoxina vacA más frecuente fue s1m1 y se detectó con mayor frecuencia en las cepas cagA+. La presencia de cagA está asociada a la presencia del alelo s1.
Es importante considerar que los pacientes infectados con los genotipos más virulentos, si no reciben tratamiento, o en su defecto si presentan falla terapéutica, podrían estar sujetos a desarrollar enfermedades más severas, como úlceras y adenocarcinoma, por la asociación entre la patología y los genotipos de virulencia del microorganismo reportadas por la literatura.
Esta bacteria produce una respuesta inflamatoria de intensidad variable. Es conocido que la infección por H. pylori es la mayor causa de inflamación crónica de la mucosa gástrica, que evoluciona con los años a gastritis atrófica y metaplasia intestinal. Estos son considerados los cambios fenotípicos o marcadores de riesgo más tempranos en la cascada de eventos que llevan al desarrollo del cáncer gástrico de tipo intestinal.10
Se reporta que las cepas más virulentas son aquellas que presentan las combinaciones cagA+/vacAs1m1, cagA+/vacAs1m1/babA2+, cagA+/vacAs1m1/iceA18, 8,11 ya que la presencia de estos genes puede estar relacionada con altos grados de colonización antral y corporal. La coexistencia de uno o más de estos genes resulta en un incremento de la severidad en cambios histopatológicos. Este hallazgo es importante puesto que pone en evidencia la presencia de cepas virulentas del H. pylori en la población de estudio. Esto contrasta con los resultados encontrados, donde a pesar de que en el grupo de pacientes con cagA+ el 76 % era s1m1 solo se encontró metaplasia en un paciente de este grupo. El único caso con displasia se ubicó en el grupo de los cagA-/vacAs2m2. A pesar de tener cepas patogénicas en esta investigación la severidad de las lesiones de la mucosa gástrica no corresponde con dicha patogenicidad.
Es probable que sea la combinación de estos dos genes (cagA y vacA) la mejor forma de expresar el poder patógeno de un aislamiento de H. pylori. La combinación alélica de la citotoxina vacA más frecuente fue s1m1 y se detectó con mayor frecuencia en las cepas cagA+. La presencia de cagA está asociada a la presencia del alelo s1. La asociación del gen cagA y de los alelos s1m1 del gen vacA se encuentra también en estudios similares realizados en países europeos.12
Es importante considerar que si los pacientes infectados con los genotipos más virulentos, no reciben tratamiento, o en su defecto si presentan falla terapéutica, podrían estar sujetos a desarrollar enfermedades más severas, como úlceras y adenocarcinoma, por la asociación entre la patología y los genotipos de virulencia del microorganismo reportadas por la literatura.
Esta bacteria produce una respuesta inflamatoria de intensidad variable. Es conocido que la infección por H. pylori es la mayor causa de la inflamación crónica de la mucosa gástrica, que evoluciona con los años a gastritis atrófica y metaplasia intestinal. Estos son considerados los cambios fenotípicos o marcadores de riesgo más tempranos en la cascada de eventos que llevan al desarrollo del cáncer gástrico de tipo intestinal. La infección persistente incrementa el riesgo. En promedio el adenocarcinoma aparece en el transcurso de 15 a 20 años.13
Llama la atención que en los pacientes del estudio predominó una cepa muy virulenta (cagA+ s1m1). Esto resulta interesante y a la vez preocupante, a pesar de tratarse de una muestra pequeña. Estas cepas virulentas se han asociado con alteraciones histológicas más severas como atrofia y metaplasia intestinal, que implican un mayor riesgo de cáncer gástrico, sin embargo Cuba tiene la menor incidencia de cáncer gástrico en el Caribe,14 aun cuando las enfermedades malignas ocupan el primer lugar entre las causas de muerte de los últimos años.15
Esto podría obedecer a que existen otros factores de riesgo para el desarrollo del adenocarcinoma gástrico que también ejercen un papel importante como son: la edad de adquisición de la infección, el origen geográfico del paciente, hacinamiento, tabaquismo, alcoholismo, desnutrición, entre otros.16
Por tanto, los factores de virulencia del H. pylori pueden servir como marcadores epidemiológicos moleculares para crear en el futuro estrategias de prevención de patologías gástricas severas, pero deberán siempre analizarse de forma integral junto a los otros factores de riesgo implicados en la carcinogénesis gástrica.
REFERENCIAS BIBLIOGRÁFICAS
1. Martínez T. Alejandra, González C. Carlos, Kawaguchi P. Fernando, Montoya Rolando, Corvalán Alejandro, Madariaga B. Jaime, et al. Helicobacter pylori: análisis de cagA y genotipificación de vacA en Chile. Detección de una cepa s2/m1. Rev. méd. Chile. 2001 [citado 2017 Feb 20];129(10):1147-53. Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0034-98872001001000006&lng=es
2. Sáenz R. Helicobacter pylori hoy. Una historia de 30 años. Rev. Med. Clin. Condes. 2015;26(5):572-8.
3. Otero W. La importancia de cultivar Helicobacter pylori. Rev Col Gastroenterol. 2013;28(2):87-92.
4. Cervantes E. Helicobacter pylori: mecanismos de patogenicidad. Rev LatinoamPatolClin Med Lab. 2016;63(2):100-9.
5. Caner V, Yilmaz M, Yonetci N, Zencir S, Karagenc N, Kaleli I, et al. Helicobacter pylori iceAalleles are disease-specific virulece factors. World J Gastroenterol. 2007;13(18):2581-5.
6. Arévalo GA, Trespalacios AA, Otero W. Importancia de la proteína cagA en infección por Helicobacter pylori. Revista Colombiana de Gastroenterología. 2009;24(4):388-95.
7. Martínez D, Atrisco J, Hernández R, Reyes S, Betancourt R, Cruz I, et al. Diversidad de los genotipos vacA y cagA de Helicobacter pylori y expresión de interferón gamma en pacientes con gastritis crónica y cáncer gástrico. Revista de Gastroenterología de México. 2014;79(4):220-8.
8. Torres LE, Melián K, Moreno A, Alonso J, Sabatier CA, Hernández M, et al.Prevalence of vacA, cag A and babA2 genes in Cuban Helicobacter pylori isolates. World J Gastroenterol. 2009;15:204-10.
9. Zambon C, Navaglia F, Basso D, Rugge M, Plebani M. Helicobacter pylori babA2, cagA and s1vacA genes work synergistically in causing intestinal metaplasia. J ClinPathol. 2003;56:287-91.
10. Guadalupe Ayala, Wendy Itzel Escobedo-Hinojosa, Carlos Felipe de la Cruz-Herrera and Irma Romero. Exploring alternative treatments for Helicobacter pylori infection World J Gastroenterol. 2014;20(6):1450-69.
11. Martinez Echavarría MT, González Torres M, Ferreira Capote R, Mas Páez JA. Genotipo cagA+ en cepas de Helicobacter pylori Asociadas a Úlcera Péptica, Gastritis Crónica y Cáncer Gástrico. Rev Cubana Med. 2008;47(2):1-8.
12. González-Carbajal M, Martínez L, Montero T, Cañete R. Diagnóstico mediante histología y test de ureasa de la infección por Helicobacter pylori en el Instituto Cubano de Gastroenterología. Rev Panam Infectol. 2009;11(1):7-10.
13. Huertas GM, Martínez JD, Oliveros R, Posso H, Bravo MM, Orozco O. Los genotipos de Helicobacter pylori en gastritis no atrófica difieren de los encontrados en úlcera péptica, lesiones premalignas y cáncer gástrico. Rev. Med. Chile. 2002;130(2):1-12.
14. Reina Alfonso BE, Lebroc Pérez D, Massip Ramírez M. Comportamiento clínico epidemiológico del cáncer gástrico en el Departamento de Gastroenterología del Hospital Provincial de Ciego de Ávila. MEDICIEGO. 2011 [citado 20 Feb 2017];17(2):1-7. Disponible en: http:// www.medigraphic.com/pdfs/mediciego/mdc-2011/mdc112j.pdf
15. Hierro A, Uime E, González L. Comportamiento clínico, epidemiológico, endoscópico e histológico del cáncer gástrico de tipo epitelial. Revista Cubana de Investigaciones Biomédica. 2016;35(1):48-64.
16. Omar E, Rabkin CS, Gammon MD, Vaughan TH, Risch HA, Schoenberg JB, et al. Increased risk of noncardia gastric cancer associated with proinflammatory cytokine gene polymorphisms. Gastroenterology. 2003;124:1193-201.
Recibido: 24 de diciembre de 2016.
Aprobado: 24 de febrero de 2017.
Ludmila Martínez Leyva. Hospital Militar Central "Carlos J. Finlay". La Habana, Cuba. Dirección electrónica: ludmila@infomed.sld.cu