INTRODUCCIÓN
La infección por el coronavirus de tipo 2, causante del síndrome respiratorio agudo grave (SARS-CoV-2) ha sido responsable de la enfermedad por coronavirus (COVID-19) que ha afectado a millones de personas en el mundo.1 La transmisión de persona a persona es la principal forma de causar infección, lo cual generó la propagación masiva y una emergencia de salud pública de importancia internacional.2
La histoplasmosis es causada por el hongo dismórfico Histoplasma capsulatum (HC), cuyas manifestaciones clínicas varían desde un cuadro asintomático hasta una enfermedad diseminada y altamente mortal, localizada principalmente a en los pulmones.3 Los pacientes inmunodeprimidos con síndrome de inmunodeficiencia adquirida o terapias inmunosupresoras presentan mayor riesgo de desarrollar formas más graves de la histoplasmosis.4 Las infecciones fúngicas diseminadas se acompañan de una alta morbilidad y mortalidad en el paciente inmunodeprimido.
La COVID-19 grave o crítica afecta principalmente el pulmón, produce el síndrome de dificultad respiratoria aguda (SDRA) y daño multiorgánico, que en determinadas condiciones puede acompañarse de coinfecciones virales, bacterianas o fúngicas; sin embargo, no es clara la asociación con la histoplasmosis y el impacto en los desenlaces clínicos.3,4
El objetivo de este artículo es presentar el caso de un paciente con diagnóstico de histoplasmosis diseminada e infección por SARS-CoV-2.
CASO CLÍNICO
Paciente masculino de 79 años de edad, con antecedentes de hipertensión arterial sistémica controlada y diabetes mellitus tipo 2, en tratamiento con antidiabéticos orales, cuyo último control estaba con niveles normales de glucemia basal y hemoglobina glicosilada. Quién acude al servicio de urgencias por un cuadro clínico de una semana de evolución, consistente en tos no productiva, disnea y fatiga con los esfuerzos medianos. El paciente refiere trabajo virtual, desde su domicilio, durante aproximadamente 3 meses; sin embargo, asistió a una reunión familiar 3 días previo al inicio de los síntomas, por lo cual se decide realizar una prueba de antígeno, que fue positivo para infección por SARS-CoV-2, 3 días previos al ingreso.
Al ingresar al hospital se realizan exámenes de laboratorio que muestran elevación de leucocitos a expensas de neutrófilos, proteína c reactiva alta, gases arteriales con un trastorno grave de la oxigenación, pese al tratamiento con máscara de no reinhalación. En una radiografía de tórax se evidencian infiltrados intersticiales reticulares finos en ambos campos pulmonares (Fig. 1A).
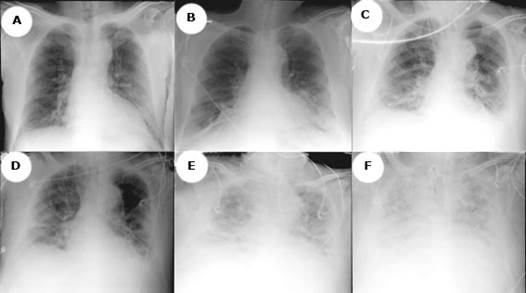
Fig. 1 Evolución radiológica. Se observa un deterioro en las radiografías de tórax, dado por infiltrados intersticiales reticulares finos en ambos campos pulmonares, los cuales con el transcurrir de la estancia clínica, muestran opacidad que compromete la totalidad de ambos campos pulmonares por un proceso inflamatorio neumónico multilobar de aspecto radiológico atípico, que borra los ángulos costofrénico y cardiofrénico, bilateralmente.
Se inicia tratamiento con dexametasona, ampicilina/sulbactam y enoxaparina a dosis de 1 miligramo por kilogramo de peso. Debido al deterioro clínico y aumento en las necesidades de oxígeno suplementario se traslada a la unidad de cuidados intensivos (UCI), con necesidad de intubación orotraqueal inmediata e inicio de noradrenalina a dosis de 0,1 µg/kg/min. En la UCI, una angiografía por tomografía computarizada de tórax muestra opacidades en vidrio esmerilado, periféricas, bilaterales, consolidaciones bibasales, con engrosamiento de paredes bronquiales y ausencia de signos de tromboembolismo pulmonar (Fig. 2). Se solicita panel FilmArray para neumonía, el cual reportó Serratia marcescens y Klebsiella oxytoca, ambas productoras de carbapenemasa tipo KPC, por lo cual se realiza cambio antibiótico a ceftazidima avibactam, más amikacina.
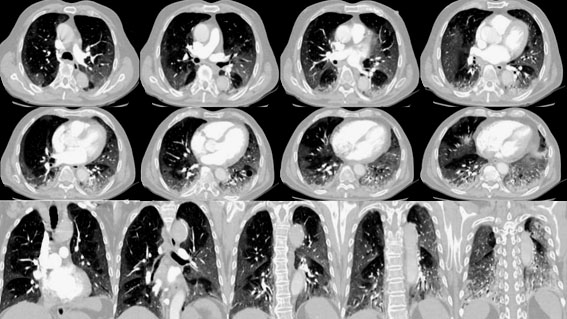
Fig. 2 Angiografía por tomografía computarizada de tórax. Se observan cortes transversales y coronal con opacidades en vidrio deslustrado periféricas, bilaterales, mayores de 3 cm, con engrosamiento de septos inter e intralobulillares, que configuran un patrón en empedrado; se asocia a consolidaciones bibasales con engrosamiento de las paredes bronquiales. Hay bronquiectasias cilíndricas bibasales asociadas a tractos fibróticos atelectásicos.
Pese al tratamiento antibiótico dirigido durante 10 días, el paciente permaneció con signos de respuesta inflamatoria sistémica y empeoramiento de la afectación radiológica (Fig. 1B-1D), con nuevos hallazgos al examen físico, dados por adenopatías cervicales e inguinales, hepatoesplenomegalia y pápulas umbilicadas del color de la piel, en el tronco y las extremidades, altamente sugestivas de infección fúngica diseminada. Se inició tratamiento con voriconazol. La secreción orotraqueal para bacilos acidorresistentes fue negativo.
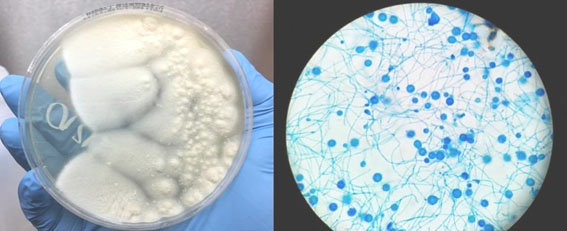
Ante la sospecha de sobreinfección micótica se realiza un minilavado broncoalveolar con hallazgos del HC, por lo cual realiza cambio al tratamiento antimicótico por anfotericina B liposomal (Fig. 3). El paciente presenta un marcado deterioro clínico, radiológico (Fig. 1E y 1F) y persistencia de la necesidad de altos parámetros ventilatorios, hipoxemia refractaria y falla multiorgánica. Falleció posteriormente.
COMENTARIOS
El HC es un hongo dimórfico intracelular que infecta a los macrófagos y causa inflamación granulomatosa, transmitida a través de la inhalación de esporas.3 La diseminación y gravedad de la enfermedad depende en gran medida de la capacidad del sistema inmune en evitar la diseminación de la infección de los pulmones, ganglios linfáticos o vísceras. Antecedentes de infección por histoplasma, síndrome de inmunodeficiencia adquirida, neoplasias malignas y tratamiento crónico con corticosteroides,5,6,7 son factores de riesgo para presentar histoplasmosis diseminada.
En este caso, la carga inflamatoria asociada a la infección “tormenta de citocinas” por SARS-CoV-2, el tratamiento inmunomodulador requerido, ventilación mecánica y el bajo recuento de células CD4 pudo haberse relacionado con el desenlace fatal del paciente.8
El antecedente de diabetes mellitus que describe el paciente puede presentar un estado de inflamación crónica, que conlleva a un proceso inmunológico, deterioro en la fagocitosis de macrófagos alveolares y reducción de la producción de citocinas, como el factor de necrosis tumoral alfa en el tejido pulmonar.9,10 Debido a lo anterior, la infección activa por el SARS-CoV-2, la edad avanzada, el tratamiento médico en UCI y el antecedente de enfermedad metabólica crónica provocan una respuesta inmune innata y adaptativa débil y predisposición al desenlace fatal en el paciente.
El diagnóstico de la infección por HC incluye pruebas serológicas como fijación del complemento, inmunoensayos enzimáticos y cultivo de lavado alveolar broncoscópico, indispensables para descartar otras infecciones pulmonares secundarias e iniciar el tratamiento médico adecuado.11 Durante la pandemia por la COVID-19 los procedimientos médicos, como la broncoscopia y el lavado broncoalveolar estaban limitados, debido a la generación de aerosoles, lo cual pudo haber retrasado el diagnóstico de la histoplasmosis diseminada y aumentado el deterioro clínico del paciente.12
La histoplasmosis afecta en mayor proporción a hombres, cuyas presentaciones más graves se presentan principalmente en niños y adultos mayores con inmunodeficiencia. Un estado de inmunosupresión y la exposición al hongo en ambientes relacionados con excremento de aves y guano de murciélagos son necesarios para el desarrollo de la histoplasmosis.9,10,12 Pese a ello, en la actualidad son escasos los reportes que describen el desarrollo de la infección por HC en un paciente con una enfermedad metabólica crónica.
Para el estándar de oro en el diagnóstico de histoplasmosis se requiere tejido para cultivo de hongos, pero este puede requerir de 4 a 6 semanas para su crecimiento3 y la histopatología del órgano afectado, generalmente muestra inflamación granulomatosa, con granulomas necrotizantes.9,10,11 En el caso que se presenta, el frotis de la secreción orotraqueal permite la visualización del HC, que al correlacionarse con las lesiones cutáneas y el empeoramiento clínico, se decide iniciar tratamiento antifúngico.
Los casos de infecciones por HC y SARS-CoV-2 en pacientes con edad avanzada y enfermedades metabólicas crónicas son limitados, siendo un reto para el personal médico su diagnóstico y requiriendo tener en cuenta infecciones micóticas pulmonares como la criptococosis o la histoplasmosis en la insuficiencia respiratoria asociados a la infección por SARS-CoV-2.