Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Salud Animal
versión impresa ISSN 0253-570X
Rev Salud Anim. vol.36 no.2 La Habana Mayo.-ago. 2014
ARTÍCULO ORIGINAL
Prevalencia de anticuerpos a Brucella abortus, Leptospira sp. y Neospora caninum en hatos bovinos y bubalinos en el Departamento de Caquetá, Colombia
Seroprevalence of Brucella abortus, Leptospira sp. and Neospora caninum in cattle, buffaloes and mixed farms, in the Department of Caqueta, Colombia
Javier Leonardo Motta GiraldoI, José Angel Clavijo HoyosII, Indira Waltero GarcíaIII, María Antonia AbeledoIV
IFlorencia, Caquetá, Colombia. Correo electrónico: motta41@gmail.com.
IILaboratorio de Diagnóstico Veterinario del Caribe, Barranquilla, Atlántico, Colombia.
IIILaboratorio de Diagnóstico Veterinario ICA, Florencia, Caquetá, Colombia.
IVDirección de Salud Animal, Centro Nacional de Sanidad Agropecuaria, San José de las Lajas, Mayabeque, Cuba.
RESUMEN
Con el objetivo de determinar y comparar la prevalencia de anticuerpos a Brucella abortus, Leptospira sp. y Neospora caninum, se investigaron siete predios, dos de bovinos, dos bubalinos y tres mixtos; además se incluyeron tres instalaciones para la venta de búfalos. La prevalencia de anticuerpos fue mayor en bubalinos que en bovinos para las tres entidades estudiadas, Leptospira sp. (37.3% vs 28%); Neospora caninum (45.4% vs 12.5%) y Brucella abortus (11.9% vs, 5.3%). Hubo presencia de anticuerpos a los seis serovares tanto en bovinos como en bubalinos y los valores de seroprevalencia a los serovares Grippotyphosa y Hardjo, fueron superiores en las dos especies. La prevalencia de anticuerpos para leptospirosis fue superior en los predios simples, tanto en bovinos como en búfalos. En el caso de brucelosis, la seroprevalencia en los bovinos de predios mixtos fue superior al ser comparada con la obtenida en los simples con una Razón de Prevalencias (RP) de 6,8; (IC, 1,58-29,6); mientras que en los bubalinos fue superior en los simples (RP, 2,8; IC=1,18-5,71). En los bovinos, no hubo asociación entre la seroprevalencia a Neospora caninum y el tipo de predio; sin embargo, en los búfalos la seroprevalencia fue superior en los simples con una RP de 2,3 (IC=1,75-3,01). Se concluye que los búfalos y bovinos presentan altos niveles de anticuerpos a Neospora caninum y Leptospira sp. en todos los tipos de predios y áreas de venta y que aún existen rebaños afectados por Brucella abortus a pesar de los programas de control establecidos.
Palabras clave: Brucella abortus, Leptospira sp., Neospora caninum, búfalos, bovinos, prevalencia.
ABSTRACT
In order to determine and compare the prevalence of antibodies to Brucella abortus, Leptospira sp. and Neospora caninum, two cattle, two buffaloes and three mixed (both species) farms, were researched, besides including three buffaloes sale facilities. Antibody prevalence was higher in buffaloes than in cattle for the three studied agents, Leptospira sp. (37,3% vs 28%), Neospora caninum (45.4% vs. 12.5%) and Brucella abortus (11,9% vs. 5,3%). Antibodies were present at six serovars in both, cattle and water buffaloes and seroprevalence values for Hardjo and Grippotyphosa serovars were superior in both species. The prevalence of antibodies to leptospirosis was higher in simple premises in both cattle and buffaloes, and the seroprevalence to brucellosis in cattle of mixed farms was higher when compared with that obtained in simple farms with a prevalence ratio (PR) of 6,8; (CI, 1,58 to 29,6), whereas in buffaloes, the prevalence of antibody was higher in those single (OR, 2,8 , CI = 1,18 to 5,71 ). In cattle, there was not an association between the seroprevalence to Neospora caninum and the herd type, but in buffaloes seroprevalence was higher in simple farms with a RP of 2,3 (CI= 1,75 to 3,01). It is concluded that buffaloes and cattle have a high prevalence of antibodies to Neospora caninum and Leptospira sp. in all herds and sale facilities and there are still herds affected by Brucella abortus in spite of having the control programs established.
Key words: Brucella abortus, Leptospira sp., Neospora caninum, buffaloes, bovine, prevalence.
INTRODUCCIÓN
La producción bovina y bubalina se ve afectada por una gran variedad de enfermedades que influyen negativamente en la reproducción, expresada en un menor número de terneros nacidos vivos, menor producción de leche, días abiertos, intervalo entre partos prolongados y crías débiles, además de provocar pérdida de la gestación por abortos y muerte embrionaria, que alteran los parámetros zootécnicos y reproductivos. Muchas de estas patologías son de origen infeccioso, se transmiten de un animal a otro y algunas son zoonóticas, generando problemas de salud pública (1).
La leptospirosis es una zoonosis de distribución mundial, que afecta a especies domésticas y salvajes, las cuales constituyen reservorios latentes y fuente primaria de contaminación para el hombre (2). Es común en climas húmedos y cálidos del trópico, en zonas urbanas y rurales. Se reconocen dos especies, Leptospira interrogans (patógenas) y L. biflexa de vida libre y saprófita. L. interrogans es dividida en serovares de los que se conocen más de 200, agrupados en 24 serogrupos por similitudes serológicas y pruebas de aglutinación (3). En los bovinos la infección se establece a través de las mucosas nasal, oral y la conjuntiva, o abrasiones de la piel; se produce leptospiremia, invade el hígado, riñón, órganos reproductivos, membranas fetales, el feto, la glándula mamaria y los testículos, el epidídimo y las vesículas seminales, donde ocasiona un daño tisular severo (2).
Neospora caninum, protozoario intracelular, causa aborto en el ganado bovino y es considerado emergente en bovinos y en caninos (1,4). Se ha encontrado en coexistencia con otros agentes infecciosos, en animales de cualquier tipo de sistema productivo y en vacas aparentemente sanas o con antecedentes de aborto (5, 6). En el bovino lechero la producción láctea disminuye hasta 4% y en el de carne se relaciona con alteraciones de la ganancia de peso y abortos (7). Además, puede provocar subfertilidad, pérdidas tempranas de la gestación, momificaciones, nacimiento de terneros con ataxia y parálisis (1). Afecta también otras especies domésticas como caprinos, ovinos, equinos, camélidos suramericanos y el búfalo de agua (Bubalus bubalis) (8).
Brucella sp. afecta animales domésticos y silvestres, se conocen seis especies que poseen cierta especie-especificidad, B. abortus afecta a los bovinos y bubalinos, B. melitensis a los ovinos y caprinos, B. suis al porcino, B. neotomae a la rata del desierto, B. ovis al ovino y B. canis a los caninos, pero también producen infecciones cruzadas. Con la excepción de B. ovis y B. neotomae, todas infectan al hombre (9). En Colombia se considera como una enfermedad de control oficial y aunque las pérdidas económicas en bovinos no han sido calculadas en toda su extensión; evaluaciones realizadas en 1993 y 1999 estiman entre 7 y 12 millones de USD cada año (10).
A pesar de la severidad de las repercusiones económicas por afecciones reproductivas causadas por neosporosis y leptospirosis, en Colombia estas enfermedades no son de control oficial y se ha delegado esta responsabilidad a la voluntad del productor (11). Los estudios de prevalencia en rebaños bubalinos son escasos en el país y la situación epidemiológica es más crítica en el departamento de Caquetá, debido a la ausencia de datos sobre su impacto real, situación que se hizo evidente con el estudio retrospectivo de agentes infecciosos que afectan la reproducción bovina en el departamento durante la década de 1999 a 2009, donde se encontraron en algunos municipios valores de seropositividad para leptospirosis de 50% o superior, y en el caso de Neospora en tres años solo se trabajó 36 muestras (12).
En estudios previos sobre la seroprevalencia de algunos virus que afectan la reproducción en predios de bovinos y bubalinos del Departamento de Caquetá, se encontraron proporciones elevadas de animales con anticuerpos a herpesvirus bovino 1 y 4 en ambas especies y presencia de virus de la diarrea viral bovina en vacas, pero no en búfalos (13), por lo que se hace necesario conocer la participación de bacterias como Brucella abortus y Leptospira sp. y el protozoo Neospora caninum en rebaños de esta región.
El presente estudio pretende determinar y comparar la seroprevalencia de Brucella abortus, Leptospira sp. y Neospora caninum en hatos bovinos y bubalinos en rebaños mixtos, simples y puntos de venta de búfalos en el departamento de Caquetá, Colombia.
MATERIAL Y MÉTODOS
Tipo de estudio y selección de predios y animales. Se realizó un estudio descriptivo y de corte transversal en un total de siete predios: tres mixtos (búfalos y bovinos), dos de bovinos y dos de búfalos. Todos los predios bovinos estaban manejados en sistemas de doble propósito, el cual constituye el principal sistema de explotación de bovinos en el Departamento; tenían características similares en cuanto a tamaño de hato y poseían registro individual de animales. Además se incluyeron tres áreas de venta de búfalos, dos en el departamento de Caquetá, uno en el municipio de Puerto Rico al norte del departamento y el otro al sur en el municipio de Valparaíso y uno en el departamento de Putumayo, en el municipio de Puerto Asís (puerto sobre el río Putumayo, por donde entran los animales desde Leticia, capital del departamento del Amazonas provenientes de Brasil).
Para seleccionar el tamaño de muestras en cada rebaño, se utilizó el programa Epidat 3.1 y se consideró una prevalencia de 50%, un nivel de confianza de 95% y una precisión de 10%. Solo se incluyeron hembras aptas para la reproducción. En aquellos casos en que el total de animales fuera de 20 o menos, se muestrearon todos. En los puntos de venta se investigó el total de animales existentes en el momento de la toma de muestra.
Toma de muestras e investigaciones realizadas
La muestra sanguínea se tomó, previa desinfección de la zona ubicada en la línea media ventral de la cola, entre la tercera y séptima vértebra coccígea, aproximadamente a 10 centímetros del ano en los bovinos; mientras que en los búfalos se tomó en la zona lateral de la cola, previo torniquete en la base de la misma para facilitar la ubicación de las venas. Se recolectaron 10 ml de sangre de la vena coccígea en tubos vacutainer® sin anticoagulante; los cuales fueron llevados al laboratorio del ICA Seccional Caquetá, donde se centrifugaron a 5000 g/minuto, para extraer el suero y conservarlo a -200C hasta su procesamiento.
Las pruebas para detectar anticuerpos específicos fueron:
ELISA indirecto anti Neospora caninum (Laboratorios IDEXX); Brucella sp., prueba de Rosa de Bengala (Vircell, S. L. Ref. RB001) y confirmación por ELISA competitivo (Brucella abortus. Brucella - AbI - ELISA - SVANOVIRTM), según instrucciones del fabricante.
Leptospira sp. por prueba de microaglutinación (MAT) (seis serovares: Bratislava, Canicola, Grippotyphosa, Hardjo, Pomona e Icterohaemorragiae), según procedimientos de laboratorio. Se interpretaron como positivos títulos ³ 1:80.
El diagnóstico de Neospora y la prueba de Rosa de Bengala para Brucella, se realizaron en el Laboratorio de Diagnóstico Veterinario del Caribe (LABVECA), el ELISA de Brucella abortus, en el laboratorio de diagnóstico del Instituto Colombiano Agropecuario (ICA), Seccional Atlántico y el MAT para Leptospira sp. en el Laboratorio Zoolab, Bogotá D.C., bajo parámetros y licencias nacionales establecidos por el ICA para estos casos.
Análisis de los datos
El porcentaje de seropositividad (seroprevalencia) para Brucella abortus, Leptospira sp. y Neospora caninum se determinó mediante la relación porcentual entre el número de animales que resultaron positivos y el número de animales evaluados. Para comparar la seroprevalencia entre rebaños de una misma especie e inter-especies, se utilizó la comparación de proporciones con Dócima de Duncan mediante el software CompaPro 2.1 (p£0,05). Para evaluar la asociación entre la prevalencia de anticuerpos y el tipo de predio, se empleó el Chi cuadrado de independencia para un nivel de confianza de 95% con el uso del paquete estadístico InfoStat 1.1. En caso de significación se calculó la razón de prevalencia (RP) como la relación de las seroprevalencias de ambos tipos de predios.
RESULTADOS Y DISCUSIÓN
La prevalencia de anticuerpos a leptospirosis varió entre los diferentes rebaños bovinos, con valores que oscilaron desde 6,1% hasta 46,5% (Tabla 1). En Colombia, FEDEGAN (Federación Nacional de Ganaderos) a partir de un análisis de las bases de datos del diagnóstico realizado por el ICA en todo el país, destacó que Leptospira sp. obtuvo la mayor solicitud diagnóstica entre las enfermedades no sujetas a control por el Estado, con seroprevalencia de 46% para Colombia (11). En la India se reportan valores de 40% en vacas y 26% en toros (14).
En los informes reportados de 13 países sobre la incidencia de leptospirosis en animales domésticos y silvestres enviados al Laboratorio de referencia de leptospira de la Organización Mundial de Sanidad Animal (OIE) se reflejó que la situación epidemiológica de Leptospira sp. en América Latina presenta dos problemas, el primero es no estar declarada como enfermedad de obligatoria denuncia y el segundo, es la multiplicidad de resultados, sin soporte científico ni periodicidad definida. Esta situación limita la identificación real de los serovares que circulan en cada país y la producción de biológicos eficaces para su control (15).
La seroprevalencia de leptospirosis en búfalos mostró también una gran variabilidad entre los rebaños con diferencias significativas entre ellos (Tabla 2), quizás motivado por la influencia de factores que favorecen la permanencia y transmisión de la infección. Nuestros resultados fueron inferiores a los encontrados en Antioquia y Córdoba (61%) posiblemente debido a que consideraron títulos desde 1:50 como positivos (16); así como también al reportado para búfalos en la Amazonía brasileña donde la frecuencia de anticuerpos a leptospira fue de 80% (17).
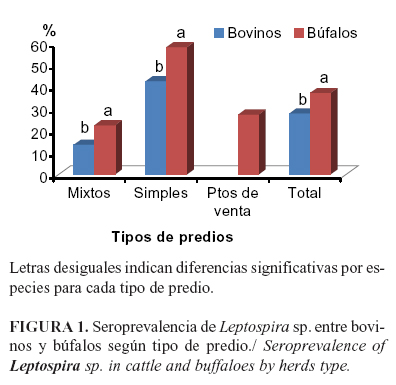
La frecuencia de anticuerpos a Leptospira sp., fue mayor en los búfalos que en los bovinos tanto en rebaños mixtos (22.5% y 13.6%); como en simples (58,3% y 42,7%), así como, en los totales por especies, 37,3% bubalinos y 28,0% bovinos (Figura 1). La alta frecuencia en los búfalos puede deberse al manejo que se les da al ubicarlos en zonas inundables o donde se cultiva arroz de forma frecuente o esporádica, facilitando el consumo de aguas contaminadas por orina de ratas o especies silvestres portadoras de Leptospira sp. que frecuentan este tipo de cultivo o ecosistema.
En los bovinos, la seroprevalencia a Leptospira sp. fue mayor en predios simples, que en mixtos (42,7% vs 13,6%) (c2=31,8; p<0,001), la RP fue de 3,1 (IC=2,01-4,85) lo que equivale a decir que en predios simples hay 3,1 veces más probabilidad de encontrar un animal seropositivo en rebaños simples. En búfalos, también se encontró una prevalencia superior (c2=32,6; p<0.001), en predios simples (58,3%) al ser comparado con los mixtos (22,5%) y la RP fue de 2,6 (IC=1,81-3,69). No existen antecedentes acerca de diferencias entre el comportamiento de esta entidad en rebaños mixtos de bovinos y bubalinos, lo que debe ser motivo de futuras investigaciones.
Se detectó la presencia de anticuerpos a los 6 serovares tanto en bovinos como en bubalinos, aunque el serovar Icterohaemorragiae no se detectó en los búfalos de los puntos de venta, ni en los bovinos de predios mixtos (Tabla 3). Los valores de seroprevalencia a los serovares Grippotyphosa y Hardjo fueron superiores en las dos especies. El porcentaje de seropositivos a L. Hardjo fue significativamente superior en los predios mixtos tanto de bovinos como de bubalinos, al ser comparados con el resto; lo que pudiera estar relacionado con la convivencia entre ambas especies, ya que L. Hardjo, es reportado como el serovar predominante en bovinos (17,18) y es considerado como causa importante de infertilidad a nivel mundial.
La presencia de los diferentes serovares de leptospira varía según la latitud, regiones naturales de un país, interacción de especies susceptibles, reservorios, época del año en el que se realice el estudio o sistemas productivos, es así como en Don Matías, Antioquia, Colombia, los serotipos más frecuentes en fincas donde conviven bovinos, cerdos y humanos fueron Pomona, Bratislava y Hardjo (19). Los resultados del ICA difieren de los obtenidos en este trabajo, ya que ellos señalan al serovar Bratislava como el más frecuente en bovinos para Colombia (20); sin embargo, en la Amazonía colombiana L. Hardjoprajitno es reportada como la más frecuente (20). En México, los serovares más frecuentes son Hardjo, Tarassovi, Icterohaemorrhagiae, Canicola y Gryppotiphosa (22). De la misma forma en bovinos de ocho estados de Brasil el serovar Hardjo presentó títulos más altos de anticuerpos con 31% (23).
En búfalos Hardjopratjino fue el más frecuente en el estado de Pará, Brasil con 15,75% (24). A diferencia de Trinidad, donde el 14,6% de los búfalos investigados fueron seropositivos con valores desde 2% hasta 32,7% y los serovares más frecuentes fueron diferentes entre fincas; serovar Copenhageni y Georgia prevalecieron en una; mientras que serovares Patoc y Bratislava fueron predominantes en la otra (25).
La seroprevalencia a Brucella abortus fue similar en los rebaños evaluados, excepto en uno mixto donde alcanzó valores de 16,3% (Tabla 4). Datos similares se han encontrado en predios lecheros y de carne en Argentina con 2,2% y 6,8% respectivamente, al igual que en Brasil donde oscila entre 4% a 5% a nivel nacional para bovinos (26). En Argentina se considera una enfermedad endémica en el ganado y la prevalencia es muy variable en los países fronterizos (27).
Existió diferencia significativa entre los rebaños para la especie bubalina, con valores que oscilaron desde 0% hasta 35,7% (Tabla 5). La capacidad que posee Brucella para sobrevivir en el medio hace que sea difícil de erradicar, los búfalos son susceptibles a la infección con Brucella abortus, biovar 1, 3 y 6, y Brucella melitensis, biovar 3. La infección al finalizar la gestación puede provocar su pérdida y muerte neonatal y los bucerros que sobreviven pueden mantenerse infectados y las bucerras abortar en su primera gestación manteniendo de forma cíclica la infección en el predio (28).
Calderón et al. (29) reportan datos diferentes a los nuestros en búfalos, en el municipio de Lorica, Colombia con el 3% de animales positivos a la enfermedad y un 50% de rebaños afectados. Para poblaciones de búfalos del estado de Pará, Brasil se reporta una frecuencia de 3,7% (17) que difiere a la encontrada en nuestro trabajo para esta especie.
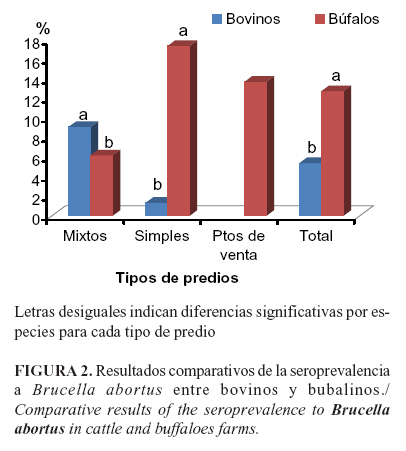
La seroprevalencia a brucelosis en bovinos en predios mixtos fue superior al ser comparada con la obtenida en predios simples(c2=9,2; p=0,023) y la RP fue de 6,8 (IC= 1,58-29,6). En el caso de los bubalinos sucede lo contrario, es decir, la prevalencia de anticuerpos es superior en los simples(c2=7,5; p=0,0124); RP de 2,8 (IC=1,18-5,71). Al comparar ambas especies, observamos que en los predios mixtos la seroprevalencia de brucelosis fue más alta en bovinos que en búfalos a diferencia de los predios simples, donde el resultado para búfalos fue superior, así como en los totales por especie (Figura 2).
Los valores inferiores a Brucella para los búfalos de predios mixtos pudieran estar relacionados con la inclusión de estos animales en los ciclos de vacunación cuya cobertura para brucelosis en Colombia llega al 97% (30). Suazo Cortez et al. (31) obtuvieron una prevalencia de anticuerpos en búfalos a Brucella abortus de 7% en Veracruz, México; sin embargo, los bovinos que compartían praderas y fuentes de agua con ellos resultaron negativos. Según los autores este resultado pudo deberse a que los bovinos estaban sujetos al programa de vacunación (31).
Existe alta prevalencia en los puntos de venta de búfalos (13.7%). En este sentido ha sido señalado que la compra con propósitos productivos, de animales con status desconocido a Brucella abortus, puede ser sospechada como una fuente de diseminación de la brucelosis en los rebaños (31).
La seroprevalencia a Neospora caninum de los rebaños bovinos investigados fue muy similar (Tabla 6). Las solicitudes diagnósticas al ICA para Neospora caninum son muy bajas en el país y la prevalencia nacional es de 37% (11) superior a la encontrada en este trabajo. En Córdoba, se reporta una seroprevalencia del 10,2% en vacas con problemas de infertilidad (32). Datos más altos en rebaños lecheros (54.2%), son reportados en el estado de Hidalgo, México (5). En el estado de Aguascalientes, México la seropositividad fue del 31% en vacas, en becerras osciló entre 6.6% al 80% y en fetos abortados de 73% (33).
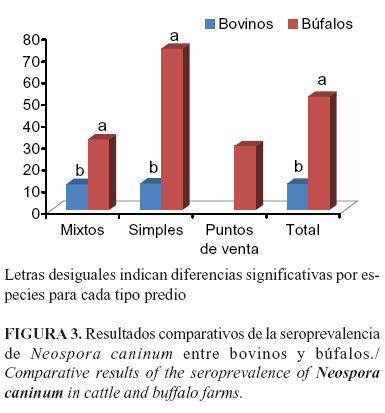
Todos los rebaños bubalinos resultaron seropositivos a Neospora caninum, con gran variabilidad entre ellos y una seroprevalencia que varió desde 7,7% hasta 78,6% (Tabla 7). Estas diferencias pueden deberse a una mayor posibilidad a entrar en contacto con el parásito, debido al tipo de manejo que se le da a esta especie en el departamento, independientemente del tipo de predio, ya que son ubicados en terrenos anegadizos y menos tecnificados, que no son aprovechados de forma eficiente por el bovino, o por el uso de perros pastores infectados, los cuales constituyen la principal fuente de mantenimiento de la infección en los rebaños (7).
En los bovinos, no hubo asociación entre la seroprevalencia a Neospora caninum y el tipo de predio; sin embargo, en los búfalos la seroprevalencia fue superior en los simples (c2=43,5; p<0.001) con una RP de 2,3 (IC= 1,75 - 3,01). Al comparar los valores de seropositividad entre bovinos y bubalinos, se encontró que en búfalos fue superior independientemente del tipo de predio (Figura 3).
La diversidad en las frecuencias de un mismo país o región o en los mismos sistemas de producción puede explicarse por la época del año en las que fueron examinados los hatos, los factores de riesgo encontrados dentro de cada predio, la densidad de la población bovina y la diversidad de animales domésticos y/o silvestres que interactúan con los bovinos (34).
Los resultados obtenidos para búfalos son inferiores a los registrados en la Amazonía Brasileña donde se reporta una seroprevalencia de 88.2% (16). En la microrregión del Valle del Cesar, Colombia, se encontró una seroprevalencia de 68% en vacas, mucho más alto que en los bovinos de nuestro estudio (35). Montiel et al. (6) afirman que la prevalencia total para México es de 20,8%; mientras que para el ganado de cría 27,4 %, vacas cruzadas 20,9%, y vacas con antecedentes de aborto 20%.
Anticuerpos a N. caninum en búfalos han sido reportados en diversos países, con seropositividades que varían desde 0% a 71% (4).En ganado cebú y sus cruces en sistemas extensivos se encontró solo el 1.5% de animales con anticuerpos a N. caninum en la Amazonía peruana (4).Los animales infectados además de disminuir la producción láctea, pueden aumentar el consumo diario de materia seca hasta 2,2kg, debido a que disminuyen la capacidad de conversión y los animales que han abortado están más predispuestos a repetir el aborto en una próxima gestación (8).
Los resultados del presente estudio evidencian una elevada seroprevalencia a Leptospira sp. y Neospora caninum en bovinos y bubalinos en el Departamento de Caquetá y que aún existen rebaños afectados por Brucella abortus a pesar de los programas de control establecidos. Por otra parte, en todos los puntos de venta de búfalos se encontraron animales seropositivos a las tres entidades investigadas, lo que puede comprometer la situación sanitaria de los rebaños de ambas especies una vez introducidos en estos. Es necesario continuar investigando las implicaciones sanitarias de los rebaños mixtos (bovinos y bubalinos) y las medidas para contrarrestar sus efectos.
REFERENCIAS
1. Contreras AM, Figueredo GM, Carrillo AC. Actualización de la Neosporosis bovina. Conexión Agropecuaria. 2012;2(1):49-66.
2. Baquero MP, Gómez AP, Hernández RP. Aspectos moleculares relevantes de las proteínas de patogenicidad de Leptospira sp. Rev Med Vet. 2010;19:101-11.
3. González R, Maranda L, Romero JJ. Efectos de la vacunación anti-leptospira en bovinos lecheros sobre la producción de anticuerpos anti-leptospira en trabajadores de lecherías de cuatro zonas de Costa Rica. Rev Costarric Salud Pub. 2007;30:39-45.
4. Jara JV, Chávez AV, Casa EA, Sánchez NP, Moreno JL, Malik M. Determinación de anticuerpos contra Neospora caninum en búfalos de agua (Bubalus bubalis) en la Amazonía peruana. Rev Inv Vet Perú. 2011;22(1):61-65.
5. Sánchez CY, Pedroso M, Cuello S. Simultaneidad serológica de Neospora caninum con Brucella abortus y los virus de la Rinotraqueítis Infecciosa Bovina y Diarrea Viral Bovina en bovinos pertenecientes al Estado de Hidalgo, México. Rev Salud Anim. 2012;4(2):95-100.
6. Montiel PT, Romero SD, García VZ, Medina EL, Cruz VC. Neosporosis bovina en ranchos ganaderos de la zona norte del Estado de Veracruz, México. Trop Subtrop Agrosystems. 2011;13(3):469-479.
7. Vega LO, Falcón NP, Casas EA. Prevalencia de Neospora caninum en perros pastores de una empresa ganadera de la sierra sur del Perú. Rev Inv Vet Perú. 2010;21(1):80-86.
8. Da Silva CL. Inquérito Sorológico de Neospora caninum em rebanhos bovinos leiteiros no Município de Parauapebas, Mesorregião Sudeste do Estado do Pará: (Tese Mestre).Universidade Federal do Pará: 2010. Disponible en: http://www.cienciaanimal.ufpa.br/pdfs/CA_Ciencia_Animal /CA_CLOVIS_LAURINDO_DA_SILVA.pdf. Consulta: 27 de Octubre de 2013.
9. Aguilar BG. Seroprevalencia y factores de riesgo asociados a brucelosis (Brucella abortus) en ganadería bovina de la zona sur de Veracruz, México: (Tesis Maestría) Colegio de Posgraduados, Institución de Enseñanza en Ciencias Agrícolas. Campus Veracruz. 2010. Disponible en:http://www.biblio.colpos.mx:8080/jspui/bitstream/handle/10521/547/Aguilar_Ballesteros_G_MC_ Agroecosistemas_Tropicales_2010.pdf?sequence=1. Consulta: 27 de Octubre de 2013.
10.Astaiza JMM. Estudio de costo-efectividad del Programa de vacunación contra Brucella abortus en bovinos en el Departamento de Nariño. Rev Colomb Cienc Quím Farm. 2012;41(2):167-186.
11.FEDEGAN. Situación en Colombia de enfermedades bovinas no sujetas al control oficial. Bogotá D.C., Colombia: Sana Martín Obregón & Cia., 2010.
12.Motta JL, Waltero IG, Abeledo MA, Fernández O. Estudio retrospectivo de agentes infecciosos que afectan la reproducción bovina en el Departamento del Caquetá, Colombia. Rev Salud Anim. 2012;34(3):159-164.
13.Motta Giraldo JL, Waltero I, Abeledo MA. Prevalencia de anticuerpos al virus de la diarrea viral bovina, herpes virus bovino 1 y herpesvirus bovino 4 en bovinos y búfalos en el Departamento de Caquetá, Colombia. Rev Salud Anim. 2013;5(3):174-181.
14.Vijayachari P. Leptospirosis: an Emerging Global Public Health Problem. J Biosci. 2008;33(4):557-569.
15.Petrakovsky JV. Incidencia de leptospirosis bovina en América Latina. II Seminario Internacional de Reproducción Bovina y Salud de Hato Leptospirosis, avances en diagnóstico, control y riesgo ocupacional. Auditorio Gobernación de Cundinamarca; 6 y 7 de Septiembre de 2012. Bogotá D.C, Colombia: Universidad Nacional de Colombia. Pg 147-161. 2012.
16.Sepúlveda F, Vallejo N, Valencia L, Henao J, Restrepo L, Berdugo J. Presencia de anticuerpos contra enfermedades infecciosas en Bubalus bubalis en Antioquia y Córdoba. Ver Col Cienc Pec. 2001;14. Suplemento.
17.Viana RB, Fava C, Moura ACB, Cardoso EC, Araújo CV, Monteiro BM, et al. Ocorrência de anticorpos anti-Neospora caninum, Brucella sp. e Leptospira spp. em búfalos (Bubalus bubalis) criados na Amazônia. Arq Inst Biol. São Paulo. 2009;76(3):453-457.
18.Castro V. Soroprevalência da leptospirose em fêmeas bovinas em idade reprodutiva no estado de São Paulo, Brasil. Arq Inst Biol. São Paulo. 2008;75(1):3-11.
19.Ochoa JE. Epidemiología de la leptospirosis en una zona andina de producción pecuaria. Rev Panam Salud Publica. 2000;7(5):325-331.
20.Toro IH. Situación actual de la Leptospirosis en Colombia. II Seminario Internacional de Reproducción Bovina y Salud de Hato: Leptospirosis, avances en diagnóstico, control y riesgo ocupacional. Auditorio Gobernación de Cundinamarca; 6 y 7 de Septiembre de 2012. Bogotá D.C, Colombia: Universidad Nacional de Colombia. Págs. 82-109.
21.Zambrano V. Aproximación epidemiológica, diagnóstico poblacional de leptospirosis en bovinos. II Seminario Internacional de Reproducción Bovina y Salud de Hato: Leptospirosis, avances en diagnóstico, control y riesgo ocupacional. Auditorio Gobernación de Cundinamarca; 6 y 7 de Septiembre de 2012. Bogotá D.C, Colombia: Universidad Nacional de Colombia. Págs. 1-47.
22.De la Peña MA. Estrategias para el control y prevención de la Leptospirosis bovina. II Seminario Internacional de Reproducción Bovina y Salud de Hato: Leptospirosis, avances en diagnóstico, control y riesgo ocupacional. Auditorio Gobernación de Cundinamarca; 6 y 7 de Septiembre de 2012. Bogotá D.C, Colombia: Universidad Nacional de Colombia. Págs. 147-161.
23.Sacramento MC, Morais ZM, Souza GO, Oliveira F, Gonçales AP, Miraglia F, et al. Emprego de estirpes Leptospira spp. isoladas no Brasil na microtécnica de soroaglutinação microscópica aplicada ao diagnóstico da leptospirose em rebanhos bovinos de oito estados brasileiros. Pesq Vet Bras. 2012;32(7):601-606.
24.Rocha da SG. Distribuição de anticorpos para Leptospira sp em búfalos (Bubalus bubalis) da região nordeste do estado do Pará, Brasil. Ciência Animal Brasileira. 2009;Suplemento 1:540-545.
25.Adesiyun AA, Hull-Jackson C, Clarke N, Whittington C, Seepersadsingh N. Leptospirosis in water buffalo (Bubalus bubalis) in Trinidad. J Veterinarski Arhiv. 2009;79(1):77-86.
26.Aznar MN, Samartino LE, Humblet MF, Saegerman C. Bovine brucellosis in Argentina and bordering countries: update. Transbound and Emerg Dis. 2012. Disponible en: http://www.europepmc.org/abstract/MED/. Consulta: 26 de Octubre de 2013.
27.Samartino LE. Estrategias internacionales para el control de la Brucelosis. Brucelosis en Argentina y otros países del Mercosur. Junta de León y Castilla, España. 20 y 21 de Junio de 2007. p. 1-60. Disponible en: http://www.iecscyl.com/aulas/modules/icontent/inPages/brucelosis/textos/3.%20Samartino.pdf. Consulta: 26 de Octubre de 2013.
28.Galiero G. Causes of infectious abortion in the Mediterranean buffalo. Ital J Anim Sci. 2007;6(Suppl. 2):194-199.
29.Calderón A, Ensuncho CF, Rodríguez V. Seroprevalencia de Brucella abortus en búfalos de agua (Bubalus bubalis) en el municipio de Lorica, Córdoba. Rev UDCA Act Div Cient. 2010;1(2):125-132.
30.Lafaurie JF. Congresso Internacional da Carne. International Meat Secretariat-Federaçãoda Agricultura e Pecuária de Mato Grosso do Sul; Campo Grande (MS), Brasil. 8-9 de Junio de 2011. p. 1-49. Disponible en: http://www.famasul.com.br/palestrascongresso/css/images/josefelix.pdf. Consulta: 26 de Octubre de 2013.
31.Suazo Cortez R, Villagómez JA, Martínez DI. First Notification on the presence of brucellosis in water buffalo (Bubalus bubalis) in Mexico by serological tests. African J Microb Res. 2012;6(13):3242-3247.
32.Oviedo T, Betancur C, Mestra A. Estudio serológico sobre neosporosis en bovinos con problemas reproductivos en Montería, Córdoba, Colombia. Rev MVZ Córdoba. 2007;12(1):929-933.
33.Medina LE. Transmisión vertical/horizontal de Neospora caninum en un hato infectado naturalmente (Tesis doctoral). Tecoman, Universidad de Colima, México; Enero de 2008.
34.Dubey JP, Schares G, Ortega-Mora LM. Epidemiology and Control of Neosporosis and Neospora caninum. Clin Microb Rev. 2007;20(2):323-367.
35.Peña L, Rubio DE, Mojica CP, Falquez JL, Avendaño KE. Estudio serológico de DVB, IBR y Neospora en bovinos de la Microrregión del Valle del Cesar. Rev Colomb Microbiol Trop. 2012;2(2).
Recibido: 7-2-2014.
Aceptado: 5-5-2014.