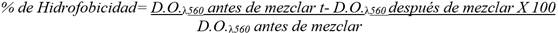INTRODUCCIÓN
La productividad animal está ligada a la existencia o no de microorganismos patógenos en su tracto digestivo. El uso de promotores de crecimiento de tipo antibiótico ayuda a controlar el crecimiento de los mismos, además de mantener un equilibrio deseable en la microbiota intestinal. La prohibición o restricción del uso de muchos de estos aditivos ha llevado a la búsqueda de nuevas alternativas, entre las que se encuentran los probióticos (1).
Un probiótico se define como microorganismos vivos que, al ser ingeridos en las cantidades adecuadas, confiere un beneficio al huésped (2). Entre los beneficios se destacan la estimulación de la inmunidad y la optimización del balance nutricional y microbiano en el tracto gastrointestinal (3).
Dentro de los géneros que se incluyen como posibles probióticos se pueden enumerar Lactobacillus, Bifidobacterium, Enterococcus, Bacillus, Streptococcus y algunas levaduras como Saccharomyces. El género Lactobacillus se reporta como uno de los géneros típicos del ecosistema gastrointestinal de los cerdos (1). A pesar de que estas bacterias se consideran seguras, la Organización Mundial de la Salud (OMS) recomienda que sean sometidas a pruebas, para que su aplicación no tenga efectos secundarios de forma negativa sobre la salud del huésped (4).
Entre las propiedades más importantes que deben cumplir las cepas candidatas a probióticas están: la capacidad de atravesar la barrera digestiva para que se puedan multiplicar y colonizar el intestino, y poseer actividad antimicrobiana, ya que esta característica hace que cuando se administran en cantidad adecuada, adquieran un potencial para generar una barrera frente a los patógenos (3).
La adhesión a células epiteliales se considera como un factor importante para lograr la colonización y prerrequisito esencial para ejercer una actividad probiótica; sin embargo, Ferreira (5) reporta que un rápido crecimiento del microorganismo puede lograr el mismo resultado. Otro requisito indispensable en el desarrollo de un probiótico es que la cepa candidata debe ser estable durante el proceso de producción y distribución, para que llegue viva a su destino y cumpla su función.
Las condiciones gastrointestinales de los animales domésticos son un reto para las bacterias que necesiten colonizarlo; los cambios en el pH, los niveles de temperatura y la secreción de bilis y sales biliares son barreras para un crecimiento adecuado de los microorganismos en el sistema digestivo, de ahí que las evaluaciones in vitro permitirán tener un primer acercamiento al potencial de la cepa como agente probiótico que pueda dar paso a una investigación a nivel de campo (6,7).
El objetivo del presente trabajo fue realizar la caracterización mediante pruebas in vitro de dos cepas de Lactobacillus plantarum aisladas de la mucosa del ciego de cerdos criollos, para su uso posterior como probióticas en la producción porcina.
MATERIALES Y MÉTODOS
Microorganismo
Cepas de Lactobacillus plantarum
Se utilizaron dos cepas de lactobacilos: Lactobacillus plantarum (22 LMC) y Lactobacillus plantarum (41 LMC), aisladas de la mucosa del ciego de cerdos de 30 días de edad, conservadas en el cepario del Laboratorio de Biología Molecular de la Escuela Superior Politécnica Agropecuaria de Manabí, Ecuador.
Se cultivaron en caldo o agar Mann Rogosa Sharp (MRS, DifcoTM EUA) a 37°C durante 24-48 horas, sin agitación; para el crecimiento en agar se empleó una incubadora con una atmósfera de 5 % de CO2. Como medio de conservación a corto plazo se utilizaron medio agar y caldo MRS a 4-8°C con pases mensualmente. Para la conservación a largo plazo, se utilizó caldo MRS con 30 % de glicerol a-20°C.
Cepas patógenas indicadoras
Como microorganismos patógenos indicadores se utilizaron Staphylococcus aureus (ATCC 6538), Escherichia coli (ATCC 11229), Salmonella sp. (ATCC 6539) y Listeria monocytogenes (ATCC 15313), obtenidos de la colección de cultivos del Centro Nacional de Sanidad Agropecuaria (CENSA), Cuba. Los aislados se conservaron a -20°C en caldo BHI (Brain Heart Infusion Difco ®, EUA).
Crecimiento en condiciones hostiles. Condiciones de crecimiento
A diferentes pH: las cepas aisladas se cultivaron en caldo MRS, al cual se le ajustó el pH inicial a pH 3,4; 4; 5,4; 6,7; 7,5. Los cultivos se incubaron a 37°C durante 24-48 horas.
A diferentes temperaturas: las cepas se cultivaron en caldo MRS y se incubaron a 15, 30, 37 y 45oC durante 24-48 horas.
El crecimiento de las cepas se determinó por medición de la absorbancia (D.O.) en un espectrofotómetro (T90+ UV/ VI; PG Intruments, Ltd) a una longitud de onda (λ) de 560 nm. Para determinar la viabilidad de las cepas evaluadas a pH ácido de 3,4 se realizó el conteo celular mediante la técnica de diluciones seriadas en agua peptonada; posteriormente, se sembraron en placas con agar MRS y se incubaron bajo condiciones anaeróbicas a 37°C por 48 horas.
Capacidad de acidificación del medio: las cepas se cultivaron en tubos cerrados con caldo MRS durante 24 horas a 37°C bajo condiciones estáticas; se tomaron muestras para medir el pH de los cultivos.
Funcionalidad de las cepas de L. plantarum
Para la ejecución de los ensayos de resistencia al jugo gástrico artificial y a sales biliares, las cepas de L. plantarum crecieron en caldo MRS por 24 horas. Después del crecimiento, se centrifugaron a 750 x g por 15 minutos, a 4oC (Beckman GS -6R). El sobrenadante se descartó y el concentrado de células se resuspendió en caldo MRS.
El concentrado celular se ajustó a una D.O. de 0,9 ± 0,2U, mediante medición a 560 nm (D.O.λ 560nm) en espectrofotómetro. El concentrado de cada cultivo se utilizó para realizar el ensayo de resistencia a jugo gástrico y a sales biliares, según lo descrito por Techima (8).
Ensayo de resistencia a jugo gástrico artificial
El 5 % del concentrado celular de la cepa seleccionada se inoculó en 10 mL de jugo gástrico artificial (2 g/L NaCl, pepsina 3,2 g/L (Merck KGaA, Alemania), pH 2,5), de acuerdo con lo reportado por Neumann (9). Posteriormente, se incubaron a 37oC y el conteo de células viables se efectuó a 0, 60 y 90 min. La tolerancia se estimó al comparar los conteos de células viables en MRS con y sin jugo gástrico artificial.
El porcentaje de sobrevivencia se calculó según lo descrito por Kociubinski et al. (10) donde:
R= (log UFC/mL CJG) / (log UFC/mL SJG) x 100, a los 90 minutos de tratamiento. Los resultados se basaron en el cálculo de las medias de tres experimentos independientes. Las cepas se clasificaron como resistentes por encima del 67 % (R), tolerantes entre 34,0 - 66,9 % (T) y sensibles por debajo de 33,9 % (S).
Ensayo de resistencia a sales biliares
Se inoculó el 5 % del concentrado celular ajustado en caldo MRS con y sin 0,3 % de sales biliares (Bacto-Oxgall, Difco ®, EUA). Todas las variantes se incubaron a 37oC y se midió el crecimiento celular (D.O.λ560nm) mediante un espectrofotómetro, a intervalos de dos horas, hasta las 24 horas de incubación (11). Una bacteria se considera resistente a las sales biliares cuando presenta D.O.λ560 nm ≥0,3 después de 3h de incubación en presencia de 0,3 % de sales biliares. Se determinó el porcentaje de sobrevivencia según lo descrito por Kociubinski et al. (10) donde: R= (Log UFC/ml CSB 0,3%) / (Log UFC/ml MRS) x 100, a las tres horas de tratamiento.
Las cepas se clasificaron como resistentes por encima del 68 % (R), tolerantes entre 34,0 - 66,9 % (T) y sensibles por debajo de 33,9 % (S).
Determinación de antagonismo de Lactobacillus plantarum ante microorganismos patógenos por la técnica de mota en césped
La actividad antagonista de dos cepas Lactobacillus plantarum se evaluó mediante el ensayo de difusión en doble capa de agar, como se describe por Teixeira et al. (12).
Cada cepa se cultivó en caldo MRS durante 18 horas para obtener 109 unidades formadoras de colonias (UFC/mL). A partir de estos cultivos, se colocó una cantidad de 5 μL en placas que contenían agar MRS. Después de la incubación, durante 24 horas en condiciones anaerobias, las bacterias crecidss se inactivaron por exposición a vapor de cloroformo durante 30 minutos; después, el cloroformo residual se dejó evaporar durante un periodo de igual tiempo.
La revelación de la presencia de sustancia antagonista se realizó recubriendo la placa con una capa superpuesta de 3,5 mL del medio BHI agar semisólido (0,7 %) con 100 μL de la bacteria indicadora activada previamente (108-109UFC/mL), respectivamente.
La actividad de antagonismo para el crecimiento microbiano de los patógenos evaluados se verificó por la formación de zonas transparentes alrededor de las colonias mayores de 1 mm (Halo de Inhibición, HI), que se midieron con un pie de rey digital (Digimatic Caliper, Mitutoyo, Japón). A cada valor se le restó el diámetro de los cultivos de las bacterias productoras.
Determinación de hidrofobicidad
Se determinó la hidrofobicidad superficial de las dos cepas de L. plantarum mediante la medición de la afinidad por el disolvente orgánico de las células cultivadas en sistema de dos fases agua-disolvente orgánico, como medida predictiva de su capacidad de adhesión a epitelios, para determinar, a través de porcentajes de hidrofobicidad, la tendencia a la adhesión epitelial (mayor porcentaje de hidrofobicidad, mayor adherencia). Cada una de estas cepas crecidas como cultivo fresco en caldo MRS a 37ºC se lavaron con solución tampón de fosfato salino (PBS) y se ajustaron a una densidad óptica de 0,6-0,7 a 560 nm (D.O.λ560nm) y se mezclaron con la misma cantidad de xileno, a temperatura ambiente. Después de un tiempo de separación de 60 min, se midió la absorbancia mediante la lectura de D.O.λ 560nmde la fase acuosa.
El porcentaje de hidrofobicidad se calculó utilizando la ecuación descrita por Gutiérrez et al. (1).
La actividad de hidrofobicidad de las cepas evaluadas se clasificó como alta (51-100 %), media (30-50 %) y baja (0-29 %), según lo propuesto por Nader-Macías (13).
Ensayos de autoagregación
Los ensayos de autoagregación se realizaron según lo descrito por Kos et al. (14). Las dos cepas de L. plantarum se cultivaron en medio MRS durante 18 horas a 37 ° C en condiciones anaeróbicas; se centrifugaron a 5500 x g durante 15 min, se lavaron dos veces y se resuspendieron en PBS hasta una concentración final de 109 UFC/mL. Las suspensiones bacterianas (4 mL) se agitaron durante 10 segundos y se determinó la autoagregación después de cinco horas de incubación a temperatura ambiente. Para ello, se transfirieron 0,1 mL de la fase superior de la suspensión a un nuevo tubo que contenía 3,9 mL de PBS y se midió la densidad óptica a 600 nm (D.O.600nm) a los tiempos 0 (D.O. 0) y después de 5 h (D.O. 5) (Multiskan Spectrum Thermo Científico). El porcentaje de autoagregación se calculó mediante la ecuación:
Ensayo cuantitativo para la producción de peróxido de hidrógeno
La producción de peróxido de hidrógeno se cuantificó por volumetría de óxido-reducción, de acuerdo con lo reportado por Santos et al. (15). Los lactobacilos se cultivaron en 10 mL de caldo MRS por 18 horas a temperatura de 37oC en tubos con tapas de roscas y alcanzaron una densidad óptica de 0,9 (109 UFC.mL-1). Los cultivos se centrifugaron a 750 xg por 25 min a 4°C. Posteriormente, a los sobrenadantes obtenidos se les adicionó 90 mL de agua destilada estéril, se homogenizaron y se tomaron 25 mL de las mezclas que se colocaron en frascos de 100 mL. Se le adicionaron 25 mL ácido sulfúrico (H2SO4, 10 %) y la preparación se tituló con KMnO4 0,1 M. El punto final de la titulación fue el punto en el cual un color violeta suave aparece por 15 segundos antes de la decoloración. Como control positivo se utilizó una cepa de referencia de Lactobacillus acidophilus (ATCC 4356). Cada mL de KMnO4 0,1 M es equivalente a 1,701 mg de H2O2 (16). Los resultados se expresaron en g.L-1
Ensayo cuantitativo para la producción ácido láctico
La producción de ácidos orgánicos por los lactobacilos (principal: ácido láctico) se determinó por la titulación ácido-base, según Santos et al. (15). Una alícuota de 1 mL de los sobrenadantes de los cultivos incubados se diluyó en 9 mL de agua destilada estéril y se homogeneizaron. Posteriormente, la mezcla se tituló con NaOH 1M y se utilizó como indicador la fenolftaleína. Las cantidades de ácidos orgánicos equivalentes están dadas por el consumo de NaOH 1M en mL. Cada mL de NaOH 1M equivale a 90,08 mg de ácido láctico. La cepa de referencia L. acidophilus (ATCC 4356) se utilizó como control y los resultados se expresaron en g.L-1.
Susceptibilidad a agentes antimicrobianos
Se utilizó el método modificado de difusión en disco impregnado (Sensidisc DME®, Sao Paulo, Brasil). Los antimicrobianos utilizados fueron: ceftriaxona (30 μg), ciprofloxacina (5 μg), eritromicina (15 μg), gentamicina (10 μg), meropenem (10 μg), oxacilina (1 μg), penicilina G (10 μg), sulfonamidas (300 μg), vancomicina (30 μg), amicacina (30 μg), amoxicilina (10 μg), ampicilina (10 μg), cefalexina (30 μg), cefalotina (30 μg).
Una alícuota de 0,1- 0,2 mL de cada cepa, correspondiente a una concentración celular de 108-109 UFC/mL, se distribuyó en placas de Petri que contenían agar MRS para Lactobacillus plantarum. Las cepas evaluadas se clasificaron para cada uno de los antibióticos como sensibles (S), moderadamente sensibles (MS) y resistentes (R), de acuerdo con Charteris et al. (17).
Análisis estadístico
Todos los ensayos se realizaron por triplicado. Para el análisis de los resultados se empleó el Software estadístico INFOSTAT versión 1 (2017). Para el tratamiento estadístico de los datos se realizaron análisis de varianza según diseño completamente aleatorizado; para verificar diferencias se utilizó la prueba de comparación de Duncan (18).
RESULTADOS Y DISCUSIÓN
En la Tabla 1 se muestra el crecimiento de las dos cepas de Lactobacillus plantarum a diferentes pH a las 48 horas de incubación. Los mejores resultados se observaron desde pH 5 hasta pH 7,5; los mejores resultados bajo estas condiciones se obtuvieron con la cepa L. plantarum 22 LMC; además, a pH ácido de 3,4 mostró una viabilidad de 1,3 x10 8 UFC/mL, por lo que en las condiciones extremas evaluadas reveló su resistencia. Jurado y Jarrin (7) reportaron que dos cepas de L. plantarum, aisladas del intestino grueso de cerdos adultos, fueron resistentes en estas condiciones y obtuvieron viabilidades de 1,1 x 1011 UFC/mL a las tres horas de tratamiento.
TABLA 1 Crecimiento de cepas de Lactobacillus plantarum aislados de cerdos a diferentes pH hasta las 48 horas de incubación a 37 0 C. n=3. / Growth of Lactobacillus plantarum strains isolated from pigs at different pH until 48 hours.
| Crecimiento bacteriano (D.O.560nm) | ||||||
|---|---|---|---|---|---|---|
| pH 3,4 | pH 4 | pH 5 | pH 6,7 | pH 7,5 | E.E± | |
| 22LMC | 2,03d | 2,3d | 3,5bc | 4,80a | 4,45a | 0,13 |
| 41LMC | 1,28d | 1,50d | 2,15c | 2, 73c | 2,3c | 0,13 |
Medias con letras distintas indican diferencias significativas (p<0,05)
En la Tabla 2 se muestra que las cepas de L. plantarum crecieron a diferentes temperaturas hasta las 48 horas de incubación; mostraron mayor crecimiento de células viables a temperaturas de 37 y 45ºC (1,3 y 4,5 x 1010UFC/mL, respectivamente) destacándose la cepa 22 LMC. Estos resultados son similares a los obtenidos por Sánchez et al. (19), quienes observaron crecimiento bacteriano de los 17 aislados bacterianos de lactobacilos procedentes del intestino de terneros y mostraron los mayores recuentos de células viables a temperaturas de 37°C. Por otra parte, los estudios de Pérez et al. (20) demostraron que dos cepas de Lactobacillus spp. aisladas de líquido ruminal vacuno presentaron crecimiento en un rango amplio de temperaturas, que van desde los 18ºC hasta los 40ºC; estos resultados le permitieron clasificar a las cepas evaluadas como mesófilas, lo que concuerdan con los resultados del presente trabajo.
TABLA 2 Crecimiento de cepas de Lactobacillus plantarum aisladas de cerdos a diferentes temperaturas hasta las 48 horas de incubación. n=3. / Growth of Lactobacillus plantarum strains isolated from pigs at different temperatures until 48 hours. n=3.
| Crecimiento bacteriano (DO560nm) | |||||
|---|---|---|---|---|---|
| T 15 0C | T 300C | T 370C | T 450C | E.E± | |
| 22LMC | 0,28 | 2,40c | 4,75a | 4,70a | 0,03 |
| 41LMC | 0,25 | 2,48c | 2,59b | 3,00b | 0,03 |
DO: densidad óptica; letras distintas indican diferencias significativas (p<0,05)
Al realizar el tratamiento con jugo gástrico artificial a las dos cepas evaluadas de L. plantarum hasta los 90 minutos, se pudo observar que fueron capaces de sobrevivir en la medida que transcurrió el tiempo (Fig. 1). Se evidenció una disminución de la viabilidad de las cepas en estas condiciones evaluadas que van desde 4,20 - 5,17 log UFC/mL, lo que se debió a las circunstancias drásticas a que fueron sometidas. Asimismo, en la Tabla 3 se pudo constatar que las cepas son resistentes a estas condiciones de jugo gástrico artificial, ya que fueron capaces de traspasar la primera barrera fisiológica del tracto digestivo que corresponde a valores bajos de pH y a la acción de enzimas proteolíticas, en este caso la pepsina.
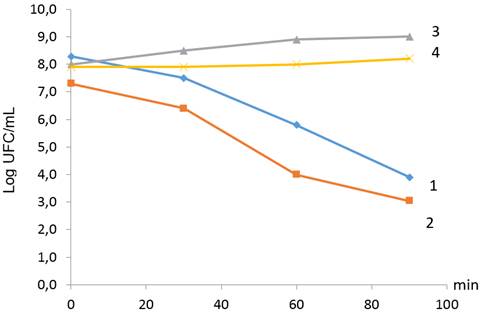
FIGURA 1 Sobrevivencias al jugo gástrico artificial pH 2 (Log UFC/mL) de las cepas de Lactobacillus plantarum hasta los 90 minutos de tratamiento. 1- L. plantarum 22 LMC con jugo gástrico artificial; 2- L. plantarum 41 LMC con jugo gástrico artificial; 3- L. plantarum 22 LMC sin jugo gástrico artificial; 4- L. plantarum 41 LMC sin jugo gástrico artificial. Los datos representan las medias de dos replicas independientes. / Survival of Lactobacillus plantarum strains in the presence of artificial gastric juice at pH 2 (log CFU/mL) after 90 minutes of exposure to treatment. 1- L. plantarum 22 LMC with artificial gastric juice; 2- L. plantarum 41 LMC with artificial gastric juice; 3- L. plantarum 22 LMC without artificial gastric juice; 4- L. plantarum 41 LMC without artificial gastric juice. The data represent the means of two independent replicas.
Song et al. (21) describen que algunas cepas tienen numerosas proteínas de choque-ácido que promueven la sobrevivencia; estas son capaces de sobrevivir a ambientes ácidos extremos. Estos resultados concuerdan con otros estudios que demuestran que las cepas de Lactobacillus permanecen viables cuando se exponen a valores de pH de 2,5-4,0, pero exhiben pérdida de viabilidad a valores de pH más bajos (19).
TABLA 3 Porcentajes de resistencia de cepas de Lactobacillus plantarum aisladas del TGI de cerdos al destete en jugo gástrico artificial y sales biliares al 0,3 %. n=3./ Resistance percentages of Lactobacillus plantarum strains isolated from the TGI of pigs at weaning in artificial gastric juice and bile salts at 0.3%. n = 3
| Resistencia (%) | ||
|---|---|---|
| Jugo gástrico | Sales biliares | |
| 22 LMC | 76,8±0,05 (R) | 90,6±1,3 (R) |
| 41LMC | 64,8±0,03(T) | 63,2± 1,50 (T) |
R- resistente T- tolerante

FIGURA 2 Resistencia a sales biliares de las cepas de Lactobacillus plantarum aisladas de cerdos. L-Crecimiento en presencia de Oxgall al 0,3 %; C- Control crecimiento L. plantarum sin sales biliares./ Resistance to bile salts of Lactobacillus plantarum strains isolated from pigs. L-Growth in the presence of Oxgall 0,3 %; C- Growth control L. plantarum without bile salts.
En la Fig. 2 y Tabla 3 se muestran los resultados del tratamiento con concentración de sales biliares de 0,3 % de Oxgall en las cepas de L. plantarum a las tres horas. Fueron resistentes a esta concentración evaluada, por lo que se demuestra que las cepas en estudio pudieran también desconjugar a las sales biliares, ya que son capaces de producir la enzima conocida como sal biliar hidrolasa (SBH), que cataliza la hidrólisis de las sales biliares conjugadas en ácidos biliares, glicina y taurina (22).
Las sales biliares actúan como detergentes y desestabilizan los lípidos presentes en la membrana citoplasmática. Esta situación trae como consecuencia la formación de poros que perturban la integridad y la fisiología de las células, lo cual puede provocar la muerte. Es probable que en las primeras horas algunas células se afecten mientras se induce la síntesis de la enzima SBH, la que posteriormente actuará en la hidrólisis de las sales biliares conjugadas (SBC) (22). Con la disminución de la concentración de las SBC en el medio, las células comienzan a multiplicarse, por lo que se observó un crecimiento a las 6 y 24 h (1,5-2,3x109 y 6,4-8,0 x 1011 UFC/mL, respectivamente)
Según Brizuela (23), esta capacidad de crecer en presencia de altas concentraciones de bilis a las que se pueden encontrar en el intestino (0,15 %), es un parámetro importante para los microorganismos que componen los preparados administrados por vía oral a animales. Esto les permite pasar a través del tracto gastrointestinal sin sufrir alteraciones en su comportamiento fisiológico. Un factor que puede favorecer la sobrevivencia de estos microorganismos in vivo en el duodeno es la presencia de alimentos, ya que las bacterias pueden no estar expuestas a las sales biliares y de esta forma se podría evitar la toxicidad sobre las membranas.
Cuando se realizó la prueba de inhibición in vitro ante los cuatro patógenos indicadores, se demostró la acción antimicrobiana de las cepas de Lactobacillus plantarum evaluadas (Tabla 4; Fig. 3) con diferencias significativas (p<0,05) entre ellas, destacándose la cepa 22LMC con los mejores resultados. Para la aplicación en los animales de las BAL, la actividad antagonista es un criterio fundamental para la selección de nuevas cepas, ya que reducen la frecuencia de las infecciones intestinales y de las mucosas (21,24).
TABLA 4 Resultados de la actividad antagonista de dos cepas de Lactobacillus plantarum frente a cepas indicadoras patógenas (Medias de los HI en mm, n=3)./ Results of the antagonistic activity of Lactobacillus plantarum strains against the pathogenic indicator strains (Means of HI in mm, n = 3).
| Cepas indicadoras | ||
|---|---|---|
| 22 LMC | 41 LMC | |
| 32,0 ±0,15a | 25,09 ±0 ,15b | |
| 31,3 ±0,03 a | 20,3 ± 0,15 b | |
| 32,5 ±0,04 a | 15,70 ± 0,56 b | |
| 28,09±0,15 a | 12,85 ± 0,56 b | |
HI: halos de inhibición; letras distintas indican diferencias significativas p<0,05 por filas
Es importante destacar la actividad antagonista de las cepas evaluadas ante Escherichia coli y Salmonella sp., agentes infecciosos que afectan a los cerdos posdestete.

FIGURA 3 Prueba de antagonismo microbiano de la cepa Lactobacillus plantarum 22 LMC frente a diferentes patógenos (halos de inhibición): A-Escherichia coli; B-Staphylococcus aureus; C-Salmonella sp.; D-Listeria monocytogenes./ Microbial antagonistic test of Lactobacillus plantarum strains against different pathogens (inhibition halos): A- Escherichia coli; B- Staphylococcus aureus; C- Salmonella sp.; D-Listeria monocytogenes.
En este sentido, se reporta por varios autores (25,26) el diagnóstico de estos agentes, donde los signos clínicos, las necropsias y los resultados de laboratorio sugieren que Escherichia coli enterotoxigénica (ETEC) coloniza el intestino de muchos lechones justo después del destete, lo que ocasiona las típicas alteraciones celulares y la diarrea acuosa y amarilla. Sin embargo, los cambios en la fisiología digestiva del lechón hacen que, en esta fase, puedan actuar tanto aquellos agentes que afectan principalmente al intestino delgado como otros que ejercen su acción patógena, principalmente sobre el intestino grueso (26). Esto incluye la edad del lechón, las circunstancias de aparición de la enfermedad y manifestaciones como son el material fecal alrededor del perineo, la diarrea, la deshidratación y la muerte. Las estrategias para disminuir estas causas son numerosas y dentro de ellas se describen la administración de cultivos bacterianos como probiótico de Lactobacillus, para inhibir la adhesión de ETEC, por lo que es una alternativa importante al uso de antibióticos (27).
Al cuantificar algunas de las sustancias inhibitorias producidas por las cepas evaluadas de L. plantarum (Tabla 5), se pudo constatar que las dos cepas produjeron peróxido de hidrógeno y ácido láctico; sin embargo, se destacó la cepa 22 LMC con mayor cantidad de este último. Hay que destacar que las cantidades de H2O2 producidas por las cepas del presente trabajo son semejantes a las encontradas en otros estudios que analizaron propiedades probióticas de lactobacilos (15). La producción del peróxido de hidrógeno por lactobacilos representa uno de los mecanismos más importantes contra la colonización por microorganismos patogénicos y oportunistas (28).
En cuanto a la producción de ácido láctico por la cepa 22LMC de L. plantarum, coinciden con los halos de inhibición encontrados ante diferentes patogénos evaluados en el presente trabajo. Esta característica incide en la reducción del pH intestinal, lo cual se considera el principal factor en la inhibición del desarrollo de enteropatógenos como Salmonella sp. y Escherichia coli. Además, la acidificación del lumen intestinal acelera las reacciones bioquímicas de la digestión.
Se describe que los efectos perjudiciales de esta molécula en los microorganismos sensibles se resumen en alteración de la permeabilidad celular, alteración del potencial de membrana, así como descenso del pH intracelular que ocasiona la alteración de funciones celulares importantes (19). Por otra parte, las BAL se caracterizan por la producción de ácido láctico a niveles elevados. Varios autores refieren que las BAL son los microorganismos que más se utilizan como probióticos y dentro de este grupo las bacterias homofermentativas, donde hay un predominio de la producción de ácido láctico. Este ácido es altamente palatable e incide directamente en la eliminación de bacterias indeseables a nivel del tracto gastrointestinal.
TABLA 5 Determinación de H2O2y ácido láctico por las cepas de Lactobacillus plantarum./ Determination of H 2 O 2 and lactic acid by Lactobacillus plantarum strains.
| Cepas de |
pH | Ácido láctico (g.L-1) | H2O2 (g.L-1) |
|---|---|---|---|
| 22 LMC | 3,51 ± 0,11a | 2,68 ± 0,04 a | 0, 28 ± 0,02a |
| 41 LMC | 4,70 ± 0,10b | 1,05 ± 0,04b | 0, 20 ± 0,02a |
|
|
3,77 ± 0,01a | 2,50± 0,04a | 0,67 ± 0,11a |
Los valores presentados corresponden a la media ± error estándar de tres experimentos independientes. Medias con letras diferentes en la misma columna son significativamente diferentes (p<0,05 por One-way ANOVA, prueba de Duncan). Control positivo: L. acidophilus ATCC 4356.
La capacidad de adhesión a las células epiteliales del intestino constituye un criterio importante a tener en cuenta para la selección de cepas con potencial probiótico. Esta actividad de adhesión a componentes de la mucosa gastrointestinal es considerada como una propiedad fundamental para la colonización y para manifestar los efectos beneficiosos sobre la salud que proveen los probióticos en su interacción con el huésped, de ahí que la autoagregación de cepas probióticas parece jugar un papel fundamental en la adhesión al epitelio intestinal (29).
En la Tabla 6 se observan los ensayos de adhesión a xileno solvente no polares y la autoagregación de las cepas evaluadas; también se muestra una fuerte propiedad in vitro dado por los valores encontrados. Algunas características físico-químicas de la superficie celular, como la hidrofobicidad, también pueden afectar a la capacidad de adhesión bacteriana. Durante la caracterización de cepas de Lactobacillus plantarum se muestra un fenotipo de autoagregación. De esta manera, se revela la capacidad para formar agregados visibles tras la agitación vigorosa del cultivo. Así, en este trabajo se observó la correlación entre ciertas propiedades físico-químicas de la superficie celular y la capacidad de adhesión de cepas de Lactobacillus plantarum.
TABLA 6 Resultados a la prueba de adherencia microbiana a hidrocarburo (ensayo de hidrofobicidad) y autoagregación de las cepas de Lactobacillus plantarum. n=3./ Results of the microbial adherence test to hydrocarbon (hydrophobicity test) and autoaggregation of Lactobacillus plantarum strains. n=3.
| Hidrofobicidad (%) | Autoagregación (%) | |
|---|---|---|
| 22L MC | 61,405±1,3a | 85,5± 0,07b |
| 41LMC | 51,85± 0,55b | 81,7±0,02b |
Los valores presentados corresponden a la media ± error estándar de tres experimentos independientes. Medias con letras diferentes en la misma columna son significativamente diferentes (p<0,05 por One-way ANOVA, prueba de Duncan)
El perfil de sensibilidad a antibióticos, de cada una de las cepas seleccionadas, mostró variabilidad en su comportamiento (Tabla 7). Las cepas de L. plantarum mostraron resistencia ante los antimicrobianos como amoxicilina, eritromicina, oxacilina, penicilina y sulfonamida. En este sentido, resultados obtenidos por Laurencio et al. (30) manifestaron que las cepas de Lactobacillus, aisladas de la vagina de vacas lecheras, fueron resistentes a cuatro antibióticos: amikacina, acitromicina, vancomicina y neomicina.
Estas resistencias se han atribuido como un aspecto intrínseco y no transmisible a otras bacterias (20). Sin embargo, no todas las resistencias a los antibióticos en los lactobacilos son intrínsecas; algunos pueden ser codificados por plásmidos, por lo tanto, su resistencia a los antibióticos debe ser cuidadosamente evaluada antes de su uso como probiótico comercial.
Tabla 7 Perfil de sensibilidad a antimicrobianos de las cepas de Lactobacillus plantarum./ Antimicrobial sensitivity profile of Lactobacillus plantarum strains.
| AGENTE ANTIMICROBIANO |
|
|
|---|---|---|
| 22 LMC | 41 LMC | |
| Amikacina | S 22 | S 21 |
| Amoxicilina | R 0 | MS 10 |
| Ampicilina | MS 10 | MS 12 |
| Cefalotina | S 22 | S 24 |
| Ceftriaxone | S 23 | MS 10 |
| Ciprofloxacina | S 32 | S 30 |
| Cloranfenicol | S 17 | S 23 |
| Eritromicina | S 23 | R 0 |
| Gentamicina | S 16 | MS 15 |
| Oxacina | R 0 | R 0 |
| Mepropem | S 30 | S 30 |
| Penicilina | R 0 | R 0 |
| Sulfonamida | S 25 | R 0 |
| Vancomicina | MS 15 | R 22 |
S-sensible; MS-medianamente sensible; R-resistente
Los resultados de las pruebas in vitro realizadas demostraron que las cepas evaluadas poseen características fisicoquímicas y biológicas compatibles con un potencial uso como probiótico: resistencia a pH ácido, sales biliares, buenas propiedades hidrofóbicas, autoagregantes, relación con su capacidad de adhesión al epitelio y actividad antimicrobiana como inhibición del crecimiento de cuatro patógenos. No obstante, para corroborar tales hallazgos hay que continuar los estudios in vivo de estas cepas, en este caso, su aplicación en cerdos al destete.