INTRODUCCIÓN
Los hongos entomopatógenos se encuentran ampliamente distribuidos en la naturaleza y frecuentemente causan epizootias en sus hospedantes. Se distribuyen aproximadamente en más de 100 géneros y se conocen 750 especies, algunas de las cuales presentan interés agronómico como agentes de control microbiano. Además de agentes patógenos de artrópodos, recientemente se ha demostrado que ocupan gran diversidad de nichos ecológicos. Ya se conoce que pueden ser endófitos, antagonistas, colonizadores de la rizosfera, promotores del crecimiento vegetativo (Ramanujam et al., 2014; Lacey et al., 2015; Liu et al., 2016).
El éxito de un programa de manejo integrado de plagas, basado en hongos entomopatógenos, depende de la producción del inóculo para las aplicaciones al campo, la selección de cepas o aislamientos con alta virulencia, el buen crecimiento, la esporulación y la resistencia a condiciones ambientales adversas (García et al., 2015). El desarrollo de alternativas biológicas para el control de organismos nocivos lleva implícito aplicar métodos mediante los cuales se puedan obtener biopreparados masivamente e ir sustituyendo de forma gradual las aplicaciones químicas sobre la base de la efectividad de los medios biológicos aplicados.
Para la producción masiva de estos agentes de control biológico es necesario el estudio de sustratos que sean más eficientes y menos costosos (Amala et al., 2012). Además, se debe trabajar con aislamientos que expresen una alta virulencia para crear fuertes epizootias en el campo, lo que puede resultar de gran utilidad a la hora de su utilización en programas de manejo integrado de plagas.
Uno de los retos en la producción de hongos entomopatógenos es la conservación de la actividad de los conidios antes, durante y después de su aplicación. Para ello, en su formulación han sido utilizados, con resultados satisfactorios, diferentes tipos de aceites, los cuales permiten mantener la viabilidad de los conidios, la estabilidad en el almacenamiento y su actividad residual (Behle y Birthisel, 2014).
Las especies pertenecientes al género Metarhizium causan la enfermedad conocida como “muscardina verde”, y son patógenos facultativos que atacan a un amplio rango de hospedantes (Hu et al., 2014). Su obtención resulta fácil a partir de muestras de suelo (Steinwender et al., 2014).
En la actualidad existe una gran variedad de insecticidas biológicos basados en hongos, siendo uno de los de mayor uso los formulados a base de Metarhizium anisopliae (Metsch.) Sorokin, considerada como la segunda especie de hongo entomopatógena con la que más se ha trabajado respecto a su producción masiva y comercialización como bioplaguicida. Además, el hongo puede estar asociado a la rizosfera de las plantas y estimular diversos procesos en las mismas (Liao et al., 2014), y comportarse como endófito en las raíces (Sasan y Bidochka, 2012).
El presente trabajo tiene por objetivos determinar los requerimientos básicos para la producción masiva y conservación de conidios del aislado Ma-005 de M. anisopliae usando diferentes tipos de aceite.
MATERIALES Y MÉTODOS
El trabajo se realizó en el Laboratorio de Sanidad Vegetal de la Facultad de Agronomía ubicado en la Universidad Agraria de La Habana, con un aislamiento fúngico de M. anisopliae (Ma-005) conservado en el laboratorio, obtenido de una muestra de suelo de la finca “El Guayabal”, municipio San José de las Lajas, provincia Mayabeque, Cuba.
Efecto de diferentes concentraciones de melaza y levadura torula sobre la producción de biomasa del aislado Ma-005
Las concentraciones de melaza y levadura torula utilizadas en los diferentes tratamientos se muestran en la Tabla 1. Se utilizaron frascos Erlenmeyer de 250 mL a los cuales se les añadió 75 mL de medio de cultivo, posteriormente se taparon con tapones de algodón y gasa para ser esterilizados en autoclave, a 121 ºC durante 20 min. Después de enfriado, cada frasco se inoculó con 2 mL de una suspensión que contenía 9,5 x 108 conidios mL-1, preparada a partir de un cultivo puro del hongo en agua destilada estéril más Tween 80 a una concentración de 0,05 %. Luego de inoculados los frascos se agitaron en una zaranda orbital (WT2 HDL Apparatus) a 150 r. p. m., con una temperatura de 27,3 ± 1,9 ºC, durante 72 h.
Tabla 1 Composición de los medios de cultivo utilizados en la producción de biomasa
| Tratamientos | Melaza (mL L-1) | Levadura torula (g L-1) |
|---|---|---|
| 1 | 10 | 10 |
| 2 | 10 | 20 |
| 3 | 10 | 30 |
| 4 | 20 | 10 |
| 5 | 20 | 20 |
| 6 | 20 | 30 |
Se utilizó un diseño completamente aleatorizado con tres repeticiones por tratamiento. Pasada las 72 h el contenido de los frascos se filtró al vacío en papel de filtro, la biomasa obtenida fue colocada en una estufa a 80 ºC durante 24 h, determinándose la cantidad de masa seca, la cual se expresó en g L-1. Los datos se procesaron mediante un análisis de varianza de clasificación simple, comparándose las medias a través de la prueba de Tukey con un nivel de significación del 5 %.
Dinámica de producción de biomasa en medio líquido
El procedimiento para el montaje, incubación y evaluación del experimento fue similar al descrito en el ensayo anterior, excepto que el medio líquido utilizado estuvo constituido por melaza 20 g L-1 y levadura torula 30 g L-1. El medio se inoculó con una suspensión de 6,32 x 108 conidios mL-1, determinada mediante la cámara de Neubauer. Las evaluaciones se realizaron desde las 24 hasta las 96 h, considerándose como tratamientos los diferentes momentos de evaluación, con un intervalo de 24 h. Se fueron desmontando tres repeticiones del tratamiento y posteriormente filtradas al vacío en papel de filtro, luego se pusieron en estufa a 80 ºC durante 24 h determinándose la cantidad de masa seca, la cual se expresó en g L-1. Los datos se procesaron mediante un análisis de varianza de clasificación simple, comparándose las medias a través de la prueba de Tukey con un nivel de significación del 5 %.
Producción de conidios en diferentes sustratos sólidos
En la producción de conidios se utilizaron cuatro sustratos sólidos: arroz, millo, soya y maíz partido. Cada uno de estos sustratos se lavaron por separado tres veces con agua común para eliminar la mayor cantidad posible de impurezas. Posteriormente se vertieron por separado en un recipiente que contenía agua común y se dejó en remojo durante 1 h. Luego se dejaron escurrir durante 30 min y después, se colocaron 100 g de cada uno en bolsas de polipropileno, las cuales se sellaron y se esterilizaron en autoclave, a 121 ºC por 20 min. Las bolsas se inocularon con 5 mL de una suspensión de conidios, preparada con un tubo de cultivo puro del hongo, con una concentración de 2,5 x 108 conidios mL-1 y se incubaron a 25 ± 1 ºC. Luego de 14 días de incubación, el contenido de las bolsas se colocó sobre bandejas para su secado, lo cual se realizó en un local con deshumidificador y aire acondicionado, logrando un contenido de agua o humedad del sustrato colonizado inferior al 15 %, valor que se determinó con una balanza infrarroja Sartorius.
En el ensayo se utilizó un diseño completamente aleatorizado, con cuatro tratamientos y cuatro repeticiones, y se evaluó la producción de conidios por gramo de sustrato colonizado. Para esto se tomó 1 g de dicho sustrato en Erlenmeyers de 250 mL al cual se le adicionó un volumen de 100 mL de agua destilada más Tween 80 a una concentración de 0,05 %, y se agitó en un agitador Vortex durante 10 min para la separación de los conidios, los que se contaron en una cámara de Neubauer, con ayuda de un microscopio NLCD-307 (40X) y del Software-NMS diseñado para el sistema Windows CE5.0. Los datos obtenidos se transformaron según la expresión Log10 X, y los resultados se expresaron en conidios g-1 de sustrato. Los resultados se procesaron mediante un análisis de varianza de clasificación simple, comparándose las medias a través de la prueba de Tukey con un nivel de significación del 5 %.
Conservación del polvo conidial del aislado Ma-005
Para este ensayo se partió de un cultivo del hongo sobre arroz, cuando este estuvo bien colonizado, el contenido de las bolsas se colocó sobre bandejas para su secado, lo cual fue realizado en un local con deshumidificador y aire acondicionado, logrando un contenido de humedad del sustrato inferior al 15 %, valor determinado con una balanza infrarroja Sartorius. Posteriormente, el arroz colonizado y seco se sometió a un proceso de tamizado con tamices de 250 y 100 μm. Del polvo conidial se tomó un gramo y se suspendió en 100 mL de aceite mineral, parafina, diesel y soya, previamente esterilizados en autoclave a 121 ºC durante 20 min, en frascos de color ámbar, los cuales se colocaron a una temperatura de 25 ± 1 ºC.
Se utilizó un diseño completamente aleatorizado con tres repeticiones de los cinco tratamientos. La viabilidad de los conidios se evaluó antes de suspenderlos en los aceites, a la 1 h, a las 24 h, a los 15 días, a los 30 días y a los 6 meses. Para realizar las evaluaciones, se tomó 1 mL de cada una de las suspensiones de los diferentes tratamientos y se preparó una suspensión de conidios en 9 mL de agua destilada estéril más Tween 80 a una concentración de 0,05 %. De la suspensión se tomó 1 mL con una jeringuilla estéril y se extendió en placas Petri contentivas de medio Agar agua al 2 %. Se evaluó la germinación a las 24 h, contando los conidios germinados de un total de 50, con ayuda de un microscopio NLCD-307 (400X) y del Software-NMS diseñado para el sistema Windows CE5.0.
Posteriormente se calculó el porcentaje de germinación y elaboró un gráfico de línea con los porcentajes obtenidos en los diferentes momentos de evaluación. Consecutivamente, los datos obtenidos en la viabilidad a los 30 días y 6 meses fueron transformados según la expresión asen (p)½ y procesados mediante un análisis de varianza de clasificación simple, incluyendo los resultados de la evaluación del polvo conidial. Las medias fueron comparadas a través de la prueba de Tukey con un nivel de significación del 5 %.
RESULTADOS Y DISCUSIÓN
Efecto de diferentes concentraciones de melaza y levadura torula sobre la producción de biomasa del aislado Ma-005
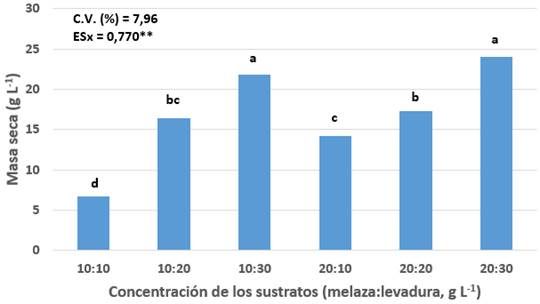
El análisis estadístico realizado demostró que existen diferencias altamente significativas entre los tratamientos. En la Figura 1 se aprecia que en todos los tratamientos el hongo logró la formación de biomasa. De las concentraciones de melaza y levadura utilizadas, las mejores resultaron ser las de 10:30 y 20:30, donde se registró 21,78 y 24,00 g L-1 de masa seca, respectivamente y no difieren estadísticamente entre sí. Le siguieron en orden las concentraciones de 10:20 y 20:20 que no difieren entre sí; mientras que la menor cantidad de masa seca se obtuvo en 10:10 con 6,67 g L-1.
Estos resultados demostraron la importancia de las concentraciones de los sustratos en la producción de biomasa del hongo. En los hongos, se necesita que la fuente de carbono esté en exceso y el contenido de nitrógeno sea el factor limitante del crecimiento, lo que desencadena el proceso esporulativo (Rao, 2007).
La melaza y la levadura torula son sustratos de bajo costo disponibles en Cuba, lo cual es un factor clave para el éxito en la comercialización de un producto fúngico de acuerdo con Keyser (2010).
Dinámica de producción de biomasa en medio líquido
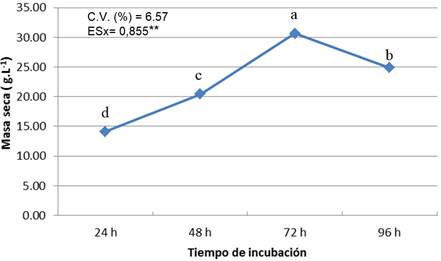
El análisis estadístico muestra que existen diferencias altamente significativas entre los distintos tratamientos. En la Figura 2 se observa que a las 24 h la producción de biomasa es de 14,11 g L-1, y a partir de este momento hay un aumento en la producción de la misma; a las 48 h hubo un incremento de masa seca hasta los 20,44 g L-1 y comienza la fase exponencial hasta las 72 h donde se encontró la mayor cantidad de masa seca (30,67 g L-1), pero después de este momento comienza a disminuir.
Barajas et al. (2009) obtuvieron en un medio a base de levadura y sacarosa y fermentación sumergida, gran producción de propágulos en 60 h, resultado similar al obtenido en este trabajo ya que a partir de las 48 h se obtiene una cantidad de biomasa apreciable y comienza la fase exponencial hasta las 72 h, por lo que a las 60 h puede ser el momento idóneo para pasar al sustrato sólido.
Producción de conidios en diferentes sustratos sólidos
El análisis estadístico mostró que existen diferencias altamente significativas entre los tratamientos. En la Tabla 2 se observa que el mejor sustrato resultó ser el arroz, aunque no difiere del millo y a su vez, el millo no difiere del maíz. Sin embargo, la soya difiere estadísticamente del resto de los sustratos.
Tabla 2 Producción de conidios (conidios g-1 x 108) en diferentes sustratos sólidos, a los 14 d
| Sustratos | X. orig. | X. transf. |
|---|---|---|
| Millo | 7,75 | 8,885 ab |
| Maíz | 6,21 | 8,789 b |
| Arroz | 8,99 | 8,953 a |
| Soya | 3,61 | 8,553 c |
| C.V. ( %) | 0,72 | |
| ESx | 0,010** |
Medias con letras iguales no difieren estadísticamente, según Tukey (p≤ 0,05)
La utilización del arroz como sustrato sólido ha resultado favorable en el caso de otras especies fúngicas (Amala et al., 2012; Kumar y Naem, 2014). Por otro lado, Latifian et al. (2013) y Jaronski (2014) demostraron que el arroz es el mejor y más barato sustrato sólido para la producción de conidios. También Sivakalai y Ramanathan (2014) lograron la mayor producción de conidios tanto en caldo de arroz como sobre granos de arroz enteros.
Conservación del polvo conidial del aislado Ma-005
Como se puede apreciar en la Figura 3 se evidenció una tendencia similar en la conservación de los conidios para los diferentes tratamientos, desde la 1 h de evaluado hasta los treinta días, con una viabilidad por encima del 95 %. A partir de los 30 días se produjo una disminución de la germinación y a los seis meses se registró el menor valor en aceite diésel, con 72 %, sin embargo, la mayor viabilidad se apreció en aceite mineral con valores superiores al 85 %.
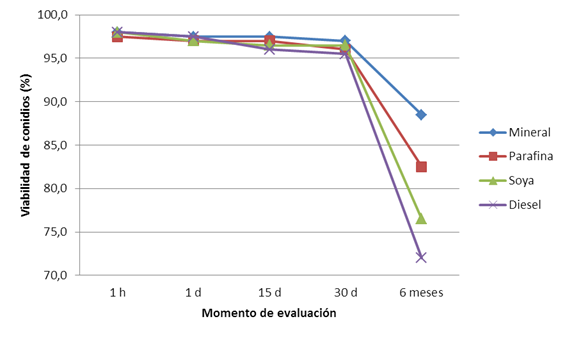
Figura 3 Viabilidad de conidios del aislado Ma-005 de M. anisopliae conservado en diferentes aceites, a temperatura ambiente
Los resultados de la viabilidad de los conidios evaluados en dos momentos (a los 30 días y a los seis meses) se muestran en la Tabla 3. El análisis estadístico realizado al primer momento no mostró diferencias significativas entre los tratamientos y se registró para todos los casos una viabilidad por encima del 90 %. A los seis meses, el análisis mostró diferencias altamente significativas, es de destacar que el porcentaje de germinación de los conidios fue superior al 70 %. El mayor porcentaje se obtuvo en polvo conidial, no difiriendo del aceite mineral que a su vez no difiere de parafina. Sin embargo, el menor porcentaje de germinación fue en aceite diésel, sin diferencias respecto al aceite de soya.
Tabla 3 Viabilidad de conidios (%) del aislado Ma-005 de M. anisopliae conservado en distintos aceites
| Aceites | 30 días | 6 meses | ||
|---|---|---|---|---|
| X. orig. | X. transf. | X. orig. | X. transf. | |
| Polvo conidial* | 100,00 | 0,5236 | 90,50 | 0,5013a |
| Mineral | 97,00 | 0,5166 | 88,50 | 0,4966ab |
| Parafina | 96,00 | 0,5143 | 82,50 | 0,4821bc |
| Soya | 96,50 | 0,5155 | 76,50 | 0,4672cd |
| Diesel | 95,50 | 0,5131 | 72,00 | 0,4561d |
| C.V. ( %) | 4,36 | 2,34 | ||
| ESx | 0,011NS | 0,006*** | ||
*- Polvo puro, evaluada la viabilidad antes de mezclar con los aceites
Medias con letras iguales no difieren significativamente, según Tukey (p≤ 0,05)
Los resultados obtenidos para parafina y diésel concuerdan con lo referido por Desphande et al. (2003) quienes, al evaluar la viabilidad de los conidios con mezcla de estos aceites y también puros, mejoraron dicha viabilidad.
Barajas (2010) evaluó, entre otros, aceite mineral, diésel y soya, para la conservación de conidios de un aislado de M. anisopliae y comprobó que los mismos mantuvieron una viabilidad superior al 60 % a los 6 meses. Igualmente, Camargo et al. (2014) señalaron que las formulaciones en aceites resultan apropiadas para las suspensiones de conidios lo que ayuda a la protección del hongo contra condiciones ambientales adversas, así como a inducir una mejor adhesión de la estructura fúngica en la superficie de los artrópodos.
CONCLUSIONES
El aislado Ma-005 de M. anisopliae puede ser reproducido utilizando la melaza y el extracto de levadura como medio líquido. Además, se logra la formación de conidios en los sustratos sólidos, siendo el arroz y millo donde se logran los más altos rendimientos.
Los aceites ensayados permitieron conservar la viabilidad de los conidios del aislado Ma-005 de M. anisopliae en más de un 70 % hasta los 6 meses, con diferencias relacionadas a la naturaleza de los mismos