Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión impresa ISSN 0258-5936
cultrop vol.35 no.3 La Habana jul.-set. 2014
REVISIÓN BIBLIOGRÁFICA
Aspectos fisiológicos, bioquímicos y expresión de genes en condiciones de déficit hídrico. Influencia en el proceso de germinación
Physiological, biochemistry and gene expression aspects in water stress. Influence in the germination process
Lissy Rosabal AyanI, Lisbel Martínez GonzálezII, Yanelis Reyes GuerreroIII, Dr. C. José Dell’Amico RodríguezIV, Dra. C. Miriam Núñez VázquezIV
IReserva científica del Departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
IIEspecialista del Departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
IIIAspirante a Investigador del Departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
IVInvestigadores Titulares del Departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700.
RESUMEN
Las condiciones de limitación de agua inducen en las plantas respuestas que afectan su morfología, fisiología y metabolismo. Una vez percibido este tipo de estrés se inician vías de transducción de señales y la expresión de genes asociados, que influyen en cambios celulares, de tejido y de órgano. Las condiciones ambientales que limitan la disponibilidad del agua para las plantas, involucran tres factores principales: el momento del año en el que se presenta (verano o invierno), su intensidad (ligera o severa), y su duración (días, semanas, meses); pero también depende de factores intrínsecos, como el estado de desarrollo de la planta en el momento en que se presente las condiciones de sequía, la especie vegetal y la variedad dentro de una especie determinada. Todos estos aspectos influyen en la productividad de un cultivo. El agua es uno de los requerimientos básicos para el proceso de germinación de las plantas y es esencial para la activación enzimática, translocación y uso del material de reserva de las semillas. Con el presente trabajo se evidencian algunos efectos que puede tener el déficit hídrico del suelo en el desarrollo de las plantas, fundamentalmente en el proceso de germinación. Además se analizan las implicaciones que tiene esta condición, para lograr el establecimiento de los cultivos en campo.
Palabras clave: déficit hídrico, germinación, expresión de genes.
ABSTRACT
The water limit condition induced in plants responses that affect their morphology, physiology and metabolism. Once this kind of stress is persuaded, it began transduction signs ways and genes expression associated that influence in cellular, tissue and organ changes. The ambient conditions that limit water availability for plants include three principal factors: the moment of the year when occur (summer or winter), the intensity (light or severe) and duration (days, weeks, months); but also depends of intrinsic factors, like the stage of development of the plant in the moment that water stress occur, the vegetal species and the variety in one specie. All that aspects participated in the cultivar productivity impact. The water is one important and basic resource for the germination process, and it is essential for the enzyme activation, translocation and used of the reserve material in the seeds. With this work existed some effects that can be the result of water deficit in the soil for the development of the plants, principally in the germination process. Besides it is analyzed the implication of this condition to make the stablemen of cultivars in yield.
Key words: water stress, germination, genes expression.
INTRODUCCIÓN
Debido a los continuos cambios del medio ambiente, se ha evidenciado un incremento en zonas áridas en todo el mundo con respecto a años anteriores, y cada vez se hacen más importantes las investigaciones relacionadas con las respuestas de las plantas al déficit hídrico. Las plantas como seres vivos, han sido capaces de adaptarse a estas nuevas condiciones, utilizando para ello diversos mecanismos que tienen un objetivo en común, lograr la sobrevivencia (1).
Uno de los puntos cruciales que, por un lado facilitan el crecimiento y el desarrollo para las plantas, y por otro, que los hombres y mujeres que trabajan la tierra puedan alcanzar el desarrollo deseado de cultivos de interés económico y nutricional, es el proceso de germinación de las semillas (2). Este proceso fisiológico es el inicio de lo que puede ser la obtención o no de un buen desarrollo de las plantas, y en buena medida depende de las condiciones ambientales, pero sobre todo de la disponibilidad de agua para que las semillas puedan activar su metabolismo y de esta forma propiciar la salida de la radícula, momento a partir del cual se puede garantizar que el proceso ha sido exitoso (3).
En Cuba existe una base de datos en la página WEB del Instituto de Investigaciones de Ingeniería Agrícola (IAgric) que recopila y tabula los resultados experimentales existentes en el Instituto de Investigaciones de Riego y Drenaje (IIRD) desde 1971 hasta 2009. En esta base de datos se puede encontrar información sobre más de 22 cultivos, cinco tipos de suelos, diferentes técnicas y tratamientos de riego, además de otras variables. Fue creada para propiciar accesibilidad a la información sobre régimen hídrico de los principales cultivos agrícolas y facilitar el planeamiento, diseño y operación del suministro de agua a los cultivos. De esta manera se contribuye a la definición de estrategias que den respuesta al problema de la escasez de agua que ha tenido gran impacto económico, social y ambiental en los últimos años en la isla (4).
Con el presente trabajo se evidencian algunos efectos que puede tener el déficit hídrico del suelo en el desarrollo de las plantas, fundamentalmente en el proceso de germinación y la expresión de genes. Debido a que la agricultura cubana se está viendo afectada por la falta de agua, se analizan algunas de las implicaciones que tiene esta condición para el establecimiento de los cultivos en el campo.
El déficit hídrico y sus efectos en las plantas
Las condiciones de limitación de agua inducen en las plantas respuestas que afectan su morfología, fisiología y metabolismo. Una vez percibido este tipo de estrés se inician vías de transducción de señales y la expresión de genes asociados, que influyen en cambios celulares, de tejido y de órgano (5).
Se han realizado investigaciones en el tema utilizándose diferentes tipos de ensayos. Estos estudios han sido enfocados a cultivos específicos, tratando de dilucidar las afectaciones que sufren las plantas debido a la falta de agua. De manera general, entre los cambios fisiológicos y metabólicos que ocurren se encuentran la disminución en la síntesis de proteínas y, por tanto, en la velocidad de crecimiento, el aumento de cera en la cubierta de las hojas (6), cambios en la transpiración (7), en la respiración (8), en la fotosíntesis (9), en la distribución de nutrientes (10) y otros.
Incluso se ha demostrado que en momentos tempranos de estrés salino, en la planta se obtiene una respuesta de déficit hídrico (11).
En Cuba, se han realizado estudios con el interés de identificar genes y proteínas que participan en las respuestas de tolerancia a la falta de agua. Uno de los resultados más recientes se obtuvo en el Centro de Ingeniería Genética y Biotecnología (CIGB), donde se realizó una investigación sobre la identificación de genes que participan en la tolerancia del estrés hídrico en plantas de arroz de las variedades LC8866 e IACuba-27, tolerante y sensible respectivamente. Se identificaron 103 transcriptos que inducen diferentes genes/proteínas asociados a la regulación durante estrés. Los transcriptos identificados se asociaron con genes que participan en el metabolismo, biosíntesis de las proteínas, defensa celular, transducción de señales y transporte (12).
Crecimiento celular
Uno de los procesos fisiológicos más sensibles al déficit de agua es el crecimiento celular, de manera que la sequía reduce la expansión y el área foliar (13). Las hojas cambian su ángulo de inclinación, se enrollan o se recambian, y se incrementa la relación del peso entre la raíz y la parte aérea (la raíz mantiene su velocidad de crecimiento, en tanto que la parte aérea la disminuye) (6). Se ha apreciado que estos cambios son consecuencia de un incremento en la producción de etileno. Cuando ocurren pequeños periodos de sequía esta hormona se produce en mayores niveles con respecto al control en peciolos de algodón (14), hojas de trigo (15) y otros cultivos.
El área foliar es importante, pues de ella depende la fotosíntesis, pero una rápida expansión foliar puede afectar negativamente la adaptación a la poca disponibilidad de agua (16).
Aunque parezca contradictorio la falta de agua puede afectar más a las plantas C3 que las C4. Se ha podido apreciar que cuando el contenido relativo de agua (CRA) de las plantas C3 es superior al 70 %, la capacidad máxima fotosintética no se afecta y si se rehidratan las plantas, se recuperan rápidamente del efecto de inhibición de la fotosíntesis. Cuando el CRA es menor del 70 %, hay menor respuesta de la actividad fotosintética a altas concentraciones de CO2 (9). Sin embargo, las plantas C4 realizan la fotosíntesis vía fosfoenolpiruvato carboxilasa (FEPC). Las enzimas que participan en el mecanismo que permite la concentración foliar de CO2 pueden afectarse por condiciones de déficit hídrico y limitar la fotosíntesis de las plantas C4 (8). Estudios realizados en caña de azúcar, las plantas C4, mostraron que una vez crecidas en altas concentraciones de CO2 se logra retrasar los efectos negativos del déficit hídrico severo impuesto durante 13 días cuando tenían cuatro meses de crecidas, y no se afectan las concentraciones de almidón, ni las de sacarosa. Pero en las plantas controles disminuye el uso eficiente de agua de un 27 % (condiciones de altas (CO2)) a un 7 % (condiciones de CO2 ambiente) y se afectan las cantidades de almidón (17).
En varios estudios se ha descrito cómo la micorrización mejora el estado hídrico de diversas especies vegetales cuando se presenta un déficit de agua, al incrementar la asimilación de agua, las tasas de transpiración y de intercambio de CO2 y la eficiencia en el uso de agua, porque propician el ajuste osmótico celular (18).
Cierre de estomas
Por otra parte, el cierre parcial o total de los estomas en las hojas, es una de las respuestas mejor caracterizadas pues evita la pérdida de agua en exceso por la planta. Este proceso, al igual que muchos otros involucrados en tal respuesta, está regulado por el ácido abscísico (ABA). El ABA es una hormona que se sintetiza en diferentes células incluyendo las que conforman los estomas. Se produce principalmente en las hojas maduras, tejidos estresados, semillas y el ápice de la raíz. Se transporta a distintas regiones de la planta, en gran parte a través del floema aunque también se ha encontrado en el xilema (19).
El cierre de los estomas ocurre para la disminución de la pérdida de agua por la hojas, pero también afecta en la reducción de la entrada del CO2, lo cual repercute directamente en el proceso fotosintético y, por tanto, en la formación eficiente de fuentes carbonadas necesarias para la nutrición vegetal. La inducción de estos procesos está perfectamente coordinada con la disminución en la velocidad de crecimiento, lo cual permite a la planta enfrentar esta nueva condición ambiental (6).
Se ha evidenciado que la salinidad, la sequía y las bajas temperaturas, causan un incremento en la biosíntesis y acumulación del ABA, pues activan genes que codifican para las enzimas que participan en la biosíntesis de esta hormona. Este incremento del ABA es la señal que permite amplificar otras cascadas de señalización que al parecer regulan el balance hídrico en la planta y la tolerancia al estrés osmótico. De esta forma la síntesis y regulación del ABA constituye un mecanismo de respuesta ante el déficit hídrico del suelo (20).
Las fitohormonas juegan un papel importante en la regulación de las respuestas de las plantas al estrés. Estudios realizados en plántulas de maíz crecidas en condiciones de déficit hídrico simulado con polietilenglicol 12 %, mostraron el incremento de ABA en las hojas, 2,3 veces superior al control, luego de 24 horas en estrés, y así se mantuvo hasta el final. También se obtuvo un incremento transitorio en el contenido de AIA durante la fase inicial de adaptación al estrés y luego cayó rápidamente (21).
Ajuste osmótico
Cuando la planta se desarrolla en condiciones de disponibilidad de agua adecuada a sus requerimientos hídricos, una hoja bien hidratada puede transpirar varias veces su propio volumen de agua durante un día. Sin embargo, cuando este elemento está en falta la planta debe modificar su metabolismo y fisiología, adaptándose a las nuevas condiciones ambientales.
La planta en busca de la homeostasis, utiliza mecanismos que permiten que la apertura del estoma, la expansión foliar, la transpiración y la fotosíntesis, se mantengan funcionando por más tiempo, almacenando sustancias que no son constituyentes normales de la célula. Este mecanismo es el ajuste osmótico (22). La planta sintetiza y acumula solutos osmóticamente activos como cationes inorgánicos (principalmente K+ y Cl-), ácidos orgánicos, aminas cuaternarias (glicina betaína, ß-alanina betaína y dimetilsulfonio propionato), aminoácidos (prolina) y azúcares (sacarosa y manitol); lo que le permite mantener un potencial de turgencia alto (17). De manera que si el potencial de agua de la célula es menor que el potencial de agua externo, hay una reducción del potencial osmótico y de esta forma el agua se mueve hacia el interior de la misma (5).
Uno de los metabolitos más estudiados que se acumulan en plantas crecidas en diferentes condiciones estresantes, es la prolina. Este aminoácido es fundamental para el mantenimiento de la homeostasis celular, incluyendo el balance redox y el estado energético. Además, puede actuar como molécula señalizadora para la modulación de las funciones mitocondriales, influir en la proliferación o muerte celular y en lo que podría ser esencial para la fase de recuperación del estrés, la expresión de genes específicos (23). En este último aspecto se ha evidenciado que los cambios en la expresión de genes son fundamentales para la respuesta que se obtiene durante el déficit de agua, y es el origen del control de muchas respuestas a corto y largo plazos (5).
En estudios de los efectos del déficit hídrico en los índices de germinación de diferentes genotipos de trigo, se obtuvo un incremento progresivo en prolina y azúcares relacionados con el incremento del estrés osmótico (24).
Expresión de genes. Genes lea
Un gran número de genes y sus productos inducidos por el déficit de agua participan en la protección de las estructuras celulares del efecto de la pérdida de agua. Dentro del conjunto se encuentran los genes lea, siendo identificados primeramente como genes que se expresan durante las fases de maduración de las semillas. Desde 1988, por Baker et al., se ha reconocido la expresión de estos genes en tejidos vegetativos durante periodos de pérdida de agua (25), como resultado de diversos tipos de estrés (bajas temperaturas, osmótico y déficit hídrico) (5).
Las proteínas LEA (abundantes en embriogénesis tardía) son una amplia familia de proteínas de plantas que se almacenan en las semillas secas. Su presencia en tejidos vegetativos se restringe a situaciones de estrés osmótico. Son proteínas muy hidrofílicas y según los resultados que se han obtenido (26, 27), todo parece indicar que varían su estructura y no se encuentran en las células en una manera globular estable, como se puede deducir por su resistencia a altas temperaturas. Estas propiedades estructurales son consistentes con su papel en la retención de agua, en conjunto con su alta concentración intracelular y sus patrones de expresión, de manera que sugiere el papel protector de las proteínas LEA a estructuras celulares específicas y aminorar los efectos del estrés ayudando en el mantenimiento de los requerimientos mínimos de agua en la célula. Además, se cree participan en el secuestro de iones, en la acción de chaperonas moleculares y en el transporte de proteínas nucleares blanco durante el estrés (28).
Estrés oxidativo de las plantas
Las plantas manifiestan un rasgo común debido a la influencia de diferentes factores estresantes, es su potencial para incrementar la producción de especies activas de oxígeno en células y tejidos, especies que en condiciones normales son generadas como consecuencia de los procesos metabólicos (29).Las especies activas de oxígeno y sus productos pueden causar la reducción de la fotosíntesis y la transpiración, acelerar la senescencia, aumentar la respiración y provocar el eflujo de los electrolitos y las mutaciones genéticas en las plantas (30).
El estrés oxidativo es el estado bioquímico de la célula y el tejido donde la generación de especies químicas oxidantes rebasa la capacidad de producción o la actividad de especies antioxidantes (31). Puede ocurrir en cortos o largos plazos y es inducido por la mayoría de los estreses ambientales (32), como consecuencia fundamental de la producción en exceso de las especies activas de oxígeno (EAO), tales como el oxígeno singlete (1O2), el radical superóxido (O2-), el peróxido de hidrógeno (H2O2) y el radical hidroxilo (OH·) (30).
A pesar de la inestabilidad de los radicales libres, se han desarrollado estudios para determinar directamente su formación, aunque no siempre se ha identificado la naturaleza de los radicales (33). Por otra parte, la detección de la acumulación de los productos relativamente estables de la degradación oxidativa de los lípidos (malondialdehído), así como la formación de proteínas carboniladas que se generan debido al ataque de los radicales libres han sido empleadas para indicar el daño oxidativo (34).
En cuanto a los sitios de producción, las especies activas de oxígeno se forman en varios de los organelos celulares. La generación del H2O2 puede ocurrir a partir de la NADPH oxidasa que se localiza en la membrana citoplasmática, las peroxidasas de la pared celular y las amino-oxidasas (35). Otras fuentes de especies activas de oxígeno son los procesos del transporte de los electrones en los cloroplastos y el estrés foto-oxidativo en los peroxisomas (36). Por ejemplo, en los cloroplastos y los peroxisomas, la disipación del exceso de la energía así como las transferencias de los electrones durante la fotorespiración y en la reacción de Mehler incrementan los flujos de los electrones hacia el oxígeno y consecuentemente la producción de las especies activas del oxígeno potencialmente tóxicas (37). En las mitocondrias también se encuentran posibles sitios de generación de las especies activas del oxígeno (38).
Para minimizar los efectos tóxicos de las especies activas de oxígeno, las plantas han desarrollado mecanismos altamente regulados de protección enzimáticos y no enzimáticos que las atrapan e inactivan eficientemente para lograr el balance entre la producción y la destrucción de las mismas (10). La habilidad de las plantas para sobreponerse al estrés oxidativo dependerá de sus capacidades para desencadenar tales mecanismos de respuesta de manera eficaz, en los diferentes organelos celulares.
En general, los sistemas antioxidantes se distribuyen por los distintos sitios y los organelos de la célula. Los antioxidantes intracelulares se han caracterizado mejor que los localizados en el apoplasto (39). Por otra parte, en la mayoría de las especies la capacidad de los sistemas antioxidantes declina con la edad (40).
Antioxidantes enzimáticos y no enzimáticos
Entre los principales antioxidantes enzimáticos se encuentran las enzimas que remueven oxidantes tóxicos como las superóxido dismutasas, las peroxidasas y las catalasas y otras enzimas que mantienen los niveles de antioxidantes en sus estados reducidos como son la deshidroascorbato reductasa, la monodeshidroascorbato reductasa, y la glutationa reductasa (41).
Actualmente son poco comprendidos los mecanismos específicos que modulan la expresión de los genes antioxidantes en el estrés de oxidación, especialmente de los genes que codifican para varias isoenzimas de una misma proteína. En general, los resultados han mostrado que las múltiples formas de las enzimas antioxidantes tuvieron el patrón de expresión diferencial, su regulación fue compleja y se localizaron en varios tejidos, tipos celulares y organelos (42).
Los antioxidantes no enzimáticos pueden ser metabolitos lipofílicos entre los que se destacan los tocoferoles, los carotenoides, los polifenoles y los alcaloides. También pueden ser hidrofílicos como la glutationa, el ascorbato, la prolina, las poliaminas y la cisteína, que pueden secuestrar directamente las EAO o servir como sustratos para los sistemas de protección enzimáticos (43).
Papel del H2O2 en las plantas crecidas bajo condiciones de déficit hídrico
En el caso de la molécula de H2O2, ha demostrado ser un componente crucial de las respuestas de movimiento y crecimiento, particularmente aquellas inducidas por los estímulos ambientales. En respuesta a cualquier estrés se incrementa la generación de H2O2 y las células son capaces de monitorear la extensión de dicho aumento. Se sabe que cambios de relativa poca magnitud o bien pequeños y localizados choques oxidativos modifican solo parte de la red de señalización y expresión génica, de tal forma que se fortifican las defensas de la planta. En cambio, las variaciones en las cantidades de H2O2 disparan una secuencia local de eventos que terminan en la senescencia o en muerte celular programada (31).
Además, se ha demostrado que es un factor importante en el fenómeno de aclimatación o tolerancia cruzada, que en exposiciones previas a un tipo de estrés puede inducirse a tolerancias en subsiguientes exposiciones al mismo u otros tipos de estreses (44, 45).
Efecto de la falta de disponibilidad de agua en el crecimiento y desarrollo de las plantas
En general, las condiciones ambientales que limitan la disponibilidad del agua para las plantas, como las heladas, la salinidad y la sequía, involucran tres factores principales: el momento del año en el que se presenta (verano o invierno), su intensidad (ligera o severa), y su duración (días, semanas, meses). Todos estos factores varían ampliamente en la naturaleza, en las diferentes regiones de la tierra. En el caso de la sequía, el impacto sobre la productividad de un cultivo está en función de los factores antes descritos, pero también de factores intrínsecos de las plantas, como el estado de desarrollo de la planta en el momento en que se presente la sequía, la especie vegetal y la variedad dentro de una especie determinada. Asimismo dependerá del tipo de suelo en el que se siembre y de las prácticas agrícolas que se lleven a cabo en cada caso. Esta gran variabilidad en dichos factores ha dificultado la definición de características en las plantas que permitan el mejoramiento de los cultivos ante todas estas situaciones de sequía (6).
Las respuestas de las plantas a la escasez de agua es compleja, involucrándose cambios adaptativos y efectos deletéreos. En condiciones de campo esta respuesta puede ser sinérgica o antagónicamente modificada por la superimposición de otros estreses. Las estrategias de las plantas para sobrellevar el déficit hídrico normalmente involucra a un conjunto de respuestas que conllevan a evitar o tolerar el estrés, lo cual está estrechamente relacionado con las características genotípicas del cultivo en cuestión (16). Cuando se trabaja en condiciones controladas o semicontroladas se obvian este tipo de interacciones existentes normalmente en la naturaleza.
Debido a que la mayoría de los estudios desarrollados en condiciones de estrés abiótico, se han realizado en condiciones controladas en los laboratorios, los resultados no reflejan las condiciones reales que se encuentran en el campo, por lo que puede existir una brecha entre los conocimientos adquiridos por este tipo de estudios y el conocimiento que se requiere para el desarrollo de las plantas y cultivos con un incremento en la tolerancia a las condiciones de desarrollo y crecimiento naturales. Por ejemplo, durante el estrés por altas temperaturas, las plantas abren los estomas para facilitar la disminución de la temperatura de las hojas, por el proceso de transpiración; pero si se combinan las altas temperaturas con la sequía, las plantas no pueden abrir los estomas, porque de lo contrario se deshidratarían, y por tanto la temperatura en las hojas es mayor (46).
En condiciones de campo, normalmente un alto índice de oxidación resulta en poca producción o en poca calidad de la cosecha, si es que esta se obtiene. Por lo que con las investigaciones se busca entonces lograr que las plantas mantengan una mayor capacidad antioxidante incluso en presencia de factores ambientales negativos, o bien que la planta sea capaz de mantener cierto estado metabólico o de funcionamiento, aunque presente un índice alto de oxidación (31).
En campo un factor importante que influye en el adecuado desarrollo de los cultivos es la humedad, la que se puede describir de diversas formas. La humedad a capacidad de campo es el nivel óptimo para que ocurra la germinación de la semilla, teniéndose en cuenta que este proceso fisiológico varía entre especies y puede ocurrir cercano al punto de marchitez permanente. La mayoría de las semillas tienen un contenido de humedad crítico para que ocurra la germinación. En el caso del maíz es de 30 % y en soya es del 50 %. Una vez ese contenido critico de humedad se alcanza en la semilla, es indicador de que suficiente agua existe para que la semilla germine y esté comprometida a ese evento sin poder retroceder (2).
Incluso, también resulta definitoria la humedad en la semilla. A medida que la semilla se va deshidratando más se retrasa el proceso de germinación y se favorece así el deterioro de la misma, como es el caso de las semillas recalcitrantes (47).
Importancia del agua en el proceso de germinación en las plantas. Tratamientos para disminuir los efectos del déficit hídrico
El agua es uno de los requerimientos básicos para el proceso de germinación de las semillas y es esencial para la activación enzimática, translocación y uso del material de reserva de las mismas (2).
Las plantas tienen gran variedad en la forma, en el tamaño y en las sensibilidades a las variaciones del medio ambiente, lo que les permite colonizar diversos hábitats en la tierra. Las semillas contienen, en condición de latencia, toda la información que necesitan para una parte importante de estas variaciones (1).
Las hormonas son extremadamente importantes para la regulación de la dormancia y la germinación de las semillas (48). A sus efectos se le adiciona la influencia por factores ambientales como la humedad, la luz, la temperatura y otros (49). Debido a que las plantas no pueden moverse, escoger entre estos dos procesos es decisivo para la sobrevivencia de la planta, y de su especie.
Se ha tratado de implementar algunos tratamientos para estudiar las posibles respuestas que se obtengan en las plantas durante los procesos de atenuación de los efectos del déficit hídrico. Existen informes en los que la aplicación exógena de hormonas como las giberelinas (GA3), citoquininas (CQ) o brasinoesteroides (24-epibrasinolida) tienen efecto protector de plántulas ante el déficit hídrico (21, 50, 51). En el Instituto Nacional de Ciencias Agrícolas (INCA) desde hace años se han realizado estudios con formulaciones que se han producido en la Facultad de Química de la Universidad de La Habana, como ejemplo: MH-5, Biobras-6 y Biobras-16. La
Dra.C. Miriam Núñez Vázquez le ha dedicado gran parte de su vida a la evaluación, efecto y estudio de estos productos en diferentes cultivos, dedicándose los últimos años a los granos como arroz y frijol (52).
Otra de las alternativas posibles es el efecto del osmoacondicionamiento de las semillas para la tolerancia a otros estreses. Muchos estudios indican que las semillas que muestran una adaptación adecuada durante la etapa de germinación a estrés salino y déficit hídrico, tienen un mejor crecimiento en la etapa de plántulas y posteriormente tendrán un sistema radical más resistente (53). El efecto del osmocondicionamiento se ha evaluado en trigo (24) y en Cuba con el cultivo de tomate (45), entre otros. Además, el uso de los hongos micorrízicos arbusculares (HMA) es una alternativa que ha tenido resultados favorables para el enraizamiento de las plántulas. Estos hongos son microorganismos simbióticos que se asocian con las plantas e incrementan su tolerancia al estrés hídrico al modificar las tasas fotosintética y de transpiración, el potencial hídrico de hojas y suelo, la concentración de osmolitos, la eficiencia en el uso de agua y la asimilación de nutrientes en el hospedero (17).
Etapas del proceso de germinación en las plantas. Acción del agua
En el estado de reposo, las semillas se caracterizan por baja humedad y prácticamente un metabolismo inactivo, es decir, están en el estado de dormancia. De manera que una semilla en este estado es capaz de mantener un nivel mínimo de actividad metabólica que garantiza su sobrevivencia por largos periodos de tiempo en el suelo. Si el contenido interno de humedad se encuentra por debajo del contenido crítico de humedad, la semilla se deteriora en el suelo incluso hasta su descomposición.
Por otra parte, existen varias etapas de desarrollo de la plántula cuyas características varían, dependiendo del tipo de germinación que presenta cada especie. Hay básicamente dos tipos de germinación (que a veces presentan algunas variantes), la germinación epigea y la hipogea. En la germinación epigea el hipocótilo se alarga y aleja a los cotiledones del suelo; en tanto que en la germinación hipogea el hipocótilo no se desarrolla y los cotiledones permanecen bajo el suelo o ligeramente sobre este. Con posterioridad el epicótilo se alarga y aparecen las primeras hojas verdaderas. En este caso las primeras hojas tienen sólo una función almacenadora de nutrientes, en tanto que en la germinación epigea estas hojas también tienen con frecuencia color verde y realizan funciones fotosintéticas durante el crecimiento temprano de la plántula. La testa de la semilla puede permanecer cubriendo los cotiledones en el caso de la germinación hipogea, en tanto que en la epigea se desprende, lo cual permite la expansión de las primeras hojas (Figura 1) (2).
La germinación de las semillas comprende tres etapas sucesivas que se superponen parcialmente y se consideran como el complejo de germinación. En la mayoría de las semillas el agua penetra inicialmente por el micrópilo y la primera manifestación de la germinación exitosa es la emergencia de la radícula, lo que depende de la expansión del embrión, proceso de crecimiento impulsado por el agua. La síntesis de ADN y la división celular no se requieren, y parece que la regulación del crecimiento potencial del embrión está dada, principalmente, por cambios en la extensibilidad de la pared celular.
Complejo de germinación
La mayoría de las semillas sufren una serie de eventos específicos durante la germinación. Antes de la germinación, las semillas se encuentran en una fase de mantenimiento que se caracteriza como dormancia impuesta por ABA, bloqueadores metabólicos u otros agentes que dificultan la transición hacia la germinación. Un agente como la luz o las variaciones de la temperatura cambian el balance a favor de los promotores como las giberelinas, y despliega así el proceso de germinación. En determinado momento, las semillas se convierten sensibles a la acción de estos promotores (55).
Un agente blanco se puede definir como un factor que provoca la germinación, pero que su presencia no se requiere para que este proceso se siga desarrollando. A diferencia de un agente de germinación, que es un factor que si debe estar presente durante todo el proceso, como es el caso del ácido giberélico.
Los eventos que conllevan a la germinación son: imbibición de las semillas secas, activación enzimática, iniciación del crecimiento del embrión, ruptura de la cubierta de la semilla (testa) y emergencia de la radícula. La germinación comienza con la toma de agua por la imbibición de las semillas secas, causando su hinchamiento seguida por la expansión del embrión, culminando en la ruptura de la testa (capas que cubren a las semillas) y la salida de la radícula (56).
Imbibición de las semillas secas
Las etapas tempranas de toma de agua por una semilla seca representan un período crucial para la germinación. Es el primer evento clave que lleva a que una semilla seca y quiescente reanude un crecimiento embrionario. De manera, que cualquier consideración de la fisiología de la germinación de la semilla y de su establecimiento, debe enfocarse en la imbibición. El momento en que la fase de imbibición ocurre depende de tres factores: composición de la semilla, la permeabilidad de la cubierta de la semilla y la disponibilidad de agua (55).
La protrusión de la radícula cuando se termina el proceso de germinación depende del crecimiento del embrión derivado de la toma de agua. La toma de agua por la semilla es trifásica (Figura 2), con una toma inicial rápida (fase I, imbibición), que se produce por el empuje del agua desde una zona mojada (el medio) a una seca (la semilla). Esta fase es igual en semillas vivas y muertas. A continuación le sigue la fase de meseta (fase II) donde el proceso de absorción es mucho más lento, pudiendo detenerse la absorción. Luego un rápido crecimiento en la toma de agua (fase III), se produce sólo en semillas vivas, y en ella hay un nuevo incremento de la absorción, asociado al crecimiento de la radícula y a la actividad metabólica que implica la germinación. Ocurre solamente cuando se completa el proceso de germinación, así como la elongación del embrión y el quebrado de las estructuras que cubren. La elongación celular es necesaria, y generalmente se acepta que es suficiente para que se complete la protrusión de la radícula (56).
Las semillas secas se caracterizan por una baja velocidad en el metabolismo que se atribuye a su bajo contenido de humedad, lo cual puede ser tan bajo como de 5-10 % en semillas no imbibidas. Tan pronto como la semilla se imbibe, ocurren cambios en el metabolismo. Se ha demostrado durante la germinación de una gran cantidad de semillas un patrón trifásico durante el proceso de toma de agua. La fase I ocurre tanto en semillas muertas como vivas, y se puede observar, una liberación de gases. Esta fase, no es dependiente del metabolismo, sino es el resultado de la acción de fuerzas matrices y la atracción intracelular de moléculas por el agua.
Activación enzimática
La activación de las enzimas comienza durante la fase I y II de la imbibición. Durante la fase II, existe un intervalo de tiempo para la toma del agua, pero la semilla sufre muchos procesos esenciales para la germinación.
Con la respiración, se comienza la degradación de azúcares para producir energía en forma de ATP. Basados en este patrón, la producción de ATP también debe tener un comportamiento trifásico.
En esta segunda fase se inicia la actividad enzimática y del metabolismo respiratorio, y ocurre la translocación y asimilación de las reservas alimentarias en las regiones en crecimiento del embrión. La semilla “seca” generalmente respira muy poco y sólo aumenta su consumo de oxígeno con la imbibición de agua, donde en la primera fase se produce un rápido incremento de la respiración, antes de llegar a estar 12 horas en un medio húmedo. A mayor hidratación, mayor respiración. En la segunda fase, entre las 12 y 24 horas se estabiliza la actividad respiratoria. En la tercera fase, a partir de las 24 horas, se produce un segundo incremento de la actividad respiratoria, generalmente debido a la ruptura de la cubierta producida al salir la radícula, esto permite que entre mucho más oxígeno. Hay una cuarta fase en la que disminuye la respiración al desintegrarse los cotiledones, después de exportar al embrión las reservas almacenadas (56).
En las respuestas de la semilla a los cambios ambientales, hay elementos que son propios de la especie y otros conservados. Los factores ambientales que afectan la germinación son variables según la especie, pero los principales procesos que ocurren durante la germinación se mantienen, la elongación y diferenciación celular y los cambios metabólicos: de hipoxia a normoxia, y luego de heterotrofía a autotrofía.
Como parte de la segunda fase la semilla adquiere tolerancia a la deshidratación y se desarrolla un evento de deshidratación programada que conlleva a un estado de dormancia y quiescencia. Durante la deshidratación las semillas maduras alcanzan niveles de agua de 5-10 % y frecuentemente pueden perder de 1-5 % de agua con poca o casi ninguna pérdida de la viabilidad (57).
La deshidratación de las semillas se ha asociado con un incremento en la viscosidad del citoplasma y consecuentemente con hipoxia. En embriones de legumbres se ha demostrado que las células están en hipoxia. También mutantes en Arabidopsis deficientes en la inducción de los genes de la alcohol deshidrogenasa (ADH) durante hipoxia/anoxia tuvieron afectaciones en la inducción durante la germinación, lo que sugiere que al menos algunas vías de regulación de estos procesos están relacionados e incluso que puedan llegar a ser los mismos. Una vez que la radícula emerge, la respiración incrementa y el metabolismo de las semillas se hace aeróbico, y a la normoxia en las células le continúa rehidratación y germinación, pero más probable es la transición de hipoxia a normoxia, lo cual es especialmente regulado y variable en los diversos tipos de células (55).
Generalmente las enzimas que degradan carbohidratos, lípidos, proteínas y compuestos que contienen fósforos son las primeras enzimas en activarse en esta fase. Pero los mecanismos que controlan este proceso dirigido de degradación de tejidos de almacén no se han dilucidado completamente.
Proteasas
La degradación de proteínas durante la germinación de las semillas es un proceso complejo en el cual están involucrados una serie de enzimas proteolíticas (58). Estas enzimas pueden clasificarse según su centro activo (59). Estas proteinasas se han purificado de semillas de diferentes especies (60, 61), y se ha reconocido que durante el proceso de germinación, hay un incremento en la actividad de las cisteínas proteinasas específicamente (61).
Incluyen alrededor de 40 familias de peptidasas, agrupadas en al menos seis superfamilias, entre las que se encuentran las caspasas, las calpaínas, las proteasas dependientes de calcio, las ubiquitinas C-terminal hidrolasas y proteasas específicas a ubiquitina (59).
Estas proteinasas participan en la proteólisis de proteínas almacenadas en el mesófilo de cotiledones de plantas dicotiledóneas, en el endospermo de cereales y en el eje embriónico de ambos tipos de vacuolas: las de almacenamiento en semillas y las líticas de los tejidos vegetativos. La acción de estas proteinasas en vacuolas posibilita el procesamiento de proteínas en semillas maduras, pero también son el grupo más abundante de proteasas responsables de la degradación y movilización de proteínas almacenadas. En la germinación de semillas de cebada están involucradas 42 proteasas y alrededor de 27 son cisteínas proteinasas. En la germinación de maíz y de trigo las cisteínas proteinasas son alrededor del 90 % de la actividad total de degradación de prolaminas, la proteína almacenada más abundante en cereales (59).
Glucanasas
Las ß-1,3-glucanasas (glucano endo-1,3-ß-glucosidasas, E.C. 3.2.1.39) son enzimas altamente reguladas y ampliamente distribuidas en las semillas de muchas especies de plantas. Permiten catalizar el corte endo-hidrolítico de uniones 1,3-ß-D-glucosídicos en ß-1,3-glucanos. Además hay evidencias de que estas enzimas participan en diversos procesos fisiológicos y de desarrollo, como la dormancia y la germinación en plantas no infectadas por patógenos microbianos, además de la embriogénesis y la movilización de reservas almacenadas en el endospermo de granos de cereales, entre otras (62).
Las ß-1,3-glucanasas (ßGlu) existen como isoformas estructurales que difieren en tamaño, punto isoeléctrico, la estructura primaria, la localización celular y el patrón de regulación. Según la identidad de la secuencia aminoacídica, los diferentes genes ßGlu de Nicotianatabacum se han clasificado en tres clases estructurales. Similares isoformas estructurales se han reportado para el tomate, la papa y otras especies de plantas (62). Las de clase I se localizan en las paredes de las vacuolas. Las de clase II y III son secretadas al espacio extracelular.
Crecimiento del embrión, ruptura de la testa y emergencia de la radícula Finalmente en la fase III, se observa la elongación de la raíz. La raíz se convierte en funcional durante esta fase y es la responsable de que se incremente la toma de agua que se evidencia en esta etapa. De forma interesante, si la velocidad de la respiración se observa, se puede encontrar un patrón trifásico también, lo que demuestra la importancia del agua en la activación de las enzimas.
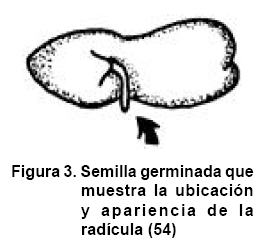
El crecimiento y la división celular que se suceden por la activación del metabolismo de las células de las semillas provocan la emergencia de la radícula, llegando así al fin del proceso de germinación y propiciando a su vez el posterior desarrollo de la plúmula (Figura 3). Durante la germinación e inmediatamente después ocurren muchos eventos de diferenciación celular que incluyen la reorganización, síntesis y distribución de componentes subcelulares y organelos. Durante la embriogénesis, germinación y etapas tempranas del desarrollo de las plantas, la síntesis y distribución sub-celular de los organelos involucra la regulación de genes de diferentes orígenes durante la evolución (55).
Varios estudios han demostrado que ocurren cambios en las semillas durante el inicio del crecimiento del embrión. Generalmente, las únicas sustancias que toma la semilla en estas etapas tempranas son el agua y el oxígeno. Debido a que las semillas se encuentran debajo de la superficie de los suelos y no son fotosintéticamente activas, existe una pérdida de CO2 y una degradación del material de reserva de la semilla que conlleva a una pérdida de la masa fresca de la misma. Una vez que las plántulas inician la fotosíntesis y tengan la capacidad de fijar CO2 en forma de azúcares, ocurre un incremento en la masa fresca de las plántulas y existe un cambio en el metabolismo de las plántulas pasando de los procesos de degradación a los fotosintéticos y así propiciando el crecimiento y desarrollo de las plantas (56).
Es importante recordar que el agua siempre se mueve hacia un potencial de agua más negativo, y que el potencial de agua pura es cero. Los suelos en que las semillas se plantan también tienen sus propios potenciales del agua. Las propiedades físicas del suelo determinan el nivel de retención o conductividad de agua. Por ejemplo, suelos abundantes en arcilla son capaces de absorber agua más vigorosamente y la retienen por más tiempo que aquellos que poseen gran cantidad de arena. De hecho el potencial de agua de las semillas debe competir con el potencial de agua del suelo, para que ocurra la imbibición de las semillas (2).
CONCLUSIONES
Las plantas han sido capaces de adaptarse a las variaciones del medio donde se desarrollan, incluso aunque estos cambios impliquen cierto tipo de estrés. Bajo estas condiciones ha podido realizar todos los procesos vitales y de esta forma lograr reproducirse.
En el proceso de germinación el papel de las semillas se evidencia como unidad reproductiva.
Debido a su rol en el establecimiento de las plantas, la germinación de las semillas continúa siendo clave para la agricultura moderna, especialmente en un mundo consciente de lo delicado que es el balance que se debe crear entre producción de alimentos y el incremento poblacional mundial. Una comprensión del proceso de germinación es esencial para el desarrollo de los cultivos y la obtención de buenos rendimientos y cosechas con calidad.
Este aspecto también es clave para nuestro país que cuenta con grandes áreas de cultivo agrícola. Es necesario la toma de medidas para atenuar los efectos nefastos de la falta de agua en la agricultura. Para ello el tener información molecular, fisiológica y de manejo según las características del cultivo se hace imprescindible. Un punto de apoyo puede ser la base de datos ya creada a partir de 30 años de investigación en el IIRD, además del fortalecimiento e intercambio de conocimientos entre los institutos y la experiencia campesina.
REFERENCIAS
1. Cervantes, E. Ethylene in Seed Germination and Early Root Development. Floriculture, Ornamental and Plant Biotechnology, 2006, vol. 1, pp. 429-438.
2. McDonald, M. B. Seed Biology Program, in Physiology of Seed Germination. Consortium for International Seed Technology Training (CISTT). 2010.
3. Zhang, W. A comprehensive study on the role of hormones, seed coat and genes during the germination of canola (Brassica napus) seed under adverse environmental conditions. Department of Plant Sciences, University of Saskatchewan. 2008.
4. González Robaina, Felicita; Herrera Puebla, Julián; Hernández Barreto, Osmany; López Seijas, Teresa y Cid Lazo, Greco. Base de datos sobre necesidades hídricas. Revista Ciencias Técnicas Agropecuarias, 2012, vol. 21, no. 2, pp. 42-47.
5. Bray, E. A. Molecular Responses to Water Deficit. Plant Physiol., 1993, vol. 103, no. 4, pp. 1035-1040.
6. Robles, A. A. C. Sobrevivir al estrés: cómo responden las plantas a la falta de agua. Biotecnología, 2007, vol. 14, pp. 253-262.
7. Reicosky, D. C. y Deaton, D. E. Soybean Water Extraction, Leaf Water Potential and Evapotranspiration During Drought. Agronomy Journal, 1979, vol. 71, no. 1, pp. 45-50.
8. Carmo-Silva, Ana E.; Bernardes da Silva, A.; Keys, Alfred J.; Parry, Martin A. J. y Arrabaca, Maria C. The activities of PEP carboxylase and the C4 acid decarboxylases are little changed by drought stress in three C4 grasses of different subtypes. Photosynth. Res., 2008, vol. 7, pp. 223-233.
9. Ghannoum, O. C4 photosynthesis and water stress. Annals of Botany, 2009, vol. 103, pp. 635-644.
10. González-Meler, M. A.; Matamala, R. y Peñuelas, J. Effects of prolonged drought stress and nitrogen deficiency on the respiratory O2 uptake of bean and pepper leaves. Photosynthetica, 1998, vol. 34, no. 4, pp. 505-512.
11. Munns, R. Comparative physiology of salt and water stress. Plant, Cell & Environment, 2002, vol. 25, no. 2, pp. 239-250.
12. Rodríguez, Mayra; Canales, Eduardo; Borroto, Carlos; Carmona, Elva; Lopez, Junior; Pujol, Merardo y Borrás-Hidalgo, Orlando. Identification of genes induced upon water-deficit stress in a drought-tolerant rice cultivar. Journal of Plant Physiology, 2006, vol. 163, pp. 577-584.
13. Parra Quezada, Rafael A.; Rodríguez Ontiveros, J. L. y González Hernández, Victor A. Transpiración, potencial hídrico y prolina en zarzamora bajo déficit hídrico.TERRA Latinoamericana, 1999, vol. 17, no. 2, pp. 125-130.
14. McMichael, B. L.; Jordan, W. R. y Powell, R. D. An Effect of Water Stress on Ethylene Production by Intact Cotton Petioles. Plant Physiol, 1972, vol. 49, no. 4, pp. 658-660.
15. Apelbaum, A. y Yang, S. F. Biosynthesis of Stress Ethylene Induced by Water Deficit. Plant Physiol, 1981, vol. 68, p. 594-596.
16. Moreno-Fonseca, L. P. Respuesta de las plantas al estrés por déficit hídrico. Una revisión. Agronomía Colombiana, 2009, vol. 27, no. 2, pp. 179-191.
17. Vu, J. C. V. y Allen Jr, L. H. Growth at elevated CO2 delays the adverse effects of drought stress on leaf photosynthesis of the C4 sugarcane. Journal of Plant Physiology, 2009, vol. 166, pp. 107-116.
18. Citlalli Harris-Valle, M. E.; Valenzuela-Soto, Elisa M. y Castellanos, Alejandro E. Tolerancia al estrés hídrico en la interacción planta-hongo micorrízico arbuscular: metabolismo energético y fisiología. Revista Fitotecnia Mexicana, 2009, vol. 32, no. 4, pp. 265-271.
19. Seo, Mitsunori y Koshiba, Tomokazu. Transport of ABA from the site of biosynthesis to the site of action. J. Plant Res., 2011, vol. 124, pp. 501-507.
20. Chávez Suárez, Licet; Álvarez Fonseca, Alexander y Ramírez Fernández, Ramiro. Revisión bibliográfica. Apuntes sobre algunos reguladores del crecimiento vegetal que participan en la respuesta de las plantas frente al estrés abiótico. Cultivos Tropicales, 2012, vol. 33, no. 3, pp. 47-56.
21. Chunrong Wang, A. Y.; Haiying, Yin y Juren, Zhang. Influence of Water Stress on Endogenous Hormone Contents and Cell Damage of Maize Seedlings. Journal of Integrative Plant Biology, 2008, vol. 50, no. 4, pp. 427-434.
22. Vítámvás, Pavel; Kosová, K. y Prášil, I. T. Proteome Analysis in Plant Stress Research. Czech J. Genet. Plant Breed., 2007, vol. 43, no. 1, pp. 1-6.
23. Szabados, L. y Savoure, A. Proline: a multifunctional amino acid. Trends in Plant Science, 2010, vol. 15, no. 2, pp. 89-97.
24. Qayyum, A.; Razzaq, A.; Ahmad, M. y Jenks, M. A. Water stress causes differential effects on germination indices, total soluble sugar and proline content in wheat (Triticum aestivum L.) genotypes. African Journal of Biotechnology, 2011, vol. 10, no. 64, pp. 14038-14045.
25. Baker, J.; Steele, C. y Dure, L. Sequence and characterization of 6 Leu proteins and their genes from cotton. Plant Mol Biol, 1988, vol. 11, pp. 277-291.
26. Goyal, Kshamata; Walton, L. J. y Tunnacliffe, A. LEA proteins prevent protein aggregation due to water stress. Biochem J., 2005, vol. 388, no. 1, pp. 151-157.
27. Tunnaclife, A. y Wise, M. J. The continuing conundrum of the LEA proteins. Naturwissenschaften, 2007, vol. 94, pp. 791-812.
28. Colmenero-Flores, J. M.; Moreno, L. P.; Smith, C. E y Covarrubias, A. A. Pvlea-18, a Member of a New Late-Embryogenesis-Abundant Protein Family That Accumulates during Water Stress and in the Growing Regions of Well-Irrigated Bean Seedlings. Plant Physiology, 1999, vol. 120, no. 1, pp. 93-104.
29. Arora, Ajay; Sariram, R. K. y Srivastava, G. C. Oxidative stress and antioxidative system in plants. Current Science, 2002, vol. 82, no. 10, pp. 1227-1238.
30. Scandalios, J. G. Response of plant antioxidant defense genes to enviromental stress. Adv. Genet., 1990, vol. 28, pp. 1-41.
31. Mendoza, A. B. Estrategias para el uso de los mecanismos naturales de tolerancia al estrés en plantas. Departamento de Horticultura, Universidad Autónoma Agraria Antonio Narro, Buenavista, Saltillo, Coah. 25315 México. 2002. pp. 1-9.
32. Hamilton, C. A.; B., H. J.; McIntyre, M.; Graham, D. y Dominczak, A. F. Superoxide excess in hypertension and aging. Hypertension, 2001, vol. 37, pp. 5029-5033.
33. Mehlhorn, H.; Tabner, B. J. y Wellburn, A. R. Electron spin resonance evidence for the formation of free radicals in plants exposed to ozone. Physiol. Plant., 1990, vol. 79, pp. 377-383.
34. Rao, M. V.; Halen, B. A. y Ormrod, D. P. Amelioration of ozone-indiced oxidative damage in wheat plants grown under high carbon dioxide. Role of antioxidantes enzymes. Plant. Physiol., 1995, vol. 109, pp. 421-432.
35. Desikan, R.; Burnett, E. C.; Hancock, J. T. y Neill, S. J. Harpin and hydrogen peroxide induce expression of a homologue of go91-phoxin Arabidopsis thaliana suspension cultures. J. Exp. Bot., 1998, vol. 49, no. 327, pp. 1767-1771.
36. Dat, J.; Vandenabeele, S.; Vranova, E.; Van Montagu, M.; Inzé, D. y Van Breusegm, F. Dual action of the active oxygen species during plant stress responses. Cell Mol. Life Sci., 2000, vol. 57, pp. 779-795.
37. Gilmore, A. M. y Yamamoto, H. Y. Linear models relating xanthophylls and lumen acidity to non-photochemical fluorescence quenching. Evidence that antheraxanthin explains zeaxanthin-independent quenching. Photosynthesis Research, 1993, vol. 35, pp. 67-78.
38. Richter, C. y Kass, G. E. Oxidative stress in mitochondria. Its relationship to cellullar Ca2+ homeostasis, cell death, proliferation and differentation. Chem. Biol. Interact., 1991, vol. 77, no. 1, pp. 1-23.
39. Polle, A. Defense against photooxidative damage in plants. Cold Spring Harbor Monograph Archive, 1997, vol. 34, pp. 623-666. DOI: 10.1101/08796502.34.623.
40. Polle, A. Photochemical oxidants: uptake and detoxification mechanisms. En: Responses of plant metabolism to air pollution and global changer. International Symposium; 4th, Responses of plant metabolism to air pollution and global change. 1998. 22 pp. ISBN 9073348951.
41. Foyer, C. H. Oxygen metabolism and electron transport in photosynthesis. 1997. pp. 587-621. DOI: 10.1101/087969502.34.587.
42. Scandalios, J. G. Oxidative stress and the Molecular Biology of Antioxidative Defenses. Cold Spring Harbor laboratory Press, 1997, pp. 992.
43. Foyer, C. H. Ascorbic acid. In: Alscher, R. G. and Hess, J. L. eds. Antioxidants in Higher Plants. Boca Raton, CRC Press, 1993, United States, pp. 31-58.
44. Neill, S.; Hancock, J. y Desikan, R. Hydrogen peroxide signalling. Current Opinion in Plant Biology, 2002, vol. 5, pp. 388-395.
45. Dell'Amico, J. M.; Morales, D.; Polón, R. y Fernández, F. Respuestas adaptativas a la sequía en el tomate inducidas por osmoacondicionamiento de plántulas. Cultivos Tropicales, 2006, vol. 27, no. 4, pp. 33-38.
46. Mittler, R. Abiotic stress, the field environment and stress combination. TRENDS in Plant Science, 2006, vol. 11, no. 1, pp. 15-19.
47. Piñuela Molina, J. R. Efecto de la pérdida de humedad en la germinación de semillas de alupay (Euphoria didyma Blanco). Zamorano Escuela Agrícola Panamericana: "El Zamorano": Honduras. 2001. 25 pp. [Consultado: marzo/2013]. Disponible en: <http:// hdl.handle.net/11036/1470> .
48. Leubner-Metzger, G. Functions and regulation of -1,3-glucanases during seed germination, dormancy release and after-ripening. Seed Science Research, 2003, vol. 13, pp. 17-34.
49. Leubner-Metzger, G. Brassinosteroids and gibberellins promote tobacco seed germination by distinct pathways. Planta, 2001, vol. 213, pp. 758-763.
50. Li, K. R.; Wang, H. H.; Han, G.; Wang, Q. J. y Fan, J. Effects of brassinolide on the survival, growth and drought resistance of Robinia pseudoacacia seedlings under water stress. New Forests, 2008, vol. 35, pp. 255-266.
51. Jager, C. E.; Symons, G. M.; Ross, J. J. y Reid, J. B. Do brassinosteroids mediate the water stress response? Physiol. Plant., 2008, vol. 133, pp. 417-425.
52. Nuñez Vazquez, Miriam; Pieters, Alejandro; Mazorra Morales, Luis M.; Reyes Guerrero, Yanelis; Rosabal Ayan, Lissy y Martínez González, Lisbel. Brasinoesteroides y las respuestas de las plantas al estrés ambiental. Instituto Nacional de Ciencias Agrícolas, Ediciones INCA. 2012. 80 pp. ISBN 978-959-7023-57-9.
53. Kadkhodaie, A. y Bagheri, M. Seed Treatment during Germination in Linseed to Overcome Salt and Drought Stresses (Linum usitatissimum L.). World Academy of Science, Engineering and Technology, 2011, vol. 73, pp. 373-377.
54. Bewley, J. D. y Black, M. Physiology and biochemistry of seeds in relation to germination. Springer-Verlag, New York. 1978. pp. 88-105.
55. Finch-Savage, William E. y Leubner-Metzger, Gerhard. Seed dormancy and the control of germination. New Phytologist, 2006, vol. 171, pp. 501-523.
56. Kucera, B.; Cohn, M. A. y Leubner-Metzger, G. Plant hormone interactions during seed dormancy release and germination. Seed Science Research, 2005, vol. 15, pp. 281-307.
57. Manfre, Alicia; LaHatte, Gabrielle; Climer, Cynthia y Marcotte, William. Seed Dehydration and the Establishment of Desiccation Tolerance During Seed Maturation is Altered in the Arabidopsis thaliana Mutant atem6-1. Plant and Cell Physiol, 2009, vol. 50, no. 2, pp. 243-253.
58. Cervantes, Emilio; Rodríguez, Antonio y Nicolás, Gregorio. Ethylene regulates the expression of a cysteine proteinase gene during germination of chickpea (Cicer arietinum L.). Plant Molecular Biology, 1994, vol. 25, pp. 207-215.
59. Grudkowska, M. y Zagdanska, B. Multifunctional role of plant cysteine proteinases. Acta Biochimica Polonica, 2004, vol. 51, no. 3, pp. 609-624.
60. Cherry, J. H. Nucleic Acid, Mitochondria, & Enzyme Changes in Cotyledons of Peanut Seeds during Germination. Plant Physiology, 1962, pp. 440-446.
61. Hara-nishimura, Lkuko; Takeuchi, Yuka; Nishimura, Mikio. Molecular Characterization of a Vacuolar Processing Enzyme Related to a Putative Cysteine Proteinase of Schistosoma mansoni. The Plant Cell., 1993, vol. 5, pp. 1651-1659.
62. Petruzzelli, L.; Kunz, C.; Waldvogel, R.; Meins, F. y Leubner-Metzger, G. Distinct ethylene- and tissue-speci®c regulation of b-1,3-glucanases and chitinases during pea seed germination. Planta, 1999, vol. 209, pp. 195-201.
Recibido: 13 de agosto de 2012
Aceptado: 8 de mayo de 2013
Lissy Rosabal Ayan, Reserva Científica del Departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700. Email: mnunez@inca.edu.cu