INTRODUCCIÓN
El cultivo del café (Coffea arabica L.) ha sido tradicionalmente uno de los rubros económicos más importantes de El Salvador por su aportación al Producto Interno Bruto (PIB), así como por la generación de empleo y su contribución a la conservación de la biodiversidad 1.
En la actualidad, tanto en El Salvador como en el mundo entero, el cambio en las condiciones climáticas está provocando el deterioro de los ecosistemas naturales debido al incremento en la temperatura, la ausencia o exceso de lluvias, etc. 2,3, incidiendo directa o indirectamente en la pérdida de flora y fauna silvestre, lo cual puede conllevar a generar resistencia genética de plagas y enfermedades sobre todo en cultivos comerciales. Este es el caso específico de la roya (Hemileia vastatrix), un hongo que tiene al cafeto como huésped obligado y crece sobre el envés de las hojas, donde forma círculos de color naranja o amarillo polvoso, provocando lesiones cloróticas con afectación de la función fotosintética, respiración y transpiración y que en los dos últimos años ha afectado de forma devastadora plantaciones comerciales de café en el área Centroamericana 3-5. En estos países se reportan pérdidas acumuladas por USD $ 243 millones por causa de la roya en los años 2012 a 2014. En El Salvador las pérdidas han sido alrededor de USD $ 25.9 millones 6. Las variedades más afectadas son las arábigas, que son las que brindan el café con mejor calidad de taza y son las más cultivadas en el país y Latinoamérica; sin embargo, debido a la estrechez genética ocasionada por ser originarias de unas pocas semillas traídas de Etiopía, surgen problemas como la pérdida de resistencia contra algunas enfermedades como la roya 6,7.
Otros factores también afectan la producción de café son las fluctuaciones del precio en el mercado internacional; políticas económicas nacionales y reducción de áreas de cultivo. Todo esto ha provocado que la productividad y el volumen de las exportaciones hayan experimentado disminuciones considerables.
Debido a lo antes expuesto, se hace primordial buscar estrategias que permitan reproducir materiales que en campo muestren una resistencia o tolerancia a la roya, manteniendo la calidad de taza, lo cual permitirá mejorar los rendimientos del cultivo. Al respecto, existe una accesión de café derivada de la variedad Bourbon, producida en una finca de la zona cafetalera del Municipio de Santa Ana, Departamento de la zona Occidental de El Salvador; la cual se ha resguardado durante varias generaciones y puede ofrecer una solución a estas eventualidades. A pesar de carecer del perfil genético de esta accesión, la resistencia a la roya se ha mantenido en campo durante mucho tiempo aún durante el apogeo del ataque de la roya, lo cual ha sido corroborado por personal técnico agrícola y por caficultores de la zona.
Aunado a este contexto, la técnica de la micropropagación de plantas es una alternativa viable para la reproducción de plantas élite a gran escala y en un corto período de tiempo, garantizando, además, la sanidad del material reproducido. Por otra parte, la caracterización molecular mediante marcadores microsatélite constituye una herramienta útil que permite verificar la estabilidad genética de los materiales vegetales micropropagados.
El café constituye un cultivo muy importante para la economía nacional de El Salvador, y por primera vez se ha trabajado en el establecimiento de un protocolo de micropropagación, que contribuye a la multiplicación rápida de plantas con calidad genética, por lo que los objetivos del trabajo fueron establecer un protocolo de micropropagación para la accesión de café Bourbon en estudio, así como realizar la caracterización molecular de las vitroplantas con marcadores microsatélite o secuencias simples repetidas (SSRs), con vistas a demostrar la afinidad genética entre ellas.
MATERIALES Y MÉTODOS
En el laboratorio de Cultivo de Tejidos Vegetales de UNICAES, se utilizaron semillas de café (Coffea arabica L.) de una accesión resguardada de la variedad Bourbon, las cuales se introdujeron en alcohol 70 % por 5 minutos. Posteriormente, se sometieron a una desinfección con cloro comercial (5,25 % de NaClO) al 50 % más dos gotas de Tween 80 por 15 minutos. Después se llevaron a flujo laminar para realizar tres enjuagues con agua estéril. Luego de efectuado este proceso, las semillas se introdujeron en una solución estéril de ácido bórico (0,5 %) y cisteína (25 mg L-1) 8, y se incubaron durante tres días en condiciones de oscuridad. Pasado este tiempo se retiró la solución, se enjuagaron tres veces con agua estéril y se procedió a extraer los embriones con mucho cuidado utilizando pinzas y bisturí.
El medio de cultivo utilizado para la fase de establecimiento de los embriones fue un MS 9 suplementado con 0,5 mg L-1 de 6-BAP (6-N-Bencilaminopurina), con un pH de 5,7. Los recipientes utilizados fueron frascos de vidrio con capacidad de 190 mL, aplicando un volumen de 28 mL de medio de cultivo a cada uno. La esterilización se realizó en autoclave a 121 °C y 15 libras de presión/pulg2, durante 15 minutos. Al germinar los embriones que se encontraban en la fase de establecimiento, fueron transferidos a condiciones de luz en el cuarto de crecimiento. El fotoperíodo de incubación fue de 16 horas de luz y 8 de oscuridad, con 1350 lux de intensidad, con temperatura promedio de 26 °C, la duración de esta etapa fue de 23 días. Para la etapa de multiplicación se empleó el medio MS con macrosales a la mitad, suplementado con 1,5 mg L-1 de 6-BAP y 30 g L-1 de sacarosa. Para esta etapa, las plantas germinadas de aproximadamente un mes fueron cortadas en secciones y colocadas verticalmente en el medio de cultivo; este proceso se continuó realizando aproximadamente una vez cada 25-30 días durante al menos cinco ciclos. Para la fase de desarrollo y enraizamiento se utilizó el medio de cultivo MS con dos tratamientos distintos: uno, que es la misma formulación del medio de multiplicación, pero sin la hormona 6-BAP (T1), y otro, también con macrosales a la mitad, más 2,5 mg L-1 de la auxina ANA (ácido naftalenacético) y 10 g L-1 de sacarosa (T2); permaneciendo en estas condiciones y en oscuridad durante un período de 14 días. Esto se realizó para favorecer el estímulo hormonal de la planta y dar inicio a la formación de raíces. Posterior a este tiempo, estas plantas se colocaron en medio MS de formulación anterior (medio de cultivo MS con macrosales a la mitad y sin hormona 6-BAP).
Cada una de las etapas o fases del proceso de micropropagación, en específico la multiplicación, tuvo una duración aproximada de 30 días, según fue el tiempo que las plantas tenían dos o tres entrenudos listos para el corte. El diseño experimental utilizado fue Completamente al Azar con cinco repeticiones. Las variables evaluadas fueron el número de brotes por explante en la fase de multiplicación; mientras que la altura de las plantas (cm), el número de pares de hojas, el número de plantas que sobrevivieron y el largo de las raíces (cm), fueron evaluadas en la fase de desarrollo y enraizamiento. El análisis estadístico de los datos fue Análisis de Varianza (ANOVA), con comparación de medias por Tukey (p≤0,01). Se empleó el programa estadístico Statgraphics Centurion XVI.I.
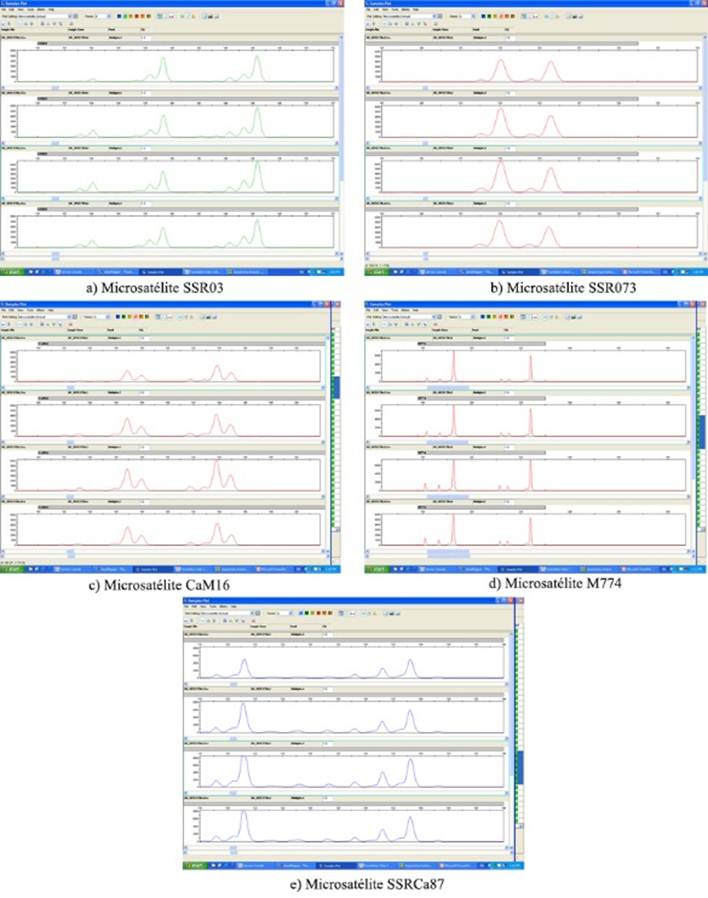
La estabilidad de las plantas micropropagadas se valoró mediante la huella de ADN, la cual se obtuvo con marcadores microsatélite o secuencias simples repetidas (SSRs) 10. Se seleccionó un subconjunto de seis vitroplantas, que fueron liofilizadas y guardadas para mientras se realizaba el análisis. De esas plantas se utilizaron 40 mg de las hojas para extraer el ADN mediante un método basado en CTAB 11. El ADN extraído se visualizó en un gel de agarosa al 1 % y se cuantificó mediante espectrofotometría (NanoDrop, ThermoScientific, USA); el ADN se ajustó a 50 ng µL-1 para la PCR de los microsatélites. El ADN de cada una de las seis muestras se amplificó con 10 microsatélites (Tabla 1) que han mostrado polimorfismo para el género Coffea11-16.
Cada reacción de PCR tuvo en concentración final los siguientes componentes: ~100 ng de ADN extraído, 1X de Master Mix Maxima Hot Start PCR (ThermoScientific, USA) el cual contiene la ADN polimerasa, la concentración final a 200 µM de cada dNTP y 2 mM de cloruro de magnesio. Cada cebador tenía una concentración final de 0,2 µM, estando el cebador de adelantamiento fluorocromado. La reacción de PCR se llevó a cabo en un volumen final de 25 µL. El programa de termociclado fue de una desnaturalización inicial a 95 °C durante 5 min; 35 ciclos de 95 °C durante 30 s, 55 °C durante 30 s y 72 °C durante 1 min, con una extensión final de 72 °C durante ocho minutos. Los productos de PCR se visualizaron mediante electroforesis capilar en un equipo ABI 3130xl (Applied Biosystems, USA) en un capilar de 50 cm y en la matriz POP7. El tamaño de los fragmentos se obtuvo con el programa GeneMapper 4.0, usando como referencia el marcador interno de masa molecular GeneScan LIZ600®.
Tabla 1 Marcadores microsatélites y cebadores empleados en el análisis de la estabilidad genética del material micropropagado de café (Coffea arabica)
| Nombre del microsatélite | Secuencia del cebador de adelantamiento (5’ - 3’) | Secuencia del cebador reverso (5’ - 3’) | Referencia |
|---|---|---|---|
| SSR04 | GGTCGCTCACTCATATCTTCCAG | GCCTGGAAAGCAAACGTCTCA | 12 |
| SSRCa087 | TCACTCTCGCAGACACACTAC | GCAGAGATGATCACAAGTCC | 15 |
| M753 | GGAGACGCAGGTGGTAGAAG | TCGAGAAGTCTTGGGGTGTT | 14 |
| SSRCa088 | TACCTCTCCTCCTCCTTCCT | ATTTCTATGGACCGGCAAC | 16 |
| CaM16 | AAGGCAGCTGAAGCGGGACAAA | TGGGGAGAGCTGCAGTTGGAGG | 14 |
| M24 | GGCTCGAGATATCTGTTTAG | TTTAATGGGCATAGGGTCC | 17 |
| M764 | CTGGCATTAGAAAGCACCTTG | GCTTGGCTCACTGTAGGACTG | 18 |
| M32 | AACTCTCCATTCCCGCATTC | CTGGGTTTTCTGTGTTCTCG | 17 |
| SSR03 | GGACAAAACACCGCCCAAAATA | AGCGAGACAGAGGAAGGGAATATT | 16 |
| SSR073 | GAGGTCTTCCCACCACAACA | GGATACGAGAGTCCCTTCC | 15 |
RESULTADOS
La germinación de los embriones comenzó a partir de los 13 días de siembra en la fase de establecimiento y se completó al cumplir un mes, cuando las vitroplantas ya presentaban dos pares de hojas verdaderas. Luego, dio inicio la fase de multiplicación, estudiándose cinco ciclos. Las tasas de multiplicación fluctuaron con un decremento en el ciclo 2, seguido por un aumento en el ciclo 3 (con diferencias estadísticas p≤0,01, según Tukey), para luego disminuir nuevamente en el número 4, y a partir de ahí, parece estabilizarse con una tendencia a fluctuaciones mayores (Figura 1).
Las vitroplantas siempre estuvieron vigorosas y con coloración verde intensa; cada planta presentaba de cuatro a seis pares de hojas cada mes, permitiendo un nuevo corte. En esta fase también hubo aparición espontánea de raíces en la mayoría las plantas. Se observó además, que en todos los ciclos de multiplicación era necesario cambiar los medios de cultivo cada 25 o 30 días, momento a partir del cual al parecer las plantas agotaban los nutrientes provocando que el follaje comenzara a ponerse necrótico.
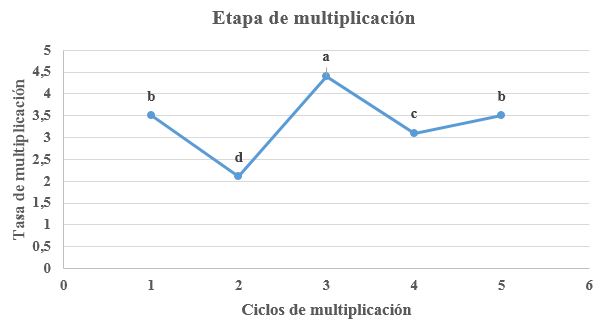
Figura 1 Tasas de multiplicación (o número de brotes por explante) de las plantas de café (Coffea arabica) correspondientes a cinco ciclos de multiplicación bajo condiciones in vitro (p≤0,01)
Luego de seis días de comenzar la fase de desarrollo y enraizamiento, se observó que las vitroplantas del tratamiento con ANA y 10 g L-1 de sacarosa (T2) comenzaron a formar raíces más robustas que las plantas del tratamiento T1 (Figura 2); no obstante, presentaron formación de callo en la base de la planta. Al cabo de un mes de encontrarse en esta fase de desarrollo, las raíces de esas plantas se encontraban más numerosas y largas en el tratamiento T1, además de haber formado, en algunos casos, brotes alrededor del explante original.
 A) Medio MS sin hormona y 30 g L-1 de sacarosaB) Medio MS más 2,5 mg L-1 de ANA y 10 g L-1 de sacarosa
A) Medio MS sin hormona y 30 g L-1 de sacarosaB) Medio MS más 2,5 mg L-1 de ANA y 10 g L-1 de sacarosaFigura 2 Imágenes de la fase final de enraizamiento in vitro de una accesión de café (Coffea arabica) de la variedad Bourbon, luego de 30 días, bajo dos tratamientos
En la Tabla 2 se presentan las variables evaluadas en esta fase. En general, se observa que la altura de las plantas presentó tendencia a ser mayor en T1, sin diferencias estadísticas. No obstante, el número de raíces y el largo de las mismas fueron mayores en T2; con diferencias estadísticas.
Tabla 2 Resultado de las variables del crecimiento evaluadas al finalizar la fase de desarrollo y enraizamiento de las plantas de café obtenidas in vitro, en dos medios de cultivo diferentes: T1- Medio MS sin hormona y 30 g L-1 de sacarosa, T2- Medio MS más 2,5 mg L-1 de ANA y 10 g L-1 de sacarosa
| Variables | Tratamiento | Media | Significación(a) |
|---|---|---|---|
| Altura de las plantas (cm) | 1 | 2,52 | n.s. |
| 2 | 2,35 | ||
| No. de pares de hojas | 1 | 3,92 | n.s. |
| 2 | 4,26 | ||
| No. de raíces | 1 | 1,17 | ** |
| 2 | 2,74 | ||
| Largo de las raíces (cm) | 1 | 3,19 | ** |
| 2 | 5,97 |
a: n.s. = no significativo; ** = diferencias significativas según la prueba de Tukey (p≤0,01)
Los resultados del estudio molecular de 10 microsatélites en cada una de las muestras de café analizadas revelaron la estabilidad genética del material micropropagado (Figura 3). En este caso se muestran los resultados de los productos de PCR visualizados como perfiles mediante electroforesis capilar.
DISCUSIÓN
En primer lugar se puede mencionar que si bien la propagación vegetativa es complicada para Coffea arabica17, este método de obtención del embrión cigótico adaptado del procedimiento realizado en el Laboratorio de Biotecnología del INCA (Cuba) 8 para variedades robustas, facilita la reproducción de algunos cultivares arábigos, entre ellos esta accesión derivada de la variedad Bourbon empleada para este ensayo. La utilización de este método de propagación pudiera parecer que conlleva a una variación genética; sin embargo, el estudio realizado con los marcadores moleculares microsatélites demostró que las plantas producidas por esta vía son clones propagados a partir de una sola planta donadora de tejido (Figura 3) y por tanto conservan las mismas características genéticas entre ellas.
Según Armendáriz 19, la función principal de la etapa de multiplicación es incrementar el número de propágulos en cultivo para aumentar la disponibilidad de plantas. En este caso, la multiplicación se realizó durante cinco ciclos y no presentó un comportamiento uniforme; puesto que mientras un ciclo incrementaba la tasa de producción de brotes, al siguiente tendía a disminuir. No obstante, se observó que durante la mitad del ciclo reproductivo ocurrió un incremento de producción, alcanzando una tasa de 4,5 (Figura 1). Esta situación pudiera deberse a que el material ha tenido un mayor vigor en esa etapa; ya que, según mencionó Condori 20, con concentraciones de 6- BAP entre 1 o 2 mg L-1 se obtiene el máximo número de brotes en los materiales juveniles. En este trabajo se obtuvo con dosis de 1,5 mg L-1. A pesar de ello, se considera que la producción de brotes por explante por esta vía es menor que la producida por meristemos ortótropos o plagiótropos 21. Además, Lozano 22 recomienda no realizar más allá de un quinto ciclo de multiplicación, debido a la disminución considerable en el número de brotes producidos por explante.
En la fase de desarrollo y enraizamiento, el método de golpe hormonal del tratamiento 2 durante 14 días y luego regresarlas a un medio de carencia hormonal, se utilizó para producir estrés en las plantas, lo cual provoca a su vez una aceleración en el metabolismo y el desarrollo de nuevos tejidos para sobrevivir 23. Sin embargo, en el caso de T2, se presentó formación de callo en la base de las plantas; no así en T1, que contenía medio MS con macrosales a la mitad, 30 g L-1 de sacarosa y sin hormonas. Precisamente uno de los efectos de las auxinas, además de la elongación de los tejidos, es la formación de callos en la base de los brotes; esto contrarresta el resultado obtenido por Dublin 24.
En T2, la aparición de las raíces demoró más de siete días, pero al final fueron más numerosas y largas que las del T1, con diferencias significativas (Tabla 2). Sobre este aspecto, también se puede hacer notar que la dosis de 6- BAP empleada en el medio no inhibió la formación de raíces en las plantas regeneradas, ya que espontáneamente se producían desde la fase de multiplicación; en parte, porque la dosis empleada no fue tan alta, sino de 1,5 mg L-1.
En general se puede decir que el número y largo de raíces de las plantas regeneradas se favorecieron por la presencia de la auxina ANA en el medio de cultivo, ya que es una hormona excelente en la inducción de elongación de los tejidos 8,25.
Se utilizó la técnica de marcadores microsatélite (SSRs) por la ventaja de ser más reproducible que otros sistemas de marcadores moleculares 26. Por lo tanto, es fácil establecer ensayos para validar los datos de la huella genética debido a que la secuencia de los cebadores es invariable y pueden ser fácilmente aplicados en diferentes laboratorios. Se observó que las seis muestras de plantas presentaron el mismo genotipo para el conjunto de 10 microsatélites empleados, lo que indica que estas muestras tienen el mismo perfil genético entre ellas y podría demostrar que son clones propagados a partir de una planta donadora de tejido. Si bien no se cuenta con un perfil genético de la planta donadora, el cultivo muestra estabilidad a nivel de campo.
El análisis en GeneMapper mostró que las muestras analizadas poseen más de dos alelos diferentes para algunos microsatélites, con un máximo de cuatro alelos y un mínimo de dos. Los microsatélites son marcadores codominantes, es decir, para un mismo locus pueden detectar individuos homocigotos y heterocigotos. En el caso de Coffea arabica, significa que en cada copia del genoma los individuos pueden tener hasta ocho alelos diferentes, en caso de que cada copia sea heterocigota. O bien si cada copia es homocigota se observarán cuatro alelos.
En el caso de los microsatélites que amplificaron cuatro alelos, no se puede determinar si cada copia del genoma es homocigota ya que los alelos poseen pesos moleculares similares. O bien pudiese ser que dos copias son heterocigotas para un juego de alelos y otras dos copias son heterocigotas para otro juego de alelos.
CONCLUSIONES
Finalmente se puede decir que con base a la metodología empleada en este ensayo, es factible la micropropagación de café arábigo, en especial de esta accesión de café Bourbon, que ha sido propagada por el embrión sexual a partir de semilla, y que su estabilidad genética se mantiene entre las plantas resultantes, lo cual se evidenció mediante los microsatélites utilizados.











 texto en
texto en