Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Medicina Tropical
versión On-line ISSN 1561-3054
Rev Cubana Med Trop v.63 n.2 Ciudad de la Habana mayo.-ago. 2011
Pneumocystis jirovecii: cien años de historia
Pneumocystis jirovecii: one hundred years of history
Enrique Calderón Sandubete,I Yaxsier de Armas Rodríguez,II Virginia Capó de PazIII
IDoctor en Medicina. Especialista en Medicina Interna. Profesor Asociado Universidad de Sevilla. Instituto de Biomedicina de Sevilla (IBIS), Centros de Investigación Biomédica en Red en Epidemiología y Salud Pública (CIBERESP) y Servicio de Medicina Interna, Hospital Universitario Virgen del Rocío, Sevilla, España.
IIMáster en Entomología Médica y Control de Vectores. Máster en Epidemiología. Licenciado en Bioquímica. Investigador Agregado. Instructor. Departamento de Anatomía Patológica. Instituto de Medicina Tropical "Pedro Kourí" (IPK). La Habana, Cuba
IIIDoctora en Ciencias Médicas Diagnósticas. Especialista de II Grado en Patología. Investigadora Titular. Profesora Titular. IPK. La Habana, Cuba.
RESUMEN
Introducción: Pneumocystis jirovecii es uno de los patógenos oportunistas más importantes que afectan a individuos con síndrome de inmunodeficiencia adquirida y pacientes inmunodeprimidos por otras causas. A pesar de haber sido observado por primera vez hace más de 100 años, se desconocen aún muchos aspectos importantes de su biología y de la morbilidad que produce.
Objetivo: en este trabajo se pretende presentar una actualización sobre los principales aspectos de la historia, la epidemiología y la biología de P. jirovecii, así como de la enfermedad que produce.
Conclusiones: se han publicado varios artículos de revisión desde su descubrimiento que brindan detalles y elementos novedosos del microorganismo, sin embargo, pocos son los manuscritos encontrados en la literatura de habla hispana que aborden esta problemática.
Palabras clave: Pneumocystis, epidemiología, biología, historia, revisión.
ABSTRACT
Introduction: Pneumocystis jirovecii is one of the most important opportunistic pathogens affecting AIDS individuals and immunodepressive patients. In spite of the fact that it was observed one hundred years ago for the first time, many fundamental aspects of its biology and the morbidity it causes are still unknown.
Objective: this paper was aimed at presenting updating on the main aspects of the history, the epidemiology and the biology of P. jirovecii and the disease it causes.
Conclusions: a number of review articles have been published since the discovery, all of which provide details and novel elements of the microorganism. However, few original papers dealing with this problem have been found in the Spanish literature.
Key words: Pneumocystis, epidemiology, biology, history, review.
INTRODUCCIÓN
Pneumocystis jirovecii, anteriormente conocido como Pneumocystis carinii f. sp. hominis, continúa siendo uno de los patógenos oportunistas más importantes que afectan a individuos con síndrome de inmunodeficiencia adquirida (sida) y pacientes con inmunodepresión debida a otras causas, en los que produce una neumonía (Pneumocystis pneumonia (PcP), siglas en inglés) grave con una alta tasa de morbilidad y mortalidad.1 Hace justo 101 años de la primera evidencia aportada por Carlos Chagas de la existencia de este microorganismo. A lo largo de este tiempo se han producido importantes avances en el conocimiento sobre la epidemiología, biología y genética de este patógeno; lo cual ha condicionado cambios en su clasificación taxonómica y en la comprensión de la historia natural de la PcP.1
Desde su descubrimiento, y durante muchos años, Pneumocystis fue considerado un protozoo, aunque hoy se reconoce como un hongo atípico. Por otra parte, se pensaba que existía una sola especie del microorganismo que infectaba a todos los mamíferos y, por tanto, se creía que la PcP en la especie humana podría ser una zoonosis y el reservorio cualquiera de los mamíferos con los que puede cohabitar el hombre de forma habitual. Sin embargo, estudios genéticos con técnicas de biología molecular pusieron de manifiesto que existían diversas especies de Pneumocystis con una estrecha afinidad por su huésped (estenoxenismo). Por otra parte, el desarrollo de técnicas moleculares para la identificación de este patógeno ha permitido estudiar mejor su epidemiología y poner en evidencia que la PcP constituye solo la punta del iceberg de la infección por P. jirovecii en la especie humana.2
Aunque se han publicado diversos artículos de revisión sobre la infección por Pneumocystis en lengua inglesa, son muy pocos los manuscritos encontrados en la literatura de habla hispana que aborden esta problemática. El objetivo de este artículo es facilitar una actualización, en español, sobre los principales elementos de la historia, la epidemiología y la biología de P. jirovecii, así como de la enfermedad que produce.
HISTORIA
Los microorganismos que hoy se conocen como Pneumocystis se observaron por primera vez en 1909 por Carlos Chagas (1879-1934), mientras investigaba una nueva enfermedad que afectaba a los trabajadores que estaban tendiendo las vías del ferrocarril central en el estado brasileño de Minas Gerais. Chagas observó en los pulmones de cobayos que fallecían a los 5 d de ser inoculados con sangre que contenía un nuevo "tripanosoma" humano, la presencia de numerosas formas esquizogónicas que interpretó de modo erróneo como una parte del ciclo vital del Trypanosoma cruzi, que él denominó por ello Schizotrypanum cruzi.3 Antonio Carini (1872-1950) director en ese momento del Instituto Pasteur de São Paulo, 1 año después hizo una descripción similar de quistes en el pulmón de ratas infectadas con Trypanosoma lewisi.4 Sin embargo, quizás ante la sospecha de que los quistes pertenecieran a un organismo desconocido, envió muestras histológicas a su colega del Instituto Pasteur de París, Charles Louis Alphonse Laveran, uno de los parasitólogos de mayor prestigio mundial que había recibido el Premio Nobel en 1907 por sus estudios sobre paludismo.
En el Instituto Pasteur dos discípulos de Laveran, el matrimonio Delanöe, investigando en ratas de las cloacas de París que no estaban infectadas por tripanosomas, observaron quistes similares en los pulmones de estos animales. De esta forma en 1912 pudieron aclarar, revisando las publicaciones previas y las preparaciones de Carini, que esos peculiares quistes observados por Chagas y Carini correspondían en realidad a un nuevo género y especie desconocidos sin relación con los tripanosomas. El matrimonio Delanöe sugirió para el nuevo microorganismo el nombre de Pneumocystis carinii. Pneumo- por su tropismo por el pulmón; -cystis por su morfología característica, y carinii en honor del Dr. Antonio Carini que les había facilitado sus preparaciones histológicas.5 El matrimonio continuó sus investigaciones y realizaron numerosos experimentos, los cuales revelaron que el nuevo organismo se transmitía por vía aérea; confirmaron su tropismo por el pulmón y sugirieron su afinidad con la familia de las Coccidia, organismos del orden de los esporozoos.
Después de la comunicación de los resultados de su trabajo, tanto Carini como Chagas se retractaron de sus descripciones originales. Ellos aportaron datos que sustentaban la investigación del matrimonio francés y Chagas tuvo que modificar su descripción inicial del ciclo vital del Trypanosoma cruzi. En 1913, Arãgao sugirió que este nuevo organismo debería colocarse dentro del género Klebsiella, aunque reconoció su semejanza con otro protozoo encontrado en el intestino de los ratones, el Cryptosporidium. Comenzaban así las dudas sobre su ubicación como protozoo.6
Los pocos estudios que siguieron a estas descripciones estuvieron orientados a conocer la distribución de Pneumocystis en el reino animal. Su presencia en una gran variedad de mamíferos (ratas, cobayos, monos y conejos en Brasil, ratas y ratones en Gran Bretaña y ratones en Suiza) sin evidencia de enfermedad hizo cuestionar su patogenicidad.7 Esto conllevó a una disminución del interés científico por este microorganismo y a considerarlo como una curiosidad biológica, por lo que en las dos décadas siguientes las publicaciones médicas fueron escasas y un gran silencio lo acompañó.6
Una generación debió pasar antes de que pudiera relacionarse a Pneumocystis con alguna enfermedad en el hombre aunque, quizás de forma inadvertida, Chagas ya había descrito en 1911 la presencia de los quistes típicos de Pneumocystis en la primera autopsia de un sujeto fallecido con tripanosomiasis americana. En 1938 Ammich8 y Benecke9 reconocieron una forma de neumonía de origen desconocido que afectaba típicamente a niños prematuros y(o) malnutridos, la cual se denominó neumonía intersticial de células plasmáticas y adquirió proporciones epidémicas en Europa Central en el preludio de la Segunda Guerra Mundial y en los años inmediatamente posteriores. En pleno apogeo de la guerra, dos científicos holandeses, van der Meer y Brug demuestran por primera vez una asociación histológica entre la neumonía intersticial de células plasmáticas y Pneumocystis, aunque su descubrimiento pasó casi inadvertido. Una década después, tres investigadores checos, Vanêk, Jírovec y Lukes hallaron la etiología de esta forma de neumonía, por lo que son considerados con frecuencia como sus primeros descubridores.6
En ese momento se pensaba que Pneumocystis solo afectaba a niños y no es hasta el inicio de la década de los sesenta cuando comienzan a describirse en EE. UU. los primeros casos de PcP en pacientes adultos sometidos a quimioterapia o radioterapia por procesos neoplásicos, así como sujetos con defectos congénitos de la inmunidad.10 Entonces no se disponía de estudios que evaluaran el impacto real de la PcP. Sería en 1974, cuando Peter Walzer realizó el primer estudio amplio, al recopilar datos de 194 casos confirmados de PcP. Esta investigación arrojó que la malnutrición era un factor de riesgo para desarrollar la enfermedad y demostró además que esta podía presentarse en los pacientes con leucemias, linfomas, tumores sólidos y con trasplantes, lo que abrió las puertas a la investigación en esos grupos poblacionales.11
Los años entre 1970 y 1980 resultaron muy importantes en el estudio de Pneumocystis, porque unido al conocimiento alcanzado mediante la microscopia electrónica y los métodos de tinción existentes (plata metenamina de Gomori y Giemsa), aparecieron los primeros estudios con anticuerpos aislados de sueros de ratas. Los resultados fueron realmente sorprendentes, porque los anticuerpos procedentes de los sueros de ratas no reaccionaban con Pneumocystis obtenidos de humanos, pero sí lo hacían con otros procedentes de ratas.12 Estas diferencias inmunológicas condujeron a Frenkel en 1976, a plantear la hipótesis de que la especie de Pneumocystis que afectaba al hombre era diferente de la que infectaba a las ratas, a pesar de no poseer diferencias morfológicas distinguibles. El nuevo nombre propuesto sería Pneumocystis jiroveci en honor al científico checo Otto Jirovec, quien en 1951 relacionara el patógeno con la neumonía que aparecía en los niños prematuros y malnutridos.12
Más tarde, en febrero de 1981, Sandra Ford, una auxiliar de farmacia de los centros para la prevención y el control de las enfermedades (CDC, siglas en inglés) de EE. UU., notó un incremento inusual de las peticiones de pentamidina para el tratamiento de la neumonía por Pneumocytis que le llegaban desde Nueva York y se dio cuenta además que no correspondían a sujetos con causas conocidas de inmunodepresión. Envió una carta a sus superiores alertándolos de estos hechos, que constituían la primera evidencia de la eclosión de la epidemia de sida.6 Se descubría de esa manera los primeros casos de sida gracias a la infección de pacientes por un patógeno oportunista.
Desde ese momento y hasta la actualidad se reconoce a Pneumocystis como uno de los principales patógenos oportunistas que afectan tanto a pacientes infectados por el virus de inmunodeficiencia humana (VIH) como a sujetos que presentan cualquier otra causa de inmunosupresión.
TAXONOMÍA
La clasificación taxonómica de Pneumocystis ha sido problemática desde su descubrimiento y ha cambiado a largo de los años. Como se ha comentado, tras su identificación y durante muchos años Pneumocystis fue considerado un protozoo, debido a sus características morfológicas, su resistencia a los antifúngicos clásicos y su respuesta al tratamiento con pentamidina (tabla 1). Sin embargo, en 1970, Vavra y Kucera sugieren, basados en sus estudios ultraestructurales, que Pneumocystis puede ser un hongo.13 Ellos plantearon un prolongado debate sobre la naturaleza de este microorganismo que se vería esclarecido con el advenimiento de las técnicas de biología molecular.
La primera evidencia molecular de que este microorganismo es un hongo fue aportada por Edman y otros en 1988. Estos investigadores encontraron que la secuencia nucleotídica del gen 16 S del ARN ribosómico de Pneumocystis presentaba mayor similitud la de los hongos que la de los protozoos. Estos mismos resultados fueron corroborados por Stringer y otros 1 año más tarde.14 Además, otros genes importantes como la subunidad mayor del ARN del ribosoma mitocondrial (mt LSU rRNA, siglas en inglés) y otros 7 genes contiguos mitocondriales mostraron una significativa homología con sus respectivos genes en los hongos. Otras evidencias importantes se identificaron; entre otras, se destaca la presencia en Pneumocystis de un tercer factor de elongación en la síntesis proteica, elemento necesario para realizar este proceso en los hongos, que se encuentra ausente en el resto de los organismos eucariotas. Finalmente, la timidilato sintasa (TS) y la dihidrofolato reductasa (DHFR) en Pneumocystis son dos enzimas diferentes, mientras en los protozoos es una proteína con doble función.6
Las técnicas moleculares también evidenciaron que existía una gran heterogeneidad genética en Pneumocystis, heterogeneidad que está clara y estrictamente correlacionada con la especie del huésped.15 Para reflejar estas diferencias se propuso en 1994 de forma provisional, mientras se describían o reescribían cada una de las especies del género Pneumocystis, un sistema de denominación trinomial que utilizaba la denominación Pneumocystis carinii en todos los casos seguida de "forma specialis" (f. sp.). En este sistema, el microorganismo que infecta a los humanos correspondía a Pneumocystis carinii f. sp. hominis, mientras que Pneumocystis carinii f. sp. carinii es una de las especies que infecta a las ratas y Pneumocystis carinii f. sp. murine el que infecta al ratón.16
Sin embargo, Frenkel en 1976 ya había propuesto el nombre de Pneumocystis jiroveci para el patógeno que afecta al hombre, en aquel momento el organismo fue clasificado como protozoo y el nombre se encontraba en concordancia con la Nomenclatura Internacional de Códigos Zoológicos. Sin embargo, al demostrarse que Pneumocystis pertenecía al reino de los hongos, su nombre debía corresponder con la Nomenclatura Internacional de Códigos Botánicos (ICBN, siglas en inglés). Eso conllevó a que cambiara el nombre anterior por el de Pneumocystis jirovecii (ICBN artículos 32.7 y 60.11). Su ubicación taxonómica actual es en el Reino: Fungi, Phylum: Ascomycota, Clase: Pneumocystidomycetes, Orden: Pneumocystidales y Familia: Pneumocystidacae.17
EPIDEMIOLOGÍA
Organismo
Pneumocystis jirovecii es un hongo atípico, extracelular, ubicuo, unicelular, no cultivable y con marcado estenoxenismo. Usualmente se encuentra restringido a los pulmones, aunque se ha demostrado su presencia en otras regiones del cuerpo. En la actualidad se han registrado casos de PcP en todos los continentes del mundo, excepto en la Antártica.18
Ciclo de vida
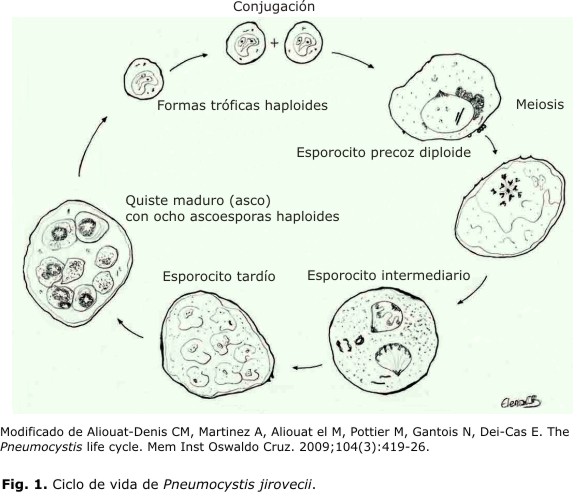
El ciclo de vida de Pneumocystis ha sido revisado recientemente, pero la ausencia de proliferación de este hongo atípico en medios de cultivos tradicionales ha impedido esclarecer detalles importantes. Están interrelacionadas en el ciclo de vida 3 principales formas morfológicas: las tróficas, las esporocíticas y los quistes maduros (Fig. 1). Cada una de ellas difiere en cuanto a tamaño, diámetro de la pared celular, así como en la filopodia (proyecciones citoplasmática). También otras diferencias como la forma del estadio, presentes en el ciclo de vida, varían desde irregular en la forma trófica, hasta ovoide en el resto de las formas morfológicas. Se considera que las formas tróficas son el estadio más abundante en el ciclo de vida del organismo, que representa de 90 a 95 % de la población de Pneumocystis en el pulmón del paciente infectado.19 En 1984, Matsumoto y Yoshida observaron la formación del complejo sinaptonémico en el núcleo de esporocitos tempranos, lo que sugiere la división mitótica del ciclo sexual.20 Con estas y otras evidencias importantes, se sugiere un ciclo de vida peculiar, donde tanto la forma asexual como sexual se plantean como modo de multiplicación del patógeno.19,20
Microbiología
El principal obstáculo en el conocimiento de la biología y para el estudio genético de Pneumocystis radica en su carencia de crecimiento continuo en medios de cultivo in vitro.2 El intento por obtener Pneumocystis no deja de ser interesante y muchos investigadores no han perdido el interés por el tema. En 1979, Bartlett y otros consiguieron mantener el microorganismo durante un tiempo breve en una línea celular de mamíferos21 y en 1990, Cushion y otros en un medio axénico.22 Posteriormente, utilizando otra vez líneas celulares de mamíferos cocultivadas, se logró mantener la infectividad en animales experimentales durante 42 d, aunque el número de microorganismos disminuía a los 10 d de inicio del experimento.23 Por último, Merali y otros comunicaron el logro del cultivo continuo de Pneumocystis carinii en medio axénico, sin embargo, este hallazgo no ha podido ser reproducido en otros laboratorios, por lo cual queda aún como un reto pendiente.24
Lo esencial que ha ayudado a esclarecer algunas cuestiones sobre la biología de Pneumocystis ha sido el desarrollo de modelos animales de neumocistosis. Varios mamíferos han servido como ejemplo, donde se ha logrado desarrollar la PcP. Estos experimentos son de suma importancia para estudios bioquímicos, evaluaciones de fármacos y para la visualización microscópica del ciclo de vida del patógeno.25
La carencia de ergosterol en la membrana es otra característica fenotípica de interés en Pneumocystis, que lo diferencia del resto de los hongos. Este lípido es el principal esterol en la membrana de los hongos, en cambio Pneumocystis presenta colesterol, encontrado fundamentalmente en las membranas de los mamíferos. La ausencia de ergosterol en su membrana explica su resistencia natural a la anfotericina B.26
Desde el punto de vista proteico, lo fundamental de Pneumocystis radica en la glicoproteína mayor de superficie (MSG, siglas en inglés), la más abundante en el microorganismo. Se estima que constituye las tres cuartas partes de las proteínas totales, siendo esta la primera aislada y caracterizada en el microorganismo. Posee un peso molecular de 120 KDa, con un porcentaje de carbohidratos entre 5 y 10 %; la manosa es el principal componente de sus hidratos de carbono.27 La MSG desempeña un papel importante al presentar una gran variabilidad antigénica, que probablemente sirve para evadir la respuesta inmune del huésped. También se ha reportado que la síntesis de antígenos recombinantes se ha utilizado para estudios seroepidemiológicos y de respuesta serológica frente a la infección por Pneumocystis.28
La PCSTE20 y la PCMAPK son otras proteínas importantes en el patógeno. Se ha demostrado que estas moléculas participan en los cambios morfológicos, el ciclo sexual y en la unión del hongo a las células del epitelio alveolar.29 Asimismo, las PRT1 también desempeñan una función relevante relacionada con la degradación de moléculas exógenas y con los procesos de variación antigénica del microorganismo.30 La proteína de choque térmico 70 (hsp 70) es otra de las más abundantes en Pneumocystis, se involucra en procesos relacionados con el estrés, con un papel esencial en el metabolismo del hongo.31 La importancia de la dihidropteroato sintetasa (DHPS) radica en su posible vínculo con la resistencia a las sulfamidas. Por otra parte, la identificación de mutaciones presentes en el gen que controla la síntesis de esta enzima resulta útil para estudios de epidemiología molecular de Pneumocystis.1
Genética
El conocimiento del genoma de Pneumocystis puede esclarecer aún muchas cuestiones oscuras relacionadas con la biología de este patógeno. Sin embargo, la ausencia de crecimiento in vitro del microorganismo ha limitado de modo considerable los estudios relacionados sobre su polimorfismo genético. Técnicas moleculares relativamente sencillas de llevar a cabo, como la amplificación al azar del ADN polimórfico (RAPD, siglas en inglés), no han podido emplearse debido a la limitante del cultivo microbiológico y a la mezcla del ADN del huésped cuando se utilizan modelos animales para la obtención de estos microorganismos.32
A pesar de estas dificultades, con otras técnicas moleculares como la electroforesis de campo pulsado (PFGE, siglas en inglés) se ha obtenido información importante sobre el hongo. Con esta metodología, se logró dilucidar que Pneumocystis tiene alrededor de 15 cromosomas lineales con un tamaño aproximado entre los 300 y 700 Kb. Se estima además, que el genoma total del microorganismo sea de 7,7 Mb, con una composición nucleotídica rica en contenido de A/T (60-65 %). Es válido mencionar, que las regiones codificadoras del material genético contienen un intrón o más de tamaño corto, aproximadamente 50 pb. Otro elemento de sumo interés son las regiones terminales de los cromosomas, porque estos contienen genes que codifican antígenos de superficie del organismo.33 Para que se tenga en cuenta la dimensión del genoma lineal de Pneumocystis, una simple comparación de materiales genéticos de diferentes organismos arrojó que se ubica entre el genoma de E. coli (4,2 Mb) y el de Saccharomyces cerevisiae (12 Mb). Esta comparación de genomas resulta de mucho interés, porque revela posibles asociaciones entre el contenido de genes y el estilo de vida de los microorganismos considerados. Específicamente, en el caso de Pneumocystis, su dependencia del huésped para realizar muchas funciones vitales. Al parecer, la esencia de la cuestión, radica en que una parte sustancial del genoma de Pneumocystis no codifica ninguna proteína y ocupan un valor importante (10 %) los espacios intergénicos.34 Estimaciones realizadas sugieren que alrededor de 6 Mb del material genético de Pneumocystis puede ser codificable. Si se considera que el promedio de las proteínas del patógeno está alrededor de los 50 Kda, este genoma pudiera codificar unas 4 000 moléculas proteicas, lo cual coincide con lo comunicado para E. coli con su correspondiente menor tamaño (4,2 Mb).34
Muchas esperanzas se depositan en el proyecto de secuenciación del genoma de Pneumocystis carinii (http://pgp.cchmc.org), porque ayudaría a esclarecer cuestiones importantes sobre la biología del microorganismo.
Prevalencia e incidencia
Hasta 1980 la PcP no era frecuente y se asociaba con síndromes de inmunodeficiencias o situaciones de intensa inmunosupresión, particularmente con la quimioterapia del cáncer. En la pandemia del VIH, la neumocistosis emergió como la enfermedad más común definitoria de sida en los países industrializados. Antes de la introducción de la profilaxis, 60 % de los pacientes con sida eran identificados por presentarla. Además, se estimó que hasta 80 % de los pacientes con recuentos de linfocitos CD4+ menores que 200 células/mm3 podían desarrollar esta enfermedad.35
En la era de la terapia antirretroviral de gran actividad (TARGA) ha existido una franca disminución de muchas infecciones oportunistas y la PcP no es una excepción. Los casos de la enfermedad disminuyeron 3,2 % por año desde 1992 hasta 1995 con la utilización de quimioprofilaxis, y después con la introducción de la TARGA; la tasa continuó descendiendo hasta valores de 21,5 % por año desde 1996 hasta 1998.36 En la actualidad, la PcP presenta una incidencia de 9,5 episodios por 100 personas al año en pacientes infectados por el VIH; se observa en más de 50 % de los pacientes con sida.37 En un estudio prospectivo realizado recién en Uganda se demostró que la PcP no era una enfermedad tan rara como se creía en el continente africano, porque se identificó Pneumocystis jirovecii en 40 % de los individuos seropositivos al VIH.18
Actualmente la neumocistosis ha adquirido una importancia creciente, sobre todo, en sujetos inmunodeprimidos no infectados con el VIH, como pacientes con cáncer, hemopatías malignas, afecciones inflamatorias crónicas donde se utiliza tratamiento con fármacos inmunodepresores y receptores de transplante de cualquier tipo. La incidencia de la enfermedad entre estos grupos de pacientes puede alcanzar hasta 40 %, con 50 % de mortalidad.37
La incidencia de la PcP varía de acuerdo con el tipo de proceso en los pacientes con cáncer, que oscila entre 22 y 45 % en aquellos con leucemia linfoblástica aguda o con linfoma no-Hodgkin; 25 % en los individuos con rabdomiosarcoma y 1,3 % en los sujetos con tumores sólidos que reciben tratamiento con esteroides. También, la PcP ha sido identificada como complicación del mieloma múltiple y la macroglobulinemia. Por otra parte, la PcP afecta a más de 25 % de los pacientes con inmunodeficiencia severa combinada.38
En los individuos sometidos a trasplante cardíaco se ha descrito una incidencia de 2 a 10 % de la enfermedad, que varía de acuerdo con su distribución mundial. Por otra parte, se ha estimado una incidencia de la PcP de 25 % en los pacientes sometidos a trasplantes de pulmón y de corazón-pulmón.39
La PcP también puede afectar a pacientes con otros tipos de enfermedades, como granulomatosis de Wegener, asma, glomerulonefritis, rectocolitis ulcerosa; y otras condiciones como lupus eritematoso sistémico, poliarteritis nodosa, polimiositis, dermatomiositis, artritis reumatoide, sarcoidosis y pénfigo. En general son personas que han estado recibiendo terapia inmunosupresora intensa. Además, P. jirovecii ha sido vinculado con el desarrollo de trastornos autoinmunes como el desarrollo de anticuerpos anticardiolipina y el síndrome de Goodpasture.37-40
En dos investigaciones seroepidemiológicas se ha puesto de manifiesto que la primoinfección por Pneumocystis se produce en los primeros años de la vida y constituye una circunstancia muy frecuente. Estudios realizados en niños de España y Chile demostraron una seroprevalencia de 73 y 85 %, respectivamente.41,42 También, existe evidencia de la relación entre este fenómeno y el aumento de la edad (52 % a los 6 años, 80 % a los 13 años).42 Por otra parte, resulta interesante conocer que publicaciones realizadas en EE. UU. y España describen pacientes sin predisposición aparente o inmunocompetentes que desarrollaron PcP; sin embargo, este hallazgo es poco frecuente.43,44
La identificación del microorganismo por métodos moleculares como la RCP ha permitido demostrar la presencia del patógeno en diferentes muestras biológicas sin manifestaciones clínicas ni radiológicas de neumonía; ese fenómeno se conoce como colonización.45 Este hecho ha revolucionado la epidemiología de la PcP porque estas personas pueden actuar como reservorio del microorganismo y transmitirlo a otros individuos susceptibles. La colonización por P. jirovecii es frecuente en pacientes con infección por el VIH. Se ha descrito prevalencia desde 46 hasta 68 %, destacándose como factores de riesgos los niveles de CD4+ < 50 células/mm3, la ausencia de quimioprofilaxis con cotrimoxazol, el tabaquismo y la ciudad de residencia.46
Otro grupo importante de pacientes colonizados son aquellos con enfermedad pulmonar crónica, donde la prevalencia de colonización oscila desde 21,5 % en los pacientes con fibrosis quística (FQ) hasta 40,5 % en los casos con enfermedad pulmonar obstructiva crónica (EPOC). En pacientes con enfermedades pulmonares intersticiales, este fenómeno se observa en 33,8 %; que varía entre 19,8 % descrito en la sarcoidosis y 37,8 % observado en la neumopatía intersticial idiomática.46,47
Existe una hipótesis interesante, donde se sugiere que los niños pueden actuar como reservorio de Pneumocystis, esto se sustenta en que 85 % de ellos presentan anticuerpos contra este microorganismo a los 20 meses de edad. Además, 10 % de los niños sanos y 15 % de aquellos con síntomas respiratorios pueden estar colonizados por el patógeno.42
Un mejor conocimiento de la epidemiología de la PcP resulta esencial para poder trazar estrategias correctas, para la prevención de la neumonía por Pneumocystis en las poblaciones de riesgo donde este patógeno actúa.
Reservorio
El ADN de Pneumocystis ha sido detectado en muestras ambientales pero nunca se ha podido visualizar la presencia de organismos completos con técnicas microscópicas. Se ha comunicado la existencia de material genético de Pneumocystis en aguas de charcas y en el aire circundante en huertos; incluso en muestras obtenidas en habitaciones de pacientes con PcP, suponiéndose su capacidad infectiva. Sin embargo, ningún reservorio ambiental ha sido encontrado hasta ahora, aunque no puede excluirse esta posibilidad.48
El estudio comparativo del material genético de Pneumocystis, obtenido de diferentes mamíferos, ha demostrado que se trata de especies distintas; trabajos realizados con modelos animales han evidenciado la imposibilidad de que se produzcan infecciones cruzadas entre especies. Se demuestra que la PcP en el hombre es una antroponosis, donde el único reservorio es el ser humano.46
Recientemente, la situación de colonización por P. jirovecii se ha descrito en individuos de diferentes grupos poblacionales.49,50 A pesar de que el significado clínico de este fenómeno no está del todo esclarecido, este hallazgo tiene un efecto importante en la epidemiología de la PcP. En primera instancia, los individuos que estén colonizados pueden estar en riesgo de desarrollar la enfermedad. Por otra parte, estos individuos pueden actuar como reservorio del microorganismo y ser potencialmente transmisores del patógeno a sujetos susceptibles. Además, en pacientes colonizados por P. jirovecii la utilización prolongada de quimioprofilaxis puede seleccionar cepas de este patógeno con mutaciones que han sido asociadas con la resistencia a los fármacos de elección para su tratamiento. Por último, la simple presencia de este hongo atípico en el pulmón puede estimular una respuesta inflamatoria por el huésped y de esa manera ocasionar daños pulmonares.45
Transmisión
El modo de transmisión de P. jirovecii ha sido un aspecto interesante y no menos debatido en la epidemiología de este microorganismo a lo largo de varias décadas. Dos hipótesis fundamentales se han planteado: la reactivación de un foco latente del microorganismo en el cuerpo humano o la adquisición reciente de la infección.51 En la actualidad, gracias a evidencias moleculares, los estudios abogan por la adquisición reciente más que por la reactivación de una infección latente. La primera evidencia que soporta esta hipótesis fue demostrada por Keely y otros en 1996. Estos autores encontraron diferentes genotipos de P. jirovecii en pacientes con sida que habían sufrido episodios recurrentes de la enfermedad.52 Por otra parte, Beard y otros al realizar un estudio en pacientes con PcP de varias ciudades estadounidenses observaron la variación geográfica de los genotipos de P. jirovecii. Estos investigadores demostraron que el genotipo presente en el momento del diagnóstico del paciente correspondía al lugar de residencia actual y no a su lugar de nacimiento. Si hubiese sido una reactivación de una infección latente, el genotipo resultante del individuo coincidiría con el existente en su lugar de nacimiento.53 Además, se han encontrado cepas mutantes en el gen que codifica la DHPS, enzima diana de las sulfonamidas utilizadas para la profilaxis y el tratamiento de la PcP, en pacientes que nunca habían sido expuestos a estos fármacos; lo que sugiere una adquisición reciente de la infección desde otros individuos que habían sido sometidos a una presión selectiva por el fármaco en cuestión.54
Se han publicado otros hallazgos importantes que corroboran esta hipótesis y desechan la teoría de la reactivación de una infección latente. Así, se han comunicado varios brotes de PcP que han ocurrido en diferentes regiones geográficas y se han observado agrupamientos similares de genotipos de P. jirovecii en las muestras de los individuos involucrados.55,56 Finalmente, estudios realizados en ratas con PcP, examinadas durante 1 año con métodos histológicos y RCP, demostraron la curación de la enfermedad con una erradicación completa del microorganismo en 75 % de los casos.57
El modo exacto de transmisión de un individuo a otro no ha sido del todo esclarecido y la forma infectiva del parásito aún no se identifica; en el caso de Pneumocystis se propone un modelo de transmisión similar al de Mycobacterium tuberculosis. Se plantea la vía aérea como vehículo, considerando que las formas tróficas del parásito, con un tamaño de 2 a 4 µm, similar al bacilo tuberculoso (1-3 µm), pueden ser expectoradas por el paciente infectado y mediante gotitas de Pflugge adquiridas por los sujetos susceptibles. Esta teoría fue postulada por Ng y otros en 1997.58 Se ha debatido mucho sobre la cuestión del período de incubación de la infección por Pneumocystis. Estudios realizados sugieren que el mismo pudiera estar comprendido entre las 3 y 12 semanas, lo cual coincide con los experimentos desarrollados en animales de experimentación.59,60
Por otra parte, investigaciones de microscopia electrónica de transmisión demuestran que los quistes maduros de pared fina, parecen estar mejor dotados para retener la capacidad infectiva durante la transmisión aérea entre individuos. Otros estudios sugieren, que los quistes maduros presentes en el lumen bronquial podrían alcanzar el medio ambiente y transmitirse a otros huéspedes susceptibles.51
En modelos animales está bien documentada la transmisión aérea. Se ha comprobado que es suficiente solo con 1 d de exposición para que ratones inmunocompetentes adquieran la infección de ratones SCID con PcP.61 La transmisión interindividual de P. jirovecii desde pacientes hospitalizados con PcP se ha constatado en diferentes estudios que incluían una amplia gama de lugares: unidades pediátricas, salas de enfermedades infecciosas, unidades de cuidados intensivos, unidades de trasplantes o salas de oncología.51 Recientemente, Rivero y otros han demostrado en el seno de una familia española la posible transmisión de Pneumocystis desde unos sujetos colonizados a un individuo susceptible.62 Varios autores consideran que la transmisión directa entre individuos por vía aérea constituye la forma de transmisión más importante de esta infección.51,58,59 Sin embargo, en otros casos no ha existido suficiente evidencia para demostrar la transmisión interindividual del microorganismo, por lo que existen resultados contradictorios en la literatura.63
La transmisión vertical transplacentaria de Pneumocystis ha sido demostrada en conejos, pero no parece ocurrir en ratas y ratones con inmunodeficiencia severa.64 En los humanos este tema ha sido discutido. Antes de la epidemia sida se había sugerido esta hipótesis en neonatos con neumonía. Más tarde, en 1995, Portier y otros publicaron un controvertido caso de infección por Pneumocystis en el feto de una madre con infección VIH y PcP que no pudo ser corroborado después utilizando inmunofluorescencia con anticuerpos específicos.65 Recientemente, se ha publicado la primera evidencia molecular de la existencia de transmisión transplacentaria en humanos, que abre las puertas a un nuevo campo de investigación en Pneumocystis con profundas implicaciones en la clínica y en la epidemiología del microorganismo.64
CLÍNICA
Formas de presentación
La neumonía por Pneumocystis puede resultar difícil de identificar y un verdadero reto si se pretende diagnosticarla solo por la clínica del paciente, porque diferentes infecciones comparten signos y síntomas similares a la PcP.18 Atendiendo a la edad y a la enfermedad de base responsable de la inmunodepresión, clásicamente se han diferenciado cuatro formas clínicas de infección por Pneumocystis: asintomática; infantil o neumonía intersticial de células plasmáticas; neumonitis esporádica niño-adulto de pacientes inmunocomprometidos; e infección extrapulmonar. A estas hoy día habría que añadir la PcP asociada al síndrome de reconstitución inmune.1
Síntomas y signos
La PcP se presenta casi siempre con fiebre, tos y disnea de esfuerzo. La tos normalmente es seca y no productiva. La disnea al inicio es a esfuerzo moderado, por lo que puede pasar inadvertida y progresar de modo gradual. La fatiga es una de las principales quejas en los pacientes con infección, mientas que el dolor torácico, los escalofríos y la sudoración nocturna son menos frecuentes. La hemoptisis también se ha registrado en los pacientes aquejados por esta infección. Por otra parte, la exploración clínica puede mostrar taquicardia, cianosis, y crepitantes finos en la auscultación de los afectados.66,67
La presentación clínica de la PcP difiere en sus características entre individuos con infección VIH de aquellos inmucomprometidos por otras razones.37 De manera general los pacientes con infección por VIH presentan un desarrollo subagudo con síntomas más prolongados de la infección; típicamente incluyen el establecimiento de tos seca y disnea con fiebre o sin esta de 1 a 2 semanas de evolución. En el examen físico puede apreciarse taquipnea, taquicardia y, en ocasiones cianosis; pero la auscultación torácica en general es normal, presentándose a veces algunos sibilantes. La presencia de hipoxemia desencadenada con el ejercicio es otro elemento presente en este tipo de sujetos. Hasta 27 % de los individuos con infección por VIH que desarrollan PcP pueden presentar una insuficiencia respiratoria que requiera ventilación mecánica.68
En cambio, en pacientes sin infección por VIH, la enfermedad tiene un comienzo más rápido con pocos días de desarrollo clínico y mayor gravedad, caracterizada frecuentemente con una marcada hipoxemia.69 Un ejemplo interesante lo constituyen los individuos con trasplantes, en los cuales la infección se presenta a menudo con un cuadro clínico fulminante consistente en fiebre, tos, disnea e insuficiencia respiratoria. En la población de individuos con trasplantes cardíaco-pulmonares los síntomas pueden estar ausentes debido a la denervación del pulmón trasplantado. Diferentes estudios han señalado que en sujetos con inmunodepresión secundaria al tratamiento de enfermedades neoplásicas o trasplantes, la enfermedad tiene una presentación subaguda, de más de 24 h y menos de una semana. En sujetos con trasplantes de órganos sólidos la PcP puede ocurrir también con un desarrollo crónico.37,38
Phair y otros al comparar dos grupos de pacientes con infección por VIH y sin esta, encontraron que los primeros presentaban una mayor tensión arterial de oxígeno y un menor gradiente alvéolo-arterial. También observaron que en estos individuos los lavados broncoalveolares contenían una significativa menor cantidad de neutrófilos en comparación con los sujetos seronegativos al VIH.70 En otros estudios publicados se realizaron similares comparaciones y se encontró que los sujetos con sida tenían una mayor duración media de los síntomas, menor frecuencia respiratoria y mayor presión parcial arterial de oxígeno, sin encontrarse diferencias en la supervivencia entre los pacientes con sida y sin esta enfermedad.37,71 Sin embargo, se ha publicado que las tasas de mortalidad por PcP son diferentes en estos dos grupos, en aquello sin infección VIH oscilan entre 30 y 60 %, mientras en los VIH positivos resultan de 10 a 20 %.66
Radiografía de tórax
La radiografía de tórax es muy útil ante la sospecha de una PcP en un paciente VIH positivo cuando muestra los típicos infiltrados intersticiales difusos bilaterales. Sin embargo, las imágenes atípicas (infiltrados unilaterales o localizados, lesiones nodulares o cavitarias) no son raras en estos individuos. En algunos casos, entre 10 y 39 %, la radiografía de tórax puede no mostrar alteraciones; se asocia esta característica con un mejor pronóstico de la enfermedad.72 Por otra parte, es menos frecuente que aparezcan consolidaciones de un lóbulo o segmento, nódulos o cavitaciones y muy rara la presencia de adenopatías y afectación pleural. Un patrón granulomatoso apical similar a la tuberculosis puede existir, asociado a la profilaxis con la pentaminida. Además, la PcP puede producir otros patrones radiológicos como neumotórax o infiltrado nodular.73,74
La clásica presentación de la PcP, con un patrón retículo-intersticial bilateral difuso, se inicia con opacidades centrales o perihiliares, con predominio en lóbulo medio o inferior; estas suelen ser bilaterales y simétricas, que progresan a difusas en ausencia de diagnóstico y tratamiento. Aunque menos clásico, puede existir una presentación unilateral, focal o asimétrica. Se debe sospechar una PcP en un paciente VIH positivo que presente un patrón reticular, independientemente de que sea unilateral o bilateral, focal o difuso, simétrico o asimétrico. Entre 5 y 34 % de los casos pueden tener quistes con paredes finas o pneumatoceles, también ser múltiples y localizados en los lóbulos superiores. Estos quistes es posible que se desarrollen durante el tratamiento y logran persistir a pesar de la curación, además pueden predisponer a que aparezca un neumotórax.66,75
La tomografía axial computarizada (TAC) de alta resolución, es más sensible que la radiografía de tórax para el diagnóstico de la enfermedad, con el hallazgo típico de opacidades en vidrio deslustrado, bilaterales, que suelen aparecer acompañadas de múltiples pneumatoceles. Aunque no son específicas para la PcP, la ausencia de opacidades va en contra de su diagnóstico. Hasta el momento, no hay casos descritos de neumocistosis en pacientes VIH positivos con radiografía tórax y TAC sin alteraciones. Algunos autores plantean que los hallazgos en una TAC de tórax de alta resolución en pacientes con clínica sugestiva de esta enfermedad son suficientes para obviar procedimientos invasivos como la broncoscopio; aunque muchos otros clínicos prefieren la identificación del organismo en las muestras clínicas.67,68
Otras técnicas han demostrado su utilidad ante un paciente con sospecha de PcP con una radiografía de tórax normal. El empleo de tecnecio-99- dietilenetriamina penta-acetato (99mtcDPTA), y la gammagrafía con galio-67, al igual que la resonancia magnética nuclear pueden ayudar en el diagnóstico; el uso de 99mtcDPTA resulta más sensible y específico.76
P. jirovecii puede diseminarse desde el pulmón a otros órganos e inducir lesiones secundarias viscerales. Las lesiones pulmonares pueden ser indetectables cuando las localizaciones extrapulmonares son diagnosticadas, como ocurre en la histoplasmosis diseminada y en otras micosis respiratorias causadas por hongos dimorfos. Ganglios linfáticos, bazo, hígado, corazón y médula ósea son los órganos afectados con más frecuencia; aunque este patógeno se ha encontrado también en cerebro, páncreas, timo, tiroides, retina, coroides, oído externo y medio, apéndice, piel y otros órganos. Las lesiones extrapulmonares son en general nodulares, que evolucionan hacia la necrosis y la calcificación; pueden evidenciarse en algunos casos mediante TAC. Entre 2 y 3 % de los pacientes con infección por VIH y PcP podrían desarrollar esta forma clínica que, por otra parte, resulta excepcional en individuos seronegativos al VIH, donde solo se ha encontrado en estudios post mortem.58
Exámenes de laboratorio
Los exámenes de laboratorio de rutina no son útiles para el diagnóstico de la PcP y frecuentemente reflejan las alteraciones producidas por la enfermedad subyacente del paciente. Diferentes estudios han mostrado valores elevados de lactato deshidrogenada (LDH) en sueros de pacientes con esta enfermedad (sensibilidad 82-100 %).77 No obstante, su interpretación debe ser muy prudente y cautelosa, porque también existen casos confirmados con valores normales. Otros estudios han intentado relacionar los valores de LDH con la supervivencia de los pacientes con neumocistosis. En este sentido, tendrían un peor pronóstico aquellos con valores elevados de LDH o que se incrementan durante el tratamiento; en cambio, valores bajos al inicio de la enfermedad o que disminuyan durante el tratamiento se relacionarían con un mejor pronóstico y menor mortalidad de los pacientes.78,79
Un detalle interesante y promisorio es el estudio de los niveles de S-adenosil metionina (SAM) en el plasma de pacientes con sospecha de la enfermedad. Skelly y otros, demostraron que la reducción de esta coenzima en suero de pacientes con sospecha de PcP puede ser útil en el diagnóstico de la infección.80 Resultados similares se encontraron por Höcker y otros en una unidad pediátrica de individuos con trasplantes en Alemania; donde observaron una significativa reducción de los niveles de SAM en el plasma de sus pacientes, específico para la neumocistosis.81
Otros marcadores serológicos también han sido evaluados para diagnosticar PcP. Uno de ellos KL-6, una mucina humana MUC-1, preferentemente expresada en los neumocitos tipo II, es un marcador sérico sensible para evaluar el daño alveolar de la neumonía intersticial y la fibrosis pulmonar. Elevados niveles plasmáticos de esta molécula se encontraron en pacientes con PcP.82
Por otra parte, la determinación sérica de 1-3 b-D-glucano, el principal componente de la pared celular de muchos hongos, es una prueba útil para el diagnóstico de la candidiasis y la aspergilosis invasiva, pero también puede emplearse para la PcP. En este sentido, Tasaka y otros encontraron una sensibilidad de 92,3 % y una especificidad del 86,1 % para esta prueba en pacientes con PcP.83 Otros autores observaron una reducción en los niveles de 1-3 b-D-glucano en pacientes con PcP que respondían al tratamiento, lo cual sugiere que esta prueba podría ser útil para monitorizar la respuesta terapéutica.84,85 Recientemente, Shimizu demostró que utilizando los niveles séricos de 1-3 b-D-glucano se puede distinguir la colonización por P. jirovecii de la PcP en pacientes con neumopatías intersticiales.84 Por otra parte, Sage y otros sugieren una posible asociación entre el aumento de los niveles de la proteína C reactiva y la gravedad de la infección, con un peor pronóstico para los paciente con infección VIH y PcP que tienen niveles más elevados de esta proteína en sangre.85
MÉTODOS DE DIAGNÓSTICO
Ante la ausencia de un sistema de cultivo in vitro para P. jirovecii, la base para el diagnóstico de la PcP es la visualización de los diferentes estadios del ciclo de vida de este patógeno en las muestras respiratorias obtenidas de los pacientes. Se han utilizado diferentes métodos para identificar estos microorganismos en las muestras biológicas.1
Para el diagnóstico microscópico de P. jirovecii las muestras clínicas más empleadas son los lavados broncoalveolares (LBA), el esputo espontáneo o inducido y la biopsia pulmonar y transbronquial. Recientemente se han comenzado a estudiar otras muestras biológicas como lavados orofaríngeos, exudados nasales o aspirados nasofaríngeos que aún no se utilizan de forma rutinaria en la clínica para evitar técnicas invasivas como las necesarias para obtener LBA o biopsias.86
Examen directo al fresco sin tinción
La observación de los exudados espumosos provenientes del alvéolo pulmonar de pacientes con PcP, que muestran una morfología microscópica de "panal de abejas", permite un diagnóstico fiable de la infección por P. jirovecii. Esta metodología de bajo coste y de rápido empleo es de suma importancia para los laboratorios con escasos recursos económicos y que atienden a pacientes con sida en situaciones de inmunosupresión avanzada. Su sensibilidad depende del tipo y la cantidad de muestra utilizada, así como del número de microorganismos presentes. Bava y otros obtuvieron resultados interesantes al aplicar esta metodología en Argentina. Estos autores detectaron 35 % de las muestras positivas para P. jirovecii, en secreciones respiratorias provenientes de pacientes ingresados en la unidad de cuidados intensivos del Hospital "Francisco J. Muñiz". Sin embargo, los propios autores recomiendan un entrenamiento previo y una adecuada selección de la muestra para garantizar la fiabilidad de los resultados.87
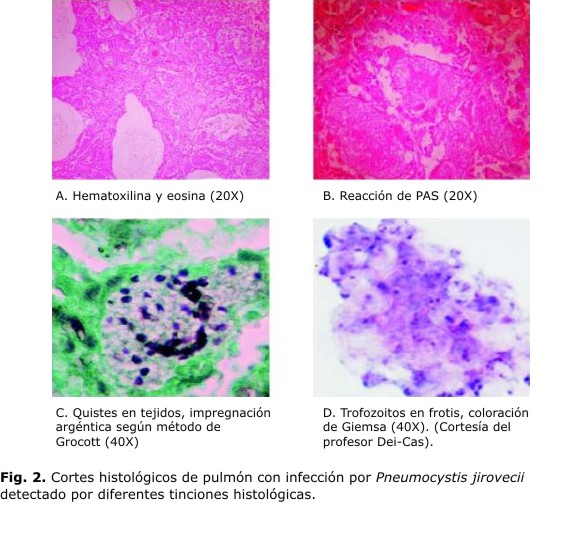
Métodos de tinción
Varios métodos de visualización microscópica para identificar Pneumocystis han sido descritos en la literatura. Para biopsias y autopsias resultan de mucha utilidad las técnicas de tinción convencionales (hematoxilina y eosina), así como las especiales (plata metenanima de Grocott-Gomori, giemsa, azul de toluidina O, Papanicolaou, violeta crisol y blanco de calcoflúor) para todo tipo de muestra clínica (Fig. 2). La plata metanamina de Grocott-Gomori tiñe de color oscuro la pared de los quistes de Pneumocystis y permite la cuantificación del patógeno en la muestra. Esta técnica es considerada de referencia para la identificación de P. jirovecii en los LBA. También, el azul de toluidina y el violeta crisol muestran afinidad por los componentes de la pared del quiste. Con este último método, se han obtenido buenos resultados en estudios con animales, sin embargo, en humanos su utilización está poco extendida. El azul de toluidina por su parte, colorea de violeta rojizo los componentes de la pared y los investigadores lo han empleado como técnica de cribado en los laboratorios al resultar más rápida que la plata metenamina. La giemsa permite identificar tanto los quistes como los trofozoitos, colorea los núcleos de ambas formas de color rosado y contrasta con el azul que adquiere el citoplasma.1,66,68 La prueba de Papanicolaou es una técnica muy empleada por los citohistopatólogos, que puede generar información importante para detectar Pneumocystis. Sun y otros demostraron la efectividad del método al detectar 8 muestras positivas entre 13 casos confirmados de la enfermedad.88 No obstante, debe prestarse especial atención cuando esta metodología es utilizada en muestras donde la carga parasitaria es baja. Por otra parte, el blanco de calcoflúor es una tinción fluorescente, rápida y útil en cualquier tipo de muestras. Esta técnica contrasta los elementos micóticos con gran claridad, debido a la unión de esta sustancia a la quitina de la pared fúngica. Además, requiere menor entrenamiento para el diagnóstico de PcP que el examen directo en fresco, sin embargo, tiene falsos positivos con fibras vegetales, colágeno o elastina.89 Procop y otros compararon 4 métodos de tinción para detectar P. jirovecii en muestras respiratorios, ellos mostraron que el blanco de calcoflúor y la plata metenamina tenían valores predictivos positivos y negativos mayores que 90 %. Parámetros suficientes para usarse como métodos de rutina en los laboratorios clínicos.90
Inmunoflorescencia directa (ID)
Esta técnica utiliza anticuerpos monoclonales específicos contra determinantes antigénicos de la pared de los quistes y trofozoitos de P. jirovecii. Tiene una sensibilidad cercana a 100 % y una especificidad alrededor de 96 %. Los anticuerpos monoclonales tienen mayor sensibilidad y especificidad en las muestras de esputo inducido que las técnicas de tinción convencionales, pero esta diferencia es mucho menor cuando se emplean muestras de LBA.91 Halford y otros, compararon esta técnica con la tinción de plata metenamina en 384 muestras de esputo, ellos encontraron P. jirovecii en 31 de las muestras analizadas por la primera metodología y solo 24 en las analizadas por la segunda.92 Hay que señalar que la ID es más cara y consume más tiempo para brindar un resultado que las técnicas de tinción convencionales. Además, pueden existir reacciones cruzadas de antígenos de Pneumocystis con antígenos de Aspergillus sp. y publicaciones recientes constatan un alto porcentaje de falsos positivos con esta metodología.90 Por otra parte, resulta prudente revisar, sobre todo en regiones donde Paracoccidioides brasiliensis es endémica, un resultado positivo para P. jirovecii por esta técnica, porque se han encontrado casos de reacciones cruzadas.93 De especial interés resulta el hecho de la detección de quistes vacíos por ID, los cuales pueden persistir en el tejido pulmonar por espacio de 4 a 6 semanas después de un tratamiento efectivo. Finalmente, esta técnica ha sido utilizada en la detección de P. jirovecii en personas inmunocompetentes con infecciones pulmonares crónicas, con menor sensibilidad que las técnicas moleculares.94
Métodos moleculares basados en la utilización de la reacción en cadena de la polimerasa (RCP)
La poca sensibilidad de las técnicas de tinción en muestras obtenidas de forma no invasiva y su menor sensibilidad en situaciones con poca carga parasitaria, así como el elevado costo de la ID, han obligado a desarrollar nuevas alternativas diagnósticas para P. jirovecii.95 Los métodos moleculares basados en la RCP, son una opción fiable y eficaz para los laboratorios con acceso a estas técnicas. Diferentes estudios publicados demuestran que la RCP es más sensible y específica que los métodos de tinción.86,96 La primera evidencia del empleo de métodos moleculares para la detección de P jirovecii en muestras clínicas fue aportada por Walkefield y otros en 1990.97 Desde entonces y hasta la actualidad, 14 genes del patógeno se han utilizado con fines diagnósticos y para estudios de genotipaje.98 En 2007, Robberts y otros evaluaron 9 métodos moleculares en diferentes muestras clínicas provenientes de pacientes sudafricanos.95 En este estudio, la RCP anidada que emplea el gen mt LSU rRNA como diana, mostró la mayor sensibilidad para detectar P. jirovecii. Varios autores coinciden con su elevada sensibilidad y especificidad y sugieren que el gen mt LSU rRNA puede emplearse como diana atractiva para fines diagnósticos, de epidemiología molecular y seguimiento de la terapia aplicada a los pacientes.99,100 Sin embargo, es conocido que los métodos que utilizan la RCP anidada brindan una proporción apreciable de resultados falsos positivos y están sujetos a una mayor contaminación que métodos que emplean la RCP simple.86
Otros genes del patógeno han sido evaluados y se han obtenido resultados interesantes (tabla 2). Por ejemplo, Miller y otros observaron una asociación entre la gravedad de la PcP y el genotipo encontrado en los microorganismos aislados, al estudiar la región transcripta de los espacios intergénicos del operón del ARNr (ITS, siglas en inglés).101 También, se ha comunicado la ausencia de genotipos específicos de la región ITS (como el A2c1) en pacientes colonizados por P. jirovecii.102 Recientemente, Esteves y otros demostraron que la presencia de citosina en la posición 85 del gen mt LSU rRNA se asociaba con una evolución favorable de la PcP.103 Por otra parte, mutaciones en el gen que codifica para la DHPS pueden indicar posible resistencia a las sulfamidas. Resultados sumamente útiles si se considera que las pruebas de susceptibilidad frente a fármacos no se encuentran disponibles para el patógeno por la carencia del cultivo microbiológico.104
Tabla 2. Estudios de genes evaluados en Pneumocystis jirovecii
| Diana/Tipo de RCP | Abreviatura para identificar los cebadores | Secuencias de cebadores | Referencia |
| Arom | Primera ronda | 5ATCCCACCAN(T,C)(A,C)NGGCCA 3 | Tsolaki AG. J Clin Microbiol. 1998;36(1):90-3 |
| Segunda ronda | 5GGGAATTCTTAACAACAACAATTTTAGCC 3 | Tsolaki AG. J Clin Microbiol. 1998;36(1):90-3 | |
| β-tubulina | Cebador 1 | 5 TCATTAGGTGGTGGAACGGG 3 | Ma L. J Infect Dis. 2002;186(11):1647-54 |
| cdc 2 | Cebador 1 | 5´ AGGTAGGAGAAGGTAAGAAA 3´ | Arcenas RC. Diag Microbiol Infect Dis. 2006;54(3):169-75 |
| Citocromo B | CytbFw | 5CCCAGAATTCTCGTTTGGTCTATT 3 | Esteves F. Infect Genet Evol. 2010;10(2):192-9 |
| DHPS | Primera ronda | 5 CCTGGTATTAAACCAGTTTTGCC 3 | Lane BR. J Infect Dis. 1997;175(2):482-5 |
| Segunda ronda | 5GCGCCTACACATATTATGGCCATTTTAAATC 3 | Lane BR. J Infect Dis. 1997;175(2):482-5 | |
| DHFR | Primera ronda | 5GAC GAA AGT AGG TAC ATT ATT ACG AGA 3 | Ma L. J Infect Dis. 1999;180(6):1969-78 |
| Segunda ronda | 5 GTTTGGAATAGATTATGT TCA TGG TGT ACG 3 | Ma L. J Infect Dis. 1999;180(6):1969-78 | |
| ITS | Primera ronda | 5AAGTTGATCAAATTTGGTC3 | Lu JJ. J Clin Microbiol. 1995;33(10):2785-8 |
| Segunda ronda | 5CGTAGGTGAACCTGCGGAAAGGATC 3 | Lu JJ. J Clin Microbiol. 1995;33(10):2785-8 | |
| Hsp 70 | HSP-Ph-SA1 | 5GTATTAGGAAAGATGAAA G 3' | Latouche S. J Eukaryot Microbiol 2001;Suppl:176S-177S |
| GK242 | 5TATTTCTTGTATCTATGCGCT 3 | Ma L. J Infect Dis. 2002;186(11):1647-54 | |
| mt LSU rRNA | Primera ronda | 5GTGTACGTTGCAAAGTACTC 3 | Wakefield AE. Lancet. 1990;336(8713):451-3 |
| Segunda ronda | 5GTGAAATACAAATCGGACTAGG 3 | Tsolaki AG. J Clin Microbiol. 1998;36(1):90-3 | |
| mt SSU rRNA | Primera ronda | 5GGGAATTCTAGACGGTCACAGAGATCAG 3 | Tsolaki AG. J Clin Microbiol. 1998;36(1):90-3 |
| Segunda ronda | 5GGGAATTCGAAGCATGTTGTTTAATTCG 3 | Tsolaki AG. J Clin Microbiol. 1998;36(1):90-3 | |
| 5 S rRNA | Cebador 1 | 5-AGTTACGGCCATACCTCA-3 | Kidata K. J Protozool. 1991;38(6):90S-91S |
| 18 S rRNA | Primera ronda | 5CCAGATTAGCTTTTGCTGATCGCGGG3 | |
| Segunda ronda | 5TGTTGGCATGAAGCCAATGGAA3 | Lu JJ. J Clin Microbiol. 1995;33(10):2785-8 | |
| 26 S rRNA nuclear | Cebador 1 | 5GAAGAAATTCAACCAAGC 3 | Nahimana A. J Med Microbiol. 2000;49(8):753-8 |
| SOD (superoxido dismutasa) | MnSODFw | 5GGGTTTAATTAGTCTTTTTAGGCAC 3 | Esteves F. Infect Genet Evol. 2010;10(2):192-9 |
| TS | TSFw | 5 GTTTCAATGGCGACCTTCG 3 | Esteves F. Infect Genet Evol. 2010;10(2):192-9 |
| Trr1 | Trr1Fw | 5ATGGCAACTGGGGCGTAT 3 | Esteves F. Infect Genet Evol. 2010;10(2):192-9 |
Otros estudios han evaluado la posibilidad de amplificar ADN del microorganismo en muestras clínicas obtenidas por métodos no invasivos para el paciente. Trabajos publicados, reflejan resultados aceptables para el diagnóstico de la infección por P. jirovecii, al emplear muestras de esputo obtenidas tras expectoración espontánea, lavados orofaríngeos y exudados nasofaríngeos, utilizando métodos basados en la RCP.100,105 Investigadores franceses describen una sensibilidad de 100 % y una especificidad de 90 %, utilizando la amplificación mediante RCP del gen mt LSU rRNA en muestras de lavados orofaríngeos.86
Recientemente la utilización de la RCP en tiempo real en muestras clínicas y tejidos facilita la obtención de un resultado más rápido (menos de 3 h) y reduce la posibilidad de contaminación en las muestras. Además, esta metodología posibilita cuantificar la carga del patógeno, lo que facilita la identificación del estado de colonización en los pacientes con baja carga parasitaria.105 No obstante, un resultado positivo para P. jirovecii por RCP no indica infección, ni viabilidad del patógeno en la muestra analizada. Para resolver esta dificultad, se han descrito métodos basados en la amplificación del ARN mensajero del microorganismo con una sensibilidad de 100 % y una especificidad de 86 %.106
TRATAMIENTO Y PROFILAXIS
Desde hace años, por su alta eficacia y disponibilidad en forma oral e intravenosa, la asociación a dosis fijas de trimetoprim y sulfametoxazol (cotrimoxazol) constituye el fármaco de elección, tanto para el tratamiento como para la profilaxis de la PcP en pacientes con infección por VIH y sin esta.1 Sin embargo, las reacciones adversas que habitualmente ocurren durante la segunda semana de tratamiento, son frecuentes sobre todo en pacientes con infección VIH, y pueden obligar a cambiar la medicación, así como en casos de alergia a las sulfamidas. Por otra parte, en estos últimos años se han detectado mutaciones del gen de la DHPS homólogas, de las que en otros microorganismos inducen resistencia a este grupo de fármacos. En P. jirovecii estas mutaciones están aparentemente asociadas al uso previo de sulfamidas y podrían indicar también la presencia de fenotipos del parásito resistentes.104 Existen alternativas al cotrimoxazol para el tratamiento y la profilaxis de la PcP, que incluyen la dapsona, la pentamidina y la atovacuona, entre otras; pero la información disponible sobre su eficacia es más limitada.1
CONCLUSIONES
Muchas cuestiones sobre la epidemiología y la biología de P. jirovecii quedan aún por esclarecer. Resulta esencial conocer las implicaciones que la colonización por P. jirovecii pueda tener en los individuos sanos o con enfermedades pulmonares crónicas, así como aclarar su papel en la transmisión y en el ciclo de vida de este microorganismo. Es muy importante poder disponer de métodos diagnósticos sensibles y específicos, que puedan aplicarse en muestras fácilmente obtenidas de forma no cruenta y cuyo costo permita su utilización de forma generalizada en países en vías de desarrollo; donde la PcP continúa siendo un problema muy importante en pacientes con VIH. Por último, resulta imprescindible desarrollar nuevos fármacos activos frente a este patógeno ante el riesgo del desarrollo y la extensión de cepas de P. jirovecii resistentes a los tratamientos disponibles, que con frecuencia producen reacciones adversas.
REFERENCIAS BIBLIOGRÁFICAS
1. Calderon EJ, Gutiérrez-Rivero S, Durand-Joly I, Dei-Cas E. Pneumocystis infection in humans: diagnosis and treatment. Expert Review Anti-Infective Therapy. 2010;8(6):683-701.
2. Dei-Cas E. Pneumocystis infections: the iceberg? Med Mycol. 2000;38(suppl 1):23-32.
3. Chagas C. Nova tripanozomiazaea humana. Mem Inst Oswaldo Cruz. 1909;1:159-218.
4. Carini A. Formas de eschizogonia do trypanosoma lewisi. Bol Soc Med Cir Sao Paulo. 1910;18:204.
5. Delanöe P, Delanöe M. Sur les rapports des kystes de carinii du poumon des rats avec le Trypanosoma lewisi. CR Acad Sci (Paris) 1912; 155: 658-60.
6. Calderón-Sandubete EJ, Varela-Aguilar JM, Medrano-Ortega FJ, Nieto-Guerrer V, Respaldiza-Salas N, de la Horra-Padilla C, et al. Historical perspective on Pneumocystis carinii infection. Protist. 2002;153(3):303-10.
7. Porter A. The occurrency of Pneumocystis carinii in mice in England. Parasitology. 1915;8:255.
8. Ammich O. Über die nichtsyphilitische interstitielle Pneumonie des ersten Kindesalters. Virchows Arch Pathol Anat. 1938;302:539-54.
9. Benecke E. Eigenartige Bronchiolenerkraskung im ersten Lebensjahr. Verh Dtsch Ges Pathol. 1938;31:402-6.
10. Rubin E, Zak FG. Pneumocystis carinii pneumonia in the adult. N Engl J Med. 1960;262:1315-7.
11. Walzer PD, Perl DP, Krogstead DJ, Rawson P, Schultz MG. Pneumocystis carinii pneumonia in the Unites States. Epidemiologic, diagnostic, and clinical features. Ann Intern Med. 1974;80:83-93.
12.Frenkel JK. Pneumocystis jiroveci n.sp. from man: morphology, physiology, and immunology in relation to pathology. Natl Cancer Inst Monogr. 1976;43:13-30.
13. Vavra J, Kucera K. Pneumocystis carinii delanoë, its ultrastructure and ultrastructural affinities. J Protozool. 1970;17(3):463-83.
14. Stringer SL, Stringer JR, Blas MA. Pneumocystis carinii: sequence from ribosome RNA implies a clear relationship with fungi. Exp Parasitol. 1989;68:450-61.
15. Dei-Cas E, Mazars E, Aliouat EM, Nevez G, Cailliez JC, Camus D. The host-specificity of Pneumocystis carinii. J Mycol Med. 1998;8:1-6.
16. Pneumocystis Workshop. Revised nomenclature for Pneumocystis carinii. J Eukaryot Microbiol. 1994;41:121S-2S.
17. Redhead SA, Cushion M, Frenkel JK, Stringer JR. Pneumocystis and Trypanosoma cruzi: Nomenclature and Typifications. J Eukaryot Microbiol. 2006;53(1):2-11.
18. Kovacs JA, Masur H. Evolving health effects of Pneumocystis: one hundred years of progress in diagnosis and treatment. JAMA. 2009;301(24):2578-85.
19. Aliouat-Denis CM, Martinez A, Aliouat el M, Pottier M, Gantois N, Dei-Cas E. The Pneumocystis life cycle. Mem Inst Oswaldo Cruz. 2009;104(3):419-26.
20. Matsumoto Y, Yoshida Y. Sporogony in Pneumocystis carinii: synaptonemal complexes and meiotic nuclear divisions observed in precysts. J Protozool. 1984;31(3):420-8.
21. Bartlett MS, Verbanac PA, Smith JW. Cultivation of Pneumocystis carinii with WI-38 cells. J Clin Microbiol. 1979;10(6):796-9.
22. Cushion MT, Ebbets D. Growth and metabolism of Pneumocystis carinii in axenic culture. J Clin Microbiol. 1990;28(6):1385-94.
23. Mirovsky P, Fishman JA. An improved method for the prolonged maintenance of Pneumocystis carinii in vitro. J Infect Dis. 1993;167(6):1470-3
24. Merali S, Frevert U, Williams JH, Chin K, Bryan R, et al. Continuous axenic cultivation of Pneumocystis carinii. Proc Natl Acad Sci USA. 1999;96(5):2402-7.
25.Dei-Cas E, Brun-Pascaud M, Bille-Hansen V, Allaert A, Aliouat EM. Animal models of pneumocystosis.FEMS Immunol Med Microbiol. 1998 ;22(1-2):163-8.
26.Wakefield AE, Stringer JR, Tamburrini E, Dei-Cas E. Genetics, metabolism and host specificity of Pneumocystis carinii. Med Mycol. 1998;36 Suppl 1:183-93.
27.Kaneshiro ES. Lipid metabolism of Pneumocystis: toward the definition of new molecular targets. FEMS Immunol Med Microbiol. 1998;22(1-2):135-43.
28. Nkinin SW, Daly KR, Walzer PD, Ndzi ES, Asonganyi T, et al. Evidence for high prevalence of Pneumocystis jirovecii exposure among Cameroonians. Acta Trop. 2009;112(2):219-24.
29. Kottom TJ, Köhler JR, Thomas CF Jr, Fink GR, Limper AH. Lung epithelial cells and extracellular matrix components induce expression of Pneumocystis carinii STE20, a gene complementing the mating and pseudohyphal growth defects of STE20 mutant yeast. Infect Immun. 2003;71(11):6463-7.
30. Ambrose HE, Keely SP, Aliouat EM, Dei-Cas E, Wakefield AE, et al. Expression and complexity of the PRT1 multigene family of Pneumocystis carinii. Microbiology. 2004;150(Pt 2):293-300.
31. Cushion MT, Smulian AG, Slaven BE, Sesterhenn T, Arnold J, Staben C, Porollo A, Adamczak R, Meller J. Transcriptome of Pneumocystis carinii during fulminate infection: carbohydrate metabolism and the concept of a compatible parasite. PLoS One. 2007;2(5):423.
32. Wakefield AE. Genetic heterogeneity in Pneumocystis carinii: an introduction. FEMS Immunol Med Mic. 1998;22:5-13.
33. Wakefield AE. Pneumocystis carinii. Br Med Bull. 2002;61:175-88.
34. Stringer JR, Cushion MT. The genome of Pneumocystis carinii. FEMS Immunol Med Microbiol. 1998;22:15-26.
35. Helweg-Larsen J. Pneumocystis jiroveci. Applied molecular microbiology, epidemiology and diagnosis. Dan Med Bull. 2004;51(3):251-73.
36. Morris A, Lundgren JD, Masur H, Walzer PD, Hanson DL, et al. Current epidemiology of Pneumocystis pneumonia. Emerg Infect Dis. 2004;10(10):1713-20.
37. Russian DA, Levine SJ. Pneumocystis carinii pneumonia in patients without HIV infection. Am J Med Sci. 2001;321(1):56-65.
38. Sepkowitz KA. Opportunistic infections in patients with and patients without acquired immunodeficiency syndrome. Clin Infect Dis. 2002;34(8):1098-107.
39. Cisneros JM, Muñoz P, Torre-Cisneros J, Gurgui M, Rodriguez-Hernandez MJ, et al. Pneumonia after heart transplantation: a multiinstitutional study. Clin Infect Dis. 1998;27:324-31.
40. Calderón EJ, Varela JM, Medrano FJ, Nieto V, González-Becerra C, et al. Epidemiology of Pneumocystis carinii pneumonia in southern Spain. Clin Microbiol Infect. 2004;10(7):673-6.
41. Respaldiza N, Medrano FJ, Medrano AC, Varela JM, de la Horra C, et al. High seroprevalence of Pneumocystis infection in Spanish children. Clin Microbiol Infect. 2004;10(11):1029-31.
42. Vargas SL, Hughes WT, Santolaya ME, Ulloa AV, Ponce CA, Cabrera CE, et al. Search for primary infection by Pneumocystis carinii in a cohort of normal, healthy infants. Clin Infect Dis. 2001;32(6):855-61.
43. Cano S, Capote F, Pereira A, Calderón E, Castillo J. Pneumocystis carinii pneumonia in patients without predisposing illnesses. Acute episode and follow-up of five cases. Chest.1993;104:376-81.
44. Jacobs JL, Libby DM, Winters RA, Gelmont DM, Fried ED, et al. A cluster of Pneumocystis carinii pneumonia in adults without predisposing illnesses. N Engl J Med. 1991;324:246-50.
45. Morris A, Wei K, Afshar K, Huang L. Epidemiology and clinical significance of Pneumocystis colonization. J Infect Dis. 2008;197:10-7.
46. Wissmann G, Morilla R, Friaza V, Calderón E, Varela JM. Human reservoirs of Pneumocystis. Enferm Infecc Microbiol Clin. 2010;28(1):38-43.
47. Calderón EJ, Friaza V, Dapena FJ, de La Horra C. Pneumocystis jirovecii and cystic fibrosis. Med Mycol. 2010;48(O1):S17-S21.
48. Bartlett MS, Lee CH. Airborne spread of Pneumocystis jirovecii. Clin Infect Dis. 2010;50(3):266.
49. Ponce CA, Gallo M, Bustamante R, Vargas SL. Pneumocystis colonization is highly prevalent in the autopsied lungs of the general population. Clin Infect Dis. 2010;50(3):347-53.
50. Wissmann G, Varela JM, Calderón EJ. Prevention of Pneumocystis pneumonia in patients with inflammatory bowel disease based on the detection of Pneumocystis colonization. Inflamm Bowel Dis. 2008;14(12):1751-2.
51. Nevez G, Chabé M, Rabodonirina M, Virmaux M, Dei-Cas E, et al. Nosocomial Pneumocystis jirovecii infections. Parasite. 2008;15(3):359-65.
52. Keely SP, Stringer JR. Multi-locus genotype switching in Pneumocystis carinii sp. f. hominis: evidence for reinfection. J Eukaryot Microbiol. 1996;43(5):50S.
53. Beard CB, Carter JL, Keely SP, Huang L, Pieniazek NJ, et al. Genetic variation in Pneumocystis carinii isolates from different geographic regions: implications for transmission. Emerg Infect Dis. 2000;6(3):265-72.
54. Huang L, Beard CB, Creasman J, Levy D, Duchin JS, et al. Sulfa or sulfone prophylaxis and geographic region predict mutations in the Pneumocystis carinii dihydropteroate synthase gene. J Infect Dis. 2000;182(4):1192-8.
55. de Boer MG, Bruijnesteijn van Coppenraet LE, Gaasbeek A, Berger SP, Gelinck LB, et al. An outbreak of Pneumocystis jiroveci pneumonia with 1 predominant genotype among renal transplant recipients: interhuman transmission or a common environmental source? Clin Infect Dis. 2007;44(9):1143-9.
56. Hauser PM, Nahimana A, Taffe P, Weber R, Francioli P, Bille J, et al. Interhuman transmission as a potential key parameter for geographical variation in the prevalence of Pneumocystis jirovecii dihydropteroate synthase mutations. Clin Infect Dis. 2010;51(4):e28-33.
57. Vargas SL, Hughes WT, Wakefield AE, Oz HS. Limited persistence in and subsequent elimination of Pneumocystis carinii from the lungs after P. carinii pneumonia. J Infect Dis. 1995;172(2):506-10.
58. Ng VL, Yajko DM, Hadley WK. Extrapulmonary pneumocystosis. Clin Microbiol Rev. 1997;10(3):401-18.
59. Manoloff ES, Francioli P, Taffé P, Van Melle G, Bille J, Hauser PM. Risk for Pneumocystis carinii transmission among patients with pneumonia: a molecular epidemiology study. Emerg Infect Dis. 2003;9(1):132-4.
60. Boylan CJ, Current WL. Improved rat model of Pneumocystis carinii pneumonia: induced laboratory infections in Pneumocystis-free animals. Infect Immun. 1992;60(4):1589-97.
61. Dumoulin A, Mazars E, Seguy N, Gargallo-Viola D, Vargas S, et al. Transmission of Pneumocystis carinii disease from immunocompetent contacts of infected hosts to susceptible hosts. Eur J Clin Microbiol Infect Dis. 2000;19(9):671-8.
62. Rivero L, de la Horra C, Montes-Cano MA, Rodríguez-Herrera A, Respaldiza N, et al. Pneumocystis jirovecii transmission from immunocompetent carriers to infant. Emerg Infect Dis. 2008;14(7):1116-8.
63. Olsson M, Strålin K, Holmberg H. Clinical significance of nested polymerase chain reaction and immunofluorescence for detection of Pneumocystis carinii pneumonia.Clin Microbiol Infect. 2001;7(9):492-7.
64. Montes-Cano MA, Chabe M, Fontillon-Alberdi M, de-Lahorra C, Respaldiza N, et al. Vertical transmission of Pneumocystis jirovecii in humans. Emerg Infect Dis. 2009;15(1):125-7.
65. Mortier E, Pouchot J, Bossi P, Molinie V. Maternal-fetal transmission of Pneumocystis carinii in human immunodeficiency virus infection. N Engl J Med. 1995;332:825
66. Thomas CF Jr, Limper AH. Pneumocystis pneumonia. N Engl J Med. 2004;350(24):2487-98.
67. Huang L, Morris A, Limper AH, Beck JM. ATS Pneumocystis Workshop Participants. An Official ATS Workshop Summary: Recent advances and future directions in Pneumocystis neumonia (PCP). Proc Am Thorac Soc. 2006;3(8):655-64.
68. Huang L. Clinical presentation and diagnosis of Pneumocystis pneumonia in HIV- infected patients. In: Walzer P, editor. Pneumocystis pneumonia. 3ª ed. Marcel and Dekker; 2005. p. 349-406.
69. Rodriguez M, Fishman JA. Prevention of infection due to Pneumocystis spp. in human immunodeficiency virus-negative immunocompromised patients. Clin Microbiol Rev. 2004;17(4):770-82.
70. Phair J, Muñoz A, Detels R, Kaslow R, Rinaldo C, et al. The risk of Pneumocystis carinii pneumonia among men infected with human immunodeficiency virus type 1. Multicenter AIDS Cohort Study Group. N Engl J Med. 1990;322(3):161-5.
71. Kovacs JA, Hiemenz JW, Macher AM, Stover D, Murray HW, et al. Pneumocystis carinii pneumonia: a comparison between patients with the acquired immunodeficiency syndrome and patients with other immunodeficiencies. Ann Intern Med. 1984;100(5):663-71.
72. Opravil M, Marincek B, Fuchs WA, Weber R, Speich R, et al. Shortcomings of chest radiography in detecting Pneumocystis carinii pneumonia. J Acquir Immune Defic Syndr. 1994;7(1):39-45.
73. Jasmer RM, Edinburgh KJ, Thompson A, Gotway MB, Creasman JM, et al. Clinical and radiographic predictors of the etiology of pulmonary nodules in HIV- infected patients. Chest. 2000;117(4):1023-30.
74. Baughman RP, Liming JD. Diagnostic strategies in Pneumocystis carinii pneumonia. Front Biosci. 1998;3:1-12.
75. Sandhu JS, Goodman PC. Pulmonary cysts associated with Pneumocystis carinii pneumonia in patients with AIDS. Radiology. 1989;173:33-5.
76. Varthalitis I, Aoun M, Daneau D, Meunier F. Pneumocystis carinii pneumonia in patients with cancer. An increasing incidence. Cancer 1993; 71: 481-485.
77. Tasaka S, Hasegawa N, Kobayashi S, Yamada W, Nishimura T, et al. Serum indicators for the diagnosis of Pneumocystis pneumonia. Chest. 2007;131(4):1173-80.
78. Boldt MJ, Bai TR. Utility of lactate dehydrogenase vs radiographic severity in the differential diagnosis of Pneumocystis carinii pneumonia. Chest. 1997;111(5):1187-92.
79. Fernandez P, Torres A, Miro JM, Vieigas C, Mallolas J, et al. Prognostic factors influencing the outcome in Pneumocystis carinii pneumonia in patients with AIDS. Thorax. 1995;50(6):668-71.
80. Skelly M, Hoffman J, Fabbri M, Holzman RS, Clarkson AB Jr, et al. S- adenosylmethionine concentrations in diagnosis of Pneumocystis carinii pneumonia. Lancet. 2003;361(9365):1267-8.
81. Höcker B, Wendt C, Nahimana A, Tönshoff B, Hauser PM. Molecular evidence of Pneumocystis transmission in pediatric transplant unit. Emerg Infect Dis. 2005;11(2):330-2.
82. Nakamura H, Tateyama M, Tasato D, Haranaga S, Yara S, et al. Clinical utility of serum beta-D-glucan and KL-6 levels in Pneumocystis jirovecii pneumonia. Intern Med. 2009;48(4):195-202.
83. Tasaka S, Kobayashi S, Kamata H, Kimizuka Y, Fujiwara H, et al. Cytokine profiles of bronchoalveolar lavage fluid in patients with Pneumocystis pneumonia. Microbiol Immunol. 2010;54(7):425-33.
84. Shimizu Y, Sunaga N, Dobashi K, Fueki M, Fueki N, et al. Serum markers in interstitial pneumonia with and without Pneumocystis jirovecii colonization: a prospective study. BMC Infect Dis. 2009;9:47.
85. Sage EK, Noursadeghi M, Evans HE, Parker SJ, Copas AJ, et al. Prognostic value of C- reactive protein in HIV-infected patients with Pneumocystis jirovecii pneumonia. Int J STD AIDS. 2010;21(4):288-92.
86. Durand-Joly I, Chabé M, Soula F, Delhaes L, Camus D, et al E. Molecular diagnosis of Pneumocystis pneumonia. FEMS Immunol Med Microbiol. 2005;45(3):405-10.
87. Bava AJ, Cattaneo S, Bellegarde E. Diagnosis of pulmonary pneumocystosis by microscopy on wet mount preparations. Rev Inst Med Trop Sao Paulo. 2002;44(5):279-82.
88.Sun T, Chess Q, Tanenbaum B. Morphologic criteria for the identification of Pneumocystis carinii in Papanicolaou-stained preparations. Acta Cytol. 1986;30(1):80-2.
89. Monheit JG, Brown G, Kott MM, Schmidt WA, Moore DG. Calcofluor white detection of fungi in cytopathology. Am J Clin Pathol. 1986;85(2):222-5.
90. Procop GW, Haddad S, Quinn J, Wilson ML, Henshaw NG, et al. Detection of Pneumocystis jiroveci in respiratory specimens by four staining methods. J Clin Microbiol. 2004;42(7):3333-5.
91. Cregan P, Yamamoto A, Lum A, VanDerHeide T, MacDonald M, et al. Comparison of four methods for rapid detection of Pneumocystis carinii in respiratory specimens. J Clin Microbiol. 1990;28(11):2432-6.
92. Halford JA, Shield PW, Wright RG. The value of direct fluorescent antibody (DFA) testing for the detection of Pneumocystis carinii in cytological specimens. Cytopathology. 1994;5(4):234-42.
93. Silletti RP, Glezerov V, Schwartz IS. Pulmonary paracoccidioidomycosis misdiagnosed as Pneumocystis pneumonia in an immunocompromised host. J Clin Microbiol. 1996;34(9):2328-30.
94. Armbruster C, Pokieser L, Hassl A. Diagnosis of Pneumocystis carinii pneumonia by bronchoalveolar lavage in AIDS patients. Comparison of Diff-Quik, fungifluor stain, direct immunofluorescence test and polymerase chain reaction. Acta Cytol. 1995;39(6):1089-93.
95. Robberts FJ, Liebowitz LD, Chalkley LJ. Polymerase chain reaction detection of Pneumocystis jiroveci: evaluation of 9 assays. Diagn Microbiol Infect Dis. 2007;58(4):385-92.
96. Arcenas RC, Uhl JR, Buckwalter SP, Limper AH, Crino D, et al. A real-time polymerase chain reaction assay for detection of Pneumocystis from bronchoalveolar lavage fluid. Diag Microbiol Infect Dis. 2006;54(3): 69-75.
97. Wakefield AE, Pixley FJ, Banerji S, Sinclair K, Miller RF, Moxon ER, et al. Detection of Pneumocystis carinii with DNA amplification. Lancet. 1990;336(8713):451-3.
98. Ripamonti C, Orenstein A, Kutty G, Huang L, Schuhegger R, Sing A, et al. Restriction Fragment Length Polymorphism Typing Demonstrates Substantial Diversity among Pneumocystis jirovecii Isolates. J Infect Dis. 2009;200(10):1616-22.
99. Lu JJ, Chen CH, Bartlett MS, Smith JW, Lee CH. Comparison of six different PCR methods for detection of Pneumocystis carinii. J Clin Microbiol. 1995;33(10):2785-8.
100. Helweg-Larsen J, Jensen JS, Lundgren B. Non-invasive diagnosis of Pneumocystis carinii pneumonia by PCR on oral washes. Lancet. 1997 Nov 8;350(9088):1363.
101. Miller RF, Wakefield AE. Pneumocystis carinii genotypes and severity of pneumonia. Lancet. 1999;353(9169):2039-40.
102. Totet A, Duwat H, Magois E, Jounieaux V, Roux P, Raccurt C, et al. Similar genotypes of Pneumocystis jirovecii in different forms of Pneumocystis infection. Microbiology. 2004;150(Pt 5):1173-8.
103. Esteves F, Gaspar J, Marques T, Leite R, Antunes F, Mansinho K, et al. Identification of relevant single-nucleotide polymorphisms in Pneumocystis jirovecii: relationship with clinical data. Clin Microbiol Infect. 2010;16:878-84.
104. Lane BR, Ast JC, Hossler PA, Mindell DP, Bartlett MS, Smith JW, et al. Dihydropteroate synthase polymorphisms in Pneumocystis carinii. J Infect Dis. 1997;175(2):482-5.
105. Flori P, Bellete B, Durand F, Raberin H, Cazorla C, Hafid J, et al. Comparison between real-time PCR, conventional PCR and different staining techniques for diagnosing Pneumocystis jiroveci pneumonia from bronchoalveolar lavage specimens. J Med Microbiol. 2004;53(Pt 7):603-7.
106. de Oliveira A, Unnasch TR, Crothers K, Eiser S, Zucchi P, et al. Performance of a molecular viability assay for the diagnosis of Pneumocystis pneumonia in HIV-infected patients. Diagn Microbiol Infect Dis. 2007;57(2):169-76.
Recibido: 12 de enero de 2011.
Aprobado: 5 de abril de 2011.
Enrique Calderón Sandubete. Instituto de Biomedicina de Sevilla, Hospital Universitario Virgen del Rocío, Avda, Manuel Siurot s/n, 41013 Sevilla, España. Teléf.: +34 955013284. Fax: +34 955013292. Correo electrónico: ecalderon@ibis-sevilla.es