Introducción
A nivel mundial, Aedes (Stegomyia) aegypti (Linnaeus, 1762) (Diptera: Culicidae) es el culícido más importante en cuanto a la transmisión de arbovirus de impacto en salud pública. Características geoclimáticas, poblacionales, económicas y sociales han contribuido históricamente a crear marcos favorables para la transmisión de las arbovirosis en el Caribe, y por ende en República Dominicana.1
El dengue es endémico en el país y, aunque su incidencia ha bajado en los últimos años, ha sido causa de la mayor mortalidad por esta enfermedad en toda la región de las Américas en el siglo XXI.2 En relación con el chikungunya, la primera epidemia en República Dominicana se inició en febrero de 2014. Al finalizar el año y tras 45 semanas, se notificaron 524 297 casos sospechosos, 84 casos confirmados y 6 muertes,3 si bien se ha demostrado que la epidemia pudo ser muchísimo más letal de lo declarado por los organismos oficiales de salud.4 En cuanto al zika, el primer caso autóctono se informó a comienzos de 2016,5 observándose una tendencia al aumento progresivo de malformaciones congénitas, sobre todo microcefalia, coincidiendo con la llegada de este virus al país.6
Aedes aegypti, de origen africano y hábitos sinantrópicos, coloniza una amplia variedad de hábitats domésticos, que se generan usualmente por: 1) recolección y almacenamiento de agua para consumo humano por deficiencias en el servicio de abastecimiento de agua; 2) uso de plantas ornamentales; y 3) existencia de objetos inútiles ubicados en patios y jardines que almacenan el agua de lluvia.7 En República Dominicana se demostró recientemente que el acúmulo de residuos sólidos urbanos incrementa las poblaciones de culícidos de importancia médica, siendo Ae. aegypti una de las especies más abundantes en estos reservorios.8
El presente estudio brinda un acercamiento al comportamiento de Ae. aegypti en el entorno doméstico en Jarabacoa, República Dominicana, con el objetivo de profundizar en el conocimiento ecológico de este aedino en el país, a través de los depósitos que utiliza para desarrollar sus formas preimaginales.
Métodos
El estudio se extendió desde octubre a diciembre de 2017 en el municipio Jarabacoa, provincia de La Vega, ubicado en un valle intramontano de la Cordillera Central de República Dominicana, a una altura promedio de 530 msnm y una superficie de 660 km2. Esta localidad presenta un clima tropical lluvioso, algo atenuado por la altitud, temperatura promedio anual de 22 °C y lluvias abundantes durante casi todo el año.
Se muestrearon aleatoriamente 100 viviendas, seleccionadas de acuerdo con una numeración preestablecida de las manzanas de la localidad. Se inspeccionó dentro y fuera de cada vivienda en busca de criaderos potenciales de culícidos, recolectándose, con ayuda de pipetas Pasteur, bandejas plásticas y botes herméticos, la mayor cantidad posible de larvas y/o pupas de cada depósito. Cada muestra se hizo acompañar de una etiqueta en la que se reflejó el tipo de depósito, su ubicación en la vivienda y la fecha de captura. Otros datos, como las coordenadas geográficas de las viviendas, también fueron tomados en cada caso.
En el laboratorio, las muestras se introdujeron en botes eclosionadores para la maduración de los ejemplares hasta alcanzar el estadio larvario L4, tras lo que se procedió a su fijación en alcohol al 70 %, previa muerte por baño de agua caliente a 60 °C. Las pupas se dejaron eclosionar para realizar la clasificación de los adultos, los cuales se les realizó la eutanasia con frío y se conservaron en fresco. La identificación se efectuó mediante la utilización de lupa binocular y, cuando fue necesario, microscopio, utilizando la clave de González Broche.9
Se cuantificó el tipo y total de cada depósito positivo según su ubicación en cada vivienda (exterior e inte rior), calculando el porcentaje de representati vidad, así como el Índice Pupal por Depósitos específicos (IPDe) para cada receptáculo con pupas según la siguiente fórmula: IPDe= (Total de pupas capturadas en depósitos específicos/Total de depósitos específicos con pupas)*100.
Para analizar el nivel de infestación de la localidad, se calcularon los siguientes índices aédicos:
Resultados
Se detectó la presencia de Ae. aegypti en el 41 % de las casas visitadas, si bien solo en un 19 % se encontraron pupas. Se analizaron 419 recipientes de los cuales 74 (17,66 %) fueron positivos a la presencia de esta especie.
En la tabla se muestran los 28 tipos de depósitos colonizados por Ae. aegypti, de los cuales el 32,14 % son de gran utilidad para la población para acumular el agua de consumo familiar. Resultó interesante apreciar que este tipo de depósito incluye el 54,05 % de los reportados con presencia de larvas del vector. Cabe destacar que el 97,29 % de las capturas se realizaron en recipientes ubicados en el peridomicilio.
Tabla Comportamiento de la positividad a Ae. aegypti según tipo de depósito
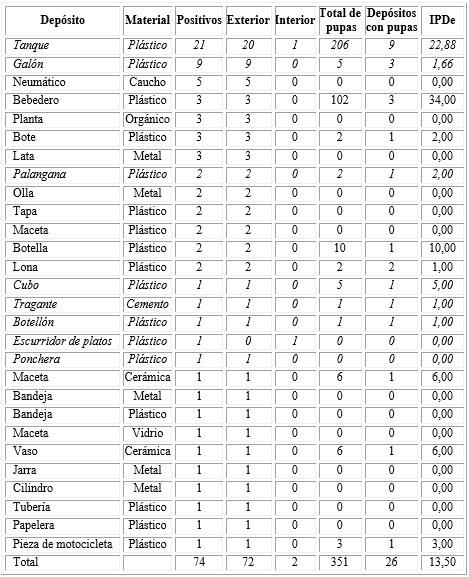
IPDe: Índice Pupal por Depósitos específicos. Solo incluyen los 13 depósitos en los que se capturaron pupas.
Lo destacado en cursiva corresponde a los depósitos de uso permanente.
Se destacaron, en orden decreciente: 21 tanques plásticos (28,37 %), 9 galones plásticos (12,16 %) y 5 neumáticos (6,75 %). En el caso del tanque plástico, este resultó ser el de mayor uso doméstico. El aporte de los depósitos naturales a la focalidad fue muy bajo, con 6 plantas positivas (8,10 %).
Respecto a las pupas, en 13 tipos de depósitos (46,42 %) se colectó dicho estado de desarrollo, de los cuales 7 resultaron ser permanentes (53,84 %). La media del IPDe fue de 13,50 pupas/depósito; por encima de este valor se ubicó el bebedero plástico (34,00 pupas/depósito) y el tanque plástico (22,88 pupas/depósito).
Sobre el material del cual estaban compuestos los depósitos artificiales positivos, 17 fueron de plástico (60,71 %), 5 de metal (17,85 %), 2 de cerámica (7,14 %), y finalmente 1 de cemento, de caucho y de vidrio (3,57 %), respectivamente. El 3,57 % restante corresponde a reservorios naturales de tipo fitotelmata, en concreto plantas de la familia Bromeliaceae.
En un análisis más detallado con respecto a los valores mostrados por tres de los índices aédicos más empleados, se obtuvo lo siguiente: Índice Casa (IC)= 41,00; Índice Recipiente (IR)= 17,66, e Índice Breteau (IB)= 74,00. Estos resultados revelan una elevada presencia del vector en el área muestreada al existir una importante dispersión de la especie, pues hubo una marcada diferencia entre el IC y el IB, resultado de un promedio de 1.80 depósitos positivos/vivienda con presencia del vector.
Discusión
Los resultados evidencian elevados niveles de infestación en los domicilios de Jarabacoa, que deben ser controlados a fin de disminuir el riesgo en la transmisión de arbovirus, priorizando los depósitos útiles y permanentes, como el tanque plástico. Sin embargo, la problemática de esta especie en República Dominicana trasciende el ámbito domiciliar, pues se ha encontrado criando en residuos sólidos urbanos en espacios públicos,8) en focos urbanos de gran importancia como los cementerios,10 y en ambientes fitotélmicos, en ubicaciones más agrestes.11) Todo lo anterior ratifica la gran plasticidad del Ae. aegypti, un mosquito cosmotropical que explota una gran variedad de receptáculos artificiales,12 así como su capacidad de adaptación, pues en su continente de origen es un componente habitual de la fauna fitotelmata.13)
En el vecino Haití, país que ocupa el tercio occidental de la isla La Española, se registró a la especie sobre todo en recipientes artificiales plásticos desechables (depósitos plásticos, botellas y pozuelos) (33,1 %), seguidos de neumáticos en desuso (26,6 %) y latas (11,8 %), todos ellos no permanentes. Por otro lado, los depósitos para el almacenamiento de agua en la vivienda, y por tanto permanentes (tanque bajo, cisternas y cubetas), solo representaron el 7,6 %.14 Es importante notar que este trabajo fue realizado en campos de desplazados en la comuna Carrefour tras el terremoto acaecido en enero de 2010, que destruyó gran cantidad de viviendas, lo cual condujo a un agravamiento de las condiciones higiénicas, sanitarias y ambientales.
En Cuba, el tanque bajo fue el depósito doméstico más importante en la proliferación del vector,15,16,17,18,19 siendo el homólogo del tanque plástico en República Dominicana, los cuales son usados por los moradores para acumular agua potable con diversos y vitales usos. En Trinidad y Tobago, en relación con la productividad pupal de Ae. aegypti en recipientes domiciliares, y en orden decreciente de importancia, cubos, tanques plásticos, tinas, cubetas, neumáticos en desuso y ladrillos huecos y bloques fueron los contenedores clave encontrados.20 En Guatemala, por su parte, la pila estándar resultó la más colonizada por el vector,21 mientras que en México fueron grandes contenedores de agua como tanques y piletas,22,23 así como pequeños, como botes y cubetas.24
Resultó interesante apreciar que esta especie colonizó, mayormente, depósitos con agua limpia en los domicilios, pero también otros eutrofizados, con abundante materia orgánica, como lonas, bebederos (sobre todo los de aves de corral) y neumáticos en desuso. Ello confirma cambios conductuales ya informados en el Caribe,25,26 por lo que podemos redefinir al mosquito como eurioico, al tolerar un amplio rango de variaciones físico-químicas del agua.
El IPDe es de gran importancia pues las pupas presentan baja mortalidad, razón por la que se relacionan directamente con la densidad de mosquitos adultos, responsables de la transmisión de arbovirus.27,28) En Puerto Rico, los cubos, barriles y macetas, informaron la mayor producción pupal;29 en Cuba, los tanque bajos y toneles estuvieron entre los informes más elevados, mientras que en nuestro estudio los bebederos de animales y tanques plásticos indicaron los mayores IPDe; el primero muy frecuente por la abundancia de animales domésticos, y el segundo por ser el principal depósito para almacenar agua de uso familiar.
La alta infestación del vector, atendiendo a los valores de los índices aédicos informados, obliga a resaltar la necesidad de eliminar de forma mecánica los criaderos potenciales identificados en nuestro estudio, lo que constituye la base y principal arma en la lucha contra Ae. aegypti. Para tal cometido es imprescindible incorporar la participación ciudadana,30 sin descartar disponer de mejores técnicas de construcción, servicios más adecuados y mejores políticas sociales. Nada de lo anterior será posible sin la implicación total de las instituciones y el endurecimiento de la actual legislación sanitaria.

















