Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.15 n.2 Ciudad de la Habana Mayo-ago. 1999
Producción
Instituto de Hematología e InmunologíaPreparación de un conjugado anti IGG de ratón-peroxidasa en cabra
Lic. Julio C. Merlín Linares, Lic. Rinaldo Villaescusa Blanco, Lic. Ana M. Guerreiro Hernández, Dr. Juan M. González González, Dra. Renée González Sampedro y Lic. Ada A. Arce HernándezResumen
Se preparó un conjugado con peroxidasa a partir de los anticuerpos específicos aislados de un antisuero de cabra anti IgG de ratón (molécula completa). Los anticuerpos se aislaron por cromatografía de afinidad y el conjugado se preparó por el método de oxidación con peryodato. El conjugado obtenido presentó una relación molar IgG/peroxidasa de 1,31, un valor de RZ de 0,285 y resultó evaluado satisfactoriamente en cuanto a su especificidad y reactividad en los ensayos inmunoenzimáticos realizados.Descriptores DeCS: SUEROS INMUNES/aislamiento & purificación; IGG/aislamiento & purificación; CROMATOGRAFIA POR INTERCAMBIO IONICO/métodos; CROMATOGRAFIA DE AFINIDAD/métodos.
Los sueros anti-inmunoglobulinas se han utilizado muy frecuentemente para potenciar y hacer más evidente la interacción antígeno-anticuerpo en los métodos indirectos o de doble anticuerpo, lo que permite alcanzar especificidad y sensibilidad superiores debido a una mayor precipitación o aglutinación, o por una mejor separación entre el antígeno libre y el que se encuentra enlazado con su anticuerpo específico. La introducción de los anticuerpos monoclonales (AcM) ha permitido elevar considerablemente la especificidad en muchos de estos métodos. Sin embargo, cuando los niveles de sensibilidad alcanzados resultan aún insuficientes, se hace necesario recurrir al marcaje del antígeno o del anticuerpo con radionúclidos, con fluorocromos o con enzimas.
Los anticuerpos marcados con peroxidasa, que fueron utilizados inicialmente como una alternativa a los anticuerpos fluorescentes,1 poseen actualmente múltiples y muy variadas aplicaciones2,3 y se pueden preparar por un método sencillo y eficiente de oxidación con peryodato4 en los mismos laboratorios donde se van a emplear.
Este trabajo se realizó con el objetivo de preparar un conjugado anti IgG de ratón-peroxidasa en cabra, para su empleo como segundo anticuerpo en aquellas técnicas en las que se emplean anticuerpos mo-noclonales de ratón como primer anticuerpo.
Métodos
Aislamiento y purificación de IGG
El aislamiento y purificación de la IgG de ratón se realizó a partir de una mezcla de sueros normales de ratones de diferentes líneas isogénicas. Para el aislamiento se aplicó una precipitación con polietilenglicol 6 000 (PEG 6 000) y para la purificación se emplearon la cromatografía de intercambio iónico en DEAE Sephacel, de filtración en gel de Sephadex G-150 y de afinidad en gel de proteína A-Sepharosa CL-4B.5,6 La IgG de cabra se purificó por cromatografía de intercambio iónico en resina tipo DE-52 y de filtración en gel de Sephadex G-150.Producción de antisueros
El suero anti IgG de ratón se obtuvo por inmunización intramuscular en cabra, y el anti IgG de cabra se obtuvo por inmunización intramuscular en conejos. Los sueros antiproteínas séricas totales de ratón y de cabra se obtuvieron por inmunización del suero normal diluido en conejos. En todos los casos se emplearon los esquemas de inmunización diseñados por nuestro grupo de trabajo.Purificación de los antisueros
El suero de cabra anti IgG de ratón se precipitó con sulfato de amonio al 50 % de saturación y se aplicó en una columna cromatográfica de Sepharosa CL-4B aco-plada con IgG de ratón pura, a una concen-tración de 2 mg/mL de gel. Los anticuerpos específicos aislados se absorbieron con proteínas de suero normal humano y de conejo. La absorción se realizó en columnas cromatográficas que contenían 5 mL de Sepharosa CL-4B acoplada con las pro-teínas presentes en 1 mL de suero humano (97,8 % de la proteína acoplada a la resina) y de conejo (99,9 % de acoplamiento).Preparación del conjugado
La conjugación de la peroxidasa (E.C.1.1.1.1.7; tipo VI, SIGMA) con los anticuerpos específicos anti IgG de ratón se llevó a cabo por el método de oxidación con peryodato,4 empleando una proporción de 0,5 mg de peroxidasa por cada mg de anticuerpo. El conjugado se dializó contra solución amortiguadora de fosfatos 0,01 M de pH 7,2 que contenía NaCl 0,15 M (PBS), se purificó por cromatografía en Sepharosa CL-6B y se le determinó la relación molar IgG/peroxidasa y el valor de RZ (DO a 403 nm/DO a 280 nm). Se le añadió albúmina de suero bovino al 1 % y timerosal al 0,01 % para su conservación en alicuotas a < 30 °C.Evaluación de los productos obtenidos
La pureza de la IgG de ratón, de la IgG de cabra y de los anticuerpos específicos, así como la reactividad y especificidad de estos últimos, se comprobaron por inmu-noelectroforesis7 y por doble inmuno-difusión en gel de agar. El conjugado se evaluó por medio de ensayos inmuno-enzimáticos heterogéneos tipo ELISA.El primer ensayo immunoenzimático se realizó por el método directo en placas recubiertas con diferentes concentraciones de IgG de ratón, saturadas con albúmina de suero bovino e incubadas con el conjugado. Posteriormente se incubó con la mezcla sustrato -cromógeno (H2O2 - OPD), se detuvo la reacción con ácido sulfúrico 2M y se leyó a 492 nm.
El segundo ensayo inmunoenzimático se realizó por un método indirecto, en una placa recubierta con factor VIII/factor von Willebrand (FVIII/vW) que se incubó con diferentes diluciones de líquido ascítico murino que contenía un AcM anti-FVIII/vW, con el conjugado y con el sustrato cromógeno. En el tercer ensayo inmunoenzimático se utilizó una placa preparada de igual forma que en el primero, que se incubó con diferentes diluciones del conjugado.
Resultados
La doble inmunodifusión y la inmunoelectroforesis en gel de agar permitieron comprobar la pureza de la IgG de ratón, de la IgG de cabra y de los anticuerpos específicos anti IgG de ratón. En todos los casos se obtuvo una sola línea de precipitación debida a la IgG de la especie en cuestión, frente al suero anti IgG y frente al suero antiproteínas séricas totales.Al emplear la doble inmunodifusión y la inmunoelectroforesis para evaluar la reactividad y la especificidad de los anticuerpos específicos anti IgG de ratón aislados, se observó que éstos producían una sola línea de precipitación con la IgG de ratón pura y con el suero normal de ratón. No se observaron líneas de precipitación con las restantes proteínas del suero de ratón, ni con las del suero humano. A partir de los anticuerpos aislados por cromatografía de afinidad y absorbidos con proteínas del suero humano y de conejo, se preparó el conjugado con peroxidasa. Se empleó una relación molar de peroxidasa/IgG de 2. El conjugado, después de la purificación con Sepharosa CL-6B, presentó una relación peroxidasa/IgG de 0,76 y un valor RZ de 0,285. El producto presentó el aspecto de un líquido transparente de color amarillo claro, sin contaminación con la peroxidasa ni la IgG sin conjugar, las que se separaron por la cromatografía en Sepharosa CL-6B.
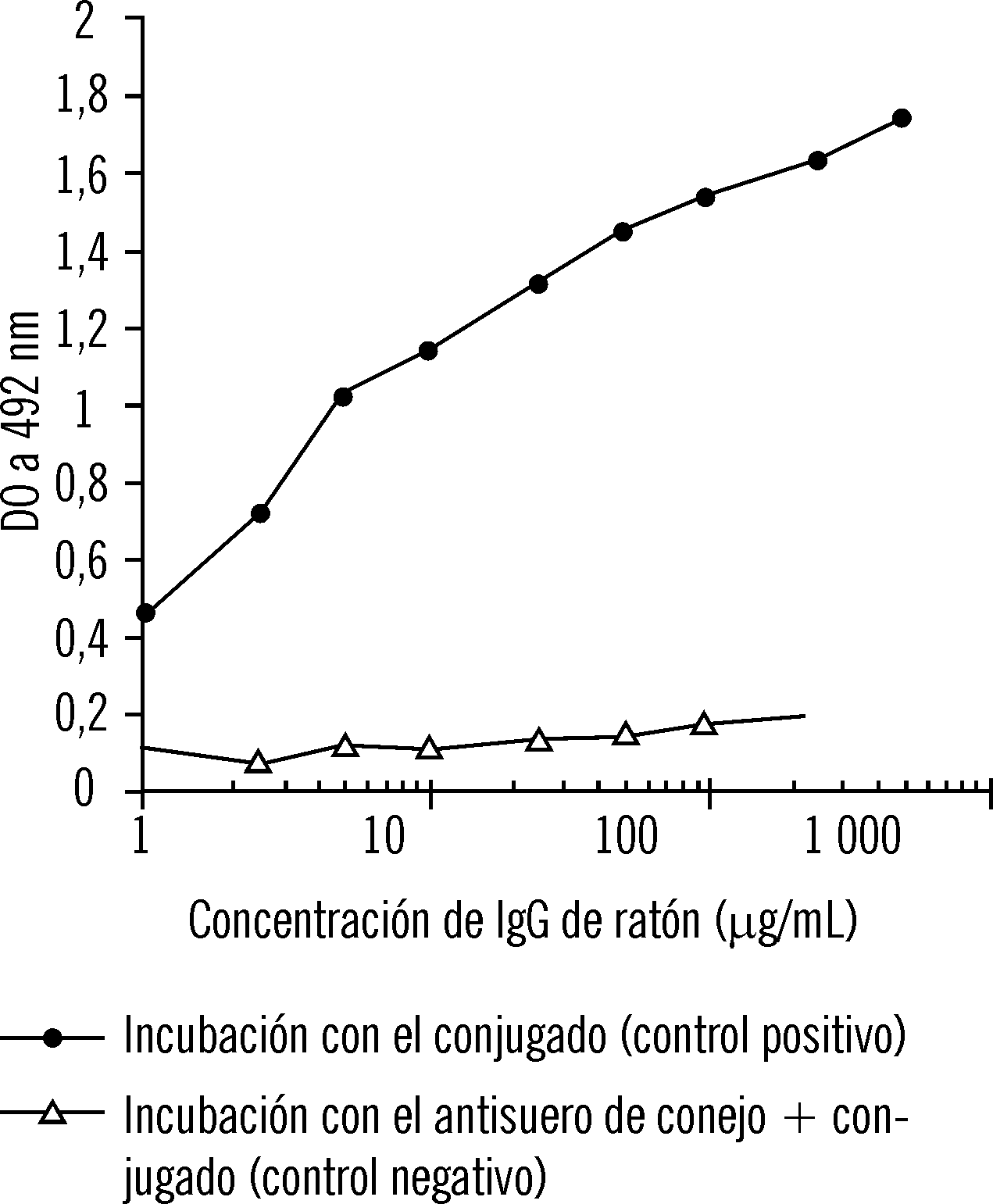
En el primer ensayo inmunoenzimático se observó que el conjugado se fijaba a la placa en cantidades directamente proporcionales a la concentración de IgG de ratón empleada en el recubrimiento (fig. 1). Cuando se incubó la placa recubierta con IgG de ratón con un antisuero de conejo antes de añadir el conjugado (controles negativos, el conjugado no se fijó a la placa.
FIG. 1. Ensayo inmunoenzimático en una placa recubierta con IgG de ratón. Influencia de la contentración de IgG de ratón.
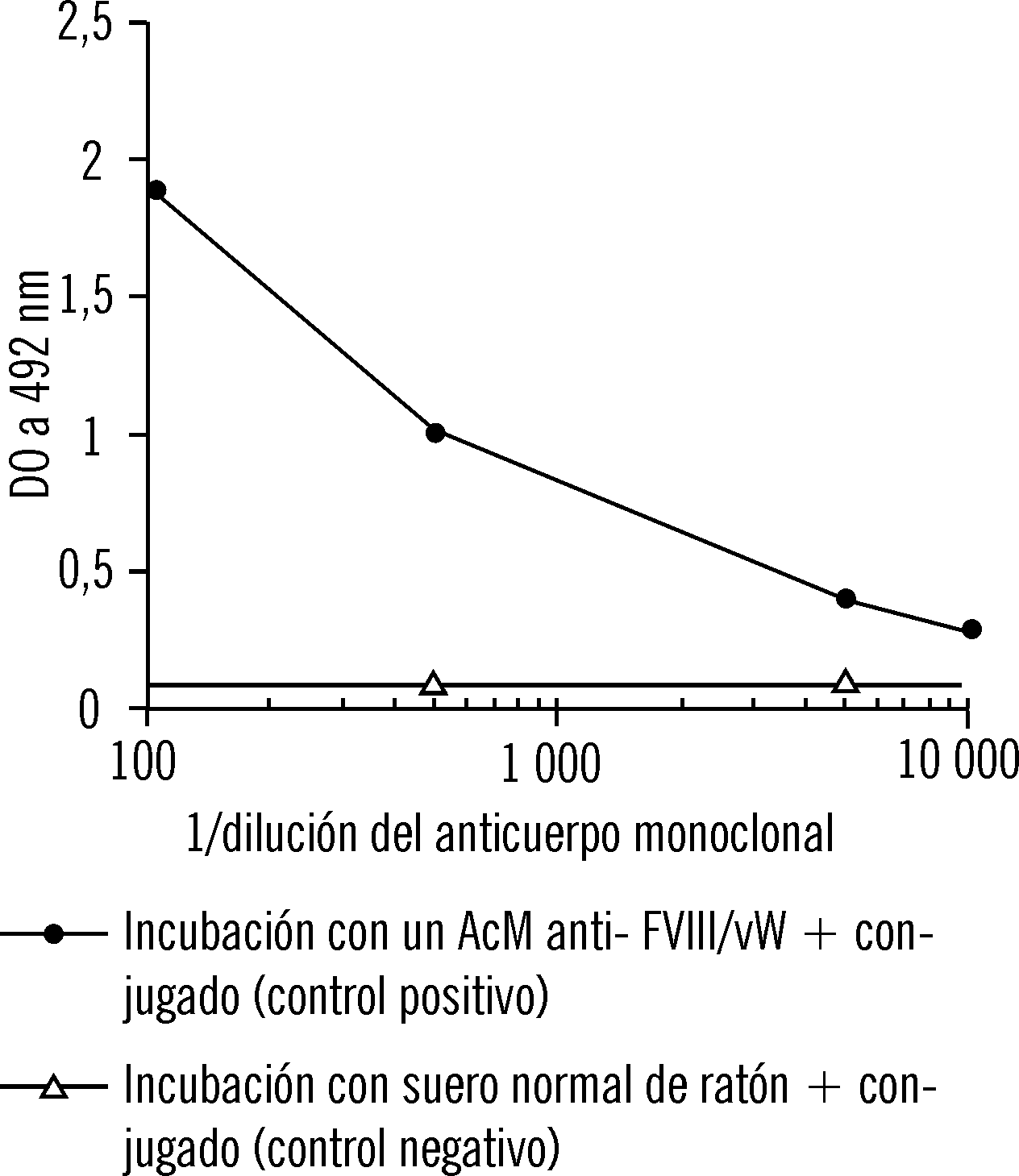
En el segundo ensayo inmuno-enzimático se observó que el conjugado se fijaba a la placa en cantidades proporcionales a las concentraciones del AcM (fig. 2). En los controles negativos, en los que se sustituyó el anticuerpo monoclonal por un suero normal (no inmune) de ratón en iguales diluciones, la fijación del conjugado se mantuvo a niveles mínimos (valores de DO inferiores a 0,1).
FIG. 2. Ensayo inmunoenzimático en la placa recubierta con FVIII/vW. Influencia de la concentración del anticuerpo primario.
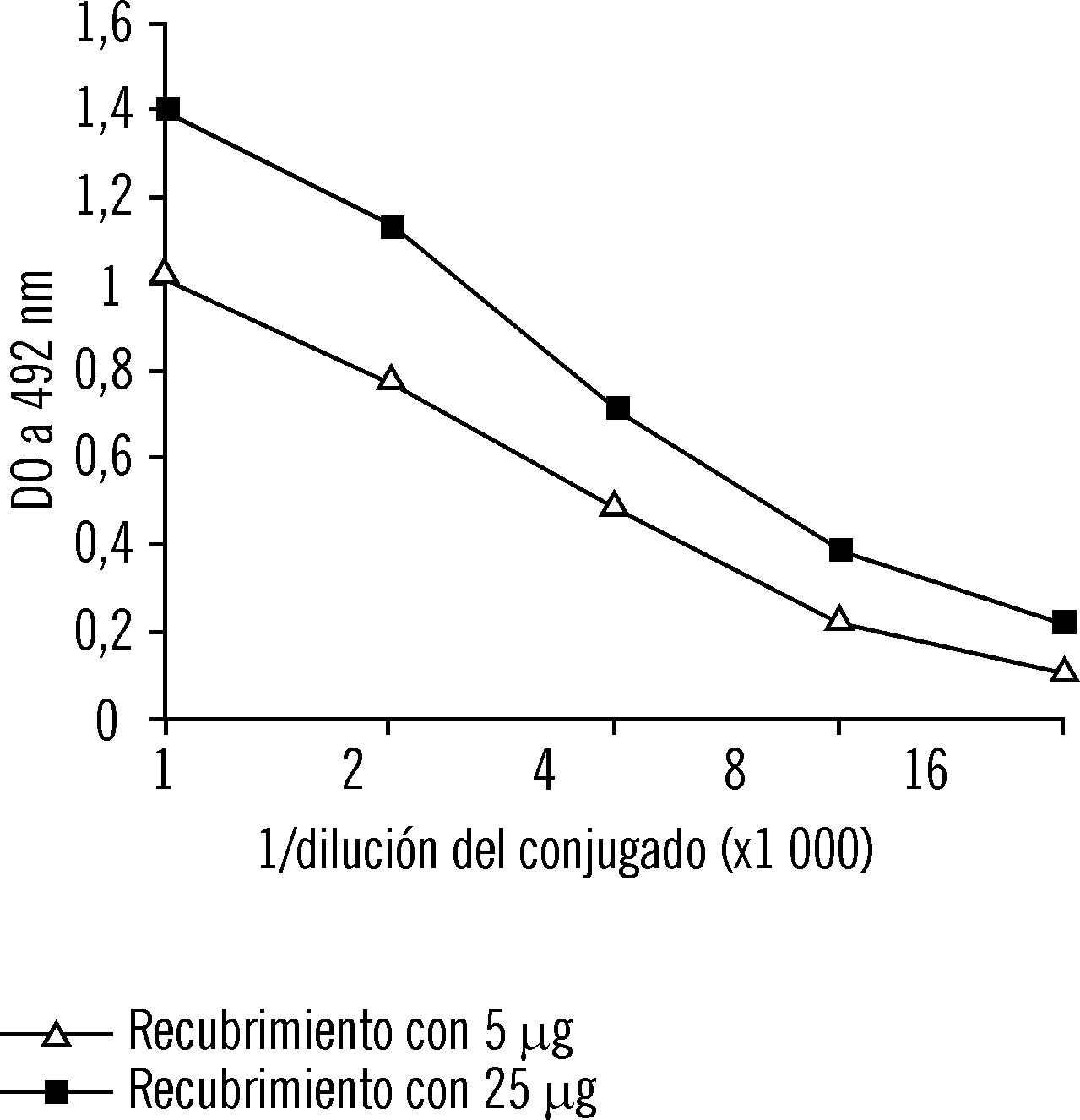
En el tercer ensayo inmunoenzimático se observó un aumento proporcional de las lecturas al aumentar la concentración del conjugado. Se obtuvo una DO de aproxi-madamente 1,0 en una placa recubierta con 25 m g/mL de IgG de ratón e incubada con una dilución 1:2 000 del conjugado, y una DO de 1,1 para una placa recubierta con 5 m g/mL de IgG de ratón e incubada con una dilución de 1:1 000 del conjugado (fig. 3).
FIG. 3. Ensayo inmunoenzimátcio en una placa recubierta con IgG de ratón. Influencia de la concentración del conjugado.
Discusión
En este trabajo se purificó la IgG de ratón para emplearla en la producción de un antisuero en cabra, a partir del cual se aislaron los anticuerpos específicos anti IgG de ratón por cromatografía de afinidad. Estos anticuerpos específicos se absorbieron con las proteínas del suero normal humano y de conejo para eliminar algunas de las posibles reacciones cruzadas, con el propósito de garantizar la preparación de un conjugado que tuviera un alto grado de especificidad.Para la preparación del conjugado se mantuvo la relación molar peroxidasa/anticuerpo de 2, aunque las concentraciones fueron inferiores a las recomendadas en la técnica original,4 para evitar la precipitación de los anticuerpos de cabra específicos para la IgG de ratón. La relación molar peroxidasa/IgG del conjugado obtenido indica la proporción de moléculas de anticuerpo marcadas con la enzima (aproximadamente el 80 %) como promedio, la cual resultó comparable con las obtenidas por otros autores y con las de los productos comerciales.4,8
A partir de los resultados del tercer ensayo inmunoenzimático, se pudo estimar el título del conjugado en el rango de diluciones entre 1:1 000 y 1:2 000. Este título constituye uno de los parámetros que permiten caracterizar el conjugado, junto con la relación molar IgG/peroxidasa (1,31), el valor del índice RZ (0,285), y las diluciones de trabajo recomendadas para diferentes tipos de técnicas, especialmente para el ELISA (1:2000).
De cuerdo con los resultados obtenidos, se comprobó que con la utilización de anticuerpos anti IgG de ratón purificados por afinidad y absorbidos con proteínas del suero de otras especies, se lograba preparar un conjugado con un alto grado de especificidad y una reactividad elevada. Los ensayos inmunoenzimáticos permitieron evaluar satisfactoriamente este conjugado, por lo que se puede considerar como apto para su utilización en técnicas de este tipo o similares, así como en el pesquisaje de AcM.
Summary
A peroxidase conjugate was prepared starting from the specific antibodies isolated from an anti-mouse IgG goat antiserum (complete molecule). The antibodies were isolated by affinity chromatography, whereas the conjugate was prepared by the method of oxidation with periodate. The conjugate obtained presented a molar relation IgG/peroxidase of 1.31 and a RZ value of 0.285. Its specificity and reactivity were satisfactorily evaluated in the immunoenzimatic assays carried out.Subject headings: IMMUNE SERA/isolation & purification; IGG/isolation & purification; CHROMATOGRAPHY, ION EXCHANGE/methods; CHROMATOGRAPHY; AFINNITY/methods.
Referencias bibliográficas
1. Nakane PK, Pierce GB Jr. Enzyme labeled antibodies: preparation and application for the localization of antigens. J Histochem Cytochem 1966;14:929-31.
2. Taylor OR, Bchir MB. Immunoperoxidase techniques. Practical and theoretical aspects. Arch Pathol Lab Med 1978;102:113-21.
3. Mason DY, Taylor CR. The detection of intracellular antigens by immunoperoxidase staining. Br J Med 1975;31:361-70.
4. Wilson MB, Nakane PK. Recent developments in the periodate method of conjugating horseradish peroxidase (HRPO) to antibodies. En: Knapp W, Hollubat K, Wick G, eds. Immunofluorescence and related staining techniques. New York: Academic, 1978:215.
5. Fahey JL. Chromatographic separation of immunoglobulins. En: Chase W. ed. Methods in immunology and immunochemistry. New York: Academic,1978;vol 1: 321.
6. Ey PL, Prowse SJ, Jenkin CR. Isolation of pure IgG1, IgG2a and IgG2b immunoglobulins from mouse serum using protein A-Sepharose. Immunochemistry 1978;15:429-36.
7. Ouchterlony O, Nilsson LA. Immunodiffusion and immunoelectrophoresis. En: Weir DM, ed. Handbook of experimental immunology. Vol 1. Oxford: Blackwell Scientific, 1978;vol 1:1-44.
8. Nakane PK, Kawaoi A. Peroxidase labeled antibody. A new method of conjugation. J Histochem Cytochem 1974;22:1084-91.
Recibido: 5 de enero de 1999. Aprobado: 3 de febrero de 1999.
Lic. Julio C. Merlín Linares. Instituto de Hematología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléfono (537) 578268. Fax (537) 338979. e-mail: ihidir @ hemato. sld.cu