Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.15 n.3 Ciudad de la Habana sep.-dic. 1999
Técnicas
Instituto de Hematología e InmunologíaPurificación de C1r a partir de la fracción I de Cohn
Lic. Ada A. Arce Hernández,1 Ing. Ed J. Nieuwahuys2 y Dr. Andrew J. Hannema2RESUMEN
Se describe un método de purificación del componente C1r del sistema complemento a partir de la fracción I de Cohn mediante cromatografías secuenciales en Bio Rex 70, DEAE Sephacel y Sephacryl S 200. La presencia de C1r en las fracciones eluidas en las diferentes corridas cromatográficas se detectó por nefelometría. La pureza del C1r obtenido se determinó por inmunoelectroforesis contra un suero anti proteínas séricas humanas y un antisuero específico. A partir del C1r purificado se produjo en conejos un antisuero de buena calidad, útil para la cuantificación del C1r sérico.Descriptores DeCS: COMPLEMENTO 1R/aislamiento & purificación; CROMATOGRAFIA POR INTERCAMBIO IONICO/métodos; CROMATOGRAFIA EN GEL/métodos.
El C1 es el primer componente de la vía clásica del sistema complemento, el cual es un complejo formado por 3 proteínas: C1q, C1r y C1s.1 Después de la unión de la molécula del C1 a la región Fc de las inmunoglobulinas IgG e IgM por la subunidad C1q, se inician procesos intramoleculares que dan lugar a la activación enzimática de C1r, y generan un fragmento proteolítico de 28 kD que tiene actividad de serinproteasa, lo que provoca la formación de una enzima proteolítica, C1s, con la activación de la vía clásica del complemento y con esto, la expresión de numerosas manifestaciones biológicas.2
En infecciones con bacterias piógenas y en enfermedades asociadas con inmunocomplejos circulantes como el lupus eritematoso sistémico, se han demostrado niveles disminuidos de C1r, lo que sugiere su posible participación en el mecanismo de aclaramiento de los complejos de la circulación, de ahí la importancia de su medición.3,4
El objetivo de este trabajo fue la purificación de C1r mediante una combinación de cromatografías de intercambio iónico y filtración en gel, y la posterior obtención de un antisuero específico.
MÉTODOS
Fuente de C1r: 600 mL de la fracción I de Cohn con una concentración de C1r de 38,5 µg/mL, cuantificado por inmunodifusión radial simple con el empleo de placas comerciales (CLB, Amsterdam),5 fueron centrifugados a 9 000 rev/min durante 30 min a 4 °C (Sorval G 53).
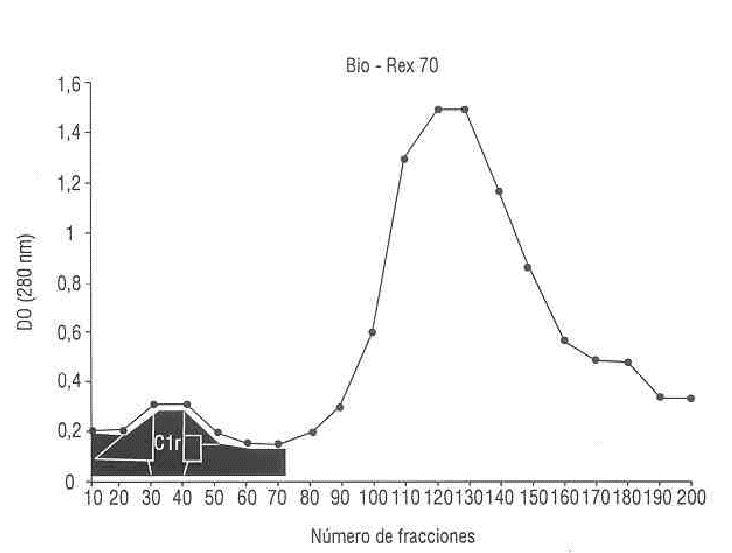
Aislamiento de C1r: la fracción I de Cohn centrifugada se fraccionó mediante cromatografía de intercambio iónico en una resina catiónica Bio-Rex 70,6 en una columna de 10,5 x 12 cm equilibrada con solución amortiguadora de fosfatos 50 mM, pH 7,3 + 2 mM EDTA + 82 mM NaCl. Se aplicaron los 600 mL de la muestra y se eluyó una parte de las proteínas con la solución amortiguadora de equilibrio.
En el eluido se detectó la presencia de C1r por nefelometría e inmuno-electroforesis; se utilizó un suero antiproteínas séricas humanas y un suero anti C1r comercial (CLB, Amsterdam).7
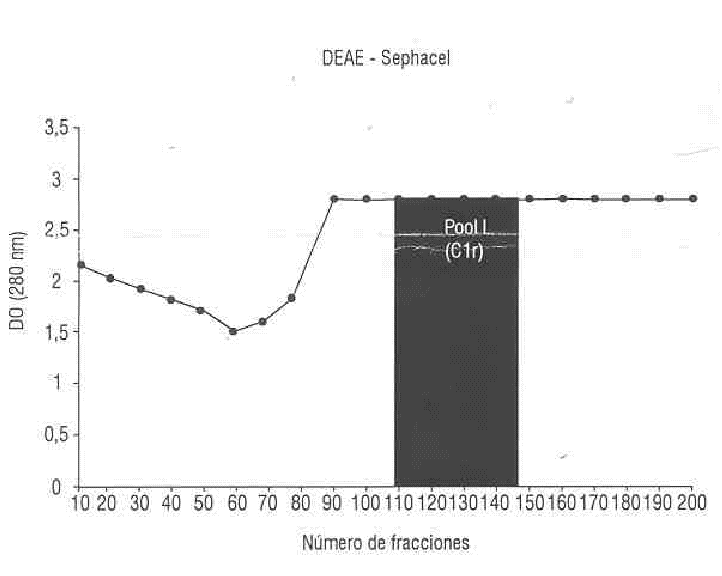
Las proteínas eluidas se concentraron por ultrafiltración con un filtro Amicon YM 10 (Amicon Corporation) hasta 800 mL y se aplicó a una columna de 10,5 ± 12 cm de DEAE-Sephacel equilibrada con solución amortiguadora fosfato salina (PBS) 1:2. A continuación, se empleó un gradiente de concentración de NaCl (1 000 mL PBS 1:2 - 1 000 mL PBS 1:2 + 0,6 M NaCl).
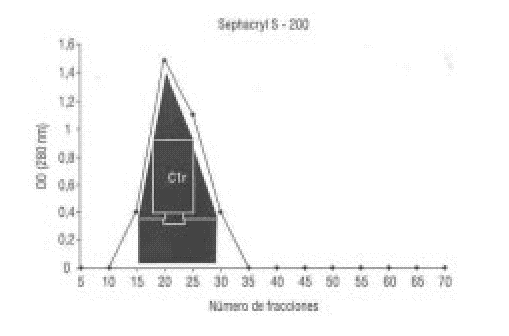
Las fracciones obtenidas que contenían C1r se concentraron por un filtro Amicon YM 10 hasta un volumen de 50 mL, y se aplicó a una columna de 2 ± 100 cm de Sephacryl S-200 equilibrada con PBS. Se unieron las fracciones en las que se detectó la presencia de C1r por nefelometría y se realizó una precipitación diferencial con sulfato de amonio al 33 %.8
El precipitado se redisolvió en PBS y se controló la pureza por inmuno-electroforesis empleando un suero antiproteínas séricas humanas y un suero anti C1r comercial.
El C1r purificado se concentró con el empleo de un filtro Amicon YM 10 hasta 50 mL y se conservó a -80 °C.
La concentración del C1r purificado se determinó mediante inmunodifusión radial simple, con el uso de placas comerciales.
Preparación de un suero anti C1r: el suero anti C1r se obtuvo en conejos, después de una inyección de 100 µg de C1r con adyuvante completo de Freund cerca de los nódulos linfáticos poplíteos. Cuatro semanas después se inyectaron por vía intramuscular y subcutánea 150 µg de C1r con adyuvante incompleto de Freund y después de una semana los animales se desangraron9 y se comprobó la especificidad del antisuero mediante inmunoelectroforesis.
RESULTADOS
En la figura 1 se observa el cromatograma de la corrida en Bio-Rex 70 utilizando una solución amortiguadora de fosfato 50 mM, pH 7,3 + 2 mM EDTA + 82 mM NaCl, donde eluyeron gran cantidad de proteínas incluyendo el C1r.
Con las condiciones empleadas en la cromatografía en DEAE-Sephacel una gran cantidad de proteínas contaminantes eluyeron de la columna. La aplicación posterior de un gradiente de concentración de NaCl dio como resultado la elución del C1r (fig. 2).
El resultado obtenido producto de la cromatografía de filtración en Sephacryl S-200 se presenta en la figura 3, donde se observa el pico correspondiente a C1r.
Se comprobó la obtención de C1r relativamente puro mediante una inmunoelectroforesis con el empleo de un suero antiproteínas séricas humanas y un suero anti C1r comercial. De igual forma, se obtuvo una línea de precipitación en la inmunoelectroforesis con la utilización del anti C1r obtenido contra un suero normal humano.
El rendimiento obtenido a partir de los 600 mL de muestra inicial fue de 32,8 %, que representa un total de 7,6 mg de C1r.
DISCUSIÓN
El empleo en la fase inicial del intercambiador catiónico Bio-Rex 70, celulosa de gran capacidad, especialmente para moléculas grandes, permitió la separación de componentes de elevado peso molecular, como es el caso del C1q eluyendo proteínas pequeñas, entre las que se encuentra el C1r.10
Las condiciones de la solución se ajustaron basadas en el hecho de que a bajas concentraciones y pH de 7,0 o menores, no se logra un buen intercambio en la resina con diversas proteínas, lo que facilita la elución del C1r.6
En una segunda etapa se utilizó una columna de DEAE-Sephacel para lograr el fraccionamiento de las proteínas y una mejor separación con el gradiente seleccionado. A partir de las condiciones empleadas, una gran cantidad de proteínas pasaron a través de la columna, incluyendo IgG, IgM, factor D y glicoproteínas. El gradiente de concentración de NaCl permitió desunir al C1r de la resina.
Mediante la cromatografía de filtración en Sephacryl S-200 se separó el C1r de los contaminantes. A continuación se efectuó una precipitación con sulfato de amonio al 33 %; estudios anteriores han revelado que el C1r precipita completamente al 33 % de saturación.11
Se inmunizó a un grupo de conejos con el C1r aislado, para lo cual se utilizó adyuvante completo de Freund, que favorece una buena respuesta por parte del animal, dirigida fundamentalmente al componente principal, en este caso el C1r, ya que no se descarta que pudieran existir trazas de algún contaminante.9 Además, el empleo de bajas concentraciones de antígeno permite la síntesis de anticuerpos de alta afinidad, muy útiles en diversas técnicas.12
Los resultados presentados muestran la aplicación de un método de purificación del componente C1r del sistema complemento a partir de la fracción I de Cohn, con el cual se logra un buen rendimiento con una pureza adecuada, lo que se demostró mediante la producción de un antisuero de calidad.
SUMMARY
A methods for the purification of component Clr from the complement system starting from Cohn's fraction I by sequential chromatographies in Bio-Rex 70, DEAE-Sephacel and Sephacryl S-200 is described. The presence of Clr in the fractions eluted in the different chromatographic runs was detected by turbidimetry. The purity of the Clr obtained was determined by immunoelectrophoresis against an anti-human serum protein serum and a specific antiserum. Starting from the purified Clr it was produced in rabbits a good quality serum, which is useful for the quatitation of serum Clr.Subject headings: COMPLEMENT 1R/isolation & purification; CHROMATOGRAPHY, ION EXCHANGE/methods; CHROMATOGRAPHY, GEL/methods.
REFERENCIAS BIBLIOGRÁFICAS
1. Lepow IH, Naff GB, Todd EW, Pensky J, Hinz CF. Chromatographic resolution of the first component of human complement into three activities. J Exp Med 1963;117:983-1008.
2. Rodríguez de Córdoba S. Estructura molecular, mecanismos de activación y genética del complemento. En: Larraga V, Fresno M, Enjuanes L, eds. Nuevas tendencias en inmunología. La Habana,1987:59-83 (Edición Revolucionaria).
3. Figueroa JE, Denser P. Infectious diseases associated with complement deficiencies. Clin Microbiol Rev 1991;12:359-95.
4. Colten HR, Rosen FS. Complement deficiencies. Annu Rev Immunol 1992;10:809-34.
5. Mancini G, Carbonara AO, Heremans JF. Immunochemical quantitation of antigens by single radial immunodiffusion. Immunochemistry 1965;193:265-373.
6. Fahey JL. Chromatographic separation of immunoglobulins. En: Williams CA, Chase W, eds. Methods in immunology and immunochemistry. Londres: Academic Press, 1967;vol1:321-32.
7. Ouchterlony O, Nilson LA. Immunodiffusion and Immunoelectrophoresis. En: Weir DM, ed. Handbook of experimental immunology. Oxford: Blackwell Scientific, 1986;vol1:32.1 32-50.
8. Heide K, Schwick HG. Salt fractionation of immunoglobulins. En: Weir DM, ed. Handbook of experimental immunology. Immunochemistry. London: Blackwell Scientific, 1978;vol 1:7.1-7.11.
9. Margni RA, ed. Inmunología e inmunoquímica. La Habana,1982:121-3 (Edición Revolucionaria).
10. Arce AA, Nieuwahuys EJ, Hannema AJ. Purificación de C1q a partir de la fracción I de Cohn. Rev Cubana Hematol Inmunol Hemoter 1998;3:(en prensa).
11. Grabar P, Williams CA. Méthode permettant l'étude conjuguée des propriétés électrophorétiques et immunochimiques d'un mélange de protéines. Application au sérum sanguin. Biochim Biophys Acta 1953;10:193 8.
12. Steward MW. Introduction to methods used to study the affinity and kinetics of antibody antigen reactions. En: Weir DM, ed. Handbook of experimental immunology. Oxford: Blackwell Scientific,1986;vol1:25.1 25.30.
Recibido: 3 de marzo de 1999. Aprobado: 15 de marzo de 1999.Lic. Ada A. Arce Hernández. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Teléfono: (537) 578268. Fax: (537) 338979.
e mail:ihidir@hemato.sld.cu
1 Instituto de Hematología e Inmunología.
2 Central Laboratory of the Netherlands Red Cross Blood. Transfusion Service.