Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.17 n.3 Ciudad de la Habana sep.-dic. 2001
Técnicas
Banco de Sangre Provincial de Camagüey
Valoración de la titulación de anticuerpos antitetánicos por UMELISA en donantes especiales
Dr. Lázaro Mena López,1 Dr. Ciro Núñez Mesa,1 Dra. Nancy Pérez Cabarco,1 Dr. José Fernández Estrada,2 Lic. Rafael Muñoz Fernández,1 Lic. Lester López Molina1 y Lic. Yaramis Armenteros Medina
Resumen
Se evaluó la precisión y exactitud del kit UMELISA en la dosificación de IgG antitétanos. Se estudió la variabilidad de la concentración de anticuerpos en función del tiempo y la temperatura de almacenamiento en 34 donantes especiales de plasma hiperinmune antitetánico inmunizados con la vacuna toxoide tetánico de producción nacional y sometidos a procedimientos de donación por plasmaféresis automatizada. Se escogieron 2 grupos de estudio según la concentración de inmunoglobulinas séricas (<10 UI/mL y >10 UI/mL) y se trabajaron con muestras conservadas a _30 °C y de 2 a 8 °C. Las pruebas estadísticas utilizadas en el procesamiento de la información arrojaron que la técnica es precisa y exacta, y que las mayores fluctuaciones ocurren cuando los títulos son bajos y se conservan a temperaturas entre 2 y 8 °C.
DeCS: GAMMAGLOBULINAS/inmunología; ANTICUERPOS/farmacología; TECNOLOGIA MEDICA/métodos; DONADORES DE SANGRE; PLASMAFERESIS/métodos.
En nuestro país comenzó a desarrollarse desde 1996 la obtención de plasma hiperinmune antitetánico a partir de donantes seleccionados con altos títulos de anticuerpos,1 destinado a la producción de gammaglobulina antitetánica de origen humano. Este mismo año, el Banco de Sangre Provincial de Camagüey se incorporó al programa utilizando el procedimiento ético e inocuo de plasmaféresis2,3 productiva automatizada en personas previamente inmunizadas con la vacuna del toxoide tetánico.4
El monitoraje del título de anticuerpos antitetánicos por la tecnología SUMA permite valorar evolutivamente la respuesta humoral de los donantes y obtener de esta forma un plasma de calidad óptima para la producción de inyectables.5-8
En el presente trabajo se realizó una evaluación de la precisión y exactitud de la técnica UMELISA para la determinación de IgG antitétanos en suero humano.
Métodos
Se escogió aleatoriamente un grupo de donantes especiales de plasma hiperinmune antitetánico (n = 34) y se agrupó en 2, uno con concentraciones inferiores a 10 UI/mL y otro con concentraciones mayores de 10 UI/mL. Ambos se subdividieron en otros 2, uno con muestras conservadas de 2 a 8 °C y el otro conservado a - 30 °C en alícuotas que fueron descongeladas durante el procedimiento solo una vez. Los 4 grupos fueron estudiados a la vez en una misma placa del kit UMELISA Tetanus durante 5 semanas consecutivas. A las muestras agrupadas se les calculó la media (![]() ) y la desviación estándar (DE), empleando el test de hipótesis de comparación de las diferencias de las medias (Microstat). Se tuvo en cuenta la temperatura de almacenamiento, la concentración y el momento de ejecución de la prueba, para establecer si las diferencias eran estadísticamente significativas con un nivel de significación alfa <= 0,05. Además, 2 muestras, una con concentraciones < 10 UI/mL y otra con concentraciones > 10 UI/mL, ambas conservadas a - 30 °C se testaron 50 veces cada una en 5 ocasiones diferentes, y se estableció el valor máximo y mínimo,
) y la desviación estándar (DE), empleando el test de hipótesis de comparación de las diferencias de las medias (Microstat). Se tuvo en cuenta la temperatura de almacenamiento, la concentración y el momento de ejecución de la prueba, para establecer si las diferencias eran estadísticamente significativas con un nivel de significación alfa <= 0,05. Además, 2 muestras, una con concentraciones < 10 UI/mL y otra con concentraciones > 10 UI/mL, ambas conservadas a - 30 °C se testaron 50 veces cada una en 5 ocasiones diferentes, y se estableció el valor máximo y mínimo, ![]() , DE y el coeficiente de variación (CV). El estudio se realizó con el kit UMELISA Tetanus, el cual es un ensayo inmunoenzimático heterogéneo de tipo indirecto7,8 producido y estandarizado por el Centro de Inmunoensayo de Ciudad de La Habana.
, DE y el coeficiente de variación (CV). El estudio se realizó con el kit UMELISA Tetanus, el cual es un ensayo inmunoenzimático heterogéneo de tipo indirecto7,8 producido y estandarizado por el Centro de Inmunoensayo de Ciudad de La Habana.
Las muestras de suero fueron diluidas 1: 400 con suero de carnero al 50 % y se colocaron 10 µL de esta dilución en las tiras de reacción conjuntamente con una curva estándar preparada a partir de un suero control de 50 UI/mL de concentración; luego se incubaron durante 30 min a 37 °C en cámara húmeda. A continuación se efectuaron 4 ciclos de lavado con solución tampón de tris-cloruro de sodio-tween 20 con el lavador automático de placas MAS-201, después se añadieron 10 mL de conjugado anti IgG/fosfatasa alcalina en cada uno de los pocillos de reacción y se incubó nuevamente durante 30 min a 37 °C. Posteriormente se lavaron las placas en 4 ocasiones y se añadió sustrato fluorigénico, y se dejó incubar a temperatura ambiente hasta lograr una fluorescencia del quinto punto de la curva entre 100-150 U. Finalmente se realizó la lectura en un equipo PR 521 de la tecnología SUMA del Centro de Inmunoensayo. Todo el trabajo lo realizó un mismo analista en iguales condiciones de laboratorio.
Resultados
Se tomó aleatoriamente la muestra # 199 con una concentración inicial de 6,3 UI/mL (< 10 UI/mL) y conservada a - 30 °C. El test de titulación fue realizado 50 veces en 5 oportunidades diferentes y se obtuvo un valor mínimo de 4,0 UI/mL, un valor máximo de 9,7 UI/mL, la media fue de 5,76 UI/mL, la desviación estándar de 1,18 y el coeficiente de variación de 20,49 %. Con estos resultados y aceptando que cualquier determinación reiterada de la misma muestra, con un 95 % de probabilidades, caería en el rango de ![]() ± 2 DE, obtenemos una variabilidad permisible de 4,72 UI/mL, en un rango que oscila de 3,40 a 8,12 UI/mL.
± 2 DE, obtenemos una variabilidad permisible de 4,72 UI/mL, en un rango que oscila de 3,40 a 8,12 UI/mL.
Se tomaron los primeros 25 valores para calcular ![]() y DE y se obtuvieron los siguientes valores:
y DE y se obtuvieron los siguientes valores:
![]() = 5,97 y DE = 1,23
= 5,97 y DE = 1,23
los cuales son similares a los obtenidos analizando las 50 determinaciones. Con ello confeccionamos una carta de precisión y ploteamos los resultados de las últimas 25 determinaciones y encontramos que 18 están entre ![]() ± 1 DE, 6 caen entre 1 y 2 DE y 1 sola determincación > 2 DE; por lo que podemos decir que aún cuando el coeficiente de variación es elevado, se obtuvo buena precisión en los resultados, con un ligero cambio de exactitud debido a la ubicación de la mayoría de los valores entre
± 1 DE, 6 caen entre 1 y 2 DE y 1 sola determincación > 2 DE; por lo que podemos decir que aún cuando el coeficiente de variación es elevado, se obtuvo buena precisión en los resultados, con un ligero cambio de exactitud debido a la ubicación de la mayoría de los valores entre ![]() y menos 1 DE (fig. 1).
y menos 1 DE (fig. 1).
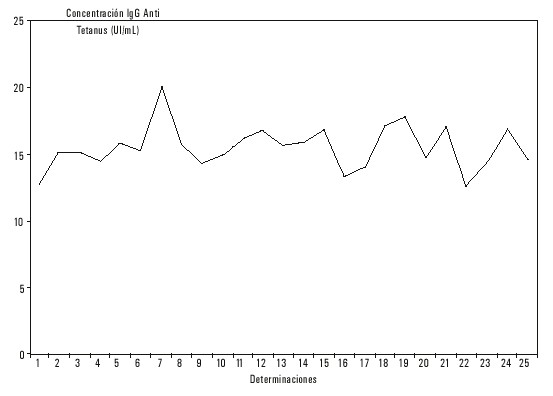
Fig. 1. Carta de precisión No. 1.
Se siguió igual procedimiento con las muestras con concentraciones de más de 10 UI/mL. De estas se tomó la # 233, cuya concentración inicial fue de 18,0 UI/mL y su estudio dio una ![]() = 15,6 UI/mL, con una DE = 1,50 y un CV = 9,62.
= 15,6 UI/mL, con una DE = 1,50 y un CV = 9,62.
El análisis de esta muestra arroja una variabilidad de 6 UI/mL, con límites de confianza de ± 2 DE, que oscilarían de 12,6 a 18,6 UI/mL.
Tomando los primeros 25 valores de los test realizados y calculando con ellos ![]() y la DE, se obtuvo una
y la DE, se obtuvo una ![]() = 15,58 con una DE = 1,36. Con ello confeccionamos la carta de precisión (fig. 2), donde se ubicaron los 25 valores restantes. Se observó que casi todos los resultados cayeron alrededor de la media en el límite de ± 1 DE, y solo 7 valores estuvieron entre 1 y 2 DE y 2 casos más allá de 2 DE.
= 15,58 con una DE = 1,36. Con ello confeccionamos la carta de precisión (fig. 2), donde se ubicaron los 25 valores restantes. Se observó que casi todos los resultados cayeron alrededor de la media en el límite de ± 1 DE, y solo 7 valores estuvieron entre 1 y 2 DE y 2 casos más allá de 2 DE.
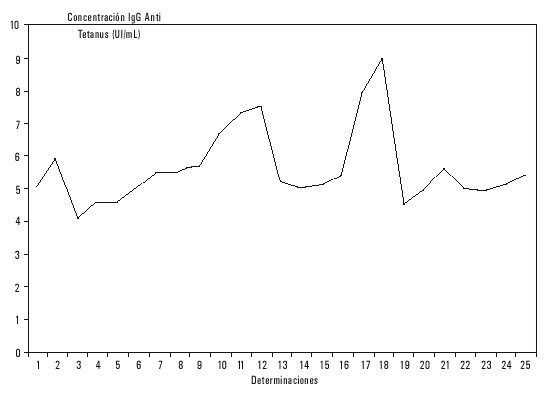
Fig. 2. Carta de precisión No. 2.
Al observar la figura 2 vemos que la exactitud y precisión son buenas; se obtuvieron mejores resultados que con la muestra 199 (< 10 UI/mL), a pesar que la variabilidad es mayor, con un rango de 6 UI/mL.
Por otro lado, las 34 muestras seleccionadas para el estudio fueron chequeadas durante 5 semanas consecutivas todas a la vez en la misma placa de reacción. Los valores de las 17 muestras con concentración < 10 UI/mL fueron conservadas de 2 a 8 °C y a menos 30 °C, respectivamente (tabla 1).
Tabla 1. Valoración de la repetibilidad del UMELISA Tetanus en muestras con concentraciones menores de 10 UI/mL
| Muestra | Conservadas de 2 a 8 °C Semanas | Conservadas a - 30 °C Semanas | ||||||||
| 1 | 2 | 3 | 4 | 5 | 1 | 2 | 3 | 4 | 5 | |
| 172 | 7,3 | 7,8 | 6,2 | 9,3 | 7,1 | 4,6 | 7,2 | 5,9 | 7,6 | 6,3 |
| 173 | 6,3 | 6,3 | 5,7 | 6,3 | 4,6 | 5,1 | 5,6 | 4,5 | 5,3 | 4,6 |
| 177 | 8,4 | 9,6 | 8,5 | 10,2 | 7,0 | 7,2 | 6,7 | 5,6 | 6,8 | 6,1 |
| 186 | 7,5 | 10,5 | 7,7 | 8,4 | 6,8 | 6,7 | 7,1 | 6,4 | 5,3 | 7,3 |
| 187 | 9,5 | 10,9 | 8,5 | 8,4 | 7,3 | 7,9 | 9,4 | 7,6 | 8,2 | 6,2 |
| 197 | 7,9 | 7,5 | 6,1 | 6,7 | 5,7 | 5,6 | 6,6 | 7,4 | 8,3 | 6,8 |
| 199 | 7,0 | 9,7 | 7,6 | 7,3 | 6,6 | 6,3 | 6,9 | 6,4 | 6,2 | 5,5 |
| 202 | 6,0 | 7,3 | 6,9 | 8,7 | 5,9 | 7,6 | 7,3 | 6,2 | 6,9 | 8,9 |
| 204 | 6,1 | 7,8 | 6,5 | 7,8 | 7,9 | 5,8 | 7,0 | 7,0 | 8,2 | 6,1 |
| 213 | 8,0 | 8,1 | 7,2 | 8,5 | 6,9 | 8,1 | 8,1 | 7,2 | 9,5 | 8,5 |
| 2 | 5,4 | 7,1 | 6,6 | 7,1 | 4,9 | 5,7 | 5,9 | 5,0 | 5,7 | 4,7 |
| 6 | 6,5 | 8,8 | 7,5 | 6,3 | 6,2 | 6,7 | 7,2 | 5,6 | 6,7 | 5,0 |
| 10 | 8,0 | 8,8 | 8,7 | 8,0 | 6,5 | 7,9 | 8,8 | 7,4 | 7,9 | 6,7 |
| 214 | 5,5 | 5,7 | 7,3 | 5,9 | 5,5 | 5,7 | 6,2 | 4,7 | 5,1 | 3,7 |
| 223 | 8,0 | 8,7 | 8,5 | 8,3 | 7,8 | 6,4 | 8,7 | 7,4 | 8,2 | 6,4 |
| 231 | 7,2 | 7,7 | 8,0 | 6,7 | 7,5 | 6,4 | 6,7 | 6,4 | 8,4 | 5,3 |
| 245 | 8,4 | 8,4 | 6,8 | 7,2 | 7,0 | 8,8 | 9,5 | 9,8 | 8,8 | 6,7 |
| Máx. | 9,5 | 10,9 | 8,7 | 10,2 | 7,9 | 8,8 | 9,5 | 9,8 | 9,5 | 8,9 |
| Mín. | 5,4 | 5,7 | 5,7 | 5,9 | 4,6 | 4,6 | 5,6 | 4,5 | 5,1 | 3,9 |
| |
7,24 | 8,28 | 7,31 | 7,71 | 6,54 | 6,60 | 7,35 | 6,50 | 7,24 | 6,19 |
| DE | 1,13 | 1,38 | 0,92 | 1,17 | 0,96 | 1,16 | 1,16 | 1,30 | 1,36 | 1,30 |
A cada grupo de valores se le determinó ![]() la y la DE y se aplicó el test de hipótesis de comparación de las diferencias de las medias, para determinar si había concordancia entre los resultados o si existían diferencias significativas entre los grupos. En el análisis se encontró que en las muestras almacenadas de 2 a 8 °C hubo diferencias significativas, para un nivel de alfa < = 0,05, entre la primera y segunda, así como entre la primera y la quinta determinación.
la y la DE y se aplicó el test de hipótesis de comparación de las diferencias de las medias, para determinar si había concordancia entre los resultados o si existían diferencias significativas entre los grupos. En el análisis se encontró que en las muestras almacenadas de 2 a 8 °C hubo diferencias significativas, para un nivel de alfa < = 0,05, entre la primera y segunda, así como entre la primera y la quinta determinación.
En las muestras congeladas a -30 °C se encontraron diferencias significativas entre la primera y la segunda.
Al comparar los resultados de las muestras conservadas de 2 a 8 °C con aquellas conservadas a -30 °C, hubo diferencias significativas en las determinaciones de la segunda y tercera semanas. En el resto del estudio realizado no hubo diferencias significativas.
En cuanto a las 17 muestras escogidas con concentraciones iniciales mayores de 10 UI/mL (tabla 2) se les aplicó el mismo procedimiento estadístico y se encontró la existencia de diferencias significativas entre la primera y segunda y entre la primera y cuarta determinaciones en aquellos conservados de 2 a 8 °C, pero no se encontraron diferencias significativas en el grupo de muestras con concentraciones mayores de 10 UI/mL conservadas en congelación a - 30 °C.
Tabla 2. Valoración de la repetibilidad del UMELISA Tetanus en muestas con concentraciones superiores a 10 UI/mL
| Muestra | Conservadas de 2 a 8 °C Semanas | Conservadas a - 30 °C Semanas | ||||||||
| 1 | 2 | 3 | 4 | 5 | 1 | 2 | 3 | 4 | 5 | |
| 149 | 6,8 | 8,7 | 7,6 | 9,7 | 9,6 | 7,8 | 7,9 | 7,0 | 7,4 | 6,1 |
| 151 | 8,1 | 10,6 | 9,3 | 10,4 | 10,7 | 8,2 | 9,4 | 7,6 | 9,5 | 7,4 |
| 165 | 12,7 | 13,9 | 12,5 | 14,4 | 14,1 | 13,1 | 13,0 | 12,4 | 14,4 | 11,9 |
| 171 | 10,8 | 11,1 | 9,9 | 11,3 | 10,4 | 10,1 | 10,5 | 9,1 | 8,9 | 9,3 |
| 180 | 14,9 | 14,1 | 13,9 | 20,0 | 17,5 | 13,5 | 16,7 | 13,5 | 17,1 | 14,6 |
| 181 | 10,8 | 13,1 | 11,3 | 14,0 | 12,6 | 11,8 | 11,6 | 10,0 | 11,0 | 10,7 |
| 183 | 10,7 | 12,0 | 10,1 | 11,7 | 11,0 | 12,5 | 11,1 | 9,8 | 11,0 | 10,5 |
| 185 | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 |
| 190 | 12,7 | 14,7 | 12,2 | 16,6 | 11,7 | 11,4 | 11,8 | 12,8 | 11,5 | 10,5 |
| 192 | 11,6 | 14,5 | 11,8 | 14,7 | 12,9 | 11,5 | 14,1 | 11,1 | 13,3 | 11,2 |
| 196 | 15,6 | 15,9 | 14,8 | 17,2 | 14,8 | 12,5 | 14,7 | 14,1 | 15,5 | 13,6 |
| 207 | 16,7 | 20,0 | 14,4 | 20,0 | 17,8 | 14,9 | 17,0 | 15,6 | 20,0 | 18,1 |
| 211 | 10,8 | 12,5 | 12,1 | 12,0 | 12,1 | 10,4 | 11,2 | 11,1 | 12,3 | 10,6 |
| 212 | 12,7 | 16,1 | 11,8 | 14,0 | 11,8 | 11,8 | 12,5 | 11,0 | 14,5 | 10,4 |
| 233 | 14,1 | 17,3 | 14,8 | 17,1 | 12,7 | 14,5 | 17,0 | 14,8 | 20,0 | 16,5 |
| 243 | 11,7 | 14,3 | 11,8 | 16,7 | 12,1 | 10,9 | 11,5 | 10,5 | 11,6 | 10,5 |
| 13 | 12,4 | 16,6 | 14,8 | 20,0 | 14,4 | 12,7 | 13,7 | 13,6 | 16,0 | 13,6 |
| Máx. | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 | 20,0 |
| Mín. | 6,8 | 8,7 | 7,6 | 9,7 | 9,6 | 7,8 | 7,9 | 7,0 | 7,4 | 6,1 |
|
12,54 | 14,72 | 12,53 | 15,28 | 13,30 | 12,2 | 12,2 | 12,0 | 13,80 | 12,1 | |
| DE | 3,13 | 3,27 | 2,82 | 3,52 | 2,85 | 2,8 | 4,14 | 3,18 | 3,93 | 3,61 |
Por último, al comparar los resultados de las muestras conservadas de 2 a 8 °C y a - 30 °C con concentraciones > 10 UI/mL, tampoco se observaron diferencias estadísticamente significativas.
Discusión
A pesar de lo referido inicialmente acerca de que el UMELISA como juego de reactivos para la selección de donantes con alto título de antitoxina tetánica,3,8 tiene exactitud y precisión cuando se repite una muestra un número determinado de veces, la variabilidad del método dentro de los límites de confianza hace que cuando se estudian grupos de muestras de forma repetida, se produzcan en ocasiones diferencias significativas entre los resultados, lo cual se observa más frecuentemente con muestras con concentraciones bajas, independientemente del tiempo de almacenada la muestra en el término de las 5 semanas en que se realizó el estudio.
Por otro lado, la temperatura de conservación también parece influir, pues las mayores diferencias se observaron en aquellas muestras conservadas de 2 a 8 °C. En las conservadas a -30 °C sólo se observaron diferencias significativas entre la primera y segunda determinación en el grupo con concentraciones inferiores a 10 UI/mL, que a nuestro juicio, no es dependiente de la técnica en cuestión. Finalmente, el valor absoluto de los resultados del pesquisaje es muy importante, pues vemos que en el grupo en que la concentración es >10 UI/mL no se observan diferencias significativas al comparar los resultados de los conservados de 2 a 8 °C con las de conservación a menos de 30 °C. Tampoco existieron diferencias significativas dentro del grupo conservado a - 30 °C durante las 5 semanas de duración del estudio, que debe ser la temperatura de conservación de las muestras del programa hasta tanto sean pesquisados.
Realizar los pesquisajes por duplicado y tomar el valor medio, o por triplicado, así como la mediana como valor real, ayudaría a mejorar esta situación.
Por otro lado, el establecimiento de un programa de control externo de la calidad en UMELISA Tetanus, permitiría conocer la calidad del trabajo de los laboratorios y monitorear la marcha del programa.
Summary
Accuracy and precision of UMELISA kit was evaluated in anti-tetanic IgG dosing. The variability of antibody concentration as a function of time and storage temperature was assessed in 34 special donors of hyperimmune anti-tetanic plasma, immunized with Cuban-made tetanus toxoid vaccine and subjected to donation methods by automated plasmapheresis. Two study groups were chosen according to serum immunoglobulin concentrations (< 10 UI/ml and > 10 UI/ml) and samples were preserved at _30 oC and at 2-8 oC were used . The statistical tests in the data processing yielded that this technique is accurate and precise ant that the highest fluctuations occur when titers are low and kept at 2-8ºC temperatures.
Subject headings: GAMMMAGLOBULINS/immunology; ANTIBODIES/pharmacology; TECHNOLOGY, MEDICAL/methods; BLOOD DONORS; PLASMAPHERESIS/methods.
Referencias bibliográficas
1. Seguridad y garantía de la terapéutica moderna en los más diversos tratameintos. Planta de Hemoderivados, Ciudad de La Habana, 1999:9.
2. Plasmaféresis e inmunización de donantes. En: Toma, fraccionamiento, inspección de la calidad y usos de la sangre y de los productos sanguíneos. Ginebra: OMS, 1982:9-23.
3. Hamerschlak N, Nobrega JL. Aféreses. Bol Soc Bras Hematol Hemoter 1986;8(141):210-6.
4. Eyquem A, Turpin A, Raynaud M. Production of anti tetanic human gammaglobulins with the aids of a vaccine adsorved on calcium phosphate. Rev Fr Transfus Inmunohematol 1970;13(1):47-60.
5. Harnaut J, Fenieres P, Golder A, Guernver P, Avenard G. Detection of antitetanic antibodies. Echnics (electrosyneresis, Laurell, latex) Applied to a high antibody population. Rev Fr Tranfus Inmonohematol 1978;21(4):981-90.
6. Fajardo, et al. UltramicroELISA para medir antitoxina tetánica en suero humano. Bol Of Sanit Panam 1995;119(2).
7. Umelisa tetanus para la determinación de anticuerpos IgG al toxoide tetánico. Código UM 2010. Centro de Inmunoensayo. Ciudad de La Habana, junio 1996.
8. Fajardo E, et al. Aplicación del método de ultramicro ELISA en el banco de sangre para el pesquisaje de plasma antitetánico con vistas a la producción de inmunoglobulina específica. Rev Cienc Farm 1987;(oct):29-31.
Recibido: 14 de septiembre del 2000. Aprobado: 11 de mayo del 2001.
Dr. Lázaro Mena López. Banco de Sangre Provincial de Camagüey. Camagüey. Cuba.
1 Banco de Sangre Provincial de Camagüey.
2 Planta de Hemoderivados, Ciudad de La Habana.














