Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.20 n.3 Ciudad de la Habana sep.-dic. 2004
Instituto de Hematología e Inmunología
Hepcidina: nueva molécula, nuevos horizontes
MsC. Mariela Forrellat Barrios y Dra. Norma Fernández Delgado
Resumen
En los últimos años se han descubierto al menos 7 nuevas moléculas relacionadas con la homeostasia del hierro, lo que cambia la visión clásica acerca del metabolismo de este mineral. Probablemente sea la hepcidina la más interesante de todas, por considerarse un regulador negativo de la absorción del hierro en el intestino delgado y de su liberación por los macrófagos. Esta proteína es un péptido antimicrobiano rico en cisteínas, producido en el hígado, que se estima como considerado como un elemento clave en la regulación de la absorción y cinética del hierro en el organismo. Su expresión es regulada por el hierro y el estímulo inflamatorio, por lo que es considerada una reactante de fase aguda. La hepcidina se presenta como un candidato atractivo para mediador en la anemia de los procesos crónicos y en otros trastornos del metabolismo férrico, lo que le confiere a esta molécula un futuro prometedor en el diagnóstico y tratamiento de estos estados patológicos.
Palabras clave: hepcidina, hierro, anemia de los procesos crónicos.
El carácter esencial del hierro para la vida de prácticamente todos los organismos vivos es un hecho indiscutible, que se basa en la capacidad de este metal de transición de existir en 2 estados de oxidación, por lo que se convierte en un importante centro catalítico de muchas proteínas y enzimas implicadas en importantes reacciones bioquímicas como la síntesis de ácido desoxirribonucléico (ADN), el transporte de oxígeno y de electrones. Sin embargo, esta misma característica lo hace un elemento tóxico, pues como hierro libre, es capaz de generar radicales libres que dañan componentes biológicos esenciales como son los lípidos, las proteínas y el propio ADN. Como consecuencia de esto, para mantener una buena salud es imprescindible mantener un adecuado control del metabolismo del hierro. 1
Hasta hace unos años solamente se conocían 3 proteínas que intervienen en el metabolismo de este mineral, ellas son la transferrina, la ferritina y el receptor de transferrina. Con el descubrimiento de los elementos de respuesta al hierro (IRE, siglas de su denominación en inglés iron responsive elements) y la proteína reguladora del hierro (IRP, siglas de su denominación en inglés iron regulatory protein), se abrieron horizontes para comprender los mecanismos de mantenimiento de la homeostasia del hierro.2 En los últimos años, la visión clásica del metabolismo de este mineral ha cambiado, pues como resultado del uso de las técnicas de biología molecular y de los modelos animales transgénicos o genéticamente modificados se han descubierto nuevas moléculas que participan en la homeostasia del hierro como por ejemplo el receptor de transferrina 2 (TfR2), el transportador de metales divalentes, conocido por sus siglas en inglés DMT1 o Nramp 2 (divalent metal transporter 1 o natural-resistance-associated macrophage protein 2), la ferroportina o Ireg 1, hefaestina, citocromo b duodenal (Citb D), HFE (proveniente de la contracción del término en inglés relacionado con HLA-H que es la región del sistema HLA cercano al gen y FE como símbolo del hierro) vinculada con la hemocromatosis hereditaria, la hemojuvelina (proteína que se corresponde al gen HFE2 responsable de la hemocromatosis juvenil), y la que probablemente sea la más interesante de todas, la hepcidina.3,4
La homeostasia del hierro a nivel del organismo se basa en un estricto control de la absorción intestinal del mineral y un estricto reciclaje de este por los macrófagos. Se plantea que la comunicación entre las reservas hepáticas de hierro, los enterocitos duodenales y los macrófagos está mediada por la hepcidina, péptido sintetizado por el hígado, secretado al plasma y excretado en la orina. El objetivo de este trabajo es hacer una primera aproximación a los conocimientos sobre la hepcidina y su participación en le metabolismo del hierro.
Hepcidina: caracterÍsticas moleculares
El término hepcidina, acrónimo que proviene de los términos en inglés hepatic bactericidal protein, fue sugerido por Park y cols., 5 quienes descubrieron y aislaron esta proteína a partir de muestras de orina humanas en las que investigaban las propiedades antimicrobianas. Por su parte, Krause y cols. 6 aislaron este mismo péptido a partir de plasma humano ultrafiltrado y lo denominaron LEAP-1 (del inglés liver-expressed-antimicrobial peptide).
Este péptido exhibe actividad antimicótica frente a Candida albicans, Aspergillus fumigatus y Aspergillus niger; y actividad antibacteriana frente a Escherichia coli, Staphylococcus aureus, Staphylococcus epidermis y Streptococcus del grupo B.5
Sobre la base de los hallazgos experimentales se plantea que la hepcidina es la molécula señal que disminuye la absorción de hierro en el intestino delgado y libera el hierro de reserva de los macrófagos, en respuesta al aumento de las reservas corporales o a la inflamación.7 Se piensa además que el aumento de la expresión de esta proteína en respuesta al estímulo inflamatorio puede servir como estrategia defensiva del hospedero, al impedir el acceso de los microbios infecciosos al hierro esencial para su crecimiento y multiplicación.8
Esta proteína hepática es un péptido catiónico rico en cisteínas, que se deriva a partir del extremo carboxilo terminal de un precursor de 84 aminoácidos codificado por un ácido ribonucléico mensajero (ARNm) de 0,4 kb, generado a parir de 3 exones de un gen de 2,5 kb localizado en el brazo largo del cromosoma 19 (19q13) del genoma humano.9,11 Se han aislado 3 péptidos de 20, 22 y 25 aminoácidos, que difieren entre sí en su amino terminal.10 Se ha observado que las formas predominantes en orina son las de 20 y 25 aminoácidos con un peso molecular de 2-3 kDa y una carga total a pH neutro de +3.5,8 Se ha visto que el péptido de 20 aminoácidos es generalmente más activo frente a S. aureus, S. epidermis, Streptococcus del grupo B y C. albicans.8
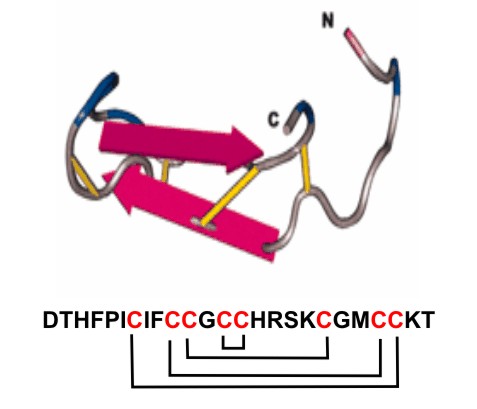
Los péptidos antimicrobianos se caracterizan por ser ricos en cisteínas. En el caso de la hepcidina, los estudios de la secuencia aminoacídica revelan la existencia de un total de 8 cisteínas (30 %) en la estructura primaria de la proteína.5,8 Este elevado contenido de cisteínas lo diferencia de otros péptidos antimicrobianos ricos en este aminoácido como las defensinas,12 la taquiplesina,13 la protegrina14 y la esnakina.15 Todas estas cisteínas se encuentran pareadas mediante enlaces disulfuro. De ellos, uno se establece entre residuos de cisteína adyacentes, lo que constituye otra característica distintiva de la hepcidina. (fig 1).8,10
Fig. 1. Secuencia aminoacídica y modelo de estructura de la hepcidina. La secuencia aminoacídica se representa por el código de una letra, en rojo se destacan las cisteínas. Los extremos amino- y carboxi-terminales se representan como N y C, respectivamente. El patrón de puentes disulfuro se representa en la secuencia aminoacídica mediante llaves. (Tomado de: Ganz T. Blood 2003;102:783-8).
Cuando se compara con otros péptidos antimicrobianos, cuyas secuencias han evolucionado rápidamente, la evolución de la hepcidina ha sido muy restringida, lo que indica la posibilidad de que este péptido interactúe específicamente con otras moléculas muy conservadas. Su composición y sitio de síntesis son reminiscencias de la drosomicina, una defensina de insectos que tiene 4 enlaces disulfuro y que se sintetiza en el cuerpo graso (equivalente al hígado) de la Drosophila en respuesta a la infección.10
Desde el punto de vista conformacional, la hepcidina es una lámina b torcida con una vuelta de horquilla simple, cuyos brazos están unidos por los puentes disulfuro, en una configuración que recuerda una escalera de mano. 5,8,10 La existencia de un enlace disulfuro entre cisteínas adyacentes cerca del punto de giro de la estructura es una característica llamativa quizás relacionada con su función antimicrobiana, 8 pues se conoce que los puentes disulfuro entre cisteínas adyacentes generalmente muestran una gran reactividad química por estar muy tensos. 10
Al igual que en otros péptidos antimicrobianos, existe una separación entre las cadenas hidrofílicas e hidrofóbicas, lo que le confiere a la estructura un marcado carácter anfipático, típico de los péptidos que rompen las membranas bacterianas.8
La expresión del ARNm de la hepcidina está casi totalmente restringida al hígado, pero se han encontrado pequeños niveles de expresión en intestino, estómago, colon, pulmón y corazón.5, 9 Se ha observado además que su excreción se correlaciona bien con la ferritina sérica, que como se sabe está aumentada en los estados de sobrecarga de hierro y en la inflamación. 16 Sin embargo, se ha planteado que los niveles séricos de hepcidina no se correlacionan tan bien con la clínica como los niveles urinarios.17
Adicionalmente, se ha observado correlación inversa entre los niveles de transcripción de hepcidina y la saturación de la transferrina férrica, así como correlación significativa entre los niveles de transcripción hepática de hepcidina y el TfR 2, independientemente del estado de hierro. 18 Por otra parte, la deficiencia o ausencia de este péptido conlleva a la sobrecarga de hierro, y su sobreexpresión a la anemia.3
Se plantea que la expresión de la hepcidina está regulada por el hierro y el estímulo inflamatorio. 19 En relación con esto, se ha visto que la expresión del ARNm de hepcidina es inducido por lipopolisacáridos y que esta inducción es mayor cuando se debe a monocinas procedentes de monocitos estimulados por lipopolisacáridos. 17 Además, es inducido por interleucina 6 (IL-6), pero no por interleucina 1 (IL-1) o factor de necrosis tumoral a (TNF a).17,20
La exposición de hepatocitos a transferrina saturada con hierro o a citrato de amonio férrico suprimió la expresión de este ARNm. Por su parte, la anemia y la hipoxia disminuyen la expresión de esta proteína,21 e incluso se plantea que la supresión de la hepcidina por la anemia es un efecto más fuerte que la sobrecarga de hierro.10
A partir de estos hechos experimentales se ha planteado que la hepcidina es un factor plasmático producido por los hepatocitos que disminuye el egreso de hierro de la célula, por lo que es considerado como un regulador negativo de la absorción de hierro en el intestino delgado y de su liberación por los macrófagos, que ejerce su efecto bloqueante en el transporte de hierro en múltiples sitios, incluido el epitelio intestinal, la placenta, los macrófagos y otros tipos celulares. 10
El aumento de la producción de hepcidina por la inflamación y la capacidad de las hepcidinas transgénicas o derivadas de tumores de suprimir la eritropoyesis debido a una fuerte deprivación de hierro, sugiere que esta proteína es un mediador clave de la anemia de la inflamación o anemia de los procesos crónicos, 10 e incluso, algunos la consideran como una proteína de fase aguda tipo II. 17
En resumen, la hepcidina no solo es un regulador fisiológico de la cinética del hierro, sino que se supone que forma parte del mecanismo patogénico de la anemia asociada con los procesos crónicos.10 Además, se estudia intensamente su relación con la hemocromatosis, pues se ha visto que su expresión también es regulada por el gen HFE y por el factor de transcripción C/EBPa (enhancer binding protein).22
Homeostasia del hierro
El hierro que se utiliza para la eritropoyesis proviene de 2 fuentes fundamentales: la absorción intestinal del hierro dietético y una fracción mayor que se obtiene a partir del reciclaje del hierro de los eritrocitos senescentes; en ambos casos, se involucra un número importante de moléculas transportadoras y reguladoras.
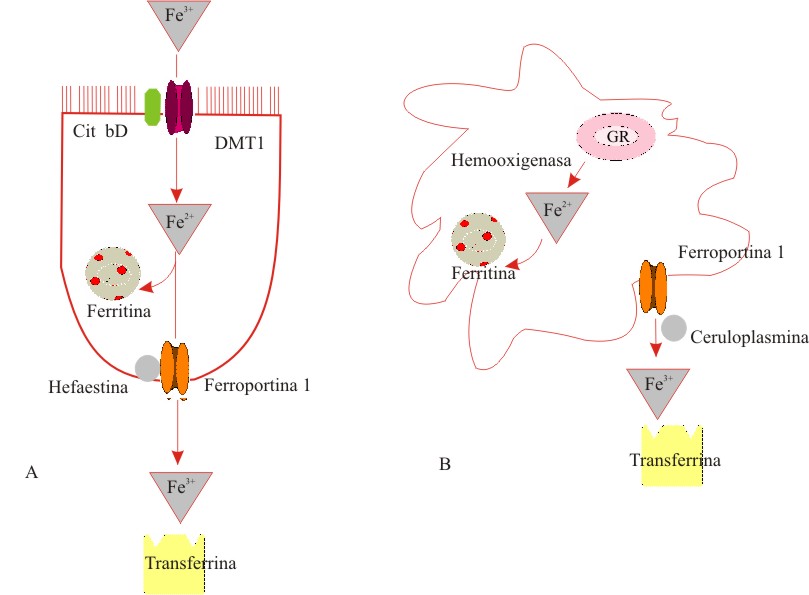
El hierro férrico proveniente de la digestión de los alimentos es tomado en la superficie apical de los enterocitos luego de su reducción a hierro ferroso, por la oxidorreductasa férrica DcytB. Una vez en estado ferroso, puede entrar a la célula a través del transportador DMT 1/Nramp 2. Dentro del enterocito, el hierro puede ser almacenado como ferritina o transportado hacia fuera a través de la superficie basolateral de la célula por la ferroportina 1, reoxidado por la hefaestina y finalmente unido a la transferrina para su distribución a los tejidos (fig. 2).10,23 Se piensa que una serie de transportadores similares medien el movimiento transplacentario del hierro.24 En el caso del hierro hemínico, se plantea que existe una vía alternativa de absorción que aún no ha sido totalmente caracterizada.25
Fig. 2. Representación esquemática de la incorporación del hierro.
(a) En la duperficie de los enterocitos el hierro férrico es reducido por la óxido-reductasa férrica (Cit bD) e internalizado por el transportador de metales divalentes (DMT1). El hierro puede ser almacenado como ferritina o transportado a través de la membrana basolateral por la ferroportina 1, reoxidado por la hefaestina y unido con la transferrina para su transporte plasmático. (b) En los macrófagos los eritrocitos senescentes (GR) son lisados y el hierro hemínico es liberado por la hemooxigenasa. Este hierro puede ser almacenado en la ferritina o exportado a través de la ferroportina, luego de ser oxidado por la ceruloplasmina y unido con la transferrina para su transporte plasmático.
La situación en los macrófagos puede ser más compleja, pues estas células contienen múltiples proteínas transportadoras de hierro que incluyen Nramp 1 y 2 y ferroportina. Durante el reciclaje del hierro a partir de los glóbulos rojos senescentes, los macrófagos fagocitan los eritrocitos y los lisan en los fagosomas. Aún no se conoce con certeza cómo el hierro eritrocitario entra al citoplasma de los macrófagos, pero hay evidencias de que sale de ellos a través de la ferroportina asistido por la ceruloplasmina ferroxidasa. Los macrófagos también pueden incorporar el hierro de la transferrina, transportarlo a través de la membrana endosomal vía Nramp 2 e incorporarlo en ferroproteínas como la ferritina (fig 2).10,23
Los estudios para dilucidar cuál de estas moléculas podría mediar los efectos de la hepcidina mostraron que cuando los niveles ARNm de la hepcidina son altos, los niveles de ARNm de los transportadores de hierro son siempre bajos y que la supresión del ARNm de la hepcidina fue simultánea con el aumento de la expresión de los ARNm de los transportadores duodenales.26
Se conoce que la síntesis de proteínas involucradas en el metabolismo del hierro, como la ferritina y el TfR, es regulada directamente por IRPs, que se unen en los respectivos IREs en los ARNm s correspondientes.2, 27 En el ARNm del Nramp 2 y de la ferroportina se han encontrado IREs adecuados; contradictoriamente el ARNm de la hepcidina no contiene IREs reconocibles.10
La regulación del transporte no ocurre por cambios en el número de moléculas transportadoras, sino por modulación de su ubicación subcelular o de su proporción. Además, los transportadores no son los únicos reguladores potenciales de la liberación del hierro, sino que al menos en principio, la liberación del hierro de las células duodenales o de los macrófagos puede ser también regulada por la avidez y magnitud del compartimiento de reserva.10
De acuerdo con esto, Ganz 10 plantea que la simultaneidad de la supresión del ARNm con el aumento de la expresión de los ARNm de los transportadores duodenales, crea dudas acerca del modelo de transporte duodenal, que plantea que la proporción de transporte duodenal es fijada durante la diferenciación de las células desde las criptas hasta las células epiteliales.1
Otros autores proponen que el hígado desempeña un papel central en el mantenimiento de la homeostasia del hierro por regular la expresión de la hepcidina en respuesta a los cambios en la relación transferrina diférrica circulante: receptor de transferrina 1. Estos cambios son detectados por el TfR 2 y el complejo TfR1/HFE. La hepcidina circulante influye entonces directamente en la expresión de la ferroportina en los enterocitos maduros del duodeno, y de esta forma regulan la absorción de hierro en respuesta a los requerimientos corporales del mineral. De esta manera, el cuerpo puede responder rápida y adecuadamente a los cambios en las demandas de hierro por ajuste de la liberación de este a partir de los enterocitos duodenales y posiblemente de los macrófagos del sistema retículo endotelial. Este modelo explicaría la regulación de la absorción en condiciones normales y la alteración de la absorción vista en enfermedades como la hemocromatosis y la talasemia.28
Es indiscutible que en los últimos años se han producido numerosos avances en aspectos esenciales del metabolismo férrico que han modificado y extendido grandemente el campo de la ferropatología. No obstante, aún quedan muchas interrogantes, pues no se conoce cuáles son las señales específicas que aumentan la síntesis de hepcidina en el hígado o cuál es el receptor intestinal que responde a esta proteína. También es posible que la hepcidina interactúe directamente con proteínas como la ferroportina, y de esa forma, controle la liberación de hierro de los enterocitos duodenales y los macrófagos. Como proteína de fase aguda es sintetizada para restringir las reservas corporales de hierro, para prevenir la utilización de este por las bacterias, pero esto no explica cómo responde a las reservas corporales.11
En síntesis, la hepcidina es un candidato atractivo para mediador de la anemia de los procesos crónicos, pues se produce exclusivamente en el hígado y circula en el plasma, 5,6 lo que concuerda con el papel que se le asigna como hormona involucrada en la homeostasia del hierro. Sin embargo, aún no se ha determinado que interactúe con proteínas transportadoras de hierro y su actividad aparente sugiere que regula directamente la maquinaria de transporte de hierro. 19 Atendiendo al desarrollo acelerado de los conocimientos científico-técnicos, es posible que todas las interrogantes que aún persisten queden esclarecidas en un futuro próximo.
Implicaciones futuras
Aunque aún no es posible realizar cuantificación de hepcidina en muestras biológicas, se especula que la determinación de los niveles de esta proteína podría ser en el futuro una herramienta diagnóstica muy útil, y si se comprueba su papel como factor central de la anemia de los procesos crónicos, la modulación de su bioactividad podría ofrecer nuevas estrategias de tratamiento para pacientes con este tipo de anemia y otros desórdenes del metabolismo del hierro.19
Asimismo, si se comprueba que la deficiencia parcial de hepcidina puede contribuir a la sobrecarga de hierro en muchas de las formas comunes de hemocromatosis, sería posible tratar esta entidad con terapia de remplazo con hepcidina o usando moléculas agonistas de la misma.10
En conclusión, la hepcidina puede ser la principal hormona reguladora del hierro, el elemento mediador de la anemia de los procesos crónicos y un puente entre la inmunidad y el metabolismo del hierro. Los estudios de los mecanismos moleculares de acción molecular de la hepcidina podrían cambiar nuestro conocimiento de la regulación del transporte de hierro y guiar a nuevas terapias para la hemocromatosis y la anemia de los procesos crónicos.10
Summary
In the last few years, at least 7 new molecules related to iron homeostasis have been discovered, which changes the vision on iron metabolism. Hepcidin is likely to be the most interesting molecule because it is considered as a negative regulator of iron uptake in the small intestine and of iron release by the macrophages. This liver-synthetized cysteine-rich antimicrobial peptide appears to be a key element in the regulation of iron absorption and kinetics in the body. Both iron and inflammatory stimulus control hepcidin expression, therefore it is considered an acute-phase reactant. Hepcidin constitutes an attractive candidate for mediator in anemia of chronic processes and in other iron metabolism disorders, which turns this molecule into a promising element for the diagnosis and treatment of these pathological states.
Key words: hepcidin, iron, anemia in chronic processes.
Referencias bibliográficas
1. Roy CN, Enns CA. Iron homeostasis: new tales from the crypt. Blood 2000;96(13): 4020-7.
2. Cazzola M. Novel genes, proteins and inherited disorders of iron overload: iron metabolism is less boring than thought. Haematologica 2002;87(2):115-6.
3. Beaumont C. Molecular mechanisms of iron homeostasis. Med Sci 2004;20(1):68-72.
4. Brissot P, Troadee MB, Loreal O. The clinical relevance of new insights in iron trnasport and metabolism. Curr Hematol Rep 2004;3(2):107-15.
5. Park CH, Valore EV, Warin AJ, Ganz T. Hepcidin, a urinary antimicrobial peptide synthesied in the liver. J Biol Chem 2001;276(11):7806-11.
6. Krause A, Neitz S, Magert HJ, Schulz A, Forssanan WG, Schulz-Knappe P, Andermann K. LEAP-1, a novel highly disulfide-bounded human peptide, exhibits antimicrobial activity. FEBS Lett 2000;480:147-50.
7. Fleming RE, Sly WS. Hepcidin: a putative iron-regulatory hormone relevant to hereditary hemochromatosis and the anemia of chronic disease. Proc Natl Acad Sci USA 2001;98 (15):8160-2.
8. Hunter HN, Fulton DB, Ganz T, Vogel HJ. The solution structure of human hepcidin, a peptide hormone with antimicrobial activity that is involved in iron uptake and hereditary hemocromathosis. J Biol Chem 2002;277(40):37597-603.
9. Pigeon C, Ilyin G, Courseland B, Leroyer P, Turlin B, Brissot P, Loreal O. A new mouse liver-specific gene, encoding a protein homologous to human antimicrobial peptide hepcidin, in overexpressed during iron overload. J Biol Chem 200;276(11):7811-9.
10. Ganz T. Hepcidin, a key regulator of iron metabolism and mediator of anemia on inflammation. Blood 2003;103(3):783-8.
11. Robson KJ. Hepcidin and its role in iron absorption. Gut 2004;53:617-9.
12. Schibli DJ, Hunter HN, Aseyer V, Starner TD, Wienick JM, McCray P, et al. The solution structures of the human b-defensins lead to a better understanding of the potent bactericidal activity of HBD3 against Staphilococcus aureus. J Biol Chem 2002;277:8279-89.
13. MatsuzakiK, Nakayama M, Fukui M, Otaka A, Funakoshi S, Fujii N, et al. Role of the disufide linkages in tachyplesin-lipid interactions. Biochemistry 1993;32:11704-10.
14. Aumelas A, Mangoni M, Roumestand C, Cheche L, Despaux E, Grassy G, et al. Synthesis and solution structure of the antimicrobial peptide protegrin-1. Eur J Biochem 1996;237(3):575-83.
15. Berrocal-Lobo M, Segura A, Moreno M, López G, García-Olmedo F, Molina A. Snakin-2, an antimicrobial peptide from potato whose gene is locally induced by wounding and responds to pathogen infection. Plant Physiol 2002;128:951-61.
16. Dallalio G, Fleury T, Means RT. Serum hepcidin in clinical specimens. Br J Haematol 2003;122(6):996-1000.
17. Nemeth E, Valore EV, Terreto M, Sciller G, Lichtenstein A, Ganz T. Hepcidin a putative mediator of anemia of inflammation, is a Type II acute-phase protein. Blood 2003;101(7): 2461-3.
18. Gehrke SG, Kulaksiz H, Herrmann T, Riedel HD, Bents K, Veltkamp C, Stremmel W. Expression of hepcidin in hereditary hemochromatosis: evidence for a regulation in response to the serum transferrin saturation and to non-transferrin-bound iron. Blood 2003;102(1):371-6.
19. Weinstein DA, Roy CN, Fleming MD, Loda MF, Walsdorf JI, Andrews NC. Inaproppiate expression of hepcidin is associated with iron refractory anemia: Implications for the anemia of chronic disease. Blood 2002;100(10):3776-81.
20. Nemeth E, Rivera S, Gabayan V, Keller Ch, Tandorf S, Pederson BK, Ganz T. IL-6 mediates hypoferremia of inflammation by inducing the synthesis of iron regulatory hormone hepcidin. J Clin Invest 2004;113(9):1271-6.
21. Nicolas G, Chauvet C, Viatte L, Danan JL, Brigard X, Devaux I, et al. The gene encoding the iron regulatory peptide hepcidin is regulated by anemia, hypoxia and inflammation. J Clin Invest 2002;110(7):1037-44.
22. Leong WI, Lonnerdal B. Hepcidin, the recently identified peptide that appears to regulate iron absorption. J Nutr 2004;134(1):1-4.
23. Fleming RE, Sly WS. Ferroportin mutation in autosomal dominant hemochromatosis: loss of function, gain in understanding. J Clin Invest 2001;108(4):521-2.
24. Gambling L, Danzeisen R, Gair S, Lea RG, Charania Z, Solanki N, et al. Effect of iron deficiency on placental transfer of iron and expression of iron transport proteins in vivo and in vitro. Biochem J 2001;356:883-9.
25. Conrad ME, Umbreit JM. Pathways of iron absorpotion. Blood Cells Mol Dis 2002; 29:336-55.
26. Frazer DM, Wilkins SJ, Beker EM, Vulpe CD, McKie CD, Mckie AT, et al. Hepcidin expression inversely correlates with the expression of duodenal iron transporters and iron absorption in rats. Gastroenterology 2002;123(3):835-44.
27. Cairo G, Pietrangelo A. Iron regulatory proteins in pathobiology. Biochem J 2000; 352:241-50.
28. Frazeta DM, Anderson GJ. The orchestration of body iron intakes: how and where do enterocytes receives their cues? Blood Cells Mol Dis 2003;30(3):288-97.
Recibido: 2 de noviembre de 2004. Aprobado: 18 de diciembre de 2004.
MsC. Mariela Forrellat Barrios. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Tel (537) 578268, 578695 544214. Fax (537) 442334. e-mail: ihidir@hemato.sld.cu
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons