Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.21 n.3 Ciudad de la Habana sep.-dic. 2005
Instituto de Hematología e Inmunología
Quimerismo molecular en el trasplante alogénico de células hematopoyéticas. Resultados preliminares
Dra.C. Ana María Amor Vigil,1 Dr. Juan Carlos Jaime Fagundo,1 Dra. Valia Pavón Morán,1 Dr. Yrving E. Figueredo Peguero,2 Dra. Clara Luna Conde,2 Dr. Mario Wilford de León,2 Dra. Elvira Dorticós Balea1 y Dra.C. Gisela Martínez Antuña1
Resumen
El estudio del quimerismo en el trasplante alogénico de células hematopoyéticas permite conocer si el sistema linfohematopoyético del donante ha sido capaz de implantarse en el organismo del receptor y si lo hace desplazando totalmente al sistema linfohematopoyético del receptor o en coexistencia con este. Se utiliza la reacción en cadena de la polimerasa para amplificar zonas del ADN altamente polimórficas y se muestran los primeros resultados del estudio molecular del quimerismo en 12 pacientes con diferentes patologías malignas y no malignas. El estudio permitió determinar si el trasplante fue exitoso y evaluar la evolución del injerto.
Palabras clave: quimerismo, trasplante alogénico, células hematopoyéticas.
Actualmente, el trasplante de células hematopoyéticas tiene un importante papel en el tratamiento de las leucemias y otras enfermedades hematológicas como la aplasia medular (AM) y la anemia drepanocítica (AD). Una importante herramienta clínica en la evaluación de los trasplantes de células hematopoyéticas es el estudio del quimerismo, el cual nos permite conocer si el sistema linfohematopoyético del donante ha sido capaz de implantarse en el organismo del receptor o paciente y si lo ha hecho desplazando al sistema linfohematopoyético del receptor o coexistiendo en equilibrio con este. De esta manera, mediante determinaciones secuenciales, es posible conocer la evolución o comportamiento de la quimera con vistas a confirmar el fallo primario del injerto o conocer, antes que otros indicadores se manifiesten, la posibilidad de un fallo secundario del mismo.
La reacción en cadena de la polimerasa (PCR) como método rápido y sensible para amplificar fragmentos de ADN ha proporcionado una importante herramienta para los estudios de quimerismo.1 Actualmente, es de uso general en el mundo para estos fines y ha devenido en análisis de rutina en los centros dedicados a la terapia de trasplante de tejido linfohematopoyético. Para los fines del trasplante, se estudian zonas muy polimórficas presentes en el ADN que permiten identificar el origen de las células hematopoyéticas presentes en el organismo del receptor en un momento dado.2 A iferencia de su antecesora, la técnica de Southern blot, la PCR requiere pequeñas cantidades de ADN, consume menos tiempo, es más sencilla de realizar y no utiliza enzimas de restricción, ni radioisótopos.3 Su gran sensibilidad, permite identificar pequeñas poblaciones de células del donante o del receptor y ha hecho posible realizar un estudio cinético del comportamiento del injerto, e incluso conocer si el injerto se ha establecido o no, antes que las evidencias morfológicas aparezcan.4
En el presente trabajo se amplifican 5 fragmentos polimórficos del ADN genómico conocidos como VNTR (variable number of tandem repeat, por sus siglas en inglés). El polimorfismo de estos fragmentos es una característica hereditaria, por lo que se requiere estudiar varios de ellos en el paciente y el donante (que por lo general son hermanos), con el objetivo de encontrar los que sean diferentes y por lo tanto, informativos para el estudio del quimerismo .
Se exponen los primeros resultados obtenidos en niños y adultos con diferentes patologías trasplantados en el IHI y el CIMEQ.
Métodos
Pacientes:
Se estudiaron 12 pacientes entre niños y adultos, de ambos sexos.
Los adultos (2 hombres y 3 mujeres) con una edad promedio de 34 años y un rango de edad de 21 a 62 años, fueron trasplantados en el CIMEQ.
Los niños (2 varones y 5 hembras) con una edad promedio de 8 años y un rango de edad de 2 a 15 años, fueron trasplantados en el IHI.
Los pacientes presentaron diferentes enfermedades. De ellos, 5 con leucemia mieloide crónica (LMC), 2 con leucemia linfoide aguda (LLA), uno con leucemia mieloide aguda (LMA), uno con linfoma no hodgkiniano (LNH), uno con AD y 2 con AM.
En todos los casos, el donante fue hermano o hermana del receptor.
Siguiendo las recomendaciones de Antin y colaboradpres, 4 el estudio se realizó en muestras de sangre periférica.
Análisis de los VNTR por la técnica de PCREl ADN genómico se aisló a partir de leucocitos de sangre periférica (10 mL ) del paciente y el donante antes del trasplante, y del paciente después del trasplante. Se utilizó el método de extracción con cloroformo/alcohol isoamílico (24:1) y precipitación con etanol absoluto.
Se utilizaron los oligonucleótidos correspondientes a los extremos 5´ y 3´ para la amplificación por PCR de 5 regiones neutras del ADN, conocidas como VNTR: YNZ22, Apo-B, Apo-C, PAH y MCT118, 2,5-8 que fueron recomendados y donados por el Centro Ricerca Tettamanti en Monza , Italia, por ser muy polimórficos e informativos para este tipo de estudio. En cada caso se estudiaron todos los VNTR que resultaron informativos.
Para la PCR se incubó un microgramo de ADN, en un termociclador o máquina de PCR minicycler, en presencia de: 2,5 unidades de Taq ADN polimerasa, 200 nM de una mezcla de nucleótidos ( dNTP ), 30 pmoles de cada oligonucleótido (correspondientes a los extremos 5´ y 3´ del fragmento amplificado), 1,25 mM de MgCl 2 y de una solución tampón que contenía Tris- HCl 10mM (a pH 9, 25 ° C), KCl 50 mM y Triton X-100 al 0,1 % en un volumen total de 50 m L. En un primer paso de desnaturalización y antes de añadir la Taq ADN polimerasa, se incubó la mezcla de reacción a 99 ºC durante 10 min ; posteriormente, previa incubación en baño de hielo durante 3 min , se añadió la enzima para iniciar la amplificación. El programa de amplificación constó de 30 ciclos, cada uno con 3 cambios de temperatura: 94 ºC durante 1' 30'', 55 ºC durante 1' 30'' y 72 ºC durante 1' 30''.
Antes del trasplante fueron amplificadas, en el ADN del paciente y el donante, las 5 regiones polimórficas seleccionadas, a fin de encontrar las que serían útiles o informativas para el seguimiento postrasplante . Después del trasplante, fueron amplificadas las regiones informativas en el ADN del paciente trasplantado, el ADN del paciente antes de ser trasplantado y el ADN del donante.
El producto de amplificación se analizó de manera cualitativa en electroforesis en gel de agarosa al 2,5 % con bromuro de etidio como marcador de fluorescencia.
Resultados
En el presente trabajo, los 5 VNTR amplificados resultaron informativos en más de una ocasión, a pesar de que el número de pacientes no fue grande. Además, en todos los pacientes siempre se encontró al menos uno informativo, lo que permitió realizar el estudio en el 100 % de los casos. El MCT118 resultó ser el de mayor polimorfismo de los 5 VNTR estudiados, y por lo tanto, fue utilizado con más frecuencia para el estudio. El orden de frecuencia en que los VNTR resultaron informativos fue: MCT118 (6) > YNZ22 (5) > PAH (3) = Apo B (3) > Apo C (2).
La cantidad de VNTR informativos por caso varió desde 1, en 6 de los pacientes, hasta 3, en 1 de ellos.
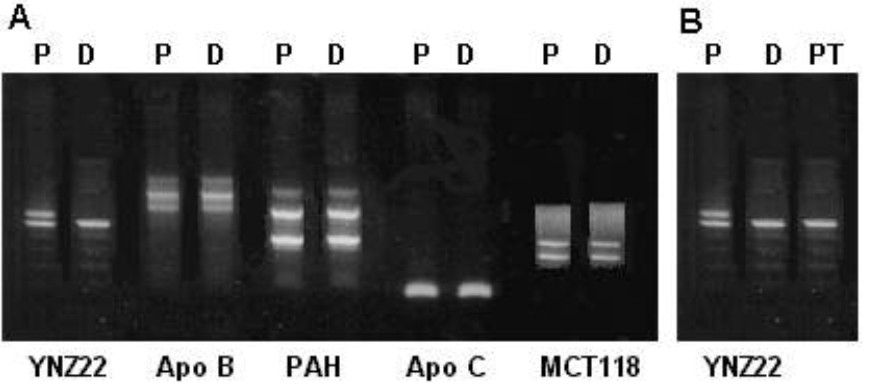
La figura 1A muestra, de manera representativa, la amplificación de los 5 VNTR en uno de los casos estudiados. Se aprecia como informativo el YNZ22 por presentar un patrón de bandas diferente entre el donante y el receptor. La figura 1B compara el patrón de bandas del paciente a los 30 días de trasplantado con el del paciente antes del trasplante y el del donante. Como se observa, el patrón de bandas del paciente después del trasplante es igual al del donante, lo cual muestra la aparición de una quimera 100 % del donante, es decir, una quimera completa (QC).
El estudio de los pacientes con enfermedades malignas, 9 en total, se muestra en la tabla 1. De 5 pacientes con LMC (2 niños y 3 adultos), a 3 se les aplicó un régimen de acondicionamiento mieloablativo , mientras que en los otros 2 el régimen de acondicionamiento fue no mieloablativo. La aparición de QC o mixta (QM) no estuvo relacionada con el régimen de acondicionamiento; de hecho apareció QM solo en un caso, que recibió recibió acondicionamiento mieloablativo. La QM fue detectada a los 20 días del trasplante , pero resultó ser temporal ya que en los estudios posteriores, a los 6 y 10 meses, se había transformado en QC .
Tabla 1. Características generales, resultado del estudio de quimerismo y evolución del injerto en los pacientes con hemopatías malignas.
| Paciente | Edad (años) | Sexo R/D | Patología | Acondicionamiento | VNTR informativos | Tiempo de toma de muestra (días o meses) Resultado | Evolución | |||
| 1 | 28 | F/M | LMC | No mieloablativo | PAH | 30 días QC | 60 días | 90 días QC | nr | EICH aguda e infección por citomegalovirus. Falleció |
| 2 | 26 | F/M | LMC | No mieloablativo | Apo C | 30 días QC | 60 díasQC | 120 díasQC | 8 meses | Alta médica |
| 3 | 35 | M/M | LMC | Mieloablativo | MCT118 | 30 días QC | nr | nr | nr | Caso reciente con buena evolución |
| 4 | 8 | F/F | LMC | Mieloablativo | YNZ22 MCT118 | 34 días QC | nr | nr | nr | Caso reciente con buena evolución |
| 5 | 15 | M / M | LMC | Mieloablativo | PAH | 20 días QM*
| 6 meses | 10 meses QC | nr | EICH crónica en la boca |
| 6 | 21 | M / M | LMA | Mieloablativo | Apo B | 35 días | nr | nr | nr | Caso reciente con buena evolución |
| 7 | 3 | F / M | LLA | Mieloablativo | Apo B | 21 días | 33 días | 120 días | 9 meses | Rechazó el injerto. |
| 8 | 6 | F / F | LLA | Mieloablativo | YNZ22 MCT118 | 33 días QC | nr | nr | nr | Infección por Citomegalovirus. |
| 9 | 62 | F/F | LNH | No mieloablativo | YNZ22 | 34 días QC | 60 días | nr | nr | EICH aguda en piel. |
LMC: leucemia mieloide crónica; LMA: leucemia mieloide aguda; LLA: leucemia linfoide aguda; LNH: linfoma no hodgkiniano; R/D: receptor/donante; F: femenino; M: masculino; VNTR: fragmentos polimórficos del ADN; QC: quimera completa; QM:: quimera mixta; nQ: no aparece quimera; nr: no realizado; bcr-abl: gen quimérico característico de LMC; EICH: enfermedad de injerto contra hospedero.
Muy bajo porcentaje del paciente.
Figura. Patrones de bandas que se observan en el estudio molecular del quimerismo.
A: estudio del paciente (P) y el donante (D) antes del trasplante, es informativo el fragmento YNZ22. B: estudio después del trasplante, el patrón de bandas en el paciente trasplantado (PT) es igual al del D.
En los 4 casos restantes con LMC, se observó QC desde la primera determinación que se les realizó después del trasplante (entre los 30 y 34 días). Dos de estos son casos recientes, por lo que solo habían sido estudiados por primera vez. En los otros 2, se mantenía la QC al momento de publicar estos resultados, uno de ellos a los 8 meses y el otro a los 90 días de realizado el trasplante.
En el resto de los casos de la tabla 1, el régimen de acondicionamiento fue mieloablativo , excepto para el caso con LNH, que recibió un acondicionamiento no mieloablativo. El caso con LMA es reciente y se observó QC a los 35 días del trasplante. Con respecto a los 2 casos con LLA, en uno de ellos se observó una QC a los 33 días, pero el paciente falleció poco después por infección por citomegalovirus . El segundo caso de LLA fue estudiado hasta los 9 meses, pero en ningún momento apareció quimera, y fue posible concluir que hubo un rechazo del injerto. Por último, en el caso con LNH, apareció QC a los 34 días y se mantuvo como tal en el segundo estudio a los 60 días.
La tabla 2 presenta los resultados del estudio en pacientes con patologías no malignas, 1 con AD y 2 con AM. En el caso de la AD , no se observó quimera desde la primera muestra a los 12 días del trasplante y hasta los 6 meses, lo cual permitió concluir que hubo un fallo primario del injerto. Por otra parte, ambos casos con AM mostraron QC en el primer estudio (86 y 30 días) y también en el segundo estudio a los 8 y 4 meses, respectivamente.
Tabla 2. Características generales, resultado del estudio de quimerismo y evolución del injerto en los pacientes con hemopatías no malignas.
| Patología | Edad (años) | Sexo D/R | Acondicionamiento | VNTR informativos | Tiempo de toma de muestra (días o meses) Resultado | Evolución | |||
| AD | 14 | M / F | No mieloablativo | PAH | 12 días nQ | 21 días nQ | 60 días nQ | 6 meses nQ | Fallo primario del injerto
|
| AM | 8 | F / M | Mieloablativo | YNZ22 MCT118 | 86 días QC | 8 meses QC | nr | nr | Buena evolución |
| AM | 2 | F / M | Mieloablativo | MCT118 | 30 días QC | 4 meses QC | nr | nr | Buena evolución |
AD: anemia drepanocítica; AM: aplasia medular; R / D: receptor / donante; F: femenino; M: masculino; VNTR: fragmentos polimórficos del ADN; QC: quimera completa; nQ: no aparece quimera; nr: no realizado.
Hasta la fecha de la última determinación, no se observó una QC que desapareciera o evolucionara hacia QM en ambos grupos de pacientes.
Discusión
Fue posible la realización del estudio del quimerismo en los pacientes con trasplante de células hematopoyéticas mediante la amplificación de los 5 VNTR utilizados con dicho fin. En el grupo de pacientes estudiados, pudo detectarse, según el caso, la aparición de QC, de QM y la no aparición de quimera alguna, indicativa del fallo primario del injerto.
La aparición de QC indica que la hematopoyesis del donante se ha implantado, pero no es posible asegurar que esta continuará establecida permanentemente, ya que varios factores influyen para que esto suceda. Por esta razón, es necesario mantener el estudio del quimerismo de manera periódica hasta el año de trasplantado el enfermo. La literatura recomienda que se realice el estudio a los 30, 60, 90, 120 días, 6 y 12 meses.4
Cuando aparece quimera mixta, esta puede evolucionar hacia el fallo del injerto, si predominan las células del receptor, mantenerse como tal o llegar al estado de QC con predominio casi absoluto (98 a 100 %) de la hematopoyesis del donante.4 Inicialmente se creyó que un trasplante sostenido era aquel en el que el 100 % de la hematopoyesis pasaba a ser originaria del donante. Sin embargo, hoy se conoce que aún en presencia de células del paciente, este puede sobrevivir, libre de enfermedad, durante un largo período de tiempo.9 Particularmente, en el caso de las leucemias, se ha observado que la ocurrencia de una recaída cuando aparece quimerismo mixto depende fundamentalmente de la línea celular que hace mixto al quimerismo, y si ella a su vez es el mismo tipo de célula que causa la leucemia.9 Serrano y colaboradores, por ejemplo, en un estudio sobre la evolución del quimerismo en pacientes con LMC, encontraron que la posibilidad de recaída estaba directamente relacionada con la aparición de QM en las células mieloides.10
En los casos con LMC se realizó de forma paralela el estudio del gen quimérico BCR-ABL por la técnica de RT-PCR para detectar enfermedad mínima residual. Por comunicación personal (Lic. Niubys Callado ), conocimos que en uno de estos casos, precisamente el que había presentado QM a los 20 días del trasplante, se detectó la presencia de este gen quimérico a los 6 meses de trasplantado, momento en que presentaba QC, y que a los 10 meses no se detectó el gen quimérico BCR-ABL y se mantenía la QC.
El resultado de QC y la presencia simultánea del gen BCR-ABL puede parecer contradictoria. Sin embargo, debe destacarse que la RT-PCR es una técnica mucho más sensible que la amplificación de los VNTR y a su vez es específica para el gen quimérico, el cual solo se encuentra en el paciente. Esta especificidad implica que, en la reacción de amplificación del gen BCR-ABL, no hay competencia entre el ADN del donante y el del receptor por los oligos. Sin embargo, en la amplificación de los VNTR sí hay competencia, ya que los fragmentos de ADN, que serán amplificados, están presentes tanto en el donante como en el receptor.9 Este hecho contribuye a que los estudios de quimerismo realizados con la técnica descrita, tengan aún una menor sensibilidad con respecto a la RT-PCR, y cabe la posibilidad de que el citado paciente presente una micro QM no detectada por nuestra técnica.
Cuando el trasplante se realiza en pacientes con patologías no malignas, no es primordial eliminar totalmente la hematopoyesis del paciente y por tanto, la aparición de QM no es alarmante. Sin embargo, sí debe establecerse una quimera hematopoyética, sea completa o mixta, capaz de sustituir o proporcionar aquella función deficiente o ausente en cada una de estas enfermedades.4
La amplificación de los VNTR por PCR pudo ser utilizada para estudiar el quimerismo aún cuando coincidieron el sexo del paciente y el donante, a diferencia de otras técnicas incluso más sensibles que la presente, por ejemplo la amplificación por PCR de secuencias específicas de los cromosomas X y Y, que no son útiles en estos casos.11
En resumen, el estudio molecular del quimerismo permite conocer el éxito o fracaso del trasplante y la posibilidad de una recaída, incluso antes que aparezcan las evidencias morfológicas.
Summary
The study of chimerism in the allogeneic transplantation of hematopoietic cells allows to know if the the lymphohematopoietic system of the donor has been able to implant itself in the recipient and if it does it by totally displacing the lymphohematopoietic system of the recepient or coexisting with it. Polymerase chain reaction is used to amplify the highly polymorphic DNA zones. The first results of the mollecular study of chimerism in 12 patients with different malignant and nonmalignant pathologies are shown. This study made possible to determine if the transplant was successful and to evaluate the graft ' s evolution.
Key words: Chimerism, allogeneic transplantation, hematopoietic cells.
Referencias bibliográficas
1. Saiki R, Gelfand D, Stoffel S. Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science 1988 ;239:487-91.
2. Lawler M, Humphries P, McCann SR. Evaluation of mixed chimerismby in vitro amplification of dinucleotide repeat sequences using the polymerase chain reaction. Blood 1991; 77:2504-14.
3. Wang LJ, Chou P, González -Ryan L, Huang W, Haut PR, Kletzel M. Evaluation of mixed hematopoietic chimerism in pediatric patients with leukemia after allogeneic stem cell transplantation by quantitative PCR analysis of variable number of tandem repeat and testis determination gen. Bone Marrow Transplantation 2002;29:51-6.
4. Antin JH, Childs R, Filipovich AH. Establishment of complete and mixed donor chimerism after allogeneic lymphohematopoietic transplantation: Recomendations from a workshop at the 2001 Tandem Meetings. Biol Blood Marrow Transplant 2001;7:473-85.
5. Horn TG, Richards B, Klinger KW. Amplification of a highly polymorphic VNTR segment by the polymerase chain reaction. Nucleic Acids Research 1989;17:2140 .
6. Boerwinkle E, Xiong W, Fourest E, Chan L. Rapid typing of tandemly repeated hypervariable loci by the polymerase chain reaction: Application to the apolipoprotein B 3´ hypervariable region. Proc Natl Acad Sci USA 1989;86:212-6.
7. Goltsov AA, Eisensmith RC, Konecki DS, Lichter-Konecki U, Woo SLC. Associations between mutations and a VNTR in the human phenylalanine hydroxylase gene. Am J Hum Genet 1992 ;51:627 -36.
8. Tanaka J, Kasai M, Imamura M, Masauzi N, Ohizumi H, Matsuura A, et al. Evaluation of mixed chimaerism and origin of bone marrow transplantation. Bone Marrow Transpant 1994 ;86:436 -8.
9. Zetterquist H, Mattsson J, Uzunel M, Näsman-Björk I, Svenberg P, Tammik L, et al. Mixed chimerism in the B cell lineage is a rapid and sensitive indicator of minimal residual disease in bone marrow transplant recipients with pre-B cell acute lymphoblastic leukemia. Bone Marrow Transplant 2000 ;25:843 -51.
10. Serrano J, Román J, Sánchez J, Jiménez A, Castillejo JA, Herrera C, et al. Molecular analysis of lineage-specific chimerism and minimal residual disease by RT-PCR of p210 BCR-ABL and p190 BCR- ABL after allogeneic bone marrow transplantation for chronic myeloid leukemia: Increasing mixed myeloid chimerism and p190 BCR-ABL detection precede cytogenetic relapse. Blood 2000 ;95:2659 -65.
11. Khan F, Agarwal A, Agrawal S. Significance of chimerism in hematopoietic stem cell transplantation: New variations on an old theme. Bone Marrow Transplant 2004;34:1-12.
Recibido: 15 de diciembre de 2005. Aprobado:
Dra. Ana María Amor Vigil . Instituto de Hematología e Inmunología. Apartado Postal 8070, Ciudad de La Habana, CP 10800, Cuba. Tel (537) 578268, 578695, 544214. Fax (537) 442334. e-mail: ihidir@hemato.sld.cu
1Instituto de Hematología e Inmunología (IHI).
2Centro de Investigaciones Médico Quirúrgicas (CIMEQ).