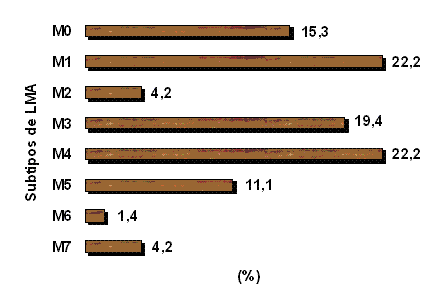Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter v.21 n.3 Ciudad de la Habana sep.-dic. 2005
Inmunofenotipaje celular en el diagnostico de la leucemia mieloide aguda
Lic. Yanelkys Cos Padrón, Dra. Vianed Marsán Suárez, Lic. Bertha B. Socarrás Ferrer, Dra. Miriam Sánchez Segura, Lic. Mercedes Martínez Machado, Lic. Lázaro O del Valle Pérez, Dra. Consuelo Macías Abraham, Dr. Aramís Núñez Quintana, Dra. Rosa María Lam Díaz.
RESUMEN
Se analizó el inmunofenotipo de las células leucémicas en 72 pacientes con diagnóstico de leucemia mieloide aguda (LMA) atendidos en el Instituto de Hematología e Inmunología en un periodo de 13 años. El inmunofenotipaje celular (IFC) se realizó a través del ultramicrométodo inmunocitoquímico (UMICIQ), mediante la utilización de un panel de anticuerpos monoclonales para evaluar la expresión de antígenos mieloides y linfoides. Del total de LMA estudiadas el 22.2% pertenecía a las variedades M1 y M4. El resto de las variedades diagnosticadas fueron: M3 (19.4%), M0 (15.3%), M5 (11.1%), M2 y M7 (4.2%) y M6 (1.4%). La expresión de antígenos linfoides se encontró en el 31.9% de estos pacientes. La enzima desoxinucleotidil transferasa terminal fue positiva en el 56.5% de los casos. El IFC es un método útil para el diagnóstico de las variedades M0 y M7 de las LMA y permite complementar el diagnóstico citomorfológico y citoquímico del resto de las variedades.
Palabras clave: Leucemia mieloide aguda, inmunofenotipo, anticuerpo monoclonal
La leucemia mieloide aguda (LMA) constituye un grupo heterogéneo de neoplasias caracterizadas por la expansión clonal de blastos mieloides que se acumulan en la médula ósea y en la sangre periférica. Puede presentarse a cualquier edad, pero representa la forma más común de leucemia aguda en adultos, particularmente en individuos mayores de 60 años. Su incidencia es de 2.5 por cada 100.000 personas y en el año 2002 fueron reportados a nivel mundial alrededor de 260 000 nuevos casos. 1,2
En el estudio de estas células se incluyen técnicas inmunológicas o de inmunofenotipaje celular (IFC) que utilizan anticuerpos monoclonales (AcMo), las cuales han permitido una caracterización más detallada de los leucocitos, así como conocer que los fenotipos leucémicos no son perfectas réplicas de sus contrapartes normales.3,4
Las técnicas de IFC son esenciales para determinar la línea específica de origen de las células leucémicas y su nivel de maduración, así como para distinguir la leucemia linfoide aguda (LLA) de la LMA mínimamente diferenciada (LMA-M0) y de la LMA megacarioblástica (LMA-M7), además de contribuir a caracterizar a la LMA en los distintos subtipos inmunológicos. 4
En nuestro estudio analizamos el inmunofenotipo de las células mieloblásticas en un grupo de pacientes con diagnóstico de LMA para determinar la frecuencia de los distintos subtipos inmunológicos, la expresión antigénica más frecuentemente encontrada en cada variedad y la expresión de marcadores linfoides que pueda implicar infidelidad de linaje en dicha enfermedad.
MATERIALES Y MÉTODOS
Se estudiaron 72 pacientes con diagnóstico de LMA, 42 del sexo masculino y 28 del sexo femenino, con una edad promedio de 24.8 años y un rango entre 11 meses y 80 años diagnosticados en el Instituto de Hematología e Inmunología, en un periodo de 13 años.
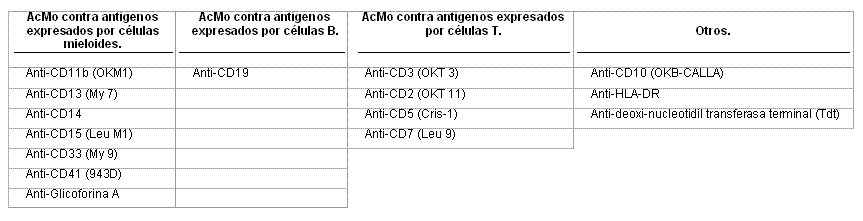
Las leucemias estudiadas estaban clasificadas según los criterios citomorfológicos y citoquímicos del grupo Grupo Franco Americano Británico (FAB).5 Para la clasificación inmunológica, se les realizó a las muestras procedentes de médula ósea o sangre periférica el IFC mediante el ultramicrométodo inmunocitoquímico (UMICIQ),6 utilizando un panel de AcMo dirigidos contra antígenos mieloides y linfoides (Tabla 1).
Tabla 1. Anticuerpos monoclonales (acmo) utilizados para el inmunofenotipaje celular.
Fueron clasificadas como LMA-Li + aquellas LMA que expresaron hasta 2 antígenos linfoides.
RESULTADOS
Del total de pacientes estudiados el 44.4 % no expresaron los antígenos pan-mieloides CD13, CD33 o ambos antígenos. De estos 31.2% no expresaron el antígeno CD13, mientras que 34.8% no presentaron el CD33. En el 34% restante se encontraron ausentes ambos marcadores antigénicos.
Al analizar el comportamiento de las variedades de LMA según la clasificación del Grupo FAB se observó un predominio de las variedades M1 y M4, diagnosticados ambos subtipos en el 22.2% de los pacientes. Las variedades M2, M6 y M7 constituyeron las variedades menos frecuentes, observadas en el 4.2%, 1.4% y 4.2% respectivamente (Figura 1).
Figura 1.- Frecuencia de las variedades de Leucemia Mieloide Aguda (LMA)
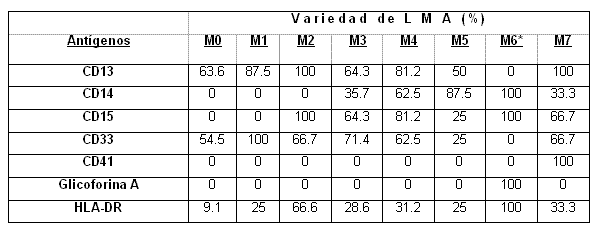
En la tabla 2 se muestra el porcentaje de pacientes que expresaron los antígenos mieloides analizados en cada variedad de LMA.
* Solamente incluye un paciente.
Los marcadores antigénicos CD13 y CD33 se expresaron en todos los subtipos FAB excepto en el subtipo eritroide (M6) donde ambos antígenos se encuentran ausentes.
En las variedades M0 y M1 solo se observó la expresión de los antígenos pan-mieloides CD13, CD33 o ambos con una pobre expresión del antígeno HLA-DR identificado en el 9.1% y 25% de los casos respectivamente.
En el 28.6% de los pacientes pertenecientes a la variedad M3 se encontró positivo el marcador HLA-DR. El 64.3% de estos pacientes fueron CD15 positivos.
El antígeno CD14 se observó frecuentemente expresado en las variedades M4 (62.5%) y M5 (87.5%), mientras que no se observó su expresión en los subtipos M0, M1 y M2.
En la variedad M7 los marcadores antigénicos CD13 y CD41 fueron positivos en el 100% de los casos, los antígenos CD15 y CD33 en el 66.7%, mientras que el CD14 y el HLA-DR lo fueron en el 33.3% de los casos.
El 31.9% de los pacientes con LMA se diagnosticaron como LMA-Li + . Los antígenos linfoides encontrados fueron CD2, CD3, CD5, CD7, CD10, CD19, CD20 y Tdt. De estos, los más frecuentes fueron la Tdt (56.9%) y el CD10 (26.1%).
En el 73.9% de las LMA-Li + se observó la expresión de un solo antígeno linfoide y en solo 6 (26%) casos se observó la coexpresión de dos de estos antígenos. Las combinaciones antigénicas linfoides encontradas fueron CD2/CD7, CD3/CD10, CD3/Tdt, CD10/Tdt, CD10/CD20; de estas la combinación que se observó con mayor frecuencia fue la de los antígenos CD10/Tdt.
DISCUSION
La mayoría de las LMA exhiben fenotipos heterogéneos en contraste con las LLA, las cuales generalmente muestran expresiones homogéneas. Virtualmente los antígenos pan-mieloides CD13 y CD33 son expresados juntos por los blastos mieloides; sin embargo, en una minoría de los casos, estos expresan solo uno de estos antígenos.7-9 En nuestro estudio observamos que la ausencia de la expresión de uno de ellos fue superior a lo obtenido por otros investigadores e incluso encontramos, en algunos casos, la ausencia de ambos marcadores antigénicos lo que constituye una aberración fenotípica. Algunos autores plantean que la no expresión del antígeno CD33 es un factor pronóstico de supervivencia desfavorable para las LMA en su fase inicial diagnosticada en adultos.10
Las células blásticas de los pacientes diagnosticados como LMA M0 y M7 no mostraron características morfológicas y citoquímicas típicas de diferenciación mieloide, no se encontraron células cloronaftol positivas, indicando que la actividad de la mieloperoxidasa era negativa mediante esta técnica. Sin embargo, en la variedad M0 la mieloperoxidasa es positiva por microscopia electrónica.3
La variedad M0 o indiferenciada puede representar hasta un 4% del total de LMA ;9 pero en nuestro estudio se encontró una frecuencia mucho más elevada. En esta variedad los blastos son positivos frente a uno o más AcMo dirigidos contra los antígenos mieloides CD13 y CD33 y son negativos frente a los marcadores linfoides, también pueden estar expresados los antígenos CD2, CD7, y Tdt, lo que no excluye el diagnóstico de LMA-M0 debido a que en esta situación no se consideran específicos de linaje.2,3,5 En nuestro estudio solo encontramos la expresión de la enzima Tdt en los casos diagnosticados con esta variedad.
La frecuencia de la variedad M3 o promielocítica (LPM) determinada en nuestro estudio fue elevada en comparación con la encontrada por Catovsky (5-7%) .5 Nuestra frecuencia está de acuerdo con los valores más altos señalados en los latinos y que también habían sido encontrados previamente en los cubanos .11 Esta variedad constituye el único subtipo inmunológico donde la morfología y el IFC habitualmente coinciden. Generalmente se caracteriza por un tipo más homogéneo, con expresión de los antígenos CD13 y CD33 y con la ausencia o pérdida de la expresión del marcador HLA-DR.12 Sin embargo, en nuestros casos la frecuencia de este antígeno fue superior. Wetzler y colaboradores13 observaron que las LMA HLA-DR negativos que no eran LPM tenían una frecuencia similar a las LPM HLA-DR negativos lo que no coincide con nuestros resultados, los cuales si coinciden con los comunicado por otros autores.14 En esta variedad el antígeno CD15 ha sido encontrado por otros investigadores en un rango entre 10-15%.3,5,12 En nuestro grupo de estudio encontramos una frecuencia mayor que el mencionado anteriormente. El diagnóstico de las LPM no puede ser basado solo en la morfología y en la ausencia de la expresión de HLA-DR, sino que se requiere también de la confirmación citogenética y molecular.13
La variedad M4 muestra una alta heterogeneidad tanto morfológica como fenotípica, lo que explica que en algunos casos esta exprese marcadores antigénicos que también lo hacen en las variedades M2 y M5.3,5 Existen algunos marcadores que muestran una alta correlación con la clasificación FAB como es el CD14 en los subtipos M4 y M5. Algunos autores han comunicado que este marcador se expresa frecuentemente en dichos subtipos, pero raramente en las variedades M0 y M1.15 Estos resultados concuerdan con los obtenidos en nuestro estudio. La alta expresión de CD14 está asociada a una resistencia a citostáticos constituyendo un factor de mal pronóstico en los pacientes con LMA.16
A pesar que los pacientes diagnosticados como M7 expresaron el antígeno CD41, se recomienda que el diagnóstico debe ser confirmado por estudios ultraestructurales de peroxidasa plaquetaria o por la detección de otros antígenos plaquetarios (CD42, CD61 y el relacionado con el factor VIII).3 La frecuencia que observamos es menor que la obtenida en el estudio de una población mexicana (19.1%).17
La frecuencia de infidelidad de linaje que encontramos es similar a la obtenida por otros autores;14 sin embargo, la frecuencia de los antígenos linfoides identificados en nuestro estudio difiere de la comunicada por otros investigadores.14,18,19
La frecuencia de Tdt positiva en pacientes con LMA varía en dependencia del método de detección utilizado; debemos destacar este no es un antígeno restringido a linaje linfoide.20 En nuestro estudio encontramos una frecuencia mayor que la señalada por otros autores. 18,19
El antígeno CD10 no es un antígeno específico de linaje linfoide; su expresión por determinados tipos celulares es selectiva. Se ha descrito su expresión muy ligera en los granulocitos. Su expresión en las LMA ya ha sido señalada previamente. En nuestro estudio la expresión de dicho antígeno coincide con los resultados comunicados por otros grupos de trabajo. 21
La coexpresión de un solo antígeno linfoide en LMA se observa con mucho más frecuencia que la coexistencia de 2 o más de estos marcadores. Las asociaciones de CD2/CD5, CD2/CD7, CD7/CD19 en los mieloblastos ya han sido comunicadas previamente. 22
El IFC demostró ser útil para el diagnóstico de las variedades M0 y M7 ya que estos blastos no muestran características de diferenciación mieloide por los métodos morfológicos y citoquímicos, por lo que no es posible descartar con estos procederes el diagnóstico de una LLA. Además el IFC complementa el diagnóstico del resto de las variedades cuando se asocia a las técnicas habituales para su caracterización.
Teniendo en cuenta nuestros resultados podemos sugerir el empleo del UMICIQ como un método confiable, sencillo y económico para su aplicación en el IFC de las leucemias, particularmente en laboratorios con pocos recursos y que no pueden acceder a procederes técnicos más avanzados.
Agradecimientos
Los autores agradecen la contribución de las siguientes instituciones que donaron anticuerpos monoclonales incluidos en el estudio: Hospital Clínico de Barcelona, España ( Anti-CD11b, Anti-CD13, Anti-CD14, Anti-CD15, Anti-CD33, Anti-CD41, Anti-Glicoforina A, Anti-CD19, Anti-CD10, Anti-HLA-DR, anti-Tdt); Fundación Tettamanti, Italia ( Anti-CD11b, Anti-CD13, Anti-CD14, Anti-CD15, Anti-CD33, Anti-CD41, Anti-Glicoforina A, Anti-CD3, Anti-CD2, Anti-CD5); e Instituto de Investigación del Cáncer, Londres ( Anti-CD7).
Summary
The immunophenotype of the leukemic cells was analyzed in 72 patients with diagnosis of acute myeloid leukemia (AML) that received attention at the Institute of Hematology and Immunology during 13 years. The cellular immunophenotyping (CIP) was performed by immunocytochemical ultramicromethod, using a panel of monoclonal antibodies to evaluate the expression of myeloid and lymphoid antigens. Of the total of studied AMLs, 22 % corresponded to the varieties M1 and M4. The rest of the diagnosed varieties were: M3 (19.4 %), M0 (15.3 %), M5 (11.1 %), M2 and M7 (4.2 %), and M6 (1.4 %). The expression of lymphoid antigens was found in 31.9 % of these patients. The terminal desoxynucleotidyl transferase was positive in 56.5 % of the cases. The cellular immunophenotyping is a useful method for the diagnosis of varieties M0 and M7 of acute lymphoid leukemia, and it also allows to complement the cytomorphological and cytochemical diagnosis of the rest of the varieties.
Key words: Acute myeloid leukemia, immunophenotype, monoclonal antibody
REFERENCIAS BIBLIOGRÁFICAS
1. Redaelli A, Botteman MF, Stephens JM, Brandt S, Pashos CL. Economic burden of acute myeloid leukemia: a literature review. Cancer Treat Rev 2004;30:237-47.
2. Casanovas RO, Slimane FK, Garand R, Faure GC, Campos L, Deneys V et al. Immunological classification of acute myeloblastic leukemias: relevance to patient outcome. Leukemia 2003;17:515-27.
3. Van Dongen JJM, Adriaansen HJ. Immunobiology of leukemia. In: Henderson ES, Lister TA, Greaves MF (eds.). Leukemia, 6 th edition. Philadelphia 1996:83-130.
4. Reilly JT. Use and evaluation of leucocyte monoclonal antibodies in the diagnostic laboratory: a review. Clin Lab Haem 1996;18:1-5.
5. Catovsky D. Leucemias mieloides agudas. Enciclopedia Iberoamericana de Hematología. Ediciones Universidad de Salamanca 1992;2:141-6.
6. Rivero RA, Bello M, Suárez LE, Cruz C, Martínez M, Palma L. Introducción de un ultramicrométodo inmunocitoquímico para la cuantificación de subpoblaciones identificadas con anticuerpos monoclonales. Rev Cubana Hematol Inmunol Hemoter 1995;11:46-56.
7. Ghosh S, Shinde SC , Kumaran GS, Sapre RS, Dhond SR, Badrinath Y, et al. Haematologic and immunophenotypic profile of acute myeloid leukaemia: an experience of Tata Memorial Hospital . Indian J Cancer 2003;40:71-6.
8. Khalidi HS, Medeiros LJ, Chang KL, Brynes RK, Slovak ML, Arber DA. The immunophenotype of adult acute myeloid leukemia: high frequency of lymphoid antigen expression and comparison of immunophenotype, French-American-British classification, and karyotypic abnormalities. Am J Clin Pathol 1998;109:211-20.
9. Piedras J, Barrales O, Lopez X. Classification of acute myeloid leukemia according to the first latin-american consensus conference for the immunophenotyping of leukemias. Rev Invest Clin 2000;52:524-8.
10. de Nully P, Jurlander J, Pedersen J, Victor MA, Geisler CH. The prognostic significance of chromosomal analysis and immunophenotyping in 117 patients with de novo acute myeloid leukaemia. Leuk Res 1997;21:985-95.
11. Hernández P, Milanés MT, Svarch E, Martínez G, Ballester JM. High relative proportion of acute promyelocytic leukaemia in children: experience of a multicenter study in Cuba. Leuk Res 2000;24:739-40.
12. Paletta E. Expression of cell-surface antigens in acute promyelocytic leukaemia. Best Pract Res Clin Haematol 2003;16:369-85.
13. Wetzler M, Mc Elwain BK, Stewarr CC, Blumenson L, Mortazavi A, Ford LA, et al. HLA-DR antigen-negative acute myeloid leukemia. Leukemia 2003;17:707-15.
14. Kaleem Z, Crawford E, Pathan MH, Jasper L, Covinsky MA, Jhonson LR. Flow cytometric analysis of acute leukemias. Diagnostic utility and critical analysis of data. Arch Pathol Lab Med 2003;127:42-8.
15. Lauria F, Raspadori D, Ventura MA, Rondelli D, Testoni N, Tosi P, et al. The presence of lymphoid-associated antigens in adult acute myeloid leukemia is devoid of prognostic relevance. Stem Cell 1995;13:428-34.
16. Norgard JM, Olesen LH, Olesen G, Meyer K, Kristensen JS, Bendix K, et al. FAB M4 and high CD14 surface expression is associated with high cellular resistance to Ara-C and daunorubicin: implications for clinical outcome in acute myeloid leukaemia. Eur J Haematol 2001;67:221-9.
17. Paredes R, Romero L, Lopez N, Trejo RA. Biology, clinical, and hematologic features of acute megakaryoblastic leukemia in leukemia in children. Am J Hematol 2003;73:71-80.
18. Venditti A, Del Poeta G, Buccisano F, Tamburini A, Cox MC, Aronica G, et al. Prognostic relevance of the expression of Tdt and CD7 in 335 cases of acute myeloid leukemia. Leukemia 1998;12:1056-63.
19. Chang H, Salma F, Yi QL, Patterson B, Brien B, Minden MD. Prognostic relevance of immunophenotyping in 379 patients with acute myeloid leukemia. Leuk Res 2004;28:43-8.
20. Del Vecchio L, Finicio O, Lo Pardo C, Pane N, Shiarone EM, Vacea C, et al. Co-ordinate expression of T-cell antigens on acute myelogenous leukemia and of myeloid antigens on T acute lymphoblastic leukemia. Speculation on a highly balanced bilinearity. Leukemia 1991;5:815-8.
21. Vidriales MB, Orfao A, González M, Hernández JM, López-Berges MC, García MA. Expression of NK and lymphoid associated antigens in blast cells of acute myeloblastic leukemia. Leukemia 1993;7:2026-9.
22. Marsán V, Sánchez M, Rivero R, Martínez M, Gutierres S, Espinosa E, et al. Inmunofenotipaje celular en el diagnóstico de las leucemias agudas híbridas. Rev Cubana Hematol Inmunol Hemoter 1999;15:190-6.
Recibido: 10 de mayo de 2005. Aceptado: 11 de octubre de 2005
Correspondencia a: Lic. Yanelkys Cos Padrón. Instituto de Hematología e Inmunología. Apartado 8070, Ciudad de La Habana, CP 10800, CUBA
Telf (537) 578268, 578695, 544214. Fax (537) 442334. Email: ihidir@hemato.sld.cu