Introducción
Los linfomas no Hodgkin de células B (LNH-B) representan 40 % de todas las neoplasias malignas hematológicas con una incidencia en Europa de 14 casos / 100 000 personas /año. Los LNH-B comprenden un grupo variado de más de 20 subtipos que se clasifican de acuerdo con determinadas características clínicas, histopatológicas y genéticas.1
El linfoma difuso de células grandes B (LDCGB) es el subtipo histológico de curso agresivo más común y de mayor prevalencia de los LNH-B y representa entre el 30-58 % de los mismos, es un linfoma de rápido crecimiento y se diagnostica aproximadamente en los Estados Unidos de Norteamérica con 72 000 casos nuevos al año de esta enfermedad.1
Su incidencia aumenta con la edad desde 0,3 /100 000 /año (entre 35-39 años) a 26,6 /100 000/ año (entre 80-84 años).1,2 Alcanza su mayor pico por encima de 50 a 60 años, con una relación masculino/femenino de 1,8/1. Más del 50 % de los pacientes son mayores de 60 años, por lo que constituyen un desafío terapéutico.2
Es el linfoma más frecuente asociado a la infección por VIH. La historia familiar de linfoma, las enfermedades autoinmunes, la seropositividad para hepatitis C y la alta masa corporal en adultos jóvenes son también considerados factores de riesgo para padecer LDCGB.3,4
La presentación clínica puede ser nodal o extranodal y 40 % de los LDCGB se originan en tejido linfoide de localización extraganglionar, siendo los sitios más frecuentes el tubo digestivo y el cavum.1,3
Se caracteriza por un alto índice de crecimiento, con síntomas que dependen de la localización tumoral. Su rápida progresión explica que pueda ser diagnosticado en estadios precoces (I y II).4 Por esta misma razón y por la mayor cohesividad de las células que lo componen, el compromiso de médula ósea (MO) al diagnóstico es menos frecuente, solo se observa en 30 % de los casos. Sin embargo, 60 % de los pacientes tienen estadios III o IV al diagnóstico.3,4
Los síntomas B se presentan en 30 % de los enfermos. En el laboratorio, la cifra de deshidrogenasa láctica sérica (LDH) representa una medida de la carga tumoral y se encuentra incrementada en 50 % de los pacientes al diagnóstico.1 Ciertos subtipos histológicos dentro del grupo constituyen verdaderos síndromes clínicos particulares tales como el LDCGB primario mediastinal y el linfoma primario de sistema nervioso central o el LDCGB rico en células T, con consideraciones pronósticas y terapéuticas particulares.5
La clasificación pronóstica más reconocida a nivel mundial y validada en grandes series de pacientes con LBDCG, es la estratificación basada en parámetros clínicos y bioquímicos que se encuentran fácilmente al alcance de toda evaluación clínica inicial, conocida como el Índice Pronóstico Internacional (IPI) desarrollada por: “El proyecto internacional de factores pronósticos para linfoma no Hodgkin” publicado en 1993 y que aún permanece vigente.6
Inicialmente se tuvieron en cuenta cinco factores pronósticos: edad, estadio según la clasificación de Ann Arbor, nivel de LDH, estado clínico general determinado por la escala del grupo cooperativo de oncología oriental (ECOG), y el compromiso de sitios extranodales como parámetros para clasificar los pacientes en riesgo bajo, bajo intermedio, alto intermedio y alto.7) Posteriormente se propuso esta misma clasificación revisada conocida como IPI revisado en la que se evalúa la clasificación IPI en pacientes tratados con anticuerpo monoclonal anti-CD20 (Rituximab, Mabthera) donde se utilizan 3 variables: estadio, nivel de LDH, y el estado clínico general determinado por el ECOG. Teniendo en cuenta el comportamiento de las curvas de sobrevida, se reducen los grupos de riesgo a tres grupos pronósticos: muy buen pronóstico, bueno y mal pronóstico.7,8
El LDCGB es potencialmente curable, particularmente cuando se diagnostica en un estadio temprano.9 Este subtipo de LNH es quimiosensible y la combinación de quimioterapia como ciclofosfamida, doxorubicina, vincristina y prednisona (CHOP) ha sido establecida como el tratamiento estándar desde 1970s.9
La introducción de un anticuerpo monoclonal (AcM) anti-CD20, en combinación con regímenes de quimioterapia, ha mejorado significativamente los resultados del tratamiento.10
La caracterización de los pacientes con LDCGB es vital para precisar la aparición de las complicaciones, las secuelas y su relación directa con los tratamientos empleados y también los factores de riesgo para su aparición. Esto permite trazar estrategias que contribuyen a mejorar su supervivencia.
Dado que la evolución y el tratamiento dependen del diagnóstico rápido y eficaz y que en el Instituto de Hematología e Inmunología (IHI) no existe una caracterización del comportamiento de los pacientes adultos con LDCGB, ni estudios que hayan evaluado su supervivencia; se realizó esta investigación para caracterizar el comportamiento de los pacientes con LNHDCGB atendidos en la institución, mediante la determinación de variables demográficas, clínicas, pronosticas y terapéuticas, además de que se estimó la superviviencia global (SG) y libre de enfermedad (SLE) en los pacientes a los 3, 5 y 10 años posteriores al tratamiento de primera línea.
Métodos
Se realizó un estudio observacional, descriptivo, longitudinal y retrospectivo en el que se incluyeron los pacientes adultos, diagnosticados y tratados con LDCGB atendidos en el IHI desde enero de 1998 hasta diciembre de 2018. Se revisó la totalidad de las historias clínicas de los pacientes durante el período de estudio y con los datos recolectados se llenó un formulario.
El universo estuvo conformado por 56 pacientes. Se incluyeron pacientes mayores de 18 años de edad en el momento del diagnóstico de acuerdo a los criterios definidos por la OMS/REAL5 y se excluyeron aquellos cuyas historias clínicas no se encontraron en el departamento de archivo del centro al momento del estudio, o no contenían los datos necesarios para la realización de la investigación.
Se tuvieron en cuenta las variables: edad, sexo, color de la piel, zona de residencia, validismo del enfermo al diagnóstico según ECOG, comorbilidades, presencia de síntomas B, masa tumoral, estadio al diagnóstico, factores pronósticos relacionados con el IPI, esquema de tratamiento y respuesta al mismo, aparición de recaídas, estado actual del paciente, tiempo para SG y tiempo para la SLE.
El protocolo fue aprobado por el comité de ética y el consejo científico de la institución. Se tuvieron en cuenta los principios referentes al código de ética de acuerdo con la declaración de Helsinki. La información referente a los pacientes se trató de acuerdo a los principios de confidencialidad que rigen la investigación científica.
Procesamiento estadístico
Los datos obtenidos fueron procesados con el paquete de programas SPSS versión 21.0, para la realización de la estadística descriptiva: determinación de la frecuencia de ocurrencia y su interpretación porcentual; se expresó en tablas de frecuencia y de relación de variables.
El análisis de la supervivencia se realizó mediante el método de Kaplan-Meier.
Resultados
El 55,4 % de los pacientes atendidos correspondieron al sexo masculino, el grupo de edades que se presentó con mayor frecuencia fue el de 59 a 78 años con un valor porcentual de 44,6, la edad media 58,.18±15,5 años, asimetría -0,3 que indica una discreta mayoría por debajo de la edad media, edad mínima 19 y edad máxima 91 años. El 76,8 % de los pacientes tenían el color de la piel blanca y el 73,2 % de los mismos eran de procedencia urbana. El 35,7 % de los casos presentaron hipertensión arterial como comorbilidad.
En cuanto a la presencia de síntomas B se encontró que 85, 7 % de los casos presentaron algunos de estos síntomas (Fig. 1).
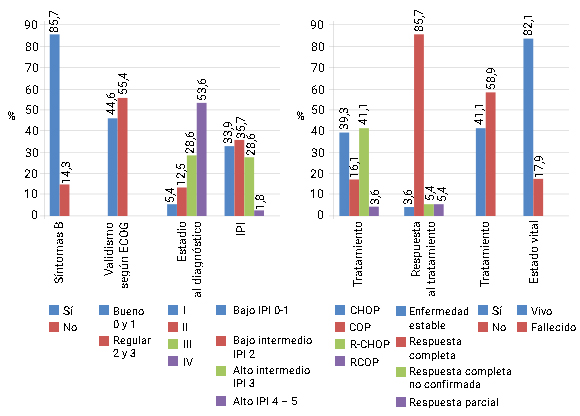
Fig. 1 - Características clínicas de los pacientes adultos con linfoma difuso de células grandes B (n=56)
Según el ECOG, el validismo fue regular entre 2 y 3 con valor 55,4 % y 44,6 % entre 0 y 1. El mayor número de pacientes se encontraba en estadio IV de la enfermedad al diagnóstico, que representó 53,6 % y correspondió a estadios avanzados de la enfermedad. Según el IPI predominó el grupo de riesgo bajo intermedio en 35,7 % seguido del riesgo bajo con 33,9 %. El esquema de quimioterapia más utilizado fue R-CHOP (rituximab (Mabthera), ciclofosfamida, vincristina, doxorubicina, y prednisona) (n=23), seguido por el esquema (CHOP) sin el uso del anticuerpo monoclonal rituximab (n=22). Con estos tratamientos se alcanzó la remisión completa (RC) en 85,7 % y 82,1 % de los pacientes, respectivamente.
Las recaídas se presentaron en 41,1 % de los pacientes estudiados y al cierre del estudio los fallecimientos tuvieron un registro porcentual de 17,9 %.
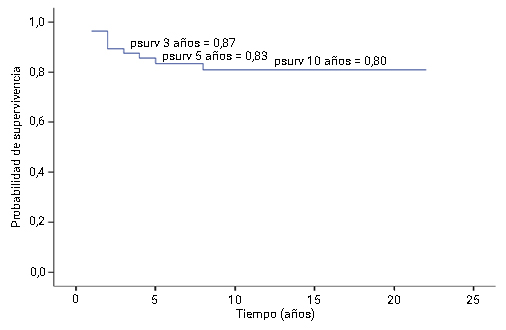
Al analizar la SG (Fig. 2) se obtuvo una sobrevida media de 10,23 años con un intervalo de confianza suficientemente estrecho para corroborar la buena calidad de la estimación obtenida. En la curva de supervivencia se observó que SG a los 3 años fue 87,0 %, a los 5 años 83,0 %, y 80,0 % a los 10 años.
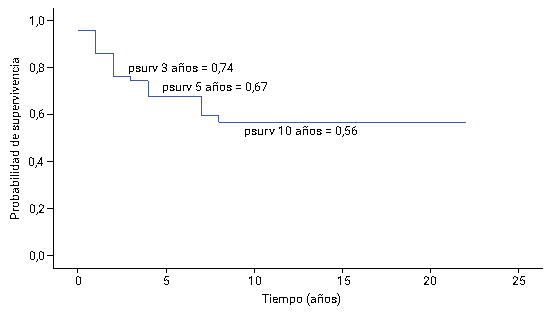
Al estimar la SLE (Fig. 3), se obtuvo que el tiempo medio fue 5,90 años. En la curva de SLE se evidenció que a los tres años de finalizado el tratamiento 4,0 % de los pacientes no habían recaído. Sin embargo, a los 5 años la SLE fue 67 % y a los 10 años 56 %, después de este intervalo de tiempo la curva hace una meseta. Llama la atención que todos los pacientes recayeron los primeros 10 años de finalizado el tratamiento, así como que el mayor número de recaídas se produjo en los primeros 5 años.
Discusión
Las principales limitaciones de esta investigación estuvieron relacionadas con el amplio período de estudio que implicó variaciones en los protocolos de tratamiento empleados.
La edad media de presentación al diagnóstico es entre la sexta y séptima década de la vida, aunque afecta a niños y adultos de todas las edades, y es más común en el sexo masculino.3
En estudio realizado en México se observó que el LDCGB predominó en los adultos menores de 65 años con un promedio de edad de 60 años.11 Similares resultados se exponen en un estudio realizado en Cuba en la provincia de Villa Clara donde se evaluaron 102 pacientes y predominó el grupo de edades de 60 años y más, así como el sexo masculino.12 Estos resultados están relacionados con lo encontrado por el investigador.
En relación a las comorbilidades Cruz D y otros, en su estudio exponen que 45 % de los pacientes tenían antecedentes de enfermedades crónicas11 y el autor señala similares resultados; aspecto que se considera perjudicial para los pacientes porque a mayor edad de diagnóstico existe más probabilidad de comorbilidades, que puedan proscribir un tratamiento agresivo y con intento curativo.11) La distribución por el color de la piel y la zona de residencia se correspondió con lo reportado internacionalmente.1,3
En 40 % de los pacientes con LDCGB se presentan síntomas generales como fiebre, pérdida de peso o sudoración profusa, no explicables por otras causas. Un estudio realizado en Costa Rica encontró, que los síntomas B están presentes en 47 % de los casos estudiados,13 estos resultados no están en relación a lo encontrado por el investigador donde la presencia de los mismos fue mucho más elevada a lo descrito internacionalmente.
En 1960 el Eastern Cooperative Oncology Group (por sus siglas en ingles ECOG) publicó por primera vez el uso de una escala muy sencilla de medición de la capacidad funcional que podía resultar útil para la toma de decisiones de tratamiento.14 Estas medidas ofrecen un buen índice del estado general del paciente y, en consecuencia, de la capacidad de soportar la quimioterapia.14 La utilización de un Índice ECOG mayor de 2 como límite para el comienzo de un tratamiento quimioterápico es muy común en todos los servicios de oncología/hematología.14 Es evidente que la decisión final sobre tratamiento no sólo va a depender de la capacidad funcional del paciente sino de una valoración clínica exhaustiva y de las probabilidades de éxito del tratamiento para cada tipo de linfoma.
En estudio realizado por Mejías Freire y otros, predominó ECOG 2-3 en 70 % de los casos.15 El investigador utilizó la variable de validismo para agrupar a los pacientes según el ECOG y predominó el validismo regular con ECOG 2-3 muy descrito con lo revisado internacionalmente.
El estadio IV avanzado en relación con la estadificación de Ann Arbor está relacionado, con lo encontrado por el investigador, al comparar un estudio en una cohorte de pacientes con LDCGB adultos en Costa Rica, donde 23,2 % se encontraban en etapas localizadas (I y II) y 76,8 % en etapas avanzadas (III y IV) al momento del diagnóstico.13
Convencionalmente, el pronóstico de los pacientes con LDCGB se establece por medio del IPI, desarrollado a partir de un estudio multicéntrico de pacientes con linfomas agresivos que recibieron quimioterapia basada en antraciclinas en la era anterior al rituximab.7,8,16
Sehn y otros,17 informaron que, si bien el IPI conserva su carácter predictivo, no distingue los cuatro grupos de riesgo, sino que se deben redistribuir en tres grupos para una mejor predicción de la SG. Por ello propusieron el IPI revisado, el cual incluye las variables del IPI convencional. Entre las desventajas del sistema está su limitación para identificar a los pacientes con menos del 50 % de probabilidad de supervivencia.17
De acuerdo a NCCN y al Grupo Oncológico del Sudoeste Americano (por sus siglas en inglés SWOG), el tratamiento se determina según estadio y factores de riesgo (IPI).17,18 En una serie de 1885 pacientes revisada por Montalbán C y otros,19 no se obtuvieron resultados similares a los descritos por el investigador.
El tratamiento estándar de los pacientes con LBDCG ha sido la poliquimioterapia tipo CHOP durante muchos años, con la que se conseguía una supervivencia a largo plazo del 40%.3,20 La combinación del CHOP con rituximab (anticuerpo monoclonal anti-CD20) ha mejorado la supervivencia de los pacientes ancianos y de los pacientes jóvenes con IPI de bajo riesgo (estudio MiNT),21 se considera actualmente el tratamiento estándar del LBDCG, con el que se consigue globalmente una supervivencia a largo plazo del 60-70 %.21
Hoy en día, el tratamiento de primera línea del LBDCG se puede estratificar en función de si la enfermedad está localizada o diseminada, edad del paciente y factores pronósticos al diagnóstico (IPI o IPI ajustado por edad, (aaIPI) en los pacientes menores de 60 años).20,21,22
Grandes estudios randomizados como RICOVER, demostraron la superioridad de la inmunoquimioterapia, siendo R-CHOP 21, el patrón de oro en primera línea (Nivel de evidencia 1).23) R-CHOP mostró una mejora en la supervivencia sin complicaciones y la SG en comparación con CHOP solo, administrado a 399 pacientes mayores de 60 años con LDCBG en estadio avanzado (57 vs. 38 %, p = 0,002 y SG = 70 vs. 57 %, p = 0,007, a los 2 años).23 En el momento de la mediana de seguimiento a los 10 años, la SG de los pacientes que recibieron R-CHOP, comparada con la de los pacientes que recibieron CHOP solo fue de 44 vs. 28 %, p < 0,001.23 Estos resultados están relacionados con los encontrados por el investigador.
En general, con los tratamientos modernos para pacientes de LNH, la supervivencia general a 5 años es de más de 60 %. De los pacientes de LDCGB, se puede curar más de 50 %, resultados acorde a lo encontrado por el autor donde 87,1 % se encuentra en remisión completa.
Las recaídas se presentan en los primeros 2 años después de terminar el tratamiento. Consideramos que pudo haber estado en relación a que en los pacientes que recayeron no se pudo utilizar el tratamiento con R-CHOP como terapia de elección. La letalidad en la investigación fue más baja de lo reportado internacionalmente.24
A pesar de que la mayoría de los estudios realizados para evaluar la SG de los pacientes con LDCGB, no cuentan con períodos de seguimiento mayores de 15 años, se considera que la sobrevida de estos pacientes ha mejorado sustancialmente en las últimas décadas con la asociación de anticuerpos monoclonales y tratamiento específico a cada subtipo.
La SG de los pacientes con LDCGB va a estar determinada por el riesgo pronóstico, el estadio y el tratamiento que realice el paciente, se estima que es aproximadamente del 71 %.3,12 En un estudio realizado en México la mediana de SG de los pacientes incluidos en el estudio fue de 1 259 días (3,44 años),11 significativamente menor en comparación a los resultados obtenidos por el autor.
La SLE se estima que se encuentra entre 40-50 % teniendo en cuenta que las recaídas se presentan en los primeros 2 años después de terminar el tratamiento, en la casuística de esta investigación la SLE se mantuvo por encima del 50 % a los 3, 5 y 10 años respectivamente, considerando que está por encima de lo revisado en la literatura internacional.3,12Los pacientes con LDCGB atendidos en el IHI tuvieron una SG y SLE altas.