Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.18 n.3 Ciudad de la Habana sep.-dic. 1999
Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón". Instituto Superior de Ciencias Médicas de La Habana
Efectos del alcoholismo crónico sobre el hígado de ratas albinas adolescentes
Dra. Aleida Herrera Batista, Dra. Maritza González Bravo, Dra. Ela Céspedes Miranda y Lic. Sonia Sánchez GonzálezRESUMEN
Se estudiaron los efectos del alcoholismo crónico sobre el hígado de ratas albinas adolescentes. Se utilizaron 57 ratas de ambos sexos a las que se le suministraron 6 g de etanol por kilogramo de peso corporal diariamente desde los 28 hasta los 90 d de nacidas. Se estudiaron las variables: ganancia en peso corporal, concentraciones en suero de la enzima transaminasa glutámico pirúvica, triacilglicéridos, lipoproteínas de muy baja densidad y las características histológicas del hígado y el glucógeno hepático. Se comprobó que las ratas alcohólicas: ganaron menos peso, presentaron valores significativamente mayores de transaminasa glutámico pirúvica y menores de triacilglicéridos y lipoproteínas de muy baja densidad que los controles. El hígado de las ratas alcohólicas presentó esteatosis intensa, signos de muerte celular por apoptosis y necrosis, infiltrados leucocitarios, cuerpos de Mallory y megalomitocondrias. Los datos encontrados sugieren que las ratas adolescentes son muy sensibles al etanol.Descriptores DeCS: ALCOHOLISMO/patología; HIGADO/patología; AUMENTO DE PESO; ALANINA TRANSAMINASA/sangre; TRIGLICERIDOS/sangre; LIPOPROTEINAS VLDL/sangre.
El alcoholismo crónico representa un grave peligro para el hombre. El consumo frecuente de alcohol puede ocasionar daño hepático,1 alteraciones en los sistemas nervioso e inmunológico,2,3 así como un comportamiento social inapropiado en el individuo.4
En las últimas décadas se ha producido un incremento en el consumo de alcohol por parte de menores de edad, sobre todo adolescentes; y lo que es más preocupante, el número de grandes bebedores ha alcanzado cifras elevadas en esta población.5,6
Durante la adolescencia se producen cambios en los sistemas endocrino y nervioso que llevan a transiciones significativas en el desarrollo biológico, cognitivo, psicológico y social del individuo.7,8 Todo esto hace que la adolescencia posea características que la hacen diferente de otras etapas de la vida.
En las ratas la adolescencia se define como la fase peripuberal de maduración sexual; en la cual se producen transformaciones biológicas y conductuales en el animal.7 Esta etapa comienza alrededor de los 28 d de nacida y culmina a los 50 d en la hembra y más allá de los 63 d en el macho.7
El hígado es uno de los órganos que más se afecta como consecuencia de la ingestión irresponsable de alcohol,1,9,10 se plantea que la enfermedad hepática alcohólica se desarrolla en 3 etapas o estadios: esteatosis hepática, hepatitis tóxica o alcohólica, y cirrosis hepática.11 Cada etapa se caracteriza por lesiones anatomopatológicas diferentes. En la etapa de esteatosis se observa infiltración grasa de los hepatocitos. En la hepatitis alcohólica se añaden otras lesiones, como son: infiltrados leucocitarios, cuerpos de Mallory y necrosis celular. La cirrosis se caracteriza por la presencia de extensas áreas de fibrosis y desorganización de la arquitectura lobulillar.11
Se han utilizado marcadores bioquí-micos efectivos para valorar la función hepática; entre los más utilizados está la enzima transaminasa glutámico pirúvica (TGP).12 Los estudios de los triacilglicéridos en suero (TG) y las lipoproteínas de muy baja densidad (VLDL) han sido utilizados como excelentes predictores de daño hepático en el hombre.1
En la literatura no se reportan trabajos donde se estudien las alteraciones que provoca el alcohol en el hígado de animales de experimentación durante la adolescencia. Por lo cual el objetivo del presente trabajo fue estudiar los efectos que el alcoholismo crónico ocasiona sobre el hígado de ratas albinas adolescentes.
MÉTODOS
Se utilizaron 57 ratas albinas de 28 d de nacidas provenientes de diferentes camadas y seleccionadas al azar con la utilización de una tabla de números aleatorios, se formaron 2 grupos: experimental y control. El primero formado por 27 ratas, 13 hembras y 14 machos. El segundo se formó con 30 animales, 15 de cada sexo.A las ratas del grupo experimental se les suministró etanol 40 % diluido en agua, desde los 28 hasta los 90 d de nacidas. La dosis fue de 6 g por kilogramo de peso corporal dividido en 2 tomas con un intervalo de 4 h entre una y otra. La vía de elección fue la oral y se utilizó una cánula intraesofágica. Las ratas se colocaron en jaulas individuales.
Se les suministró agua y comida para ratas ad libitum, y se mantuvieron en iguales condiciones ambientales e higiénicas. Las ratas fueron pesadas semanalmente para ajustar la dosis de alcohol. Al final de la experiencia se tomaron los valores de los pesos iniciales y finales para determinar la ganancia en el peso (s P). Para conocer el valor de s P se tomó el valor de peso final (PF) y se le restó el valor del peso inicial (PI), de este modo s P = PF-PI. Las pesadas se efectuaron en una balanza marca Yamato LW 3200.
Al final de la experiencia los animales fueron colocados en atmósfera de éter con el auxilio de una campana. Se tomaron 5 cc de sangre directamente del seno orbicular para determinar TGP, TG y CT. Con esta maniobra el animal murió y se procedió a extraer el hígado. Se tomaron fragmentos de 1 cm3 y se fijaron en líquido de Carnoy y formalina neutra tamponada 12 % y el material obtenido fue procesado por el método de la parafina. Se obtuvieron cortes histológicos a 4 m con un micrótomo vertical marca Spencer.
Para realizar el estudio histológico se tomaron 10 cortes de cada animal y se colorearon con la técnica de hematoxilina y eosina. La esteatosis se evaluó mediante la presencia de vesículas (macrovesículas y microvesículas) en el citoplasma de los hepatocitos. Se tomó la escala convencional siguiente: Negativo (0): ninguna célula afectada, Débil (x): células afectadas aisladas, Moderada (xx): la mitad de las células afectadas, Intensa (xxx):la totalidad o casi la totalidad de las células afectadas.
La inflamación se valoró de acuerdo con la presencia de células inflamatorias en el tejido hepático. Se evaluó de la forma siguiente: Ausente (0): no hubo células inflamatorias, Escasa (x): células inflama-torias aisladas, Focal (xx): colección de células inflamatorias en el parénquima, Inflamación difusa (xxx): áreas extensas de células inflamatorias en el parénquima y en los tractos portales.
La fibrosis se evaluó por la presencia de tejido conectivo. Los cuerpos de Mallory se reconocieron como estructuras redondeadas intensamente acidófilas en el citoplasma celular. Las megalomitocondrias se identificaron por la existencia de reacción acidófila que rodeaba a los núcleos.
Para el estudio del glucógeno hepático se tomaron 10 cortes de cada animal. Se utilizó la técnica de PAS según Hotchkiss.13 Como control se tomaron 2 de los 10 cortes y se incubaron con amilasa salival a 37 °C, en la estufa, durante 3 h, antes de realizar la técnica de PAS. Se utilizó la escala convencional siguiente: Negativo (0): no hay reacción, Débil (x): hasta 10 gránulos PAS + por célula, Intensa (xx): más de 10 gránulos PAS + por célula.
Todos los cortes fueron observados y fotografiados en un microscopio Olympus.
Se realizaron determinaciones en suero de la enzima transaminasa glutámico pirúvica (TGP) mediante el método alanin amino transferasa (ALAT) según Reitman-Frankel.14 Se realizaron determinaciones de triacilglicéridos (TG) en suero, por el método GOP-PAP15 y se determinaron los valores de CT mediante el método de CHOP-PAP de la Boehringer Mannheim, según Siedel,16 para obtener los valores de VLDL.
Para el procesamiento estadístico se utilizó una ANOVA de 2 vías, se tomaron las variables s P, TGP, TG y VLDL como variables dependientes y el grupo (alcohólicas y controles) y el sexo (hembras y machos) como variables independientes.
RESULTADOS
El análisis de varianza para comparar la ganancia de peso (s P) no resultó estadísticamente significativo entre ambos sexos en ninguno de los 2 grupos, tampoco resultó significativa la interacción sexo/tratamiento. La comparación de esta variable entre alcohólicos y controles fue estadísticamente significativa (tabla 1).| Ratas | | | ||
| |
| |
| |
| Hembras | | | | |
| | | | | |
| |
| |
| |
| Machos | | | | |
| | | | | |
| Efectos | | |
| Sexo | 1,563 | 0,217 |
| Tratamiento | | |
| | | |
Los valores medios de TGP no presentaron diferencias entre los sexos, ni se comprobó relación entre el sexo y el tratamiento. Esta variable presentó diferencias estadísticamente significativas entre ratas alcohólicas y controles (tabla 2).
| Ratas | | | ||
| |
| |
| |
| Hembras | | | | |
| | | | | |
| | | | | |
| Machos | | | | |
| | | | | |
| Efectos | F | V |
| Sexo | 0,889 | 0,351 |
| Tratamiento | 2,168 | 0,019 |
| Interacción Sexo/Tratamiento | 0,324 | 0,372 |
Las ratas alcohólicas presentaron valores significativos inferiores de TG que los de las ratas controles (tabla 3). No se comprobaron diferencias entre los sexos, ni interacción sexo/tratamiento. Las VLDL no presentaron diferencias entre los sexos, ni se observó interacción sexo/tratamiento. Los valores de las medias fueron significativamente diferentes entre ratas alcohólicas y controles; aunque las ratas alcohólicas mostraron valores inferiores.
| | | | ||
| |
| |
| |
| | | | | |
| | | | | |
| |
| |
| |
| | | | | |
| | | | | |
Efectos F P
Sexo 0,400 0,531
Tratamiento 10,145 0,003
Interacción Sexo/Tratamiento 2,383 1,132
En el estudio histológico de los hígados se comprobó que todas las ratas alcohólicas presentaron esteatosis intensa (fig. 1) en los hepatocitos de las zonas periportal, intermedia y perivenosa. Se observaron focos de células necróticas acompañadas de inflamación focal (fig. 2). No se observaron signos de fibrosis.

Fig 1. Rata alcohólica. Se observan hepatocitos con esteatosis intensa. Técnica hematoxilina y eosina. M.O. 120x.

Fig. 2. Rata alcohólica. Se observan signos de inflamación focal con células necróticas. Técnica hematoxilina y eosina. M.O. 120x.
Se encontraron megalomitocondrias en los hepatocitos de las 3 zonas del lobulillo hepático. Los cuerpos de Mallory son poco frecuentes y sólo se observaron en los hepatocitos localizados próximos a las venas centrolobulillares.
Algunos hepatocitos de la zona perivenosa presentaron signos de muerte por apoptosis.
Los hepatocitos de las ratas controles mostraron aspecto normal (fig. 3). No se observaron células necróticas ni inflamación en ninguna de las 3 zonas del lobulillo hepático. Tampoco se observaron cuerpos de Mallory ni megalomitocondrias.

Fig. 3 Rata control: Los hepatocitos muestran aspecto normal; núcleos eucromáticos y citoplasma basófilo y vacuolado. Técnica hematoxilina y eosina. M.O. 120x.
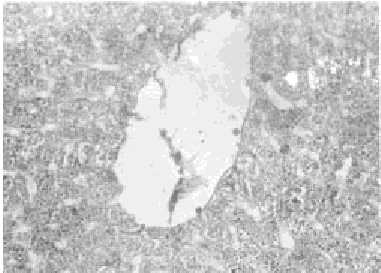
Fig. 4. Rata alcohólica. Técnica de PAS. Se observan células que no reaccionan y algunas con débil reacción que rodean a la vena centrolobulillar. Nótese que va aumentando la intensidad de la reacción en la medida en que se aleja de la vena. M.O. 120x.
Las ratas controles presentaron reacción intensa en los hepatocitos periportales. En la zona intermedia la mayoría de las células presentaron reacción intensa; algunas células mostraron reacción débil. Las células perivenosas presentaron reacción débil; algunas células presentaron reacción intensa. No se observaron diferencias entre los sexos.
DISCUSIÓN
En el presente trabajo se observó que las ratas alcohólicas ganaron menos peso que las controles y que no hubo diferencias entre los sexos. Estos hallazgos resultaron diferentes a los reportados por la literatura17 donde se han encontrado diferencias significativas en el peso de las ratas adultas sólo después de un tiempo prolongado de tratamiento. Esto hace pensar que las ratas que ingieren alcohol durante la adolescencia son más susceptibles al etanol que las adultas.Los signos de daño hepático que con más frecuencia se encontraron en las ratas alcohólicas fueron: esteatosis intensa y necrosis focal con acúmulos de neutrófilos y otras células inflamatorias. Según plantea la literatura, la esteatosis es un signo precoz de daño hepático y puede aparecer sola o presentarse con otras alteraciones anatomopatólogicas más severas.1
Las ratas alcohólicas de la presente serie mostraron concentraciones de triacilglicéridos y VLDL en suero inferiores que las controles, con una diferencia estadísticamente significativa.
Otros autores han encontrado que las cifras de los lípidos y lipoproteínas aumentan en las ratas alcohólicas en la medida en que se prolonga el tratamiento y refieren que el etanol provoca un incremento en la síntesis de éstos.1,17
Los hepatocitos exportan lípidos en forma de lipoproteínas ricas en TG (las VLDL) y se plantea que el etanol estimula la síntesis de TG,1 por lo cual resulta atractiva la hipótesis de que la esteatosis se debe a un aumento en la síntesis de TG y VLDL con una exportación deficiente de estos compuestos. Esta hipótesis explicaría la presencia de esteatosis, así como las bajas concentraciones de TG y VLDL encontradas en las ratas adolescentes en el presente trabajo.
Las ratas de la presente serie presentaron además de esteatosis hepática otros signos severos de daño hepático como son: necrosis focal, acúmulos de neutrófilos y otras células inflamatorias, cuerpos de Mallory, megalomitocondrias y marcada disminución del glucógeno hepático. El daño hepático es corroborado con los valores elevados de la TGP. Todo esto hace pensar que estas ratas son portadoras de hepatitis alcohólica, una etapa avanzada de la enfermedad hepática alcohólica.1,11,12,17
Como se dijo en párrafos anteriores, en la adolescencia el individuo es más susceptible al etanol que en etapas posteriores del desarrollo. Esto hace que la ingestión irresponsable de este tóxico resulte más peligrosa en esta etapa de la vida.
Se ha planteado que la muerte celular por necrosis se produce ante un daño masivo que provoca el colapso de la homeostasis interna de la célula.18 En el presente trabajo la noxa que provocó este tipo de muerte celular fue el etanol.
En la zona perivenosa del lobulillo hepático de las ratas alcohólicas adolescentes se encontraron algunos hepatocitos con características de células apoptóticas. Este hecho ha sido reportado por otros autores en el hígado de ratas alcohólicas.18,19 Esto parece indicar que el alcohol no sólo ocasiona la muerte celular por necrosis, sino que además, desencadena los mecanismos fisiológicos de la apoptosis; esto último debe ser corroborado con técnicas inmunohistoquímicas más especializadas.
SUMMARY
The effects of chronic alcoholism on the liver of adolescent albinic rats were studied. 57 rats of both sexes were administered 6 g of ethanol por kg of boby weight daily from the 28 th to the 90th day of life. The following variables were studied: body weight gain, concentrations in serum of alanine transaminase, triglycerides, very low density lipoproteins, the histological characteristics of the liver and the liver glycogen. It was proved that the alcoholic rats gained less weight and presented significantly higher values of alanine transaminase and lower values of triglycerides and of very low density lipoproteins than the controls. The liver of alcoholic rats showed severe steatosis, signs of cellular death due to apoptosis and necropsy, leucocytic infiltrates, Mallory bodies and megalomitochondria. The data found suggest that the adolescent rats are very sensitive to ethanol.Subject headings: ALCOHOLISM/pathology; LIVER/pathology; WEIGHT GAIN; ALANINE TRANSAMINASE/blood; TRIGLYCERIDES/blood; LIPOPROTEINS, VLDL/blood.
REFERENCIAS BIBLIOGRÁFICAS
- Simpson KJ. Pathogenesis of alcoholic steatosis. Add Biol 1996;1:363-70.
- Mitsuijama H, Litlle KY, Seighart W, Devand LL, Morrow L. GABA a receptor a1, a4 and b3 subunit in RNA and protein expression in frontal cortex of human alcoholics. Alcohol Clin Exp Res 1998;22(2):815-22.
- Gentry MJ. Pneumococcal pneumonia in alcoholism and HIV infection. Alcohol Clin Exp Res 1998;22(1):201s-203s.
- Camatta CD, Nagoshi CT. Stress, depression, irrational beliefs, and alcohol use and problems in a college student sample. Alcohol Clin Exp Res 1995;19:142-6.
- Menéndez RG, Maiza SG. Comportamiento del consumo de bebidas alcohólicas en estudiantes de medicina. Rev Cubana Salud Pública 1995;21:95-100.
- Alexander DE, Gwyther E. Alcoholism in adolescents and their families. Family focuses assessment and management. Pediatr Clin Nort Am 1995;42:217-34.
- Witt ED. Mechanism of alcohol in adolescents: A case for developing animal models. Behav Neurol Biol 1994;62:168-77.
- Ron DH, Ellickson PL. What is adolescent alcohol misusre in United States according to the expert? Alcohol and Alcoholism 1996;31(3):297-303.
- Sherlock S. Alcoholic liver disease. The Lancet 1995;345:227-9.
- Ktoczko J. Plasma protein C as a marker of hepatocellular damage in alcoholic liver disease. Haemeostasis 1992;22:340-4.
- Hall P. Pathology and pathogenesis of alcoholic liver disease. En: Hall P. Alcoholic Liver Disease: Pathology, Epidemiology and Clinical. New York:Edward Arnold, 1985:41-8.
- Aurousseau MH, Augeli L, Josso F. Antithrombin III versus prothrombin in liver cirrhosis. Haemeostasis 1981;10:104-7.
- Hotchkiss RD. A microchemical reaction resulting in the staining of polysaccharides structure in fixed tissue preparation. Arch Biochem 1948;16:131.
- Reitman S, Frankel S. Método Alanin Amino Tranferasa (ALAT). Amer J Clin Path 1961;28:56.
- Study Group, European Atherosclerosis Society Strategies for the prevention of coronary heart disease: A Policy Statement of the European Atherosclerosis Society European Heart Journal 1987;8:77-88.
- Siedel J, Hagele EO, Ziegenhorn J, Wahlefeld AW. Método de CHOP-PAP de la Boehringer Mannheim. Clin Chem 1983;29:1075.
- Bosma A, Seifert WF, Van Thiel-de Ruiter GCF. Alcohol in combination with malnutrition causes increased liver fibrosis in rat. J Hepatol 1994;21:394-402.
- Schulte-Hermann RW, Bursch W, Grasl-Kraupp B.Ockner Rk,En: Bayer JL. Active cell death (apoptosis) in liver biology and disease. Philadelphia:WB Saunders,1995:1-35.
- Deacinc IV, Fortunato F, D Sousa NB, Hill DB, Schmidt J, Lee EY, et al. Modulation of caspase-3 activity and fas legand m RNA expression in rat liver cells in vivo by alcohol and Lipopolysaccharides. Alcohol Clin Expres Res 1999;23(2):349-56.
Recibido: 11 de noviembre de 1999. Aprobado: 25 de noviembre de 1999.
Dra. Aleida Herrera Batista. Instituto Superior de Ciencias Médicas de La Habana. Avenida 31 y Calle 146. Reparto Cubanacán, municipio Playa, Ciudad de La Habana, Cuba.














