Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300
Rev Cubana Invest Bioméd vol.33 no.2 Ciudad de la Habana abr.-jun. 2014
ARTÍCULO ORIGINAL
Crecimiento pre y postnatal asociados a sobrepeso corporal en escolares de Bayamo
Pre and postnatal growth as related to overweight among Bayamo school-age children
Mariela Suárez RondónI, Vladimir Ruiz ÁlvarezI, Milagros Alegret RodríguezII, Maria Elena Díaz SánchezI, Manuel Hernández TrianaI
I Instituto de Nutrición e Higiene de los Alimentos. La Habana, Cuba.
II Dirección Provincial de Salud. Villa Clara, Cuba.
RESUMEN
Objetivo: identificar la asociación entre factores prenatales y relacionados con el primer año de vida y su influencia en el sobrepeso corporal de edades ulteriores.
Métodos: se realizó un estudio observacional, retrospectivo, analítico, de casos y controles en el municipio Bayamo con 200 escolares con sobrepeso corporal y 200 niños normales de 6-11 años de edad, de la misma zona de residencia, nacidos de madres con similar edad gestacional de 37-42 semanas, homogéneos en edad y sexo y con historia de no afecciones de salud. En el análisis estadístico se estimó el riesgo asociado como Odd Ratio.
Resultados: se mostró una fuerte asociación entre el sobrepeso corporal en la edad escolar y la ganancia de peso excesiva en los primeros 4 meses de vida, bajo peso, reducida longitud supina y circunferencia cefálica en el momento del nacimiento y hábito de fumar, insuficiente ganancia de peso corporal, bajo IMC y enfermedades de la madre durante el embarazo.
Conclusiones: estos factores deben ser considerados en la prevención de la obesidad infantil. La ganancia de peso acelerada en los primeros meses de vida de niños nacidos con afectación del crecimiento fetal debe ser prevenida.
Palabras clave: obesidad, escolares, bajo peso al nacer, ganancia de peso en embarazo, hábito de fumar, crecimiento postnatal acelerado, enfermedades crónicas.
ABSTRACT
Objective: Describe the relationship between prenatal factors and those occurring during the first year of life, and determine their influence on overweight in later stages.
Methods: An analytical observational retrospective case-control study was conducted in the municipality of Bayamo with 200 overweight school-age children and 200 normal children aged 6-11 years from the same area of residence, born to mothers with similar gestational age of 37-42 weeks, homogeneous as to age and sex, and with a history of good health. The statistical analysis included estimation of the associated risk as odd ratio.
Results: A strong association was found between overweight at school age and the following factors: excessive weight gain during the first 4 months of life, low weight, reduced supine length and head circumference at birth, smoking, insufficient weight gain, low BMI and maternal diseases during pregnancy.
Conclusions: These factors should be borne in mind in the prevention of child obesity. Rapid weight gain during the first months of life should be prevented among children born with fetal growth disorders.
Keywords: obesity, school-age children, low birth weight, weight gain during pregnancy, smoking, rapid postnatal growth, chronic diseases.
INTRODUCCIÓN
El peso al nacer y la ganancia de peso acelerada durante los primeros meses de vida han sido previamente informados como favorecedores de obesidad en la infancia.1-9
Para ello, se ha sugerido una relación en forma de "J" o de "U", con un mayor riesgo de obesidad en los extremos de peso al nacer. 7,8,10-12 Algunos indicadores, como la circunferencia de la cintura y la sensibilidad a la insulina, también han mostrado una curva en forma de "U" con relación al peso al nacer. La importancia de estos hallazgos radica en que la hiperinsulinemia precede al desarrollo de otros factores de riesgo cardiovascular.13
En niños con peso normal al nacer, la ganancia de peso durante los primeros 6 años de vida constituye un factor de riesgo importante para la obesidad, sobre todo cuando se produce durante los primeros años del periodo preescolar.14 Recién nacidos macrosómicos (niños grandes para la edad gestacional, RNGEG),15 tienen mayor riesgo de desarrollar obesidad durante en edad escolar.
Las alteraciones del crecimiento intrauterino y postnatal temprano (períodos críticos del desarrollo humano), pueden tener a largo plazo implicaciones para la salud posterior.16 La malnutrición por defecto en la vida intrauterina aumenta también el riesgo de enfermedades crónicas de la vida adulta. La programación durante el desarrollo y un medio ambiente prenatal desfavorable desencadenan adaptaciones que mejoran ciertamente la supervivencia fetal.17 Los mecanismos de la programación incluyen cambios epigenéticos en la regulación de los genes, del ciclo celular y en la diferenciación celular o tisular.18
El concepto de programación fetal implica a repercusiones en el desarrollo postnatal y a lo largo de toda la vida de los cambios registrados en la dieta durante el embarazo. El término surgió de estudios en descendientes de los individuos afectados por la hambruna holandesa durante la Segunda Guerra Mundial y de estudios en neonatos en la India.19 Las restricciones en la dieta materna provocaron que los niños nacieran con bajo peso. Décadas después, en su adultez, se elevó en ellos la incidencia de diabetes, obesidad, hipertensión y afecciones cardíacas, en comparación con la observada en hijos de la población que no sufrió hambre. En ratas, el comienzo de la gestación es el momento más vulnerable del feto a un déficit alimentario, sus consecuencias se imprimen en los genes y predisponen a enfermedades a largo plazo.20,21
La teoría de que los individuos que pueden experimentar desnutrición fetal suelen estar programados para almacenar nutrientes, se originó hace más de veinte años.22 La atractiva hipótesis de David Barker,23 sobre el origen fetal de las enfermedades crónicas propone que una inadecuada nutrición del embrión, desde la mitad hasta el final del embarazo, conduce a un crecimiento fetal desproporcionado, el cual "programa" desde entonces, la posibilidad de eventos de la adultez. Este enunciado tiene dos interesantes premisas: La primera establece que en el período fetal, desde la novena semana de la concepción hasta el final del embarazo, comienza en el feto la fase de crecimiento rápido tisular (CRT), que continúa incluso después del nacimiento. El promotor fundamental de este crecimiento lo constituye la división celular (DC) y diferentes tejidos del organismo tienen la característica de crecer en períodos llamados "críticos", donde la DC es muy apresurada, dependiendo ésta, sin dudas, de las demandas de nutrientes y oxígeno, así como de la adaptación del feto a sus carencias. En fetos mal nutridos, tiene lugar un retardo de la DC, y por consiguiente una reducción del número de células en los tejidos que experimentan un CRT, lo que constituiría un negativo "recuerdo genético de memoria" (RGM).
La segunda premisa establece que esta inadecuada nutrición embrionaria, sería la causa de cambios en la distribución y funciones de diferentes células, lo que se traduciría en alteraciones persistentes, tanto de la secreción hormonal y actividad metabólica, como de estructura y función de diversos órganos corporales, que permanecen latentes en memoria corporal, casi desde la implantación del huevo, con una posibilidad elevada de tornarse patológicas hacia edades puberales o adultas. 24
Una madre mal nutrida, que no acumula los nutrientes necesarios, en cantidad y calidad, es más probable que genere un niño bajo peso. Contrariamente a lo que se puede suponer, un recién nacido con bajo peso al nacer es más propenso a desarrollar obesidad, diabetes e hipertensión en la vida adulta. Todas las agresiones que sufre el feto en la etapa intrauterina o el recién nacido pueden producir alteraciones a nivel epigenético que no se manifiestan de inmediato, sino que quedan latentes hasta que se presenten condiciones adecuadas, o se acceda a nutrientes de alto valor calórico.25
El tamaño del recién nacido y las tasas de progresión postnatales son determinantes importantes de supervivencia perinatal humana, influenciados por factores genéticos, ambientales y de la placenta de la madre. Ellos también pueden predecir el tiempo de crecimiento, altura del adulto, además de asociarse a diferentes situaciones clínicas como son: asociación del hipocrecimiento prenatal con insulinorresistencia y síndrome de insulinorresistencia, con o sin la presencia en la mujer premenárquica de poliquistosis ovárica, obesidad, diabetes mellitus tipo 2, daño renal, elevación de la LDL-c y Apo B en el plasma, hipertensión arterial y enfermedad cardiovascular. La desnutrición fetal en la etapa media de gestación es capaz de predisponer particularmente a la obesidad central y a sus cambios metabólicos asociados. 19
Los niveles de leptina en el cordón umbilical y en el plasma de niños con bajo peso al nacer están reducidos., En estudios con animales se ha postulado, que los niveles perinatales de leptina modifican la sensibilidad hipotalámica a esta hormona y que la programación de los circuitos hipotalámicos orexigénicos ocurre en la vida intrauterina y en la etapa postnatal temprana. 26
Una falta relativa de sensibilidad a la leptina podría ser responsable de la ganancia rápida ("catch-up") de peso que presenta una gran parte de estos niños en la vida posnatal y que también se ha observado en otras especies y parece corresponder a una respuesta para aumentar las posibilidades de supervivencia y reproducción cuando las fuentes externas son limitadas, aún a costa de una disminución de la duración de la vida.27
En países en desarrollo, son frecuentes el retraso del crecimiento intrauterino y la baja talla durante la infancia debidos a malnutrición temprana, combinados con la facilidad para ser vulnerados por sobrealimentación en etapas posteriores de la vida. Esto jerarquiza la relación entre el peso al nacer y la velocidad de ganancia de peso posterior y las acciones dirigidas a optimizarla.28,29 Por esta razón, en materia de salud pública es necesario prevenir la excesiva ganancia de peso desde las etapas precoces de la vida, poniendo también la atención en los nacidos con bajo peso.30
En los países en transición nutricional, la combinación de bajo peso en niños recién nacidos con exceso de peso en edades ulteriores, aún en la misma familia, sugiere la existencia de factores ambientales que participan de ambos fenómenos. Una alimentación pobre en nutrientes y rica en energía, tiene un efecto desigual en niños y en adultos, como consecuencia de las diferencias en el contexto biológico que cada uno transita. La necesidad de hierro de un niño, por ejemplo, quintuplica a la del adulto, razón por la cual los alimentos pobres en nutrientes pueden afectar el crecimiento de los primeros, pero proveer a los segundos la energía suficiente como para conducir a una acumulación de grasa excesiva.31
En Latinoamérica es notable la asociación entre sedentarismo y alimentación hipercalórica, con impacto particular sobre la incidencia de sobrepeso corporal y obesidad, especialmente en la infancia.32 El crecimiento y desarrollo socioeconómico, aparejado a la industrialización, estimularon y facilitaron la urbanización y la migración desde el campo hacia ciudades, produciendo la ruralización de las ciudades y el aumento de las limitaciones para satisfacer necesidades básicas. De la actividad física típica del trabajo rural, se transitó a la vida sedentaria de ciudades y al notable cambio en hábitos alimentarios.33
Estudios epidemiológicos previos han identificado factores de etapas tempranas de la vida que favorecen el desarrollo de obesidad en niños, como peso materno, diabetes gestacional, peso al nacer, alimentaciones con fórmulas diferentes de la leche materna, introducción temprana de alimentos sólidos 34 y patrones de ganancia de peso acelerada en los primeros meses de la vida, 35 hábito de fumar materno durante la gestación, 36 bajo nivel educacional de los padres,37, elevado peso al nacer,38 obesidad familiar 39 y elevado tiempo frente a la televisión y en juegos electrónicos,40 mientras que un adecuado nivel de actividad física 41 y la lactancia materna 42 han sido informados como aparentemente protectores.
La identificación de factores de riesgo es clave en la prevención. Este estudio de casos y controles en niños con sobrepeso corporal de Bayamo se ha propuesto identificar factores relacionados con el crecimiento fetal y durante el primer año de vida y su relación con el desarrollo de la obesidad en la edad escolar.
MÉTODOS
Se realizó un estudio observacional, retrospectivo, analítico, de casos y controles. La población objeto de estudio estuvo constituida por escolares entre 6 y 11 años de edad en el período de 2007 y 2008 de los de los Grupos Básicos de Trabajo (GBT) de Bayamo, provincia Granma. Se informó a madres, padres o personas a cargo sobre los objetivos del estudio y los resultados esperados. Se solicitó el consentimiento escrito y se mantuvo confidencialidad de la información.
Los escolares estudiados, se seleccionaron y subdividieron en dos subpoblaciones según dispensarización utilizando criterios los siguientes criterios:
- Escolares con sobrepeso (valor estandarizado de Índice Peso/Talla (P/T) según sexo mayor de 1 desviación estándar (ds) por encima de la media de referencia del CDC/2000.43
- Escolares con peso normal (-1 a + 1 ds de valor estandarizado P/T según sexo de acuerdo a datos de referencia de la población de referencia del CDC/ 2000).43
Inicialmente se seleccionaron los sobrepeso (casos) y se hizo una selección de un grupo control en proporción 1:1, de aquellos con un peso corporal normal, historia de no afecciones de salud, homogéneos en edad, sexo, zona de residencia y nacidos de madres con edad gestacional de 37-42 semanas.
Se realizaron mediciones antropométricas de peso corporal, estatura, circunferencia de la cintura, circunferencia de la cadera, 44,45 y circunferencia del brazo según las normas del Programa Biológico Internacional (PBI) (Weiner y Lourie, 1969)44 Se calcularon los valores del Puntaje Z de: Peso para la Edad (P/E), Talla para la Edad (T/E), Índice de Masa Corporal (IMC) e Índice Cintura/Cadera (IC/C). Los valores del P/E, T/E, P/T e IMC para los niños del estudio se compararon para su evaluación con los valores específicos para edad y sexo de las tablas de referencia desarrolladas por el CDC en el año 2000.43. Valores superiores a las 2ds en la tabla de referencia fueron clasificados como obesos.
La ganancia de peso durante el embarazo para gestantes de diferente IMC al inicio del embarazo fue evaluada utilizando las recomendaciones establecidas por el Instituto de Medicina de los Estados Unidos (IOM) en el año 1990.46 Las embarazadas con bajo peso, peso normal, sobrepeso u obesidad al inicio del embarazo, deberían aumentar 12,5-18,0; 11,5-16,0; 7,0-11,5 y 6,0-7,0 Kg durante el embarazo, respectivamente.
Las variables cuantitativas relacionadas con el crecimiento de la etapa prenatal, que comprendieron peso al nacer (≥ 2500g), longitud supina al nacer (≥48 cm), circunferencia cefálica al nacer (≥ 32), e Índice de Masa Corporal (IMC) al inicio o final del embarazo (≥ 26,1) y ganancia de peso durante el embarazo (IOM 46) fueron dicotomizadas con los puntos de corte referidos. El hábito de fumar en la madre y enfermedades asociadas al embarazo (anemia, hipertensión arterial, diabetes mellitus infección del tracto urinario y sepsis vaginal) fueron categorizadas.
Las variables relacionadas con crecimiento en primer año de vida: peso a los 4 meses de edad, peso al año de edad, ganancia de peso entre el nacimiento y los 4 meses, entre los 4 meses y el primer año y entre el nacimiento y el primer año se evaluaron en su nivel de medición cuantitativo continuo para emprender el análisis multivariante. Se realizaron comparaciones de medias mediante la prueba t de Student para grupos independientes en las variables cuantitativas. Se identificó y estimó el grado de correlación entre variables cuantitativas. En las variables que mostraron correlación y tuvieron nivel de medición cuantitativo, se estimó el riesgo asociado como Odd Ratios (OR) (razón de disparidad). Mediante clasificación multivariante se explicó la presencia o ausencia de la obesidad en la niñez a partir del conjunto de variables predictoras considerado. Todo el procesamiento estadístico se realizó con el paquete estadístico EXCEL y SPSS versión 11.5.
RESULTADOS
Las tablas 1A y 1B muestran los resultados de las mediciones antropométricas de niñas y varones sobrepeso en comparación con aquellos que fueron normopeso. Las niñas con sobrepeso con una estatura discretamente superior (1,5 cm), tuvieron como promedio 15 kg más de peso corporal, 17,7 cm más de cintura, 13 cm más de circunferencia de cadera, 5 cm más de circunferencia del brazo y un valor medio del Índice de Masa Corporal que fue 8,1 unidades superior al registrado en las niñas escolares que se incluyeron como controles en este estudio.
Los varones sobrepeso, con una estatura discretamente superior (0.7 cm), fueron como promedio 13.6 kg más pesados, tuvieron 13 cm más de circunferencia de cadera, 17 cm más de cintura, 6 cm mas de circunferencia del brazo y un valor del Índice de Masa Corporal 7.5 unidades superior al de los varones normopeso.
Los escolares fueron similares en edad (8,78 años) y estatura (132 cm), sin embargo, los escolares con sobrepeso tuvieron significativamente más peso corporal y un puntaje Z para el peso corporal y el índice de Masa Corporal (2,10 vs 0,10) que fue significativamente más elevado.
Las dimensiones corporales al nacer se muestran en la tabla 2. Los escolares con sobrepeso corporal fueron en el momento del nacimiento significativamente más ligeros pequeños, y con una menor circunferencia cefálica. (p=0.000)
La ganancia de peso durante el embarazo también mostró valores significativamente inferiores (p=0.002) en las madres de niños que después fueron sobrepeso en la edad escolar. (tabla 3)
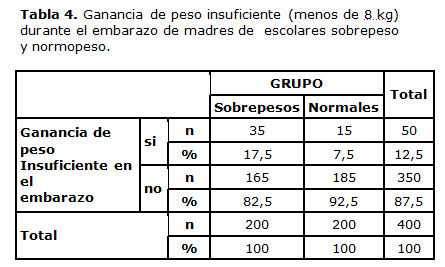
Cuando se utilizó el criterio anterior vigente en Cuba hasta 20111 para la vigilancia nutricional de 8 kg de ganancia de peso en el embarazo para todas las madres (tabla 4), más del doble de los escolares con sobrepeso provenía de madres que tuvieron una ganancia de peso insuficiente durante su embarazo (X²=9.143 p=0.002).
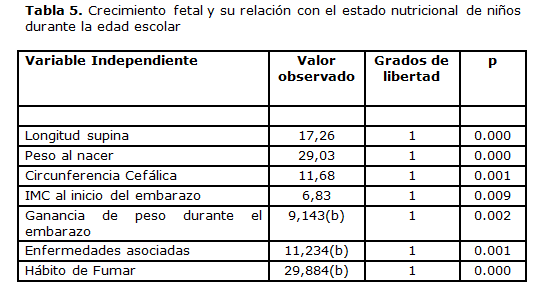
Al establecer la asociación entre los factores relacionados con el crecimiento fetal y el estado nutricional actual de los niños en estudio se encontró significación estadística en la relación o asociación de la evaluación nutricional con el peso al nacer, la longitud supina, la circunferencia cefálica, el IMC de la madre al inicio del embarazo, la ganancia de peso durante el embarazo, la enfermedades asociadas al mismo y el hábito de fumar. (tabla 5)
El 83 % de los niños incluidos en este estudio tuvo un peso igual o superior a 2500 gramos, considerado como peso adecuado al nacer. Sin embargo, la gran mayoría de los niños y niñas con bajo peso al nacer, 54 de 67 (27 %), se encontró en el grupo de los que se convirtieron en sobrepeso en la edad escolar (Figura). Nacer con menos de 2500 gramos representó para esos niños un riesgo 5.32 veces superior de convertirse en sobrepeso en esa edad. (tabla 6)
Cuando se subdividió esta variable en tres categorías, de forma general, predominaron los niños nacidos con más de 3000 gramos (42,8 %), pero al compararlo por grupos, la mayoría de los escolares sobrepeso (71 %) nació con un peso corporal inferior a 3000 gramos, mientras que solo menos de la mitad (43,5 %) de los escolares normopeso se ubicó en esa categoría. Un análisis de tendencia lineal considerando 3000g y más al nacimiento como nivel base muestra el crecimiento del riesgo de forma significativa con el progresivo descenso del peso al nacer.
Casi la totalidad de los niños estudiados (92 %) presentó una longitud supina mayor de 47 cm, sin embargo la mayor cantidad de valores inferiores a 48 cm se encontró en los escolares pertenecientes al grupo con sobrepeso corporal (13,5 vs. 2,5 %). Para este grupo, nacer con una longitud supina inferior a 48 cm representó un riesgo ulterior de sobrepeso 6.08 veces mayor. (tabla 6)
El 94,5 % de los escolares estudiados tuvo una circunferencia cefálica de 32 cm y más (tabla 6). Los valores inferiores a este fueron más frecuentes en los escolares sobrepeso (9,5 %) que en los normopeso (1,5 %). Nacer con una circunferencia cefálica inferior a 32 cm representó un riesgo 8,7 veces mayor de sobrepeso.
El estado nutricional materno también estuvo fuertemente asociado al desarrollo ulterior de sobrepeso escolar. Casi tres veces más frecuente fue el bajo peso corporal en las madres de escolares sobrepeso durante el embarazo de éstos, que en las madres de niños con peso corporal normal en la edad escolar. Haber nacido de una madre que ganó menos de 8 kg durante el embarazo, representó para ello un riesgo 2,61 veces mayor de sobrepeso posterior.
La utilización de LME hasta los 4 meses de edad mostró valores manifiestamente bajos en todos los niños estudiados (13,5 %), los cuales fueron más manifiestamente bajos en los niños que posteriormente tuvieron sobrepeso (9,5 vs. 17,5 %). La ausencia de lactancia materna mostró una aparente no asociación con la obesidad en la edad escolar, porque tanto en escolares sobrepeso como en normales, no se practicó este hábito (90 y 82 %, respectivamente). (tabla 6)
El hábito de fumar en la madre durante la gestación también se asoció con el crecimiento fetal. El 65 % de las madres no practicaban este hábito. Sin embargo su frecuencia durante el embarazo fue 5 veces superior en madres de niños que después fueron sobrepeso. Fumar durante el embarazo elevó 4,21 veces este riesgo. (tabla 6)
La presencia de enfermedades, como anemia, hipertensión y diabetes gestacional durante el embarazo fue dos veces mas frecuente en madres de niños sobrepeso con un riesgo 3,48 veces superior para el desarrollo de esta afección ulterior. (tabla 6)
Casi uno de cada tres de los 400 niños estudiados (29 %) mostró una ganancia de peso excesiva (mas de 8,5 kg) durante el primer año de vida. Sin embargo, los niños que resultaron sobrepeso en la edad escolar mostraron en una mayor proporción (41 vs. 17 %) motivo por el cual mostrar esta ganancia excesiva durante este tiempo representó para ellos desde la infancia precoz, un riesgo de sobrepeso posterior 3,23 veces superior. Sin embargo, esta ganancia en los 4 primeros meses de vida tuvo un efecto determinante sobre el valor total del primer año. Una cuarta parte de todos los niños estudiados ganó peso de forma excesiva durante este tiempo, efecto que también fue significativamente mas marcado en escolares sobrepeso (39 %), que en normopeso (12,5 %) y generó, desde esa temprana edad un riesgo 4,47 veces mayor de sobrepeso. (tabla 6)
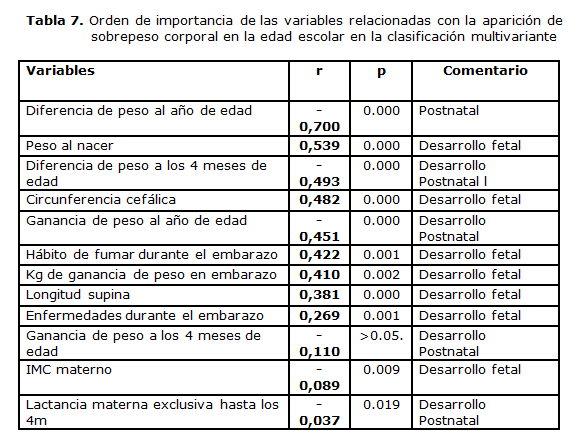
La tabla 7 muestra, entonces, el orden de importancia de las variables en la función multivariada discriminante, en la cual, el crecimiento acelerado en el primer año de vida, el peso al nacer y las dimensiones corporales marcan la pauta del estado nutricional posterior. En orden decreciente de importancia, pero también guardando alta significación en la ecuación multivariante, el hábito de fumar, connotado factor de riesgo del bajo peso, aparece a continuación así como la ganancia de peso en kg de la madre y las enfermedades asociadas en el embarazo.
Estos elementos permiten un análisis de la cadena causal que parece determinar el sobrepeso corporal. Así, factores de riesgo presentes desde la gestación, que incluyen hábitos tóxicos y algunas enfermedades en la madre y factores del desarrollo fetal que preconizan la aparición de bajo peso al nacer, anteceden este proceso. Una vez el fruto de la concepción resulta un bajo peso, algunos factores (que no fueron estudiados en este trabajo, pero que puede intuirse se deban a favorecimiento de la carga genética de los más susceptibles o actitudes y prácticas reactivas a la presencia del bebe bajo peso en el medio familiar, pudieran condicionar la introducción de hábitos alimentarios incorrectos que conducen a una elevada ganancia de peso en el período desde el nacimiento hasta los cuatro meses, y al año.
DISCUSIÓN
La prevalencia de sobrepeso en la población infantil de 6 a 11 años estudiada fue elevada y similar cifras expuestas por otros estudios, 47-49 entidad vinculada a patologías como hipertensión arterial, diabetes mellitus, enfermedad cardiovascular, cerebrovascular o cáncer, principales responsables de la morbimortalidad en nuestro país, países desarrollados y muchos en vías de desarrollo.
La vida fetal e infancia temprana, el período de rebote adiposo entre los 5 y 7 años de edad y la adolescencia son períodos críticos para el desarrollo de la obesidad, que ofrecen oportunidades para su prevención. Los factores prenatales y de la infancia temprana en el desarrollo de la obesidad posterior han conformado la hipótesis del "origen fetal de la obesidad",50 la cual constituye en la actualidad un aspecto central en la etiología de esta afección, de la intolerancia a la glucosa y la génesis de diversas enfermedades crónicas.
Los hallazgos son, sin embargo, contradictorios en ocasiones. Algunos estudios informan, sin embargo, sobre una prevalencia elevada de obesidad en individuos que tuvieron, tanto bajo como elevado peso al nacer, 51- 52 lo que sugiriere que la asociación entre el crecimiento en el útero y la obesidad es compleja.
Los escolares con sobrepeso corporal estudiados en Bayamo tuvieron un crecimiento fetal muy inferior al de los normopeso, el cual se puso de manifiesto por valores reducidos de peso al nacer, longitud supina y circunferencia cefálica, con respecto al de escolares controles con un peso corporal normal. Estos escolares con sobrepeso, contrariamente a los que tenían un peso corporal normal, provenían de madres que arribaron al embarazo con un estado nutricional mas afectado, que presentaron una ganancia de peso durante la gestación mas manifiestamente reducida, que estuvieron más afectadas por anemia, hipertensión y diabetes gestacional y que adicionalmente fumaron mas durante el embarazo.
La asociación de pequeñas dimensiones al nacer con obesidad central o troncular posterior han sido regularmente informada.53-55 La circunferencia de la cintura y el índice cintura /cadera se han utilizado como marcadores indirectos del tejido adiposo intrabdominal.56
Sin embargo, aunque el patrón de grasa no queda definitivamente establecido hasta haberse completado la maduración sexual del individuo, se ha observado una mayor frecuencia en la asociación de hiperlipidemias, hipertensión arterial e intolerancia a la glucosa en adolescentes obesos con distribución androide de la grasa, en la cual la relación entre la circunferencia de la cintura y de la cadera, muestra un cociente elevado. 57
Las cifras elevadas de grasa abdominal (circunferencia de cintura y cadera) de los escolares con sobrepeso de Bayamo (tablas 1A y 1B) , fueron similares a los informados por Cabrera Hernández et al en La Habana en 1996, los cuales estuvieron asociados con los niveles séricos de colesterol total y colesterol LDL.58 En niños costarricenses,59 nicaraguenses60 y peruanos,61 se han observado resultados semejantes.
Alto peso al nacer también se asocia con alto IMC en la niñez y vida posterior, pero esta asociación es mayor con la masa magra que con la grasa. El BPN, contrariamente, se asocia con una ulterior proporción más elevada de grasa central e insulino resistencia. Este paradójico efecto de los pesos bajos al nacer ha sido explicado por el hecho de que niños con crecimiento intrauterino restringido, tienden a crecer más velozmente y depositar mas grasa central durante el período postnatal.62
Los mecanismos moleculares de este vínculo etiológico se encuentran aun en debate.50,63 Dos principales hipótesis han sido expresadas: la programación y la hipótesis de la insulina fetal. La hipótesis de la programación propone que alteraciones en la nutrición fetal y el estatus endocrino resultan en adaptaciones que cambian permanentemente la estructura, la fisiología y el metabolismo, predisponiendo a los individuos a enfermedades cardiovasculares, metabólicas y endocrinas.64
El grupo de David Barker de la Universidad de Southhampton en Inglaterra 65,66 propuso, desde la década del 90 del siglo pasado, la hipótesis del "fenotipo ahorrador". La restricción materna de nutrientes antes o inmediatamente después de la concepción determina la salud en el feto y su vida posterior. El estudio del "invierno hambriento holandés" mostró que cinco meses de malnutrición en mujeres embarazadas en Ámsterdam durante 1944-1945 tuvieron una influencia determinante en la prevalencia de sobrepeso corporal y enfermedad coronaria de sus hijos en su adultez.67-69 Hallazgos similares han sido informados en diversos estudios epidemiológicos.70,71
Niños hindúes nacidos de madres más "pequeñas" y jóvenes que madres inglesas, tienen vísceras abdominales más pequeñas y poca masa muscular, pero preservan la grasa corporal desde su desarrollo intrauterino. Esta condición reconocida como el "fenotipo ahorrador hindú" persiste y condiciona el desarrollo ulterior de obesidad e intolerancia a la glucosa. 72-75 Estudios similares realizados en otras locaciones también muestran que niños nacidos con peso, longitud y circunferencia cefálica reducidos tienen mayor tendencia al desarrollo posterior de obesidad.76
La programación fetal del eje Hormona de crecimiento-Factor insulínico de crecimiento (GH-IGF siglas en inglés) es un posible vínculo entre el crecimiento fetal y el desarrollo posterior de enfermedades crónicas. Individuos nacidos de crecimiento uterino retardado (CIUR) muestran alteraciones del eje GH-IGF en asociación con enfermedades cardiovasculares, diabetes tipo 2 y obesidad posteriormente.77, 78 Variantes de genes moduladores de la secreción de insulina, pueden contribuir a un crecimiento fetal dañado y posterior desarrollo de sobrepeso corporal y obesidad.79
El estado nutricional materno, la función placentaria y la capacidad del feto para utilizar los nutrientes son determinantes del crecimiento y desarrollo fetal. 80 En este estudio de niñas y niños bayameses, la ganancia de peso insuficiente en el embarazo y la presencia de enfermedades asociadas durante el embarazo como la anemia, hipertensión arterial, diabetes mellitus, infección del tracto urinario y sepsis vaginal se asociaron muy significativamente con la presencia de sobrepeso corporal y obesidad en la edad escolar.
Un trabajo realizado en Buenos Aires mostró que el peso materno, evaluado tanto en la primera como en la última consulta prenatal, se asoció de forma significativa con el CIUR y la prematuridad; el peso neonatal es un sensible indicador del estado nutricional materno, siendo por ello el más estudiado en la estratificación de poblaciones con relación a la tasa de desnutrición materno fetal. 81
En el Policlínico Comunitario Docente "Carlos J. Finlay" de Camagüey, se desarrolló un estudio sobre los efectos del bajo peso materno preconcepcionales sobre el embarazo y el parto. En éste, la malnutrición materna por defecto, presente en el 88.9 % de los sujetos objeto de estudio y en el 46.2 % del grupo de comparación, mostró una fuerte asociación estadística con el bajo peso al nacer (RR=8.654; P≤0.0097; IC 95 %; 1.14-65.83). 82
En ratas,83 cobayos84 u ovejas85 se ha confirmado que cambios en la nutrición materna, modifican el tamaño al nacer de sus productos, además de alterar (programar) aspectos de su fisiología. Las anomalías provocadas por la influencia nutricional dependen del periodo en el que la madre es privada de una alimentación adecuada. La investigación animal ha confirmado los hallazgos clínicos y epidemiológicos. Las crías de ratas86 u ovejas, 87 provenientes de madres con dietas isocalóricas y bajas en proteínas durante todo el embarazo, o en diferentes periodos de la gestación, desarrollan hipertensión e intolerancia a la glucosa en la vida adulta.
En la primera mitad del embarazo, la placenta crece más rápido que el feto, de tal forma que la deficiencia de nutrientes afecta el crecimiento fetal por la interacción feto-placenta. La desnutrición materna severa restringe el crecimiento fetal y placentario; sin embargo, una desnutrición moderada origina un crecimiento normal de la placenta, más no del feto.87-89 La desnutrición al final del embarazo puede ocasionar una desaceleración del crecimiento fetal y alterar la interacción metabólica entre el feto y la placenta. Una vez más, el crecimiento fetal se sacrifica para mantener la función placentaria, motivo por el cual se han informado también asociaciones positivas entre la dimensión de la placenta y el desarrollo de obesidad y enfermedades crónicas en la adultez. El desarrollo placentario y fetal está fuertemente influenciado por mecanismos epigenéticos, que alteran la expresión de genes a largo plazo, sin afectar la secuencia del ADN. La diferenciación celular y el desarrollo embrionario y fetal, son procesos regulados por múltiples mecanismos epigenéticos, tales como la modificación de la cromatina e histonas, la existencia de ARN no codificante y la metilación del ADN. Este último mecanismo es importante, ya que determina la expresión de los llamados "genes improntados" (en inglés, imprinted genes). Éstos pueden considerarse como genes cuya expresión depende de su origen parental, es decir, si provienen del padre (genes paternos) o la madre (genes maternos). El mecanismo de metilación del ADN actúa "silenciando" uno de los genes (materno o paterno) mediante la inserción de un grupo metilo en nucleótidos de citosina acompañados de guanosina, en las denominadas islas de CpG. Estas islas se encuentran presentes en las regiones promotoras del gen en cuestión. En la placenta, la expresión de genes que favorecen el crecimiento fetal, por ejemplo el gen codificante para el factor de crecimiento similar a la insulina tipo 2 (IGF-2, sigla en inglés) o los transportadores de aminoácidos, son de origen paterno. Por el contrario, aquellos genes que restringen el crecimiento fetal, por ejemplo el gen que codifica para el receptor soluble de IGF-2 (IGF-2R), son de origen materno.89
Múltiples enfermedades del embarazo, en las que existen alteraciones en el crecimiento fetal, están relacionadas con mutaciones en las regiones promotoras de estos genes, que cambian su patrón de expresión. Existe evidencia reciente de que los factores nutricionales interactúan con los estímulos ambientales en el control epigenético de los genes improntados.
Los estudios en sobrevivientes de la hambruna de Holanda,68 impuesta por la Alemania Nazi durante los últimos meses de la Segunda Guerra Mundial, revelaron que la restricción calórica durante el periodo perinatal tuvo un efecto demostrable en la metilación del gen de la IGF-2; en forma contrastante, aquellas personas que sufrieron la hambruna al fin de la gestación no tuvieron sus genes improntados.90 Estos estudios contrastan con la visión del "determinismo genético", ya que reivindican la influencia del ambiente sobre el fenotipo; los genes no determinan el "destino" por sí solos, sino que son un "mapa" que permite llegar a más de un destino. El fenotipo no esta predeterminado únicamente por los genes, sino que también depende del ambiente, incluida la nutrición.
En este proceso es determinante la placenta como órgano regulador del bienestar fetal; así la placenta sufre alteraciones anatómicas y/o funcionales, que redundan en alteraciones del desarrollo y madurez fetal. Entre los factores determinantes que pueden dar cuenta de esta anormalidad placentaria, se encuentran los mecanismos epigenéticos,90 la disfunción endotelial,91,92 las alteraciones en la invasividad del trofoblasto,93 el estrés oxidativo y la alteración del equilibrio de la actividad de las sintasas de NO y las arginasas. 94
Una desnutrición aguda ocasiona un retraso en el crecimiento fetal, vinculado con el catabolismo fetal pero, en cuanto se reanuda la ingestión adecuada, el crecimiento se reinicia. En contraste, los periodos prolongados de desnutrición pueden detener de forma irreversible el crecimiento fetal hasta el nacimiento.88
Un estudio japonés reciente ha evidenciado que la restricción alimentaria durante el embarazo genera la producción prematura de leptina, crecimiento rápido neonatal en los descendientes y alterada sensibilidad a la leptina y obesidad posterior como consecuencias.95
La obesidad materna también se asocia con obesidad en la descendencia, 96-98 pero el enfoque para interpretación de las asociaciones es algo diferente. Se le adjudican aquí importancia a los genes que confieren susceptibilidad a la obesidad, los efectos de la obesidad materna en el ambiente intrauterino y el rol materno en el ambiente postnatal en los hábitos de alimentación y actividad física.99
La ganancia ponderal materna durante la gestación es un indicador de la cantidad de nutrientes que se le proporciona al feto para su desarrollo. El promedio de la ganancia ponderal materna durante la gestación difiere según la población de estudio, encontrándose diferencia entre los países desarrollados y los países en vías de desarrollo; así Durnin en un estudio realizado en cinco países ha informado que el promedio de ganancia ponderal en Escocia fue de 11.7 kg y de 10.5 kg en los Países Bajos comparados con la ganancia de peso de 8.9 kg en Tailandia, 8.5 kg en Filipinas y 7.3 kg en Gambia. La OMS informa un promedio de ganancia ponderal de 10.5 a 13.5kg para los países desarrollados y de 5-9 kg para los países en desarrollo. En una zona rural de Costa Rica, Sandra Murillo, Ulate E y Mata L, encontraron un promedio de 7,9 kg, mientras que Contreras et al en el 2000, informan sobre un promedio de 9,87 kg en una población de gestantes de 20 a 30 años del Hospital Nacional Arzobispo Loayza de San José. En Lima, Perú, Cabrera establece una relación lineal positiva entre la ganancia ponderal de la madre durante la gestación y el peso del recién nacido, estableciéndose que el peso al nacer aumenta en 32.75 grs por cada kg en la ganancia de peso durante la gestación; mientras Johnson y col., Abrams y Laros y Anderson y col. informan un incremento en el peso del recién nacido de 15,4, 20,1 y 21,7 g, respectivamente, al aumentar un kg en la ganancia ponderal materna durante la gestación. 100
Numerosos estudios dan cuenta de alteraciones en las diferentes funciones de la placenta presentes en enfermedades del embarazo, poniendo de manifiesto el papel clave que tiene este órgano durante el desarrollo. 89,101 La preeclampsia, la diabetes gestacional y la restricción de crecimiento intrauterino, están asociadas a cambios estructurales y funcionales en la placenta102, los cuales dan cuenta de los problemas en el desarrollo fetal característicos de estas patologías.
La hipertensión arterial, es la causa más frecuente de parto pretérmino y BPN después del embarazo múltiple. La preclampsia (PE) durante el embarazo comporta un aumento importante de la morbimortalidad perinatal asociándose con mayor incidencia de sufrimiento fetal intraparto y CIUR (18,8 % en la PE leve y 37 % en la grave). 103-104 Los hijos de madres diabéticas presentan macrosomía atribuible en parte a los elevados niveles de insulina fetal. Sin embargo, a pesar de presentarse un mayor crecimiento en útero, el aumento en el metabolismo, inducido por esta hormona, eleva el consumo de oxígeno, exponiendo al feto a hipoxia. 105 El déficit de hierro en la gestación determina prematuridad, BPN y aumento de la mortalidad perinatal.104 Todas las afecciones anteriormente señaladas fueron significativamente más frecuentes durante el embarazo de las madres de los escolares con sobrepeso corporal.
El 50 % de las madres de los niños bayameses obesos de esta investigación fumaba y el hecho de fumar durante la gestación condicionó un riesgo para ellos, 4,21 veces superior de desarrollar obesidad en la edad escolar. Estos resultados son consistentes con regulares informes de la bibliografía internacional.105-109
Este estudio en Bayamo muestra también que un patrón de ganancia acelerada de peso en el primer año de edad estuvo asociado con la obesidad en la edad escolar. Estudios previos han vinculado la rápida ganancia de peso en la infancia temprana con el sobrepeso corporal en la niñez. 110-113 Este período representa la mayor ganancia proporcional de peso en el ciclo de la vida postnatal, por tanto puede corresponder a un período crítico para el desarrollo de sobrepeso corporal y obesidad y de los mecanismos de regulación del balance de la energía. 114 Esta proporción variable en el crecimiento a menudo compensa un crecimiento fetal intrauterino restringido o intensificado. El catch up es una propiedad del crecimiento humano donde el niño retorna a su trayectoria genética de crecimiento, después de un período en que este fue dañado. 115-116
En un estudio realizado en Inglaterra, niños nacidos pequeños para la edad gestacional, quienes mostraron un catch up en el peso o en la talla, fueron más pesados o más altos que otros niños a los cinco años, nacidos con tamaño normal, además tuvieron mayor IMC, porcentaje de grasa corporal, masa grasa total y distribución de grasa central.110
En un gran grupo de niños norteamericanos, los investigadores del Hospital Infantil de Filadelfia y del Colegio de Medicina de la Universidad de Pensilvania encontraron, que la rápida ganancia de peso durante los primeros cuatro meses de vida estaba significativamente asociada con un riesgo incrementado de estar excedido de peso a los siete años de edad. 117
Una investigación reciente en Chile, sobre el incremento de peso promedio durante los primeros 12 meses de vida refleja una mayor prevalencia de niños(as) con exceso de peso que la esperada por la referencia del CDC-OMS, con un 20 % de sobrepeso y 9 % de obesidad al cumplir el año, con incrementos de la ganancia de peso a partir del primer mes de vida, alcanzando los valores máximos entre 3 y 6 meses. 118
Un catch up del crecimiento asociado a crecimiento fetal restringido puede desarrollar a largo plazo complicaciones metabólicas. 119,120 Cómo los infantes, quienes tuvieron un crecimiento intrauterino restringido, presentan un catch up postnatalmente no es totalmente conocido, aunque ha sido observada una mayor ingestión de alimentos comparada con otros infantes.121 La leptina en sangre del cordón umbilical se asocia positivamente con el índice ponderal al nacer, pero inversamente con la ganancia de peso en la infancia. 122 Estudios en primates 123 no confirmaron la hipótesis inicial propuesta en la década de los 70 de la hiperplasia de los adipocitos sugerida por estudios en roedores.124 Más recientemente, algunos estudios han mostrado cambios a lo largo de la vida en los centros reguladores del apetito y en la secreción de insulina de ratas sobrealimentadas por cortos períodos después del nacimiento.125
La proporción de madres de niños bayameses obesos que lactaron a sus hijos fue significativamente menor que la de normopesos. La nutrición adecuada durante la infancia y la niñez temprana resulta fundamental para el normal desarrollo del potencial del niño,126 razón por la cual la lactancia se ha propuesto como un factor fundamental para el adecuado formateo del sistema alimentario y de sus efectores metabólicos. Sin embargo, esta afirmación no es clara para el caso de la obesidad. Algunos autores 127 destacan el efecto protector de la lactancia materna; otros, en cambio, lo niegan128 o afirman que produce hasta un efecto contrario.129 En este sentido, ciertos estudios señalan una asociación significativa entre la alimentación con leche materna y la existencia de menores concentraciones de leptina (a igual masa grasa) en adolescentes, estableciéndose así un vínculo entre la calidad de la nutrición temprana y la obesidad en la adultez. 130
Los sucedáneos de la LME han sido asociados con una más rápida ganancia de peso y con un incrementado riesgo de obesidad en la niñez y la adolescencia.131 Un patrón de rápida ganancia de peso durante la infancia puede ser una expresión temprana de una predisposición genética a un excesivo peso más que a un vínculo causal.
Estudios en ratas132 muestran que la exposición en útero, a una restricción materna de alimentos, resulta en descendientes con reducido peso corporal, leptina plasmática disminuida e incremento de grelina plasmática el primer día de edad. Pasados nueve meses, los descendientes tenían alta masa corporal con incremento de la grasa, niveles de leptina plasmática incrementados, sugiriendo que una resistencia a esta hormona estaba contribuyendo a una inhibición de la anorexia. Similar resistencia a la leptina ha sido demostrada en obesos humanos. 133 Estos resultados sugieren que una rápida ganancia de peso puede en parte estar relacionada con elevados niveles de grelina, resistencia a la leptina, con incremento de la masa grasa corporal propiciando potencialmente la obesidad y otros desórdenes metabólicos posteriores.
Existen evidencias de que el niño (a) hasta los tres o cinco años de edad puede espontáneamente adecuar su ingesta energética al gasto energético (incluido el gasto por crecimiento), si se le otorga libre acceso a una alimentación variada. Esta capacidad de mantener un balance energético se puede perder por la oferta excesiva de alimentos de muy alta densidad energética y de grandes porciones.
La autorregulación energética también puede perderse cuando las señales internas que indican al niño(a) "qué, cuándo y cuánto" comer son repetidamente sobrepasadas por un adulto que impone al niño(a), no sólo sus propios horarios de alimentación, sino también un "qué" y "cuánto" comer. 134
Los padres, del mismo modo que muchos abuelos, también pecan con la preocupación exagerada por la cantidad de comida que consumen los niños. Les ofrecen unos menús sin considerar los controles en cuanto a grasas, azúcares, y otros componentes que solo incrementan la grasa corporal. En lugar de comer pan, arroz o legumbres, los niños están comiendo dulces, refrescos y golosinas. 135
Una mejor comprensión de la importancia relativa de los períodos de crecimiento pre y postnatal en la determinación del riesgo de una futura obesidad, puede permitir la estructuración de intervenciones con impactos diana bien identificados que resulten en mejores efectos beneficiosos. Los resultados de este trabajo en la ciudad de Bayamo así lo han evidenciado.
REFERENCIAS BIBLIOGRÁFICAS
1. Kain J, Albala C, García F, Andrade M. Obesidad en el preescolar: evolución antropométrica y determinantes socioeconómicos. Rev. Med. Chile 1998; (126): 271-8.
2. Mardones F, Bastías G, Farías M, Dinamarca Raúl, Olavarría F, Rada G, Rojas A, Rojas P. Composición corporal de neonatos con alteraciones en el crecimiento fetal. Rev. Chil. Pediatr.1999; (70): 300-5.
3. Oken E, Gillman W. Fetal Origins of Obesity. Obesity Research 2003; (11): 496-506
4. Soto N, Rodrigo A, Bazáes RA, Peña V, Salazar T, Avila A, Iñiguez G, Ong KK, Dunger DB, Mericq V. Insulin sensitivity and secretion are related to catch-up growth in small-for-gesttionalage infants at one year: results from a prospective cohort. J Clin. Endocrinol. Metab 2003; (88):3645-50.
5. Violante R, del Rio Navarro BE, Berber A, Ramirez Chanona N, Baeza Bacab M, Sienra Monge JJ. Obesity risk factors in the ISAAC (International Study of Asthma and Allergies in Childhood) in Mexico City. Rev. Alerg. Mex 2005; (52): 141-5.
6. Mericq V, Ong KK, Peña V, Avila A, Salazar T, Soto N, [et.al]. Longitudinal changes in insulin sensitivity and secretion from birth to age three years in small- and appropriate-forgestational-age children. Diabetologia 2005; (48): 2609-14.
7. Raghav CH. Risk factors for death in infancy persist into older age groups in England and Wales. BMJ 2004; (329): 1204-6.
8. Rogers and the EURO-BLCS Study Group. The influence of birthweight and intrauterine environment on adiposity and fat distribution in later life. Int J Obes 2003; (27): 755-77.
9. Ekelund U, Ong K, Linné Y, Neovius M, Brage S, Dunger D, [et.al]. Upward weight percentile crossing in infancy and early childhood independently predicts fat mass in young adults: the Stockholm Weight Development Study (SWEDES). Am J Clin Nutr 2006; (83): 324-30.
10. Remacle C, Bieswal F, Rouses B. Programming of obesity and cardiovascular disease. Int. J Obes 2004; (28): S46-S53.
11. Schroeder D, Martorell R, Flores R. Infant and Child Growth and Fatness and Fat Distribution in Guatemala. Am. J Epidemiol 1999; (149): 177-85.
12. Harder T, Rodekamp E, Schellong K, Dudenhausen J, Plagemann A. Birth Weight and Subsequent Risk of Tipe 2 Diabetes: A Meta-Analysis. Am. J Epidemiol 2007; (165): 849-57.
13. Murtaugh M, Jacobs D, Moran A, Steinberger J, Sinaiko A. Relation of Birth Weight to Fasting Insulin, Insulin Resistance, and Body Size in Adolescence. Diabetes Care 2003; (26): 187-92.
14. Kain J, Lera L, Rojas J, Uauy R. Obesidad en preescolares de la Región Metropolitana de Chile. Rev. Med. Chile 2007; (135): 63-70.
15. Loaiza S, Atalah E. Peso de nacimiento como factor de riesgo de obesidad en escolares de primer año medio. [Tesis para optar al grado de Doctor en Salud Pública]. Escuela de Salud Pública, Universidad de Chile, 2008.
16. Loaiza S, Atalah E. Factores de riesgo de obesidad en escolares de primer año básico de Punta Arenas. Rev. Chil. Pediatr. [en línea]. 2006; 77(1): Disponible en: http://www.scielo.cl/scielo.php?cript=sci_arttext&pid=S0370-41062006000100003&lng=es. doi: 10.4067/S0370-41062006000100003. [Consultado: 29/9/2009].
17. MCmillenI C, Robinson JS. Developmental origins of the metabolic syndrome: prediction, plasticity, and programming. Physiol. Rev 2005; 85:571-633.
18. Gluckman PD, Hanson MA. Developmental Origins of Disease Paradigm: A Mechanistic and Evolutionary Perspective Pediatric. Research 2004; 56:311-17.
19. Krishnaveni GV, Hill JC, Veena SR, Leary SD, SaperiaJ, Chachyamma KJ, [et al]. Truncal adiposity is present al birth and in early childhood in South Indian children. Indian Pediatr 2005; 42 (6): 527-38.
20. Fernández P. Asociación de bajo peso al nacer con Diabetes y Obesidad en la adultes. El Litoral [en línea]. 2007. Disponible en: http://www.ellitoral.com/index.php/diarios/2007/11/21/udopina/index.htnl [Consultado: 7/5/2009].
21. Hales CN, Ozanne DE. The dangerous road of catch-up growth. J. Physiol 2003; 547:5-10.
22. Cormillo T. El Origen fetal de la Obesidad. Dr Comillot. [en línea]. 2008. Disponible en: http://www.drcormillot.com/clinica_nutricion/default.php [Consultado: 7/5/2008].
23. Barker DJP. Fetal origins of coronary heart disease. BMJ 1995; 311(15): 171-174.
24. Barker DJP. Early growth and cardiovascular disease. Arch. Dis. Child 1999; 837: 305-307.
25. Schwartz J, Morrison JL. Impact and mechanisms of fetal physiological programming. Am J Physiol Regulatory Integrative Comp Physiol 2005; 288:11-15.
26. McMillen IC, Edwards LJ, Duffield J, Muhlhausler BS. Regulation of leptin synthesis and secretion before birth: implications for the early programming of adult obesity. Reproduction 2006; 131:415-427.
27. Jiménez-Chillaron JC, Patti ME. To catch up or not to catch up: is this the question? Lessons from animal models. Curr. Opin. Endocrinol. Diabetes. Obes 2007; 14:23-29.
28. Adair LS, Prentice AM. A critical evaluation of the fetal origins hypothesis and its implications for developing countries. J Nutr 2004; (134): 191-3.
29. Caballero B. The Global Epidemic of Obesity: An Overview. Epidemiol Rev 2007; (29): 1-5.
30. Eriksonn JG. The fetal origins hypothesis-10 years on. BMJ 2005; (330): 1096-7.
31. Caballero B. A nutrition paradox - underweight and obesity in developing countries. N Eng J Med 2005; (352): 1514-6.
32. Olivares S, Kain J, Lera L, Pizarro F, Vio F, Morón C. Nutritional status, food consumption and physical activity among Chilean school children: a descriptive study. Eur J Clin Nutr 2004; (58):1278-85.
33. Ariza J. Consenso de la Federación Latinoamericana de Sociedades de Obesidad (FLASO). 1998: 7-22.
34. Buchan IE, Heller RF, Clayton P, Bundred PE, Cole TJ. Early life risk factors for obesity in childhood: early feeding is crucial target for preventing obesity in children. BMJ 2005;331(7514):453-4.
35. Reilly JJ. Early life risk factors for obesity in childhood: cohort study. BMJ. 2005;330(7504):1357.
36. von Kries R, Toschke AM, Koletzko B. Maternal smoking during pregnancy and childhood obesity. Am J Epidemiol 2002;156:954-61.
37. Troiano RP, Flegal KM. Overweight children and adolescents: description, epidemiology, and demographies. Pediatrics 1998;101:497-504.
38. Rasmussen F, Johansson M. The relation of weight, length and ponderal index at birth to body mass index and overweight among 18-year-old males in Sweden. Eur J Epidemiol 1998;14:373-80.
39. Locard E, Mamelle N, Billette A, et al. Risk factors of obesity in a five year old population. Parental versus environmental factors. Int Obes Relat Metab Disord 1992;16:721-9.
40. Robinson TN. Reducing children's television viewing to prevent obesity: a randomized controlled trial. JAMA 1999;282:1561-7.
41. Moore LL, Nguyen US, Rothman KJ, et al. Preschool physical activity level and change in body fatness in young children. The Framingham Children's Study. Am J Epidemiol 1995;142:982-8.
42. Toschke AM, Vignerova J, Lhotska L, et al. Overweight and obesity in 6 to 14 year-old Czech children in 1991: protective effect of breast-feeding. J Pediatr 2002;141:764-9.
43. Kuczmarski RJ, Ogden CL, Guo SS, et al. 2000 CDC growth charts for the United States: methods and development. Vital Health Stat 11. 2002;11(246):1 -190.
44. Weiner JS, Lourie JA. Human Biology. A guide to field methods. Oxford: Blackwell Scientific Publications;1969. (Handbook No. 9).
45. Chumlea WC. Methods of Nutritional Anthropometric assessment for special groups. In: Lohman TG, Roche AF, Martorell R, editors. Anthropometric Standardization Reference Manual. Illinois: Human Kinetics Books.1988;pp:93-5.
46. Institute of Medicine. Nutrition during pregnancy, weight gain and nutrient supplements. Reports of the Subcommittee on Nutritional Status and Weight Gain during Pregnancy, Subcommittee on Dietary Intake and Nutrient Supplements during Pregnancy and Lactation, Food and Nutrition Board. Washington, DC: National Academy Press, 1990:1-233.
47. Ramírez E, Grijalva-Haro MI, Ponce JA, Valencia ME. Prevalencia de sobrepeso y obesidad en el noroeste de México por tres referencias de índice de masa corporal: diferencias en la clasificación. ALAN [serie en Internet]. 2006; 56 (3): [aprox. 3 p.]. Disponible en: http://www.alanrevista.org/ediciones/2006-3/htm. [Consultado: 25/7/2009].
48. He M, Beynon C. Prevalence of overweight and obesity in school-aged children. Can J Diet Pract. Res 2006; 67 (3): 125-9.
49. Victoria I, Dalmau J. Prevalencia de la obesidad en la infancia y la adolescencia. Actividad desde la atención primaria. Nutr Clin 2004; 41 (2):35-44.
50. Oken E, Gillman MW. Fetal Origins of Obesity. Obesity Research 2003; 11:496-506.
51. Hulman S, Kushner H, Katz S, Falkner B. Can cardiovascular risk be predicted by newborn, childhood, and adolescent body size? An examination of longitudinal data in urban African Americans. J Pediatr 1998; 132: 90-7
52. Curhan GC, Chertow GM, Willett WC, Spiegelman D, Colditz GA, Manson JE, [et al]. Birth weight and adult hypertension and obesity in women. Circulation 1996; 94: 1310-5
53. Okosun, IS, Liao, Y, Rotimi, CN, Dever, GE, Cooper, RS. Impact of birth weight on ethnic variations in subcutaneous and central adiposity in American children aged 5-11 years Int J Obes Relat Metab Disord 2002; 24:479-84.
54. Barker M, Robinson S, Osmond C, Barker DJ. Birth weight and body fat distribution in adolescent girls. Arch. Dis. Child 1997; 77:381-3.
55. Walker SP, Gaskin PS, Powell CA, Bennett FI. The effects of birth weight and postnatal linear growth retardation on body mass index, fatness and fat distribution in mid and late childhood. Public Health Nutr 2002; 5(3):391-6.
56. Phylips W. Childhood Obesity. Consensus Statement. J Clin. Endocrinol. Metab 2005; 90 (3):1871-87.
57. Amador García M, Cobas Selva M, Hermelo Treche M. Evaluación del estado de nutrición. En: Torre Montejo E de la, [et.al]. Pediatría. T: 2. La Habana: Ed. Pueblo y Educación 1996. p:75-86
58. Cabrera Hernández A, Damiani Roseli A, Chiong Molina D, Quintero Alejo ME, Fernández Ubeda L. Relación entre los lípidos séricos y la distribución de grasa corporal en un grupo de niños obesos. Rev. Cub. Aliment. Nutr. [en línea]. 1996; 10(2): Disponible en: http://bvs.sld.cu/revistas/ali/vol10_2_96/ali10296.htm. [Consultado: 25/7/2009].
59. Esquivel V, Suárez de Ronderos P, Calzada L, Sandí L, Ureña J. Factores de Riesgo Cardiovascular en un grupo de niños escolares obesos Costarricenses. Acta Pediátr. Costa Rica 2002; 16(1):15-8.
60. Castellón Pérez M. Correlación clínica de obesidad y alteración de pruebas bioquímicas. [Tesis]. Managua, Nicaragua: Universidad Nacional Autónoma de Nicaragua; 2005.
61. Pajuela J, Cancharf E, Carrera J, Leguía D. La circunferencia de la cintura en niños con sobrepeso y obesidad. An Fac Med Lima 2004; 65(3):167-71.
62. Ong KK. Size at birth, postnatal growth and risk of obesity. Horm Res. 2006; 65 (Suppl 3):65-9.
63. Sallout B, Walker M. The fetal origin of adult diseases. J Obstet. Gynaecol. 2003; 23:555-60.
64. Barker DJ. Intrauterine programming of adult disease. Mol Med Today. 1995; 1:418-23.
65. Barker DJP. Mothers, Babies and Health in Later Life. Edinburgh, Scotland: Churchill Livingston; 1998.
66. Hales CN, Barker DJP. The thrifty phenotype hypothesis. Br Med Bull 2001; 60:5-20.
67. Ravelli A, Vander Meulen J, Osmond C, Barker D, Bleker O. Obesity at the age of 50 in men and women exposed to famine prenatally. Am J Clin Nut 1999; 70: 811-6.
68. Roseboom T, Vander Meulen J, Osmond C, Barker D, Ravelli A, Schroeder-Tanka J, et al. Coronary heart disease after prenatal exposure to the Dutch famine, 1944-45. Hear 2000; 84: 595-8.
69. Roseboom T, Vander Meulen J, van Montfrans G, Ravelli A, Osmond C, Barker D, [et al]. Maternal nutrition during gestation and blood pressure in later life. J Hypertens. 2001; 19: 29-34
70. Godfrey KM, Barker DJ. Fetal nutrition and adult disease. Am J Clin Nutr 2000; 71:1344-52.
71. Barker DJ. In utero programming of chronic disease. Clin Sci (Colch) 1998; 95:115-28.
72. Yajnik CS, Fall CH, Coyaji KJ, Hirve SS, Rao S, Barker DJ, [et al]. Neonatal anthropometry: the thin-fat Indian baby. The Pune Maternal Nutrition Study. Int J Obes Relat Metab Disord. 2003; 27:173-80.
73. Yajnik CS. The lifecycle effects of nutrition and body size on adult adiposity, diabetes and cardiovascular disease. Obesity Rev 2002;3:217-24.
74. Yajnik CS. Early life origins of insulin resistance and type 2 diabetes in India and other Asian countries. J Nutr 2004;134:205-10.
75. Yajnik CS, Lubree HG, Rege SS, Naik SS, Deshpande JA, Deshpande SS, [et al]. Adiposity and hyperinsulinemia in Indians are present at birth. J Clin Endocrinol Metab 2002;87:5575-80.
76. Garnett SP. Abdominal fat and birth size in healthy prepubert children.Int J Obes Relat Metab Disord 2001; 25(11):1667-73.
77. Holt RI. Fetal programming of the growth hormone-insulin-like growth factor axis. Trends Endocrinol Metab 2002;13:392-7.
78. Cutfield WS, Hofman PL, Vickers M, Breier B, Blum WF, Robinson EM. IGFs and binding proteins in short children with intrauterine growth retardation. J Clin Endocrinol Metab 2002;87:235-9.
79. Meyre D. Is Glutamate Decarboxylase 2 (GAD2) a Genetic Link between Low Birth Weight and Subsequent Development of Obesity in Children? J Clin Endocrinol Metab 2005; 90(4): 2384-90.
80. Moreno Villares JN, Dalmau Serra J. Alteraciones en la nutrición fetal y efectos a largo plazo.¿Algo más que una hipótesis? Acta Pediatr. Esp 2001;59:573-81.
81. Torres AM. Evaluación del estado nutricional en escolares de bajos recursos socioeconómicos en el contexto de la transición nutricional. Arch. Argent. Pediatr. [en línea]. 2005;103(3): 205-211. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-00752005000300004&lng=es&nrm=iso. [Consultado: 14/11/2009].
82. Juarte ER; López Montero M; Trufero Cánovas N. Efectos del bajo peso materno preconsepcional sobre el embarazo y el parto. Policlínico Comunitario Docente "Carlos J. Finlay" Camagüey. Archivo Médico de Camagüey. [en línea]. 2006;10(4). Disponible en: http://www.amc.sld.cu/amc/2006/v10n4-2006/2113.pdf. [Consultado: 14/11/2009].
83. Woodall SM, Johnston BM, Breier BH, Gluckman PD. Chronic maternal undernutrition in the rat leads to delayed postnatal growth and elevated blood pressure of offspring. Pediatr. Res 1996;40:438-43.
84. Persson E, Jansson T. Low birth weight is associated with elevated adult blood pressure in the chronically catheterized guinea pig. Acta Physiol. Scand 1992;145:195-6.
85. Oliver MH, Gluckman PD, Breier BH, Harding JE. Brief Undernutrition of Sheep in Late Gestation Causes Insulin Resistance in the Adult Offspring. International Fetal Physiology Symposium, Aspen.1999; A 19.
86. Kwong WY, Wild AE, Roberts P, Willis AC, Fleming TP. Maternal undernutrition during the preimplantation period of rat development causes blastocyst abnormalities and programming of postnatal hypertension. Development 2000;127:4195-202.
87. MacLaughlin SM, Walter SK, Roberts CT, Kleemann DO, McMillen IC. Preconceptional nutrition and the relationship between maternal body weight changes in the periconceptional period and feto-placental growth in the sheep. J Physio 2005; 565(1): 111-24.
88. Gluckman PD. (Editorial). Nutrition, glucocorticoids, birth size, and adult disease. Endocrinology 2001; 142:1689-91.
89. Krause B, Sobrevia L, Casanello P. Papel de la placenta en la programación fetal de las enfermedades crónicas del adulto. En: Uauy R, Camuerga E, Barrer D, [et.al]. [libro en Internet]. Impacto del crecimiento y del desarrollo temprano sobre la salud y bienestar de la población. Instituto Danone, Nov 2009. Disponible en: http://www.institutodanoneconosur.org. [Consultado: 4/11/2009].
90. Heijmans BT, Tobi EW, Stein AD, Putter H, Blauw GJ, Susser ES, [et.al]. Persistent epigenetic differences associated with prenatal exposure to famine in humans. ProcNatl Acad Sci USA 2008; (105): 17046-9.
91. Carbillon L, Uzan M, Uzan S. Pregnancy, vascular tone, and maternal hemodynamics: acrucial adaptation. Obstet Gynecol Surv 2000; (55): 574-81.
92. Saldeen P, Olofsson P, Laurini RN. Structural, functional and circulatory placental changes associated with impaired glucose metabolism. Eur J Obstet Gynecol Reprod Bio 2002 ;( 105): 136-42.
93. Casanello P, Escudero C, Sobrevia L. Equilibrative nucleoside (ENTS) and cationic amino acid (CATS) transporters: implications in foetal endothelial dysfunction in human pregnancy diseases. Curr Vasc Pharmacol 2007; (5): 69-84.
94. Karadas B, Kaya T, Cetin M, Parlak A, Durmus N, Bagcivan I, Gulturk S. Effects of formoterol and BRL 37344 on human umbilical arteries in vitro in normotensive and pre-eclamptic pregnancy. Vascul Pharmacol 2007; (46): 360-6.
95. Yura S, Fujii S. Obesity in offspring with undernutrition during pregnancy. Nippon Rinsho 2006; 64 (4):795-803.
96. Laitinen J, Power C, Jarvelin MR. Family social class, maternal body mass index, childhood body mass index, and age at menarche as predictors of adult obesity. Am J Clin Nutr 2001;74 :287 -94
97. Stettler N, Tershakovec AM, Zemel BS. Early risk factors for increased adiposity: a cohort study of African American subjects followed from birth to young adulthood. Am J Clin Nutr 2000;72 :378 -83.
98. Whitaker R. Predicting Preschooler Obesity at Birth: The Role of Maternal Obesity in Early Pregnancy. Pediatrics 2004; 114(1): 29-36.
99. 157. Chagnon YC, Rankinen T, Snyder EE, Weisnagel SJ, Perusse L, Bouchard C. The human obesity gene map: the 2002 update. Obes Res 2003;11: 313 -67.
100. Valderrama F, Cabrera E, Herrera J. Estado nutricional pregestacional y ganancia de peso materno durante la gestación y su relación con el peso del recién nacido. Rev. Med. Hered 2003;14(3).
101. Jansson T, Powell TL. Role of the placenta in fetal programming: underlying mechanisms and potential interventional approaches. Clin Sci (Lond) 2007; (113): 1-13.
102. Calderon IM, Damasceno DC, Amorin RL, Costa RA, Brasil MA, Rudge MV. Morphometric study of placental villi and vessels in women with mild hyperglycemia or gestational or overt diabetes. Diabetes Res Clin Pract2007; (78): 65-71.
103. Roberts JM, Catov JM. Preeclampsia more than 1 disease: or is it? Hypertension. 2008 ;( 51): 989-90.
104. Álvarez Fumero R, Urra Cobas LR, Aliño Santiago M, Repercusión de los factores de riesgo en el bajo peso al nacer. RESUMED. [en línea]. 2001; 14(3):115-21. Disponible en: http://www.bvs.sld.cu/revistas/res/vol14_3_01/res02301.pdf. [Consultado: 28/11/2005].
105. Power C, Jefferis BJ. Fetal environment and subsequent obesity: a study of maternal smoking. Int J Epidemiol 2002; 31:413-19.
106. Toschke M, Koletzko B, Slikker W Jr. Childhood obesity is associated with maternal smoking in pregnancy. Eur J Pediatr 2002; 161:445-8.
107. Von Kries R, Toschke AM, Koletzko B. Maternal smoking during pregnancy and childhood obesity. Am J Epidemiol 2002; 156: 954-61.
108. Al Mamun A, Lawlor DA, Alati R, O'Callaghan MJ, Williams GM, Najman JM. Does maternal smoking during pregnancy have a direct effect on future offspring obesity? Evidence from a prospective birth cohort study. Am J Epidemiol 2006; 164(4): 317-25.
109. Oken E, Huh SY, Taveras EM, Rich-Edwards JW, Gillman MW. Associations of Maternal Prenatal Smoking with Child Adiposity and Blood Pressure. Obesity Research 2005; 13:2021-8.
110. Ong KK, Ahmed ML, Emmett PM, Preece MA, Dunger DB. Association between postnatal catch-up growth and obesity in childhood: prospective cohort study. BMJ 2000; 320:967-71.
111. Stettler N, Zemel BS, Kumanyika S, Stallings VA. Infant weight gain and childhood overweight status in a multicenter, cohort study. Pediatrics 2002; 109 (2): 194-9.
112. Stettler N, Kunanyika SK, Katz SH, Zemel BS, Stallings VA. Rapid weight gain during infancy and obesity in young adulthood in a cohort of African Americans. Am J Clin Nutr 2003; 77(6): 1374-8.
113. Macías Gelabert A, Hernández Triana M, Ariosa Abreu J, Alegret Rodríguez M. Crecimiento prenatal y crecimiento posnatal asociados a obesidad en escolares. Rev. Cub. Invest Bioméd. [ en línea]. 2007; 26(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-l03002007000300002&lng=es. [Consultado: 28/11/2005].
114. Seidman DS, Laor A, Gale R, Stevenson DK, Danon YL. A longitudinal study of birth weight and being overweight in late adolescence. Am J Clin Nutr 1991; 145:782 -5.
115. Tanner JM. Growth from birth to two: a critical review. Acta Médica. Auxológica 1994; 26: 7-45.
116. Tanner JM, Healy MJR, Lockhart RD, Mac-Kenzie JD, Whitehouse RH. Aberdeen growth study I. The prediction of adult body measurements from measurements taken each year from birth to five years. Arch. Dis. Chile 1956; 46: 372-81.
117. Giuffré E. La Obesidad Infantil. ESMERALDA 183. [en línea]. Disponible en: http://www.monografias.com/trabajos14/obesidadinfan/obesidadinfan.shtml [arroba]arnet.com.ar. [Consultado: 28/11/2005].
118. Ivanovic R, Olivares M, Ivanovic D. Estado nutricional en escolares chilenos urbanos y rurales de la Región Metropolitana, 1986-1987. Rev. Chil. Pediatr 1990; 61(4):210-7.
119. Ong KK, Dunger DB. Perinatal growth failure: the road to obesity, insulin-resistance and cardio-vascular disease in adults. Best Pract Res Clin Endocrinol Metab 2002; 16:191-207.
120. Eriksson JG, Forsen T, Tuomilehto J, Jaddoe VW, Osmond C, Barker DJ. Effects of size at birth and childhood growth on the insulin resistance syndrome in elderly individuals. Diabetologia 2002; 45:342-8.
121. Ounsted M, Sleigh G. The infant's self-regulation of food intake and weight gain. Difference in metabolic balance after growth constraint or acceleration in utero. Lancet 1975; 1: 1393-7.
122. Ong KK, Ahmed ML, Sherriff A, Woods KA, Watts A, Golding J, [et al]. Cord blood leptin is associated with size at birth and predicts infancy weight gain in humans. J Clin Endocrinol Metab 1999;84: 1145-8.
123. Lewis DS, Bertrand HA, McMahan CA, McGill Jr, Carey KD, Masoro EJ. Reweaving food intake influences the adiposity of young adult baboons. J Clin Invest 1986;78:899-905
124. Faust IM, Johnson PR, Hirsch J. Long-term effects of early nutritional experience on the development of obesity in the rat. J Nutr 1980; 110:2027-34.
125. Wasteland RA, Gaza C. Early postnatal nutrition determines adult pancreatic glucose-responsive insulin secretion and islet gene expression in rats. J Nutr 2002;132:357-64.
126. Martorell R, Kettel Khan L, Schroeder DG. Reversibility of stunting: epidemiological findings in children from developing countries. Eur J Clin Nutr. 1994;(48): S45-S57.
127. Owen CG, Martin RM, Whincup PH, Davey Smith G, Cook DG. Effect of infant feeding on the risk of obesity across the life course: a quantitative review of published evidence. Pediatrics 2005;( 115): 1367-77.
128. Michels KB, Willett WC, Graubard BI, Vaidya RL, Cantwell MM, Simsbury LB, Forman MR. A longitudinal study of infant feeding and obesity throughout life course Int J Obes . 2007;(31):1078-85.
129. Martin R, Ben-Shlomo Y, Gunnell D, Ellwood P, Yarnell J, Davey S, [et.al]. Estado nutricional en escolares chilenos urbanos y rurales de la Región Metropolitana, 1986-1987. Rev Chil Pediatr 1990; 61(4):210-7.
130. Singhal A, Baroque IS O'Rahilly S, Cole TJ, Fewtrell M, Lucas A. Early nutrition and leptin concentrations in later life. Am J Clin Nutr 2002;(75): 993-9.
131. Gillman MW, Rifas-Shiman SL, Camargo CA Jr, [et al]. Risk of overweight among adolescents who were breastfed as infants. JAMA 2001; 258:2461-7.
132. Desai M, Gayle D, Babu J, Ross M. Programmed obesity in intrauterine growth-restricted newborns: modulation by newborn nutrition. Am J Physiol Regul Integr Comp Physiol 2005;288: 91-6.
133. Sahu A. A hypothalamic role in energy balance with special emphasis on leptin. Endocrinology 2004;145:2613-20.
134. Pizarro QT. Intervención nutricional a través del ciclo vital para la prevención de obesidad y otras enfermedades crónicas no transmisibles Rev Chil Pediatr 2007;78(1):76-83.
135. Chueca M, Azcona C. Obesidad infantil. Salud Navarra Nafarroan Osasuna [Internet].España; 2009 [Citado: 28/11/2005]. Disponible en: http://www.cfnavarra.es/salud/anales/textos/vol125/sup1/suple13a.htm1
Recibido: 30 de mayo de 2013.
Aceptado: 1 de julio de 2013.