Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.36 no.1 Ciudad de la Habana ene.-mar. 2017
ARTÍCULO ORIGINAL
Deposición sol-gel de hidroxiapatita bioactiva sobre titanio poroso
Sol-gel deposition of bioactive hydroxyapatite on porous titanium
Eduardo Peón,I Cristina Domínguez,II Helen Pérez,I Juan Carlos Galván,III José Antonio Rodríguez Ortiz,II Juan José Pavón,IV Yadir TorresII
I Centro de Biomateriales. Universidad de La Habana. La Habana, Cuba.
II Departamento de Ingeniería y Ciencia de los Materiales. Universidad de Sevilla. Sevilla, España.
III Centro Nacional de Investigaciones Metalúrgicas. Consejo Superior de Investigaciones Científicas. Madrid, España.
IV Grupo de Biomateriales Avanzados y Medicina Regenerativa. Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Introducción: el titanio y algunas de sus aleaciones son considerados la mejor opción para fabricar implantes permanentes, debido a sus excelentes propiedades mecánicas y resistencia a la corrosión en el ambiente fisiológico, además de su buena biocompatibilidad y osteointegración.
Objetivo: solucionar algunas de las limitaciones más significativas de los implantes de titanio: fenómenos de fatiga y falla de la biointerfase.
Métodos: muestras de titanio qp grado IV con porosidad de 250-355 µm, fueron obtenidas por la técnica de space-holder (50 % vol. NH4HCO 3, 800 MPa y 1250 ºC durante 2 h en alto vacío), produciéndose buen balance entre rigidez y resistencia mecánica del material. Detrás los sustratos de titanio poroso fueron recubiertos con hidroxiapatita obtenida vía sol-gel, por inmersión, secadas a 80 ºC y tratadas térmicamente a 450 ºC durante 5 h en vacío. La formación de fase, morfología de la superficie, microestructura interfacial, capacidad de infiltración y sección transversal de los recubrimientos, fue investigada por diferentes métodos de análisis químico-físico.
Resultados: los análisis de espectroscopia infrarroja de transformada de Fourier y difracción de rayos X mostraron la cristalinidad de la fase y la homogeneidad en la composición química del recubrimiento. La evaluación micromecánica y adherencia del recubrimiento (curvas de P-h y resistencia al rayado) demostraron una buena adherencia del recubrimiento al sustrato metálico. El recubrimiento fue poroso sin evidencia de formación de grietas. Estos poros aparecen interconectados formando una red continua, característica morfológica que es una ventaja para permitir la circulación de fluido fisiológico, cuando se utiliza el sistema para aplicaciones biomédicas.
Conclusiones: la cristalinidad satisfactoria y adhesión entre el recubrimiento y el sustrato sugieren el sistema como promisorio para aplicaciones en el desarrollo de implantes ortopédicos.
Palabras clave: Hidroxiapatita; titanio; sol-gel; tamaño de poro.
ABSTRACT
Introduction: Titanium and some titanium alloys are considered to be the best materials for permanent implants, due to their excellent mechanical properties and resistance to corrosion in physiological environments, as well as their good biocompatibility and osseointegration. Objective: Solve some of the most significant limitations of titanium implants: fatigue phenomena and biointerface failure.
Methods: Samples of cp titanium grade 4 with a porosity of 250-355 µm were obtained by space-holder technique (50 % vol. NH4HCO3 , 800 MPa and 1250 ºC for 2 h in high vacuum), achieving a good balance between rigidity and mechanical resistance of the material. The porous titanium substrates were then covered with hydroxyapatite obtained via sol-gel immersion, dried at 80 ºC and thermally treated at 450 ºC for 5 h in a vacuum. Phase formation, surface morphology, interfacial microstructure, infiltration capacity and cross-section of coatings, were assessed with various physicochemical analysis methods.
Results: Fourier transform infrared spectroscopy and X-ray diffraction analysis showed the crystallinity of the phase and the homogeneity in the chemical composition of the coating. Micromechanical evaluation and coating adherence (P-h curves and scratch resistance) revealed good adherence of the coating to the metallic substrate. The coating was found to be porous without any evidence of crack formation. The pores seem to be interconnected into a continuous network, a morphological characteristic enabling circulation of physiological fluid when the system is used for biomedical applications.
Conclusions: Satisfactory crystallinity and adhesion between the coating and the substrate suggest that the system is promising for application in the development of orthopedic implants.
Key words: hydroxyapatite; titanium; sol-gel; pore size.
INTRODUCCIÓN
El desarrollo de implantes ortopédicos se enfoca en lograr una mejor calidad y una mayor durabilidad. La funcionalidad del implante es afectada por varios factores: las propiedades intrínsecas de los materiales utilizados en su fabricación y sus componentes (forma y geometría que ofrece); la calidad y cantidad de tejido óseo y la bioquímica y energía de la superficie de la biointerfase entre el hueso y el implante. La meta para un implante ideal es lograr el equilibrio bioquímico y mecánico.1
El titanio y algunas de sus aleaciones son considerados la mejor opción para fabricar implantes permanentes, debido a sus excelentes propiedades mecánicas y resistencia a la corrosión en el ambiente fisiológico, además de su buena biocompatibilidad y osteointegración.2 Una solución recurrente es el uso de la técnica de space-holder para aproximar ambos módulos elásticos (hueso-implante), por su buena efectividad y viabilidad. Es posible producir un material con un módulo elástico similar al hueso cortical, con una porosidad entre 40-50 %. Además de obtener un material poroso que resuelve el problema de la protección contra la tensión, el tamaño de poro conseguido asegura un crecimiento óseo óptimo hacia el implante y la rugosidad de poro mejora la osteointegración.
Los implantes metálicos porosos recubiertos con materiales bioactivos, como la hidroxiapatita (HA), puede acelerar la formación del hueso en la fase inicial de oseointegración, mejorándose la fijación del injerto.3 La alta resistencia mecánica y tenacidad del titanio y sus aleaciones son las ventajas más importantes sobre la cerámica de HA. Por lo tanto, un sistema que unen ambos materiales tiene las ventajas mecánicas del sustrato subyacente (metálico) y la afinidad biológica de la HA.3,4 Capas finas de HA sobre sustratos de titanio (Ti) poroso puede prepararse utilizándose la técnica de sol-gel. Los métodos sol-gel son capaces de mejorar la homogeneidad química de la HA resultante que recubre en una magnitud significante, cuando se compara con otros métodos.5-8 Estos métodos también son simples y menos caros que el método de rociado por plasma, empleado en la actualidad para las aplicaciones biomédicas.9-11 Estudios previos relacionados con la obtención de polvos de HA nanoestructurada por la ruta sol-gel, demostraron la dependencia de tamaño del cristalitas así como el grado del cristalinidad en las capas de HA, en dependencia del tratamiento térmico aplicado.12,13
El objetivo de este trabajo consiste en solucionar algunas limitaciones importantes de los implantes de titanio. Por un lado, el fenómeno de tensiones en el material, desarrollándose un sustrato de titanio poroso con buen equilibrio entre rigidez y resistencia mecánica. Por otro lado, las fallas de la biointerfase, mediante recubrimientos de HA bioactiva, utilizándose la técnica sol-gel, sobre el sustrato metálico.
MÉTODOS
Los materiales empleados en la preparación de los sustratos porosos (figura 1 a y b), consistió en titanio c.p. grado IV (SEJONG Materials Co. Ltd. Seoul, Korea) y bicarbonato de amonio (Cymit Química S.L. España) para crear el sustrato poroso de Ti mediante el uso de la técnica de space-holder. El NH4HCO3 debe ser tamizado de manera previa para obtener el rango de tamaño de poro empleado en este trabajo, correspondiente al tamaño de partícula de 250 a 355 μm.
La mezcla de Ti en polvo y partículas de NH4HCO3 se preparó con una concentración de 50 % vol., mediante un mezclador Turbula T2C durante 40 min, para lograr un buen grado de homogeneización. El contenido y el tamaño del NH4HCO 3 fueron elegidos de acuerdo con los trabajos previos de otros autores,14-16 basados en la porosidad óptima para igualar las propiedades mecánicas del hueso cortical (módulo de Young de 20 GPa y resistencia mecánica de 150-180 MPa). Detrás, se aplicó una presión de compactación de 800 MPa, utilizándose una prensa Instron 5505. Los compactos se colocaron primero en estufa a 60 ºC y después a 110 ºC bajo vacío (~ 10-2 mbar), durante 12 h. El proceso de sinterización se realizó en mufla Carbolyte STF 15/75/450 con tubo horizontal a 1250 ºC durante 2 h utilizándose alto vacío (~ 10-5 mbar).
El recubrimiento de HA cristalina, fue preparado aplicándose una variante del proceso sol-gel descrito por D. M. Liu.17,18 Los soles se obtuvieron utilizando como reactivos trietil fosfito y nitrato cálcico tetrahidratado. La hidrólisis del precursor del fósforo se realiza bajo agitación vigorosa, utilizando una relación molar agua/fosfito igual a 4. Tras 24 h de hidrólisis, se añade al medio el precursor salino de Ca, para que se obtenga el gel de HA. Luego de 24 h de hidrólisis, se añade al medio la cantidad estequiométrica (relación Ca/P = 1,64) de disolución 4 M de nitrato de calcio. Se mantiene la agitación durante 30 min y a continuación se deja reposar a temperatura ambiente otras 24 h. Cuando el gel alcanza la viscosidad adecuada, se deposita sobre la superficie metálica mediante inmersión, a una velocidad de 5 cm/min. Los recubrimientos producidos se sometieron a tratamiento térmico de 450 ºC durante 5 h en vacío.
El recubrimiento resultante de hidroxiapatita se ha caracterizado mediante espectroscopia infrarroja (FTIR, Nicolet Magna 550), difracción de rayos X (DRX, Rigaku-Miniflex), microscopía electrónica de barrido (MEB/EDX, JEOL JSM-6460LV con analizador Noran System Six 200).
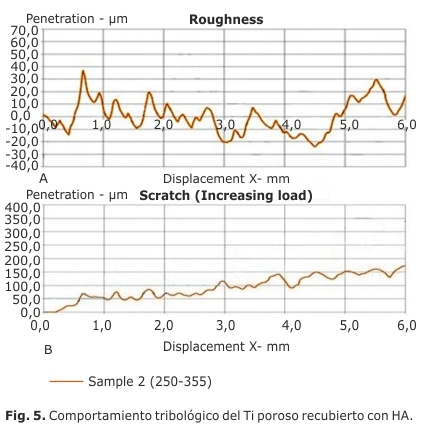
Además, se estudió el comportamiento de contacto deslizante de las superficies mediante ensayos de micro-rayado, en un dispositivo comercial MICROTEST (MTR3/50-50/NI) utilizándose punta de diamante Rockwell con un diámetro de 200 μm y cargas constantes de 1 N y 30 N a una velocidad de 0,5 mm/min durante 6 mm de longitud, respectivamente según lo establecido por la norma ASTM C1624-05. La carga normal se registra continuamente durante el rayado. La respuesta de contacto deslizante se dio en términos de curvas de penetración-carga de rayado.
RESULTADOS
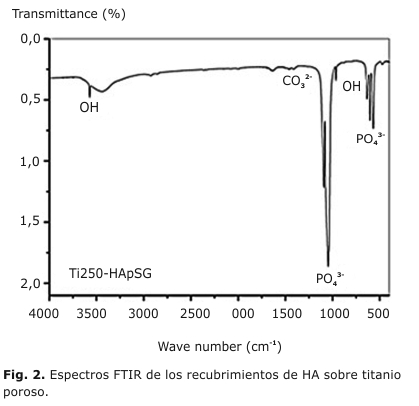
En teoría, existen cuatro modos de vibración para iones fosfato n1(961 cm−1), n2(475-440 cm−1), n3(1 190-976 cm−1) y n 4(660-520 cm−1). El ion fosfato es el principal grupo funcional empleado en la caracterización estructural de HA. Las bandas entre 500-700 cm -1 son típicas de la vibración antisimétrica P-O-P y definen la HA cristalina por dos bandas al menos.19,20
En la figura 2 se muestra los detalles del espectro IR de las muestras estudiadas. Se observan las bandas características de las vibraciones n4(PO43-) sobre los 560 y 600 cm-1, n1(PO43-) sobre los 960 cm-1 y n3(PO43-) entre los 1 040 y 1 090 cm-1. La vibración n(OH-) se observa a 3 572 cm-1, atribuible a los grupos OH-, además a 632 cm-1 atribuible también a los grupos OH -.21
Los patrones de DRX para las muestras de titanio poroso recubiertas con HA se detalla en la figura 3. Se observan los picos que aparecen en 25,93° (002), 31,82° (211), 32,27° (112), 32,99° (300) y 49,58° (213), son característicos de la fase HA, según la cartoteca PCPDFWIN v. 2,4 # 09-0432.
Según Landi y colaboradores,22 la fracción de fase cristalina en HA (Xc) se calcula mediante la siguiente ecuación:
Dónde: V112/300 es la intensidad del valle entre los picos de los planos (112) y (300) de la HA. I300 es la intensidad del pico de difracción del plano cristalográfico (300) para la HA.
Cuando se aplica la expresión anterior, a partir de los datos que se obtienen del patrón de difracción de la figura 3, que se amplía en el intervalo de 32 a 33,2º; se obtiene que el grado de cristalinidad de los recubrimientos de HA que se prepararon por vía sol-gel sobre la aleación de Ti6Al4V.5
Los resultados MEB (Fig. 4) mostraron la formación de cristales en forma de racimos, estructura típica de apatita. Se observa una morfología homogénea del recubrimiento, sin grietas y sin la presencia de discontinuidad sobre el sustrato metálico.
El análisis de recubrimiento global realizado por EDX (Fig. 4 derecha) mostró que el Ca y P estaban presentes en la HA. No hubo picos comunes relacionados con el sustrato metálico u otros elementos contaminantes, lo que demostró la continuidad del recubrimiento HA.
En cuanto al comportamiento micromecánico, los resultados obtenidos se muestran en la figura 5 a) y b) y los parámetros de rugosidad se detallan en la tabla.
DISCUSIÓN
Los espectros FTIR de los materiales obtenidos, mostraron las vibraciones ν4PO43- (a 563, 600 y 942 cm-1), ν1PO43- (a 1000 cm-1) y ν3PO43- (a 1100 cm -1). Estas reflexiones indican el reordenamiento de los poliedros de PO43- en la estructura del cristal, confirmándose la transformación de la HA de fase amorfa a cristalina a solo 450 ºC. La banda a 631cm-1 y la banda fina a 3570 cm -1 son características de la estructura apatita y se atribuyen a la vibración de grupos OH-. La banda ancha que oscila entre 3300 y 3600 cm-1 puede explicarse debido a la vibración de estiramiento del grupo O-H del agua absorbida. Todas las bandas observadas concuerdan con lo que se reporta en la literatura para la HA.17-20
La HA estequiométrica Ca10(PO4)6(OH) en su forma más común presenta estructura hexagonal, mientras que la apatita de los tejidos biológicos es carbonato sustituida entre un 5 y 6 % en peso que corresponde a los iones CO32- y suelen sustituir cualquiera de los grupos PO43- u OH - en la HA.21 Durante el proceso de obtención del sol-gel de HA, una pequeña incorporación de CO32- se detecta por la presencia de las bandas del ión CO 32- a 1 468 cm-1; atribuida a la formación de HA carbonatada o CaCO3. La formación CO 32- es la consecuencia de dos procesos:
- Por un lado, la presencia de radicales etilo en el gel de HA que forman carbonato de calcio durante la pirólisis.
- La segunda razón es la combinación de calcio y CO 2 de la pirólisis durante el proceso de cristalización.
No obstante, no se consideran como impurezas para la aplicación futura del material, debido a su presencia implica una mayor similitud con el hueso.13,22
Los patrones de DRX de las muestras analizadas, confirmaron que las capas de HA evolucionaron de amorfo a cristalino. La fase de CaCO3 encontrada (correspondiente a la Calcita según la cartoteca PCPDFWIN v. 2.4 # 86-2343), y su formación ya se discutió cuando se analizaron los espectros FTIR. No se detectan picos correspondientes a otras fases de fosfatos de calcio por lo que se afirma que el sol-gel evolucionó completamente a la fase de HA.
Al aplicar la expresión de Landi, utilizándose los datos obtenidos del patrón de difracción de la figura 3; se obtuvo que el grado de cristalinidad de los recubrimientos de HA sobre Ti poroso, que osciló entre 83 y 87 %.
La morfología superficial, áspera y porosa, observada por MEB y estudiada en los ensayos micromecanicos, proporciona una gran superficie y sitios de nucleación para la precipitación de la apatita una vez que se expone a los fluidos biológicos. La rugosidad superficial de los materiales de implante constituye un punto crítico para el crecimiento óseo en la interfaz hueso-implante. La actividad funcional de las células en contacto con los biomateriales se define por las características superficiales, especialmente por la rugosidad superficial. La última muestra una influencia importante en términos de adsorción de partículas de apatita del plasma sanguíneo. Esto promueve la transformación del enlace mecánico, lo que resulta en una mayor fuerza de unión entre el hueso y el implante.23
CONSIDERACIONES FINALES
El trabajo realizado ha ilustrado que es posible depositar capas de HA, firmemente adheridas sobre sustratos de Ti poroso por la vía sol-gel, y tratamiento térmico a solo 450 ºC. Tanto la espectroscopia FTIR como la DRX mostraron que las capas exhiben una estructura apatitica cristalina. Los recubrimientos de HA están de manera firme unidos al sustrato de Ti, a través de un enlace mecánico y posiblemente cierto grado de unión química. La presencia de recubrimientos HA juega un doble papel en la prevención de la liberación de iones metálicos (haciéndolo más resistente a la corrosión) y en hacer la superficie más bioactiva. Lo expuesto hace promisorio el sistema recubrimiento HA/Ti poroso para posibles aplicaciones biomédicas como prótesis ortopédicas.
AGRADECIMIENTOS
Este trabajo cuenta con el apoyo del Ministerio de Ciencia e Innovación y la Junta de Andalucía-FEDER (España), financiada en parte por el Fondo Europeo de Desarrollo Regional.
APOYO FINANCIERO
Centro de Biomateriales, Universidad de La Habana.
DECLARACIÓN DE CONFLICTOS DE INTERESES
Los autores declaran que no existe conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Ponsonnet K, Reybier N, Jaffrezic V, Comte C, Lagneau M, Lissac C, et al. Martelet. Relationship between surface properties (roughness, wettability) of titanium and titanium alloys and cell behaviour. Mat. Sci. Eng. C-Mater. 2003;23:551-60.
2. Ferraris S, Vitale A, Bertone E, Guastella S, Cassinelli C, Pan J, et al. Multifunctional commercially pure titanium for the improvement of bone integration: Multiscale topography, wettability, corrosión resistance and biological functionalization. Mat. Sci. Eng. C-Mater. 2016;60:384-93.
3. Goodman Stuart B, Yao Z, Keeney M, Yang F. The future of biologic coatings for orthopaedic implants. Biomaterials. 2013;34:3174-83.
4. Dorozhkin Sergey V. Calcium orthophosphate coatings, films and layers. Progress in Biomaterials. 2012;1:1-40.
5. El hadad AA, Barranco V, Jiménez-Morales A, Peón E, Galván JC. Multifunctional sol-gel derived thin film based on nanocrystaline hydroxyapatite powders. J. Phys.: Conf. Ser. IOP Publishing Ltd. 2010;252:012007.
6. Liu DM, Troczynski T, Tseng W. Water basec sol-gel synthesis of hydroxyapatite: process development. Biomaterials. 2001;22:1721-30.
7. Liu DM, Yang Q, Troczynski T. Sol-gel hydroxyapatite coatings on stainless steel substrate. Biomaterials. 2002;23:691-8.
8. Choudhury Pritha, Agrawal DC. Sol-gel derived hydroxyapatite coatings on titanium substrates. Surf. Coat. Tech. 2011;206:360-5.
9. Candidato R, Sokołowski P, Pawłowski L, Denoirjean Al. Preliminary study of hydroxyapatite coatings synthesis using solution precursor plasma spraying. Surf. Coat. Tech. 2015;277:242-50.
10. Roy M, Krishna Balla V, Bandyopadhyay A, Bose S. Compositionally graded hydroxyapatite/tricalcium phosphate coating on Ti by laser and induction plasma. Acta Biomater. 2011;7:866-73.
11. Melero H, Fernández J, Dosta S, Guileman JM. Caracterización de nuevos recubrimientos biocompatibles de hidroxiapatita-TiO2 obtenidos mediante Proyección Térmica de Alta Velocidad. Bol. Soc. Esp. Ceram. Vidr. 2011;50(2):59-64.
12. Dorozhkin SV. Calcium orthophosphate coatings, films and layers. Progress in Biomaterials. 2012;1:1-66.
13. Peón Avés E, Galván JC, Lima IR, Mauro Granjeiro J, Napoleau Bastos I, Soares GD. Recobrimento da liga Ti-6Al-4V com hidroxiapatita pelo método sol-gel e sua aplicação a hastes femorais não-cimentadas. Cerâmica. 2008;54:476-9.
14. Kotan G, Bor AS. Production and characterization of high porosity Ti-6Al-4V foam by space holder technique. Powder Metallurgy. 2007;3:82-94.
15. Esen Z, Bor S. Processing of titanium foams using magnesium spacer particles. Scripta Mater. 2007;56(5):341-4.
16. Takemoto M, Fujibayashi S, Neo M, Suzuki J, Kokubo T, Nakamura T, et al. Mechanical properties and osteoconductivity of porous bioactive titanium. Biomaterials. 2005;26:6014-23.
17. Liu DM, Troczynski T, Tseng W. Water basec sol-gel synthesis of hydroxyapatite: process development. Biomaterials. 2001;22:1721-30.
18. Liu DM, Yang Q, Troczynski T. Sol-gel hydroxyapatite coatings on stainless steel substrate. Biomaterials. 2002;23:691-8.
19. Fowler BO. Infrared Studies of Apatites I. Inorganic Chemistry. 1974;13:194-206.
20. Fowler BO. Infrared Studies of Apatites II. Inorganic Chemistry. 1974;13:207-14.
21. Pleshko N, Boskey A, Mendelsohn R. Novel Infrared Spectroscopic method for the determination of crystallinity of hydroxyapatyte minerals. Biophys. J. 1991;60:786-93.
22. Landi E, Tampieri A, Celotti G, Sprio S. Densification Behaviour and Mechanisms of Synthetic Hydroxyapa-tites. Journal European Ceramic Society. 2000;20:2377-87.
23. Bagno A, Bello DD. Surface treatment and roughness properties of Ti based biomaterials. J. Mater. Sci. Mater. Med. 2004;15(9):935-49.
Recibido: 4 de octubre de 2016.
Aprobado: 4 de noviembre de 2016.
Eduardo Peón. Centro de Biomateriales. Universidad de La Habana. La Habana, Cuba.
Correo electrónico: epeon@biomat.uh.cu