Introducción
La enfermedad periodontal es un fenómeno inflamatorio crónico que afecta a los tejidos de sostén del diente.1 El acúmulo de biopelícula dental facilita la colonización de grupos bacterianos en el surco gingival, lo que promueve una respuesta inflamatoria local con la consecuente liberación de moléculas proinflamatorias como interleuquina-1, interleuquina-6, interleuquina-17, factor de necrosis tumoral e interferón-gamma.2 Estadios avanzados de la enfermedad están relacionados con la pérdida del ligamento periodontal y la consecuente pérdida del hueso alveolar, asociado a la liberación en enzimas como las colagenasas y metaloproteinasas de la matriz.1,2
La periodontitis es una enfermedad inflamatoria inducida por agentes bacterianos; principalmente Fusobacteriun nucleatum, Prevotella intermedia, Aggregatibacter actinomycetemcomitans, Treponema denticola y Porphyromonas gingivalis,1,3 aunque la sola presencia de los diversos grupos bacterianos no es suficiente para el establecimiento de la enfermedad. Se conoce que el desarrollo de la periodontitis está relacionado con una base genética y factores condicionantes ambientales como fumar, una pobre higiene oral y comorbilidades. Hong y otros,4 estimaron una prevalencia del 25 % en una población koreana, estos valores fueron significativamente más altos (43,7 %) en adultos diagnosticados con diabetes mellitus.
Porphyromonas gingivalis (P. Gingivalis) está asociada tanto al inicio como a la progresión de la periodontitis; se trata de un bacilo gram-negativo y anaerobio estricto. P. gingivalis puede ser aislada de la biopelícula supragingival y principalmente dentro del surco gingival3 y se ha sugerido que es un patógeno de tipo oportunista, así como un colonizador secundario de la biopelícula dental.1
Se han propuesto diversos métodos para la reducción de la carga bacteriana para el control de la periodontitis, como el uso de colutorios, geles, pastas dentales, tratamiento médico, para reducir la proliferación de las bacterias involucradas y la progresión de la enfermedad.5 Estos métodos presentan diversos niveles de efectividad y se encuentran también asociados a la adherencia al tratamiento.
Diversos estudios han demostrado el interés en el desarrollo de productos farmacológicos a base de plantas medicinales como Punica granatum var Pleniflor,6,7Plantago lanceolata y Salvia officinalis.8,9 Se han explorado sus propiedades para el control de la biopelícula dental y la enfermedad periodontal y han demostrado ser eficaces; se abre así la posibilidad del desarrollo de nuevos estudios relacionados a este campo. Una de las plantas que por sus propiedades ha sido propuesta es Eucalyptus globulus Labill. Esta planta pertenece a la familia Myrtaceae, de donde se han identificado más de 300 especies del género Eucalyptus.10 Los principales derivados de las plantas aromáticas son los aceites esenciales (AE), que son sustancias volátiles sintetizadas a partir de las plantas, en el caso del AE obtenido de E. globulus se han identificado como principales constituyentes monoterpenos como 1,8-cineole, α-pinene; limonene a los que se les atribuyen sus propiedades antiinflamatorias y antibacterianas.11,12
Damjanović-Vratnica y otros,13 demostraron que el AE de E. globulus Labill posee importante actividad antibacteriana frente a Streptococcus pyogenes, Escherichia coli, Candida albicans, Staphylococcus aureus, Acinetobacter baumannii y Klebsiella pneumoniae. En el área de la odontología, extractos hexánico, etil-acético, metanólico y acuoso de E. glubules fue probado frente a cuatro bacterias cariogénicas como Lactobacillus acidpophylus, Lactocillus casei, Spaphylococcus aureus y Streptococcus mutans, demostrando ser altamente efectivos con concentraciones inhibitorias desde 0,031 a 0,062 mg/mL.14Hans y otros15 evaluaron la eficacia antimicrobiana del AE de eucalipto frente a P. gingivalis demostrando ser efectivo para inhibir el crecimiento bacteriano por medio de una prueba de difusión de disco (4,5 ± 0,183 mm).
Con base en los resultados positivos del AE de E. globulus reportados frente a P. Gingivalis, sería interesante analizar las propiedades antibacterianas de productos alternativos que puedan ser propuestos con el objetivo de controlar la proliferación de los agentes bacterianos asociados al desarrollo de la periodontitis; incluidos aquellos con diseños in vitro. Esto abriría la posibilidad de desarrollo de ensayos clínicos para evaluar la efectividad y seguridad de los productos farmacológicos derivados de plantas medicinales.
En consecuencia, el presente estudio fue diseñado para determinar la actividad antibacteriana de un gel experimental a base de aceite esencial de Eucalyptus globulus Labill frente a Porphyromonas gingivalis ATCC 33277.
Métodos
Diseño del estudio
Se llevó a cabo una investigación experimental in vitro y de corte transversal. El cálculo de las muestras requeridas para las repeticiones de los ensayos microbiológicos se realizó con el programa EPi InfoTM, el número mínimo de repeticiones establecido fue de 10. El estudio fue aprobado por el comité de ética de la Facultad de Ciencias de la Salud de la Universidad Privada de Tacna con el registro N.º 081-2018-FACSA/UPT, aunque se trata de un estudio in vitro sin intervención de seres humanos, animales o sus tejidos.
Obtención del aceite esencial
Se recolectaron 4 kg de hojas frescas de eucalipto en la provincia de Tarata, de la región Tacna, Perú; durante el mes de febrero de 2019. Se registró una muestra de la planta en la Facultad de Ciencias Agropecuarias de la Universidad Nacional Jorge Basadre Grohmann bajo el voucher n.º 3277, identificándola como Eucalyptus globulus Labill. Las hojas fueron secadas a la sombra antes de uso. La obtención del AE se realizó por el método de destilación por arrastre de vapor agua. Se emplearon 1000 g de hojas trozadas que fueron colocadas en un sistema de doble balón con 1 L de agua destilada. El sistema se aplicó por 1 h, obteniéndose 10,5 mL de AE de E. globulus Labill, que fue almacenado en un tubo de ensayo envuelto con papel aluminio para evitar su exposición a la luz y se almacenó a 4 °C hasta su posterior uso.
Identificación química de los componentes del aceite esencial
Se empleó el método de cromatografía de gases - espectrometría de masas (CG-EM) para la identificación de los componentes químicos del AE de E. globulus Labill. Se usó un cromatógrafo QP2010 Ultra Shimadzu con una columna DB-5 MS, el gas de carga fue helio a un flujo constante de 1 mL/min. Se inyectaron 1,0 µL del AE diluido al 5 % en diclorometano a una razón de 1:75. La identificación de los componentes químicos se realizó por el índice de retención. Se reflejó el espectro de masas por medio del número de picos que se registraron en el cromatograma, los valores se compararon con la librería NIST 08 incluida en el equipo.
Actividad antibacteriana del aceite esencial
Para determinar la concentración mínima inhibitoria (CMI), se mezclaron 1000 µl del AE en 1000 µl de DMSO (dimetilsulfóxido) y se preparó una solución madre con 1800 mL de caldo Müeller-Hinton (Merk Millipore). Para la CMI se prepararon 31 tubos, conteniendo solución madre, inóculo de P. gingivalis ATCC 33277 incubado por 7 h hasta alcanzar el crecimiento logarítmico bacteriano a una concentración de 1,5 x 108 UFC/mL equivalente a la escala 0,5 de McFarland. Las concentraciones finales del AE en los tubos se establecieron desde 26,270 a 43,784 mg/mL. El detalle de la preparación de los tubos se muestra en la tabla 1. Los tubos fueron incubados por 24 h a 37 °C. La CMI correspondió a la mínima concentración del AE que presentó ausencia de turbidez, en este caso 36,195 mg/mL.
Tabla 1 Concentraciones iniciales del aceite esencial de E. globulus Labill para la prueba de concentración mínima inhibitoria
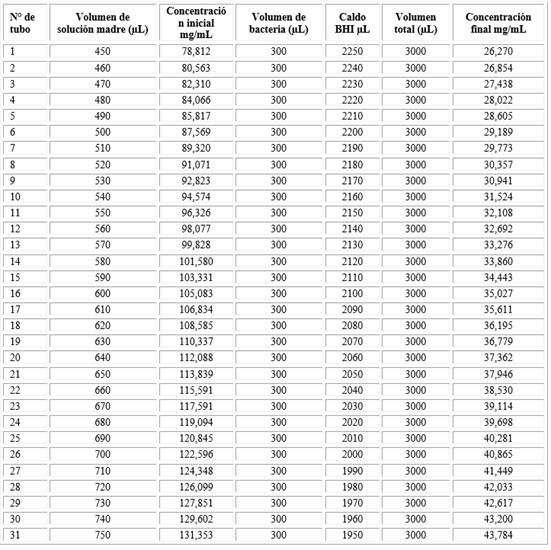
Para determinar la concentración mínima bactericida (CMB) se sembraron 100 µL en placas Petri con Agar Müller-Hinton (Merk Millipore) de la solución de los tubos a partir del primero que no presentó turbidez. Las placas se incubaron por 24 h a 37 °C, en un sistema GasPack 100® para anaerobiosis. Posteriormente, se contabilizaron la presencia de unidades formadoras de colonias (UFC/mL) en las placas. La CMB fue de 39,114 mg/mL.
Preparación del gel experimental a base de aceite esencial
El gel experimental a base del AE de E. globulus Labill se preparó a partir de la CMB. Para la preparación en empleó vaselina como vehículo del AE, la vaselina es un producto incoloro, insípido e inodoro, que no presenta actividad antibacteriana frente a P. gingivalis. Se mezclaron 44,66 µL del AE con 1000 µL para obtener un gel al 4,46 % con una concentración de 39,114 mg/mL. El gel presentó una consistencia viscosa ligeramente amarillenta y fue almacenada en un frasco a 4 °C hasta su uso.
Actividad antibacteriana del gel experimental a base de aceite esencial
Para determinar la actividad antibacteriana del gel experimental se realizó un ensayo de difusión en Agar. Se prepararon 10 placas con Agar Müller-Hinton inoculadas con 50 µL de caldo cerebro-corazón (BHI, Himedia®) con P. gingivalis ajustada a 1,5 x 108 UFC/mL, las placas se dejaron secar por 10 min. Se realizaron pozos individuales con un sacabocado en cada placa y se colocaron 50 µL del gel experimental; se empleó clorhexidina al 0,12 % (PERIO-AID®) como solución control en la misma cantidad de repeticiones. Las placas fueron incubadas a 37 ºC por 24 h en un sistema GasPack para anaerobiosis. La lectura de los halos de inhibición en las placas se midió con un compás digital (Ubermann©).
Análisis estadístico
Para el análisis estadístico se empleó el programa SPSS V. 21.0 para Windows (SPSS Inc., Chicago Illinois). Se empleó estadística descriptiva incluyendo la media y la desviación estándar para determinar los halos de inhibición producto del efecto antibacteriano del gel experimental a base de AE de E. globulus Labill. Para la comparación de los halos de inhibición con la clorhexidina al 0,12 % se empleó la prueba U de Mann-Whitney, con un nivel de significación del 5 %.
Resultados
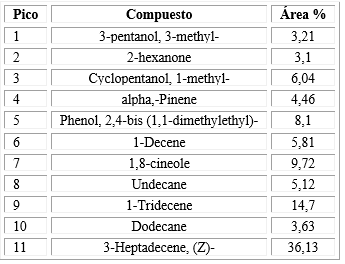
El AE de E. globulus Labill, presentó un rendimiento de 1,05 % (v/p) y una densidad de 0,875 g/mL. Se identificaron 11 constituyentes del AE por medio de CG-EM. Los principales componentes químicos fueron 3-Heptadecene, (Z)- (36,13 %), 1-Tridecene (14,7 %) y 1,8-cineole (9,72 %). Los componentes según los picos del cromatograma y sus cantidades se muestran en la tabla 2.
La CMI del AE de E. globulus Labill se identificó a 36,195 mg/mL, mientras que la CMB fue de 39,114 mg/mL (Tabla 3).
Tabla 3 Concentración mínima inhibitoria y concentración mínima bactericida del aceite esencial de E. globulus Labill frente a P. gingivalis

N. C.: no contabilizable.
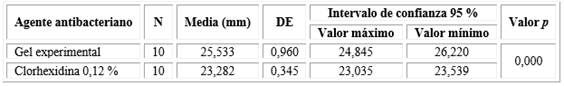
El gel experimental al 4,46 % a base de AE de E. globulus Labill presentó actividad antibacteriana frente a P. gingivalis, generó halos de inhibición de 25,533 mm ± 0,960 mm. Se observaron diferencias estadísticamente significativas con los halos de inhibición generados por la clorhexidina al 0,12 % (p < 0,05) (Tabla 4 y Fig. 1).
Tabla 4 Promedio de halos de inhibición del gel experimental a base del aceite esencial de E. globulus Labill frente a P. gingivalis
Discusión
El uso de productos herbales ha demostrado poseer un efecto potencial comparable a los tratamientos tradicionales para el manejo de la enfermedad periodontal, estos efectos positivos se atribuyen a los diversos constituyentes químicos de las plantas analizadas.16 En nuestro estudio se evaluó la composición química del AE obtenido de una muestra de E. globulus Labill proveniente de una región altoandina peruana. Se identificaron principalmente 3-heptadecene, (Z)-, 1-tridecene y 1,8-cineole. Estos resultados difieren a los reportados por Damjanović-Vratnica y otros,13 quienes describieron 1,8-cineole y α-pinene como los constituyentes más abundantes de una muestra de E. globulus Labill de Montenegro. De una muestra de AE de E. globulus de Irán los principales constituyentes fueron 1,8-cineole y limonene.11Fratini y otros,17 encontraron como principal constituyente del AE de E. globulus Labill proveniente de Italia, 1,8-cineole, α-pinene y p-cymene. De una muestra de AE de E. globules de Pakistán se identificaron como los principales componentes químicos 1,8-cineole y limonene.12 Estos estudios muestran en común un alto porcentaje cercano al 80 % de 1,8-cineole en las muestras estudiadas, este constituyente es conocido también como eucalyptol; llama la atención que en nuestro estudio se encontró una concentración bastante menor de este componente (9,72 %). Estas diferencias pueden ser debidas a diversos factores como la temporalidad de la cosecha y las condiciones geográficas y ambientales del origen de la planta, que han sido reportadas como responsables de las variaciones de los constituyentes de los AE de las plantas.18
El presente estudio encontró que el AE obtenido de E. globulus Labill posee actividad inhibitoria y bactericida frente a P. gingivalis en concentraciones mayores a 36,195 y 39,144 mg/mL, respectivamente. A partir de esta última concentración se elaboró un gel experimental que demostró poseer una excelente actividad antibacteriana frente a P. gingivalis, generando halos de inhibición mayores a los registrados para la clorhexidina al 0,12 %.
En la literatura revisada existen pocas experiencias de trabajos que evalúen la actividad antibacteriana del AE. de E. globulus frente a P. gingivalis. Al respecto, el reporte de Hans y otros15 comparó el efecto de cuatro aceites esenciales de Eucalyptus, Matricariarecutita, Melaleucaalternifolia y Curcuma longa, demostrando que el AE de Eucalyptus al 100 % posee una actividad antibacteriana significativa frente a P. gingivalis. Aunque esos resultados fueron menores a los registrados en nuestro estudio, en el que el gel experimental a base de AE de E. globulus generó halos de inhibición incluso, superiores a la clorhexidina al 0,12 %. Estas diferencias pueden deberse a que en el reporte de Hans y otros15 no se identificaron la CMI ni la CMB del AE, lo que significa una limitante para poder llegar a conclusiones más precisas. En nuestro estudio la CMB fue de 39,114 mg/mL, lo que permitió caracterizar el gel experimental con esta concentración y demostrar su efectividad antibacteriana mediante un ensayo de difusión de disco.
El efecto antibacteriano del AE de E. globulus frente a diversas especies está relacionado con los constituyentes químicos que lo integran. Diversos estudios identifican a 1,8-cineole como el más abundante.11,13,17 El 1,8-cineole es un monoterpeno y presenta diversas propiedades, entre ellas, actuar como antimicrobiano, antialérgico, antiinflamatorio, hepatoprotector y antitumoral.19 La actividad de los AE de E. globulus de los estudios previos puede ser atribuida a la gran cantidad de este constituyente en las muestras analizadas.
Es necesario considerar el efecto sinérgico de todos los constituyentes del AE de E. globulus Labill, esto es particularmente importante en nuestro estudio, donde el 1,8-cineole fue el tercer constituyente más abundante después de 3-heptadecene y 1-tridecene. Estos dos últimos constituyentes son compuestos volátiles que pertenecen al grupo hidrocarbono y se sabe que los elementos de grupos oxigenados, como los terpenoides, exhiben mejor actividad antibacteriana que los hidrocarbonos.20 Es necesario realizar ensayos adicionales de fraccionamiento del AE para aislar los constituyentes y poder evaluar la actividad antibacteriana individual frente a P. gingivalis u otras especies relacionadas con las enfermedades periodontales.
En la literatura se menciona que los AE presentan su acción antibacteriana de acuerdo a diversos mecanismos que son dependientes del tipo de microorganismo. Estos mecanismos están principalmente asociados a los cambios en los canales de iones como el sodio, potasio y calcio, que aumentan la permeabilidad de la membrana bacteriana y propician su ruptura, con la consecuente liberación de sus constituyentes intracelulares.21
Las bacterias gram-negativas presentan una membrana externa con canales de porinas que permite el transporte de moléculas de bajo peso molecular.22 Esta característica podría afectar, incrementando o disminuyendo, el efecto antibacteriano de los agentes antibacterianos. En este sentido, el mayor constituyente del AE de E. globulus estudiado fue 3-heptadecene, (Z)- que presenta un peso molecular de 238,5 g/mol, mayor a los registrados para 1,8-cineole (182,35 g/mol) y para 1-tridecene (182,35 g/mol).19,23,24 Considerando estas propiedades, es probable que el efecto antibacteriano del AE de E. globulus Labill sea producto principalmente de 1,8-cineole a pesar de encontrarse en menor concentración que otros constituyentes.
Una de las limitaciones del estudio es que no fue posible realizar el fraccionamiento del AE por medio de solventes orgánicos como el hexano, diclorometano o éter de petróleo, que permitiría aislar sus constituyentes, ya que es posible que la importante actividad antibacteriana reportada se deba a alguno de los componentes químicos encontrados. El fraccionamiento del AE facilitaría realizar ensayos para comparar su efecto antibacteriano, considerando que no se han encontrado estudios previos que evalúen la actividad antibacteriana de 3-heptadecene, (Z)- de forma individual frente a bacterias asociadas al este padecimiento periodontal.
En conclusión, el uso del aceite esencial de E. globulus Labill es una sustancia con un interesante potencial para el desarrollo de formulaciones farmacológicas efectivas para el control de la enfermedad periodontal. La muestra de E. globulus Labill obtenida de la región altoandina de Tarata, Tacna, Perú presentó como principales constituyentes 3-heptadecene, (Z)-, 1-tridecene y 1,8-cineole. El gel experimental a base aceite esencial demostró ser efectivo para inhibir el crecimiento de Porphyromonas gingivalis ATCC 33277. Es necesario realizar estudios adicionales para evaluar la liberación controlada de los constituyentes en el gel experimental, así como evaluar su estabilidad y citotoxicidad en modelos in vitro antes de considerar su empleo y el desarrollo de ensayos clínicos.