Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Pastos y Forrajes
versión On-line ISSN 2078-8452
Pastos y Forrajes vol.38 no.2 Matanzas abr.-jun. 2015
ARTÍCULO DE INVESTIGACIÓN
Caracterización cultural y morfológica e identificación de especies de Aspergillus asociadas a semillas de Leucaena leucocephala cv. Perú
Cultural and morphological characterization as well as identification of Aspergillus species associated to Leucaena leucocephala cv. Peru seeds
J. C. Lezcano1, B. Martínez2 y O. Alonso1
1Estación Experimental de Pastos y Forrajes Indio Hatuey, Universidad de Matanzas Camilo Cienfuegos, Ministerio de Educación Superior. Central España Republicana, CP 44280, Matanzas, Cuba
Correo electrónico: lezcano@ihatuey.cu
2Centro Nacional de Sanidad Agropecuaria
RESUMEN
Se evaluaron, desde el punto de vista cultural y morfológico, diez aislamientos puros de Aspergillus, obtenidos de semillas previamente desinfectadas de Leucaena leucocephala cv. Perú, con el objetivo de identificar a qué especie(s) pertenecían. La siembra de los hongos se realizó a partir de discos miceliales de 7 mm de diámetro, procedentes de cultivos de 10-15 días de edad, que fueron colocados en el centro de placas Petri de cristal de 9 cm de diámetro y se incubaron durante 10 días a 25 °C, con alternancia de 8 h luz por 6 h oscuridad. El diseño experimental fue completamente aleatorizado, y para cada aislamiento se utilizaron como réplicas tres placas. Los aspectos culturales medidos fueron: el color de la colonia en el anverso y el reverso, el diámetro, la textura, el crecimiento lineal (cm/día), el crecimiento aéreo y la pigmentación del sustrato; y los morfológicos: el tamaño, la forma y el color de las estructuras con valor taxonómico para la determinación de las especies de Aspergillus. Los aislamientos No. 2, No. 3, No. 4 y No. 5 se correspondieron con la especie Aspergillus flavus Link; el No. 19, con Aspergillus wentii Wehmer; y los tratamientos No. 7, No. 20 y No. 21, con Aspergillus niger van Tieghem. Se concluye que tres especies de Aspergillus se asociaron a las simientes de leucaena almacenadas. Se recomienda continuar los estudios para lograr la identificación de los aislamientos No. 6 y No. 22 hasta el nivel de especie.
Palabras clave: Almacenamiento de semillas, hongos.
ABSTRACT
Ten pure isolations of Aspergillus, obtained from previously-disinfected seeds of Leucaena leucocephala cv. Peru, were evaluated from the cultural and morphological point of view, in order to identify to which species they belonged. The fungi were planted from mycelial discs of 7 mm diameter, of cultures which were 10-15 days old, that were placed at the center of glass Petri dishes of 9 cm diameter and were incubated for10 days at 25 ºC, with alternance of 8 h of light by 6 h of darkness. The experimental design was completely randomized, and for each isolate three dishes were used as replications. The cultural aspects measured were: color of the colony on the obverse and reverse, diameter, texture, linear growth (cm/day), aerial growth and substratum pigmentation; and the morphological aspects: size, shape and color of the structures with taxonomic value for the determination of the Aspergillus species. Isolates No. 2, No. 3, No. 4 and No. 5 were in correspondence with the species Aspergillus flavus Link; No. 19, with Aspergillus wentii Wehmer; and treatments No. 7, No. 20 and No. 21, with Aspergillus niger van Tieghem. It is concluded that three Aspergillus species were associated with the stored leucaena seeds. It is recommended to continue the studies to achieve the identification of isolates No. 6 and No. 22 to the species level.
Key words: Fungi, seed storage.
INTRODUCCIÓN
Aspergillus es considerado uno de los géneros más versátiles y cosmopolitas de la naturaleza, el cual agrupa a diversos hongos de vital importancia desde el punto de vista ecológico y económico, así como en la agricultura, la medicina y la industria.
Mayea et al. (2004) informaron la relevancia de dicho género en el ciclo del carbono, en el que estos hongos desdoblan el almidón y, conjuntamente con otros microorganismos, participan en la descomposición de la celulosa, la hemicelulosa y la quitina. Además, reconocieron su labor en el ciclo del fósforo y en la degradación de los compuestos carbonados y nitrogenados presentes en el suelo.
Por otra parte, algunas de las especies de Aspergillus se destacan en la producción de ácidos orgánicos, antibióticos, enzimas y otras sustancias tóxicas llamadas micotoxinas (Saha et al., 2009; González, 2009). También, actúan como biorreguladores de plagas y descomponedores de la materia vegetal muerta en el suelo, y constituyen agentes causales de enfermedades de las plantas, los animales y los humanos (Nicholls, 2008; Mohammadi et al., 2009; Scazzocchio, 2009; Buzina, 2013).
Asimismo, la literatura internacional reconoce a Aspergillus por su condición de contaminante y patógeno de las semillas (Mittal y Mathur, 2002; Anon, 2010). En el caso particular de Leucaena leucocephala cv. Perú, Lezcano et al. (2007) informaron que dicho género afectó a las simientes germinadas y podridas de esta arbórea, lo que provocó pérdidas en su calidad y viabilidad. De igual forma, Alonso et al. (1996) reportaron afectaciones de hasta un 42,68 % en sus semillas, almacenadas al ambiente.
A pesar de lo antes expuesto no se han identificado totalmente, hasta el nivel taxonómico, las especies de Aspergillus detectadas y aisladas de las semillas de leucaena, y en la literatura consultada solo aparece informado dicho género. Por ello es necesario identificar las especies de Aspergillus que más se asocian a las semillas de esta leguminosa, con base en su caracterización cultural y morfológica, lo que constituyó el objetivo de este trabajo.
MATERIALES Y MÉTODOS
Localización. La investigación se realizó en el laboratorio de micología vegetal del Centro Nacional de Sanidad Agropecuaria (CENSA), en Mayabeque, Cuba; y en el laboratorio de protección de plantas de la Estación Experimental de Pastos y Forrajes Indio Hatuey, ubicada en la provincia de Matanzas, Cuba.
Material vegetal. Los aislamientos se hicieron de semillas de L. leucocephala cv. Perú, con 6 y 18 meses de almacenamiento al ambiente, procedentes del almacén de la finca de semillas La Rioja que pertenece a la Empresa Pecuaria Martí (provincia de Matanzas, Cuba).
Desinfección de las semillas. Las semillas fueron previamente lavadas con abundante agua corriente, durante 10 minutos, y desinfectadas con hipoclorito de sodio al 1 %, durante 3 minutos, y con alcohol al 70 %, por 45 segundos. Posteriormente, se lavaron tres veces con agua destilada estéril (desinfección completa) y se secaron sobre láminas de papel de filtro a temperatura ambiente, durante 20 minutos, en un cuarto aséptico.
Prueba de sanidad a las semillas. Se aplicó el test de cámara húmeda, según el ISTA (1999), y se utilizaron 400 semillas (cuatro réplicas de 100 semillas por cada periodo de almacenamiento). En dicha prueba, las estructuras fúngicas que se detectaron en las semillas infectadas se aislaron con el empleo de agujas previamente desinfectadas y con un estereomicroscopio Zeiss SV-6.
Aislamientos en estudio. Se utilizaron diez aislamientos puros de Aspergillus spp. (No. 2, No. 3, No. 4, No. 5, No. 6, No. 7, No. 19, No. 20, No. 21 y No. 22), obtenidos de las semillas infectadas de leucaena, los cuales fueron cultivados inicialmente en medio agar papa y dextrosa (APD), dentro de tubos de cristal de 150 x 20 mm, y conservados en cámara fría a 10 °C.
Aspectos culturales. Como aspectos culturales se midieron: el color de la colonia en el anverso y el reverso, la textura, el crecimiento lineal (cm/día), el crecimiento aéreo y la pigmentación del sustrato. El medio de cultivo utilizado fue Agar Czapek (AZ), recomendado por Raper y Fennell (1965), Onions (1966a, 1966b) y Singh et al. (1991). Para cada aislamiento se utilizaron tres placas Petri de cristal, de 9 cm de diámetro, y cada una de ellas constituyó una réplica.
La siembra de los hongos se realizó a partir de discos miceliales de 7 mm de diámetro, procedentes de cultivos de 10-15 días de edad, los cuales fueron colocados en el centro de cada placa. Dichas placas se sellaron con papel parafinado y se incubaron durante 10 días a 25 °C, con alternancia de 8 h luz por 16 h oscuridad.
Para el crecimiento micelial de cada aislamiento se midió el diámetro de la colonia (dos mediciones diarias, a las 8:00 a. m. y 4:00 p. m., hasta el decimoquinto día). La pigmentación se evaluó de modo cualitativo, por apreciación visual del pigmento producido y por su intensidad. La coloración de la colonia se determinó a partir de la carta de colores de Rayner (1970).
Aspectos morfológicos. Los aislamientos se caracterizaron morfológicamente, teniendo en cuenta el tamaño, la forma y el color de las estructuras, las cuales fueron descritas por Raper y Fennell (1965), Onions (1966a, 1066b) y Singh et al. (1991) para la determinación de las especies de Aspergillus. Además se consideraron los criterios expuestos por Minter et al. (1985), Klich y Pitt (1988) y Abarca (2000). Las observaciones se realizaron a partir del montaje de numerosas preparaciones microscópicas, y se hicieron 50 mediciones para cada tipo de estructura, con el empleo de un microscopio óptico Zeiss Estándar 25.
Para la identificación de los agentes fungosos se utilizaron las claves taxonómicas de Raper y Fennell (1965), Onions (1966a, 1966b) y Singh et al. (1991).
Diseño experimental y análisis estadístico. Se empleó un diseño completamente aleatorizado, y los datos se procesaron estadísticamente a partir de un análisis descriptivo.
RESULTADOS Y DISCUSIÓN
A partir de los aislamientos No. 2, No. 3, No. 4 y No. 5 (fig. 1), que se cultivaron en AZ a 25 °C, se obtuvieron colonias de crecimiento superficial abundante (con 63-66 y 70-77 mm, como promedio, al séptimo y decimotercer días de incubación, respectivamente) y de crecimiento aéreo escaso, afieltradas y de tipo zonal. Dichas colonias presentaron en el anverso una coloración verde amarillenta, con una zona radial de color blanco cerca de los bordes; mientras que el reverso se observó incoloro, aunque en dos aislamientos (No. 3 y No. 4) se pudo notar una coloración parda. En cuanto a la pigmentación del medio, no se evidenció ningún cambio durante la investigación.
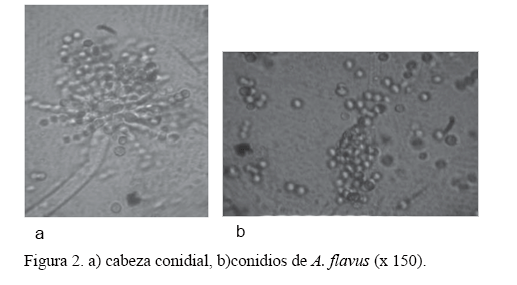
Desde el punto de vista morfológico, los aislamientos presentaron las siguientes estructuras: cabezas conidiales de color verde amarillento, no compactas y típicamente radiadas (de 322 a 475 mm de diámetro), las cuales se dividieron en varias columnas escasamente definidas (fig. 2a); conidióforos hialinos y, en ocasiones, con tonalidades amarillo claro, de paredes gruesas, rugosos, usualmente de 1 mm de largo y 10-18 mm de diámetro, localizados justo debajo de la vesícula; vesículas alargadas cuando eran jóvenes y subglobosas a globosas o esféricas con la edad, de 35,75 mm de diámetro; métulas de 7,5 x 4,8 mm; fiálides usualmente de 7,0 x 3,3 mm, que nacen sobre las vesículas; conidios equinulados, globosos, verdoso-amarillentos, de 3,5-4,13 mm (fig. 2b). Tales características coinciden con las citadas por Raper y Fennell (1965), Onions (1966a), Singh et al. (1991) y Guevara et al. (2007) para la especie A. flavus Link.
De manera similar, Abarca (2000) reportó colonias de color verde oliváceo a verde amarillento en Agar Czapek extracto de levadura (CYA) y Agar Czapek extracto de levadura con 20 % de sacarosa (CY20S), y de reverso incoloro o ligeramente amarillo pálido; así como cabezas conidiales radiadas, vesículas esféricas y conidios globosos y rugosos. Estos aspectos morfoculturales coinciden con los citados por EMSIBA (2013), al cultivar esta especie fungosa a 25-35 °C en Agar Malta (AM). Además, se corroboró lo planteado por Mohammadi et al. (2009) acerca de la producción de conidios de color amarillo a verde olivo, que se observan cuando se cultiva A. flavus en medio AZ.
Con respecto al aislamiento No. 19, sus colonias presentaron un crecimiento rápido al séptimo y décimo días de incubación (fig. 3a), a 25 °C en AZ (45 y 70 mm como promedio). Además tuvieron una coloración amarillo-carmelitosa en el anverso y crema en el reverso. Entre los caracteres morfológicos que más distinguieron a este aislamiento se destacan: la presencia de cabezas conidiales de color carmelita, radiadas, con columnas de esporas usualmente en cadenas, y de tamaño variable de 201-300 mm de diámetro como promedio (fig. 3b); esterigmas biseriados; conidióforos lisos y hialinos; así como conidios de color carmelita, globosos, equinulados y de 35-40 mm de diámetro.
De acuerdo con las características descritas con anterioridad, se pudo corroborar lo planteado por Raper y Fennel (1965) para la especie Aspergillus wentii Wehmer.
Las colonias de los aislamientos No. 7, No. 20 y No. 21 (fig. 4a) cultivadas en medio AZ e incubadas a 25 °C mostraron en el anverso, al decimoquinto día, las siguientes características: crecimiento lineal de 60-65 mm, como promedio; coloración blanca, inicialmente, que cambió a carmelita oscuro y negro con el desarrollo del cultivo; y textura polvorienta, plana y granular. Por otra parte, en el reverso estas colonias permanecieron generalmente incoloras, aunque en el aislamiento No. 20 se pudo observar una coloración blanca que alcanzó tonalidades amarillas.
Con respecto a las características morfológicas, se observó lo siguiente: cabezas conidiales radiadas, globosas, con apariencia de color carmelita a negruzco a simple vista (fig. 4b), entrelazadas o divididas en columnas; conidióforos lisos, hialinos o ligeramente carmelitas cerca del ápice, de 2,05 x 14,48-16,80 mm; vesículas globosas o casi globosas que producían fiálides alrededor de ellas, las cuales eran biseriadas y tenían una longitud uniforme en la mayoría de los casos, de 6,6-9,5 x 2,5 mm, y conidios globosos, oscuros de color castaño a marrón y negro (fig. 4c) y a menudo rugosos, de 4,2-5,0 mm de diámetro.
Como resultado de esta caracterización se corroboró lo descrito por Raper y Fennell (1965), Onions (1966b), Singh et al. (1991), Castañeda (2001), CABI (2003) y Guevara et al. (2007) para la especie Aspergillus niger van Tieghem.
Abarca (2000) obtuvo un resultado similar al reportar la presencia de colonias densas, de granulares a flocosas y de color negro o marrón oscuro cuando cultivó este hongo sobre los medios CYA y AM; dichas colonias, en ocasiones, permanecían incoloras o amarillas en el reverso. Asimismo, informó características microscópicas similares a las observadas en esta investigación: presencia de cabezas conidiales biseriadas y radiales; vesículas casi esféricas; métulas que ocupaban toda la superficie de la vesícula y conidios de color marrón, globosos y rugosos.
Por su parte, las colonias de los aislamientos No. 6 y No. 22, desde el punto de vista cultural, tenían en el anverso una coloración verde olivo con tonalidades amarillentas cultivadas en medio AZ; mientras que en el reverso se observaban incoloras. Además, eran radiadas, con bordes regulares (fig. 5), y de crecimiento superficial abundante (70-90 mm como promedio al séptimo y decimotercer días de incubación a 25 °C) y crecimiento aéreo escaso. Por otra parte, se constataron como caracteres morfológicos: cabezas conidiales de color verde a amarillo pálido, pobremente definidas, las cuales se tornaron carmelitas con la edad del cultivo, de 420-438 mm de diámetro; conidióforos lisos, hialinos, de 14-17 mm; y conidios globosos que mostraron una coloración oscura. Sin embargo, en ambos aislamientos no se pudieron definir exactamente sus métulas y fiálides, ni el tipo de esterigma que las caracteriza. Estos aspectos deben ser investigados en estudios posteriores, o a través de técnicas más modernas como las moleculares. No obstante, la caracterización descrita coincide con la informada por Barnett y Hunter (1999) para las especies del género Aspergillus, por lo que estos agentes fungosos se clasifican como Aspergillus sp.
CONCLUSIÓN
La caracterización cultural y morfológica realizada a los 10 aislamientos en estudio permite concluir que se identificaron tres especies de Aspergillus, asociadas a las semillas de L. leucocephala cv. Perú; estas fueron: A. flavus Link, A. wentii Wehmer y A. niger van Tieghem. Se recomienda continuar los estudios con los aislamientos No. 6 y No. 22, para completar su identificación hasta la categoría de especie.
REFERENCIAS BIBLIOGRÁFICAS
1. Abarca, Ma. Lourdes. Taxonomía e identificación de especies implicadas en la aspergilosis nosocomial. Rev. Iberoam. Micol. 17:S79-S84, 2000.
2. Alonso, O.; Delgado, A. & Sánchez, Saray. Hongos asociados a las semillas de una leguminosa tropical (Leucaena leucocephala cv. Perú). Pastos y Forrajes. 19 (2):161-168, 1996.
3. Anon. Hongos de granos almacenados. En: Almacenaje y conservación de granos. Santiago de Chile: Cía. Molinera El Globo S.A. p. 15-17, 2010.
4. Barnett, H. L. & Hunter, B. B. Illustrated genera of imperfect fungi. 4th ed. St Paul. Pilot Knob Rodal, Minnesota: The American Phytopathological Society, 1999.
5. Buzina, W. Aspergillus: classification and antifungal susceptibilities. Curr. Pharm. Design. 19 (20):3615-3628, 2013.
6. CABI. Seed-borne disease. In: Crop Protection Compendium. UK: CAB International. [CD-ROM], 2003.
7. Castañeda, R. F. Identificación de hifomicetes causantes de enfermedades en hortalizas comunes en Cuba. Tesis presentada en opción al grado de Doctor en Ciencias Agrícolas (Resumen). La Habana: INIFAT, 2001.
8. EMSIBA. Les Aspergillus: Ecole Supérieure de Microbiologie et Sécurité Alimentaire de Brest, 2013. http://esmisab.univbrest.fr/scientifique/Mycologie/Principaux_groupes/Les+Aspergillus. [28/11/2013].
9. González, Amaia. Diagnóstico y control de especies de Aspergillus productoras de ocratoxina A. Tesis Doctoral. España: Universidad Complutense de Madrid, 2009. http://eprints.ucm.es/10545/1/ T30977.pdf. [28/11/2014].
10. Guevara, Miriam; Urcia, Flor & Casquero, J. M. Identificación de principales hongos filamentosos (Sección 5). En: Manual de procedimientos y técnicas de laboratorio para la identificación de los principales hongos oportunistas causantes de micosis humanas. Lima: Instituto Nacional de Salud. Serie Normas Técnicas No. 44. p. 59-63, 2007.
11. ISTA. International rules for seed testing. Seed Science and Technology. 27 (supl.):1-333, 1999.
12. Klich, M. A. & Pitt, J. I. A laboratory guide to common Aspergillus species and their teleomorphs. North Ryde, Australia: CSIRO Division of Food Processing, 1988.
13. Lezcano, J. C.; Navarro, Marlen; González, Yolanda & Alonso, O. Determinación de la calidad de las semillas de Leucaena leucocephala cv. Perú almacenadas al ambiente. Pastos y Forrajes. 30 (1):107-118, 2007.
14. Mayea, S.; Valiño, A.; Morales, Yolanda; Soria, Miguelina; Silveira, E.; Boado, Isabel et al. Microbiología agropecuaria. La Habana: Editorial Félix Varela. Tomo II, 2004.
15. Minter, D. W.; Hawksworth, D.L.; Onions, A.H.S. & Kozakiewicz, Z. Descriptive terminology of the conidiogenous structures in Aspergillus and Penicillium. In: R. A. Samson and J. I. Pitt, eds. Advances in Penicillium and Aspergillus systematic. New York: Plenum Press. p. 71-82, 1985.
16. Mittal, R. K.; Mathur, S. B.; Old, K. & Yuan, Z. Q. Pathology. In: J. A. Vozzo, ed. Tropical tree seed manual. Washington, D.C.: USDA, Department Forest Service. Agric. Handbook 721. p. 177-190, 2002. http://www.rngr.net/publications/ttsm/ch6/?searchterm=Fungi%20of%20forest%20tree% 20seeds.
17. Mohammadi, A. H.; Banihashemi, Z. & Haghdel, M. Identification and prevalence of Aspergillus species in soils of fars and Kerman provinces of Iran and evaluation of their aflatoxin production. Rostaniha. 10 (1):9-30, 2009.
18. Nicholls, Clara. I. Patógenos. Enemigos naturales. En: Control biológico de insectos: un enfoque agroecológico. Medellín, Colombia: Editorial Universidad de Antioquia. Colección Ciencia y Tecnología. p. 109-112, 2008.
19. Onions, A. H. S. Aspergillus flavus. In: Descriptions of pathogenic fungi and bacteria. Kew, England: Commonwealth Mycological Institute. No. 1, 1966a.
20. Onions, A. H. S. Aspergillus niger. In: Descriptions of pathogenic fungi and bacteria. Kew, Surrey, England: Commonwealth Mycological Institute. Set 10, No. 94, 1966b.
21. Raper, K. B. & Fennell, D. I. Key of the genus Aspergillus. Baltimore: Williams & Wilkins, 1965.
22. Rayner, R. W. A mycological colour chart. Kew, Surrey, England: Commonwealth Mycological Institute, 1970.
23. Saha, B. C.; Jordan, D. B & Bothast, R. Enzymes, industrial (overview). Applied microbiology: Industrial. In: M. Schaechter, ed. Encyclopedia of Microbiology. 3rd ed. Oxford: Elsevier. p. 281-294, 2009.
24. Scazzocchio, C. Fungi. Aspergillus: a multifaceted genus In: M. Schaechter, ed. Encyclopedia of Microbiology. 3rd ed. Oxford: Elsevier. p. 401-421, 2009.
25. Singh, K.; Frisvad, J. C.; Thrane, U. & Mathur, S. B. An illustrated manual on identification of some seed-borne Aspergilli, Fusaria, Penicillia and their Mycotoxins. Demark: Danish Government Institute of Seed Pathology for Developing Countries, 1991.
Recibido el 11 de marzo del 2014
Aceptado el 12 de enero del 2015